Introducción
El cultivo de tejidos se inició a principios del siglo XX, como un método para estudiar el comportamiento de células animales fuera de las variaciones sistémicas que pueden ocurrir in vivo. Debido a que la técnica predominante durante 50 años fue el cultivo de fragmentos no disgregados de tejido (explantes), el término cultivo de tejidos se ha utilizado para englobar las técnicas de cultivo de órganos, el propio cultivo de tejidos y el cultivo celular (Freshney, 2010). El cultivo celular, específicamente, consiste en un procedimiento tecnológico de mantenimiento y estudio de células vivas en un medio artificial, donde se procura reproducir las condiciones biológicas originales en las que se desarrollan las células (Cofán y Fernández-Solá, 1992).
En los últimos veinte años, y de forma exponencial, han surgido múltiples variantes técnicas y campos potenciales de aplicación de los cultivos celulares (Cofán y Fernández-Solá, 1992), entre ellos, la ingeniería de tejidos. Esta se define como “La aplicación de los principios y métodos de la ingeniería y las ciencias de la vida hacia la comprensión fundamental de las relaciones estructura-función de los tejidos normales y patológicos de mamíferos y el desarrollo de sustitutos biológicos para restaurar, mantener y mejorar funciones de los tejidos” (MATES, 2007).
El presente trabajo compila los principios generales y las técnicas más relevantes de cultivo celular e ingeniería de tejidos para la producción de autoinjertos epiteliales cultivados in vitro con potencial para uso terapéutico, área en la cual se desarrollan los esfuerzos del Laboratorio de Ingeniería de Tejidos (LAINTEC) del Centro de Investigación en Biotecnología (CIB) del Instituto Tecnológico de Costa Rica (ITCR).
Cultivo celular: principios generales
El cultivo celular in vitro se lleva a cabo mediante diversas estrategias, entre las que destacan el método del explante y el método de disgregación por técnicas enzimáticas o mecánicas. El primero consiste en la inoculación y mantenimiento de pequeños fragmentos no disgregados de tejido vivo, donde el crecimiento se restringe a la migración y ocasional proliferación celular en los bordes del explante. El método de disgregación enzimática implica la disociación de fragmentos de tejido en células individuales, mediante el uso de enzimas proteolíticas para la destrucción de la matriz extracelular (el soporte o andamio natural de las células en el tejido) y los enlaces intercelulares. La disociación mecánica se basa en el mismo principio, pero utilizando técnicas como microcorte, vibración, centrifugación o electroforesis. En cualquiera de los casos, las células que se inoculan pueden ser mantenidas y amplificadas in vitro (Freshney, 2010).
Los cultivos así establecidos se denominan cultivos primarios cuando proceden directamente del organismo vivo, mientras que los cultivos secundarios son los que se obtienen de la resiembra de otro cultivo (Cofán y Fernández-Solá, 1992). Dependiendo de las propiedades de las células, se pueden obtener cultivos en monocapa (para células adherentes) o cultivos en suspensión (para células carentes de dependencia de anclaje). Además, es posible establecer cultivos puros (axénicos), es decir, de un solo tipo celular, o cultivos mixtos (Freshney, 2010).
Según su capacidad de mantener sus propiedades proliferativas y su estado de diferenciación o linaje (funciones diferenciales o progenitoras de cada célula en cada tejido), las células cultivadas pueden ser diferenciadas (con nula o limitada capacidad de división), o progenitoras y células madre (células indiferenciadas con gran capacidad de división que pueden dar origen a otros linajes con distintas funcionalidades) (Cofán y Fernández-Solá, 1992; Estrada, Paz y López, 2006; Tacchi, 2008 y Freshney, 2010).
Cualquier linaje celular puede o no mantener su identidad morfológica y funcional in vitro, y es común que la pierdan con el tiempo de no suplirse los requerimientos ambientales, nutricionales y hormonales adecuados. La pérdida irreversible de las funciones especializadas expresadas in vivo o de la morfología diferenciada se denomina desdiferenciación, un fenómeno indeseable para las aplicaciones en ingeniería de tejidos. Por otro lado, las células progenitoras y las células madre no solo poseen alta capacidad de multiplicación, generando en cada ciclo de división nuevas células del mismo linaje, sino que, con los estímulos adecuados, también pueden generar células diferenciadas (fenómeno de diferenciación) (Cofán y Fernández-Solá, 1992; Estrada et al., 2006; Tacchi, 2008 y Freshney, 2010). Para las aplicaciones en ingeniería de tejidos es primordial la obtención, el aislamiento y el mantenimiento de la población de células progenitoras y/o de células madre del tejido que se va a cultivar.
La piel: estructura y función
La piel es el órgano más extenso del cuerpo: una persona promedio está cubierta por 1,8 m2 de piel de aproximadamente 2,2 mm de espesor. La elasticidad, resistencia, flexibilidad, extensibilidad, turgencia y humedad de este órgano le permiten cumplir diversas funciones (Sánchez, Quesada y Cedeño, 2010), incluyendo protección de los tejidos internos, prevención de la deshidratación, regulación de la temperatura, almacenamiento de energía en el tejido adiposo subcutáneo, excreción de agua, sales y otras sustancias, percepción del dolor, calor, frío y otras sensaciones, protección contra agentes patógenos y producción de vitamina D (Yamamoto, 2001; Beele, 2002 y Eckes, Krieg y Niessen, 2010). Estructuralmente, desde el exterior hacia el interior, la piel se divide en tres capas o estratos principales, cada uno compuesto por células y tejidos específicos: la epidermis, la dermis y la hipodermis o subdermis (figura 1). Para entender los principios del cultivo in vitro de las células de estos tejidos, es necesario conocer su estructura y función.
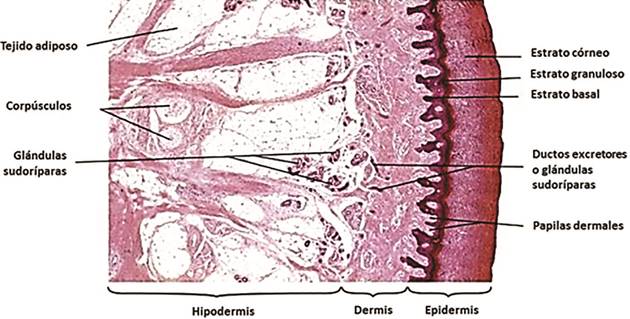
Figura 1 Histología general de la piel. Tinción con hematoxilina eosina de tejido de piel humana de la palma de la mano. Se señalan las capas de la piel: epidermis, dermis e hipodermis. Se observan además los estratos que componen la epidermis; a saber, córneo, granuloso y basal. Modificado de Eroschenko (2008).
Epidermis
Es la capa más superficial de la piel, cuya principal función es protegerla ante lesiones físicas, químicas y biológicas. Está compuesta mayoritariamente por queratinocitos, e incluye además otras células dendríticas residentes como las células de Langerhans, melanocitos y células de Merkel (Foster y Foil, 2008). Los queratinocitos, además de constituir una importante barrera protectora entre el interior y el exterior del organismo, desempeñan un papel fundamental en el sistema inmune de la piel (principalmente en los procesos inflamatorios) y se encargan de la producción de queratina, principal proteína estructural de la epidermis (Fitzpatrick, 2006 e Ibisch, Bourdeau, Cadiot, Viac y Gatto, 2007).
La epidermis consta de varias subcapas o estratos principales. El estrato basal está compuesto de melanocitos y queratinocitos, producidos por un número pequeño de células madre empaquetadas en columnas, así como de un gran repositorio de células progenitoras de vida corta llamadas células amplificadoras transitorias. Los queratinocitos de este estrato tienen la capacidad de dividirse y migrar hacia el exterior para el recambio continuo de las células del estrato córneo. Estos queratinocitos contienen abundantes ribosomas libres en el citoplasma para la síntesis de queratina (Fitzpatrick, 2006 y Atiyeh y Costagliola, 2007).
Los queratinocitos poligonales del estrato espinoso y los queratinocitos fusiformes con gránulos de querato-hialina del estrato granuloso también se encargan de la síntesis y producción de queratina (Pavletic, 1991). El estrato córneo, la capa más externa, está compuesta por 15 a 20 filas de células terminales sin núcleo, de morfología alargada y con depósitos de queratina y filagrina. Estas células se descaman continuamente en la superficie de la piel y por esa razón son reemplazadas de manera constante (Young, Lowe, Stevens y Heath, 2006).
Dermis
El tejido conectivo organizado de la dermis consiste en una matriz extracelular de proteínas fibrosas y no fibrosas, con células permanentes y transitorias, vasos sanguíneos y linfáticos, nervios y tejido muscular suave. Asimismo, en esta capa se alojan estructuras como glándulas y folículos pilosos. La dermis se divide en dos subcapas: la dermis papilar y la dermis reticular. Ambas capas integran una estructura sensorial que almacena una parte significativa del agua corporal, a la vez que brinda resistencia mecánica, elasticidad, homeostasis, defensa inmune y cicatrización (Prost-Squarcioni, 2006 y Sánchez et al., 2010).
Las células residentes de la dermis son los fibroblastos, las células mesenquimales con forma dendrítica y los mastocitos (Kanitakis, 1998 y Sánchez et al., 2010). Los fibroblastos son las células más abundantes de este tejido y son metabólicamente muy activas en la secreción de componentes de la matriz extracelular. En general, se encargan de la síntesis y degradación (recambio) del tejido conjuntivo fibroso y no fibroso de la matriz extracelular proteica. Su morfología se caracteriza por un aspecto alargado, fusiforme o estrellado, el cual depende del tipo de matriz extracelular en la que se encuentren inmersos (Foster y Foil, 2008; Gómez y Campos, 2009). Los miofibroblastos son células derivadas de los fibroblastos; aparecen durante los procesos de cicatrización, en los cuales sintetizan y contraen proteínas de la matriz extracelular, remodelando el tejido para la formación de la cicatriz (Smaldone et al., 2011).
La abundante matriz extracelular que rodea a todas las células de la dermis está compuesta de ácido hialurónico, varios tipos de colágeno, fibrina, elastina, fibronectina, tenascina, epimorfina y reticulina (Radostits, Houston y Mayhew, 2002; Prost-Squarcioni, 2006 y Sánchez et al., 2010).
Lámina basal
La lámina basal es una interfaz compleja y funcional que media la adhesión entre la dermis y la epidermis. Esta estructura contiene a las células basales de la epidermis y es rica en proteínas de matriz extracelular y factores de crecimiento (Foster y Foil, 2008 y Fuchs, 2009). Puede dividirse en cuatro áreas estructuralmente diferenciables: la interfaz hemidesmosoma/lámina lúcida superior, la lámina lúcida inferior, la lámina densa y las fibrillas de anclaje contenidas en la sublámina densa. Los hemidesmosomas (estructuras proteicas transmembrana) conectan el interior de la célula con la matriz extracelular de la lámina basal, formando una estructura funcional que adhiere los queratinocitos al tejido conectivo subyacente (Zambruno y Failla, 1999 y Prost-Squarcioni, 2006).
Cultivo in vitro de fibroblastos y queratinocitos
Los primeros trabajos para el cultivo in vitro de piel humana datan de hace más de un siglo; sin embargo, aunque la producción de epitelios cultivados in vitro se inició formalmente en la década de 1950, no fue sino hasta que Rheinwald y Green publicaron su trabajo sobre el crecimiento y la proliferación de queratinocitos in vitro en 1975 que se logró el cultivo eficiente de las células epidérmicas, obteniéndose grandes rendimientos a partir de una biopsia pequeña, con láminas de epitelio estratificado que mantuviese las características de una epidermis auténtica (Brychta, Adler, Rihovd y Komdrkovd, 1994; Leigh y Birgitte, 1994 y Atiyeh y Costagliola, 2007). Se han desarrollado diversas modificaciones y alternativas al protocolo de Rheinwald y Green, pero su trabajo sigue siendo el modelo de referencia para el establecimiento de cultivos in vitro de fibroblastos y queratinocitos de piel humana, y en él se basan la mayoría de los procedimientos descritos a continuación.
Obtención y cultivo de queratinocitos
Para el cultivo de queratinocitos es necesario tomar una muestra de 2 a 3 cm2 de piel sana, generalmente de la axila o del área púbica, al mismo tiempo que se hace el desbridamiento inicial y la curación tradicional de la lesión en la zona que se va a tratar (Atiyeh y Costagliola, 2007). La toma de esta biopsia debe hacerla personal médico especializado, y el tejido debe colocarse inmediatamente en un recipiente con un medio nutritivo adecuado para su transporte al laboratorio de cultivo celular. Las células humanas epidérmicas son aisladas de la pequeña biopsia de piel, utilizando técnicas de disociación mecánica y enzimática bajo condiciones totalmente estériles (figura 2). El protocolo implementado en el Laboratorio de Ingeniería de Tejidos realiza primero una desinfección superficial del tejido para eliminar los contaminantes ambientales (utilizando lavados con yodo, etanol 70% y solución salina con antibióticos de amplio espectro). Seguidamente, la separación de la dermis de la epidermis se realiza mediante enzimas como la dispasa, la hialuronidasa y, de preferencia, la colagenasa, para destruir la lámina basal y liberar cada tejido. Finalmente, en el Laboratorio de Ingeniería de Tejidos se emplea la colagenasa para disgregar la dermis y la tripsina para la epidermis, obteniéndose células individuales.
En este sentido, se ha encontrado que el uso de dispasa puede causar la pérdida de hasta 37% del total de células clonogénicas (Atiyeh y Costagliola, 2007). Dado que la dispasa es una metaloproteinasa que destruye la fibronectina, el colágeno IV y el colágeno I de la lámina basal (Tavira, Ortega, Dávila, Estrada y Meneses, 2009), es posible que cause además la destrucción y pérdida temporal de las α6β4-Integrinas (esenciales para la adhesión) de las células clonogénicas del estrato basal cercano (Atiyeh, Hayek y Gunn, 2005), lo cual podría inducir a los queratinocitos a entrar en un proceso de diferenciación debido a la ausencia de anclaje, tal como se ha reportado que ocurre con otras metaloproteinasas de matriz (Muffler et al., 2008). Debido a esto, en el Laboratorio de Ingeniería de Tejidos se ha preferido la utilización de colagenasa para separar la dermis de la epidermis, con resultados satisfactorios.
Una vez obtenidas las células, los queratinocitos aislados del tejido se inoculan sobre una capa de células alimentadoras o feeder-layer (como, por ejemplo, de líneas celulares murinas tales como 3T3-J2 o 3T3-152), cuya mitosis ha sido inhibida por radiación. La función de esta capa alimentadora es actuar como una matriz mesenquimal in vitro, dado que se sabe que los queratinocitos son células altamente dependientes de la interacción con proteínas de matriz extracelular para su supervivencia y proliferación (Hernon et al., 2006 y Atiyeh y Costagliola, 2007), pero son incapaces de producir algunas proteínas de la lámina basal (Ikada, 2006; Arango, Chamorro, Restrepo, Correa y Henao, 2009). Las células de la capa alimentadora permiten una óptima expansión clonal de las células epiteliales y promueven la proliferación y el crecimiento de los queratinocitos (Atiyeh y Costagliola, 2007).
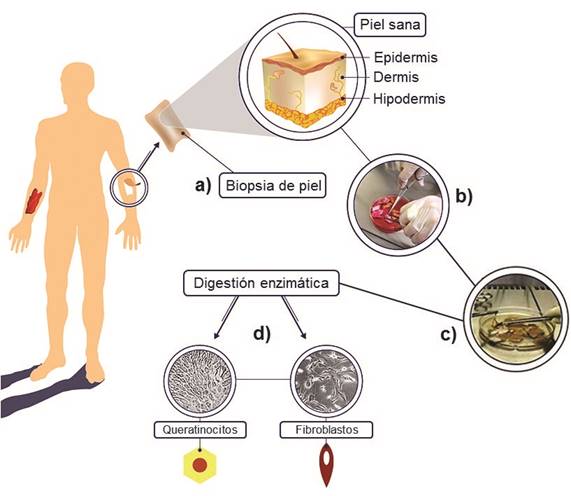
Figura 2 Obtención de fibroblastos y queratinocitos a partir de una biopsia de piel. Se toma un fragmento de tejido de 2-3 cm2 de profundidad parcial (a). En el laboratorio, el tejido se desinfecta (b) y se separa la dermis de la epidermis (c), y ambos tejidos se disgregan en células individuales utilizando enzimas (d) para su posterior inoculación en el medio de cultivo correspondiente.
Las capas de células alimentadoras se pueden obtener a partir de células irradiadas subletalmente con rayos X o rayos γ; además, también se pueden aplicar tratamientos químicos con mitomicina C (Freshney, 2010). Ambos tratamientos generan células no proliferativas que se pueden mantener viables hasta por varias semanas. En el Laboratorio de Ingeniería de Tejidos, se preparan capas alimentadoras de fibroblastos irradiados con rayos X a una dosis de 80 Gy.
Por otro lado, los queratinocitos se cultivan en medios de cultivo celular que proveen a las células, de forma bastante aproximada y específica, de los requerimientos fisiológicos normales del ambiente in vivo, a la vez que inhiben el crecimiento de otros tipos celulares. El medio de cultivo tradicional para los queratinocitos incluye el medio Eagle modificado de Dulbecco (DMEM, por sus siglas en inglés) combinado con el medio Ham’s F12 (en una proporción 3:1) y suplementado con suero fetal bovino (SFB), antibióticos (generalmente penicilina y estreptomicina), antimicóticos (usualmente anfotericina B), factor de crecimiento epidermal (EGF), hidrocortisona, toxina colérica (como factor mitogénico), adenina, insulina, transferrina, glutamina y triiodotironina (Hernon et al., 2006). En nuestro laboratorio, también se agrega piruvato de sodio y/o HEPES para estabilizar el pH.
Bajo estas condiciones, algunos queratinocitos resultan competentes para iniciar colonias y, después de 3 a 4 semanas, los cultivos pueden pasar de monocapa a multicapa, formando estratos con un espesor de hasta 8 a 10 capas celulares. La población inicial de queratinocitos es amplificada por subcultivo (usualmente utilizando el método enzimático con tripsina-EDTA). La adición de factores de crecimiento y suero al medio de cultivo permite un crecimiento óptimo de las células, y un nivel relativamente alto de calcio (1,8 mM), y posibilitan la diferenciación parcial y la estratificación de las células luego de alcanzada la confluencia, de manera que se puede formar una multicapa intacta de células epiteliales (Atiyeh y Costagliola, 2007).
Sin embargo, la estratificación del cultivo implica directamente la diferenciación de los queratinocitos, de manera que es recomendable mantener las células en monocapa con el fin de propiciar la selección y mantenimiento de las propiedades progenitoras de las células madre con alta capacidad proliferativa. Esto incide en la incorporación del injerto al tejido tratado, así como en la funcionalidad de las células por trasplantar en el largo plazo, con resultados clínicos permanentes (Atiyeh et al., 2005).
No obstante, el cultivo primario in vitro de la población progenitora de células madre de la epidermis es limitado, ya que solo el 1% o menos de las células del estrato basal de este tejido son células madre. Se asume que las células madre se dividen de forma asimétrica, produciendo en cada división una célula hija con calidad de célula madre (la cual raramente prolifera) y una célula hija con capacidad proliferativa limitada, llamada célula amplificadora transitoria, la cual genera un linaje que se divide durante un número finito de ciclos celulares hasta diferenciarse y morir (Muffler et al., 2008 y Atiyeh y Costagliola, 2007).
Así, la vida a largo plazo de los queratinocitos cultivados depende de la subpoblación o linaje que da origen a las colonias en el cultivo, las cuales pueden ser iniciadas por queratinocitos clonogénicos, llamados holoclones y meroclones, los cuales poseen un potencial de crecimiento significativo; o por queratinocitos con un potencial restringido de crecimiento, llamados paraclones. La transición de holoclones a meroclones y a paraclones es un proceso unidireccional irreversible que ocurre lentamente durante el envejecimiento (Atiyeh y Costagliola, 2007). Esto implica que las colonias originadas desde paraclones se perderán en fases tempranas del cultivo, mientras que las colonias originadas desde holoclones o meroclones tendrán el mayor potencial de proliferación a largo plazo.
Aun así, la eficiencia de formación de colonias de los queratinocitos recién aislados de biopsias suele ser muy baja (de 0,15 a 3,8%), y el número de queratinocitos clonogénicos por mm2 de piel varía grandemente entre individuos y zonas anatómicas. Hacia el final del cultivo primario, un gran número de queratinocitos (hasta 59%) puede llegar a formar colonias, pero la cantidad de colonias con potencial de crecimiento restringido (abortivas) aumenta con los sucesivos pasajes o por condiciones inadecuadas de cultivo. No obstante, se ha estimado que las células de una biopsia de piel de 3 cm2 pueden ser expandidas de 5000 a 10000 veces en 3 a 4 semanas, generando suficiente piel para cubrir la superficie corporal de un adulto (Atiyeh y Costagliola, 2007). En este sentido, un estudio en curso en nuestro laboratorio (datos no publicados) ha mostrado que los queratinocitos obtenidos por los métodos aquí descritos se mantienen poco diferenciados y retienen una alta capacidad proliferativa hasta el pasaje o subcultivo número 6 y 20, respectivamente.
Obtención y cultivo de fibroblastos
Los fibroblastos de la dermis pueden ser aislados de la misma biopsia de piel inicial de la cual se obtienen los queratinocitos. Los fibroblastos tienen una tasa de supervivencia, desarrollo y proliferación in vitro superior a la de los queratinocitos (Gil, 2011); además, no necesitan de capas alimentadoras para su cultivo in vitro, y sus requerimientos nutricionales son menores, por lo que se utilizan medios de cultivo menos exigentes que usualmente incluyen solo DMEM o RPMI, con SFB al 5-10% y antibióticos, aunque también se suelen suplementar con L-glutamina y piruvato de sodio o HEPES para el control de pH (Cofán y Fernández-Solá, 1992; Abdel-Naser, Adallah, Larangeira de Almeida y Wollina, 2005 y Freshney, 2010). Debido a la mayor facilidad para el cultivo de estas células, se pueden establecer cultivos primarios mediante el método del explante o el método de disociación enzimática (Rittié y Fisher, 2005). En el Laboratorio de Ingeniería de Tejidos se prefiere este último, utilizando colagenasa para disgregar las células de la dermis, principalmente porque es más efectivo para obtener gran cantidad de células en un lapso corto de tiempo.
Los fibroblastos humanos normales obtenidos de adultos jóvenes alcanzan la senescencia entre las semanas 10 y 20, y pueden alcanzar de 30 a 50 ciclos de división; aunque se pueden mantener viables hasta por 18 meses luego de alcanzar su punto crítico (Rittié y Fisher, 2005 y Freshney, 2010). Además, para evitar la inducción de anomalías y senescencia por inhibición por contacto, los fibroblastos deben cultivarse en monocapas subconfluentes, y es recomendable criopreservar fibroblastos con bajo número de pasajes, manteniendo así reservas de células genéticamente jóvenes.
Los fibroblastos son esenciales para la curación de las heridas, donde han sido asociados con mejoras en la deposición y remodelación del colágeno y en la formación y organización de las uniones dermoepiteliales; promueven el crecimiento y la supervivencia de los queratinocitos y se ha demostrado que reducen la formación de miofibroblastos y la contracción de las heridas. En general, los fibroblastos mejoran las propiedades mecánicas de los injertos, acelerando el desarrollo de la función del tejido como barrera protectora y el anclaje entre la dermis y la epidermis (Atiyeh y Costagliola, 2007).
Mientras que el uso de queratinocitos autólogos para el tratamiento de lesiones en la piel es esencial para la incorporación adecuada del injerto al tejido basal de la lesión, se ha demostrado que existe tolerancia inmunológica hacia los fibroblastos alogénicos (de un donador diferente al receptor), los cuales parecen ser aceptados por el paciente receptor sin evidencia de rechazo inmunológico en el largo plazo. Esto implica que los injertos epiteliales cultivados in vitro pueden ser producidos con fibroblastos tanto autólogos como alogénicos, donde el uso de fibroblastos alogénicos permitiría la preparación previa de equivalentes dérmicos y el mantenimiento de bancos de reserva, reduciendo el tiempo y esfuerzo necesarios para la elaboración del injerto y la reconstrucción del tejido cuando los pacientes lo requieren. No obstante, estudios recientes han demostrado que el uso de fibroblastos autólogos resulta en mejoras funcionales y estéticas (Atiyeh y Costagliola, 2007).
Trasplante de las células o de los injertos a la lesión
Las células cultivadas in vitro pueden ser trasplantadas a la lesión mediante diversas y numerosas estrategias, que incluyen desde la administración directa de las células en monocapa o en suspensión hasta la aplicación de las células en estructuras histotípicas u organotípicas (sustitutos o equivalentes epiteliales), elaboradas generalmente con andamios de soporte naturales o artificiales.
Actualmente, los esfuerzos se dirigen a la creación por ingeniería de tejidos de sustitutos organotípicos que se asemejen mejor a la microanatomía y la fisiología normales de la piel, de manera que favorezcan una mejor integración en el receptor, con poca o ninguna cicatrización y que reproduzcan y mantengan las propiedades bioquímicas, morfológicas y funcionales del tejido a largo plazo (Atiyeh et al., 2005).
Las estrategias con mejores resultados implican el desarrollo de análogos dermoepidérmicos que incluyen tanto fibroblastos como queratinocitos, con células jóvenes con potencial proliferativo suficiente para sustentar la toma del injerto en el largo plazo. Para ello, las células cultivadas in vitro requieren de un soporte estructural para su aplicación como implante. Una de las técnicas más exitosas utiliza matrices a base de fibrina, una de las proteínas de la sangre involucradas en la coagulación, la cual puede obtenerse de forma autóloga o alogénica a partir de plasma sanguíneo irradiado y certificado de un banco de sangre. Los epitelios así creados (figura 3) permiten preparar una matriz gelificada a base de fibrina dentro de la cual se encuentran embebidos los fibroblastos y sobre la cual se inoculan los queratinocitos. Esta es la técnica que ha sido implementada y optimizada en el Laboratorio de Ingeniería de Tejidos.
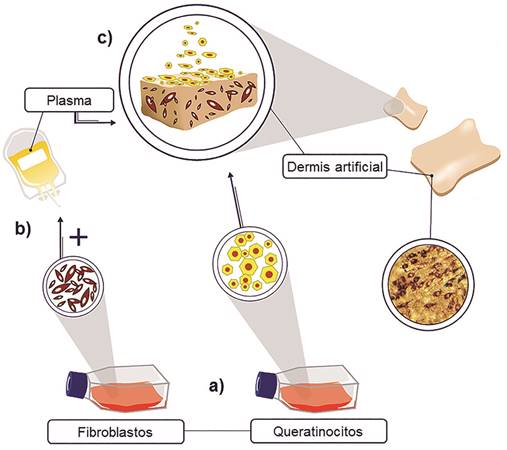
Figura 3 Elaboración de un equivalente dermoepidérmico cultivado in vitro a base de fibrina. Los fibroblastos y queratinocitos se cultivan por separado (a); los fibroblastos son embebidos en plasma sanguíneo (b) junto con una solución de cloruro de calcio para inducir su coagulación. Los queratinocitos posteriormente se inoculan sobre esta “lámina” (c), recreando la disposición que presentan normalmente en el tejido in vivo.
En nuestra experiencia, la lámina dermoepidérmica puede ser sujetada al tejido receptor utilizando puntos quirúrgicos o adhesivos quirúrgicos. El éxito del implante dependerá tanto de la condición fisiológica general del paciente como del estado del tejido receptor, para lo cual es preferible contar con un buen tejido de granulación y ausencia de infecciones y de tejido necrosado. Es importante considerar que el tejido implantado es delgado, por lo que, aunque su adhesión sea buena, será una piel más frágil que la natural y, por lo tanto, más susceptible a las tensiones mecánicas. Por otro lado, rara vez se logra mantener la población de melanocitos original del paciente, lo que resulta en que la piel del injerto sea mucho más sensible a la luz solar natural que la piel original. Sin embargo, el efecto más relevante del injerto es la inducción de la regeneración en la zona de la lesión, donde el injerto estimula la proliferación y migración de las células nativas de la piel del paciente.
Por otro lado, cuando la lesión es de gran profundidad y el tejido receptor no se encuentra en buenas condiciones, puede ser recomendable tratar la lesión primeramente con trasplantes de piel cadavérica o con aplicaciones previas de una suspensión axénica de fibroblastos autólogos embebidos en la matriz de fibrina. Esta matriz de fibroblastos autólogos en fibrina puede ser dispensada directamente sobre la herida, de manera que al gelificar se ajustará estrictamente a la forma de la lesión.
Las aplicaciones de fibroblastos en fibrina no necesariamente son permanentes, ya que no siempre estarán sujetas al tejido receptor con puntos quirúrgicos o adhesivos, pues solo se mantendrán sobre la herida durante varios días utilizando vendajes con gasa vaselinizada. Durante este período, los factores de crecimiento secretados por los fibroblastos del implante estimularán la proliferación y crecimiento de las células vivas de la lesión, preparando el tejido basal para la aplicación de equivalentes dermoepidérmicos más elaborados, tal como se describió previamente. Es poco probable que los fibroblastos de las aplicaciones iniciales se incorporen al tejido basal, pero podrán favorecer el depósito de proteínas de matriz extracelular (principalmente colágeno) sobre el lecho de la herida, lo cual contribuye a la regeneración de la lesión.
Finalmente, dado que se tarda alrededor de 2 a 4 semanas en amplificar suficiente cantidad de células para cubrir la herida, durante este período se deberá tratar al paciente con los métodos convencionales de debridación, irrigación, curación y vendaje, con el fin de evitar la deshidratación y reducir el riesgo de infección, y a la vez preparar la herida para la recepción de los implantes. En todos los casos, es posible cubrir la lesión con implantes de piel cadavérica mallada durante el período de cultivo de las células y de preparación de los equivalentes dermoepidérmicos. Además, la técnica del “emparedado”, en la cual se cubren los análogos dermoepidérmicos con piel cadavérica usualmente mallada, ha sido ampliamente recomendada con el mismo propósito de protección.
Consideraciones finales
Los esfuerzos realizados por el ITCR en el área de ingeniería de tejidos, a través del establecimiento y optimización de procedimientos para el cultivo in vitro de células de piel humana, han permitido que esta tecnología se encuentre disponible para el tratamiento de pacientes con lesiones en la piel en Costa Rica. No obstante, para ampliar y difundir la implementación clínica de estos procedimientos en nuestro país resulta necesario que el personal médico y de atención clínica se familiaricen y conozcan más sobre ellos. Además, es imprescindible establecer alianzas entre el sector médico y las universidades, con el fin de posibilitar el desarrollo y traducción clínica de este tipo de productos para su uso cotidiano en la práctica clínica.














