Introducción
La planta de fresa (Fragaria ananassa (Weston) Roziersp.) produce frutos de vida útil muy corta, la cual depende de la temperatura de almacenamiento, Acosta (2019) indicó que el período varía entre 2 y 8 días, a 37°C y 4°C, respectivamente. Los frutos son considerados como un alimento funcional, debido a su alto contenido de vitamina C, taninos y antioxidantes, ya que proporcionan beneficios a la salud humana, como protección contra eventos cardiovasculares (Do Carmo et al. 2015).
En Costa Rica, el cultivo es permanente y está en manos de pequeños productores, repartidos en 342 fincas, la mayoría (39%) ubicadas en la provincia de Cartago, seguida de Alajuela y San José, con 21% cada una, y finalmente, Heredia con el 16%. Además, se reportan 9 fincas productoras de fresa, en la provincia de Puntarenas (INEC 2015).
Según datos generados en los censos locales realizados por las Agencias de Extensión del Ministerio de Agricultura y Ganadería, que dan apoyo a los productores de las zonas de Poás y Llano Grande, se registró una reducción de 93 ha de cultivo entre 2016-2017 (Avendaño 2017, Zuñiga 2017).
Esta disminución en área se asume que se debió principalmente a la aparición de una enfermedad de etiología desconocida, que provoca la muerte de lotes enteros. La sintomatología que describen los productores es marchitez y muerte de plantas en estado reproductivo, la cual inicia con coloración anormal de las hojas bajeras, que se tornan rojizo-púrpura, desde el margen hacia la lámina con deshidratación hasta senescer. El sistema radical es pobre, con zonas necróticas y reducido sistema absorbente.
Al disectar las plantas enfermas fue posible observar diversos grados de decoloración de la médula de la corona, que van desde punteados rojizos en tejido compacto, hasta áreas extensas de consistencia friable con tonalidades cobre-rojizas.
Desde 2005, se han reportado problemas fitosanitarios en fresa en el ámbito mundial, que se denominaron pudrición de raíz y corona y que han sido asociados a diferentes especies de hongos. En Australia, se definió que los agentes asociados a la muerte de plantas eran Fusarium oxysporum f.sp. fragariae (FOF) y Phytophthora cactorum, aislados de corona y raíces, respectivamente. También, reportaron la presencia de Pythium spp., Phoma spp., Rhizoctonia spp., Colletotrichum spp. y Macrophomina spp. (Golzar et al. 2007). Fusarium oxysporum se ha reportado en otros países como Corea, China, España, Estados Unidos, Japón y México (Suga et al. 2013; Bracénas-Santana et al. 2019) y la enfermedad se conoce como marchitez por Fusarium o secadera de la fresa.
En España y Estados Unidos se observó colapso y secamiento de plantas de fresa de distintas variedades, denominada pudrición carbonosa; se concluyó por medio de pruebas de patogenicidad, que el causante de la enfermedad era Macrophomina phaseolina. Al parecer, la aparición del daño está relacionada al desuso del bromuro de metilo y a condiciones de estrés por clima cálido y riego escaso (Avilés et al. 2008, Koike et al. 2013).
De acuerdo con los mismos autores, los síntomas de marchitez y pudrición carbonosa son indistinguibles en el campo, ya que ambos ocurren en las mismas zonas, por lo que cualquier finca puede tener las 2 enfermedades.
En 2016, España reportó al hongo Neopestalotiopsis clavispora como el causante de la pudre de corona y raíz en fresa (Chamorro et al. 2016). Finalmente, en 2017, Weber y Entrop indicaron que anamorfos tipo Cylindrocarpon tenían un rol importante en el complejo denominado muerte negra de las raíces de fresa y frambuesa en Alemania.
Por lo expuesto, en 2017 se inició una investigación con el fin de determinar la patogenicidad de hongos asociados a plantas de fresa enfermas en Costa Rica; así como, describir morfológicamente la relación hospedero-patógeno.
Materiales y métodos
Material vegetal y aislamientos. Se recolectaron 6 plantas enfermas de fresa variedad Festival, provenientes de 3 fincas ubicadas en el distrito de Llano Grande, Cartago. Se trasladaron al Centro de Investigación en Estructuras Microscópicas (CIEMic) de la Universidad de Costa Rica; luego se procedió a describir los síntomas (Figura 1) y a realizar aislamientos a partir de raíces y coronas en medio de cultivo agar agua rosa de bengala (AARb). Los aislamientos se incubaron a 24°C en oscuridad por 7 días. Luego, se realizaron cultivos de punta de hifa en medio de cultivo papa-dextrosa-agar (PDA). Una vez desarrollados, se determinaron los morfotipos recuperados de acuerdo con la coloración del cultivo y características microscópicas como tipo de conidioma, conidióforo y conidio. Se eligieron 3 para la prueba de patogenicidad, de acuerdo con la posible capacidad patogénica informada en la literatura.

Figura 1 Síntomas de colapso de plantas de fresa variedad Festival recolectadas en campo. A. Síntomas en follaje. B y C. Síntomas en corona. D, E y F. Síntomas en raíz.
En el Centro de Investigaciones en Productos Naturales (CIPRONA) de la Universidad de Costa Rica, se extrajo el ADN de los morfotipos seleccionados, por medio del kit Prepman Ultra (Applied Biosystems™). Se realizó PCR de la región del espaciador interno transcrito del ADN nuclear ribosomal (nrDNA ITS por sus siglas en inglés), código de barras fúngico (Schoch et al. 2012), con los imprimadores ITS 5 e ITS 4 (White et al. 1990). Los productos se enviaron a Macrogen (USA) para su purificación y secuenciación. Las secuencias obtenidas se editaron y alinearon con el programa Geneious 11.1.5., y luego se compararon con las bases de datos del NCBI mediante BLAST. Se consideró en el rango de especie aquellas secuencias que obtuvieron similitudes de 100%. Si el porcentaje fue del 99% se definió como posible especie (cf.) y si se obtuvo entre 96-98% se determinó como especie relacionada (aff.) (Hofstetter et al. 2019). Con respecto al rango de género se consideró una similitud del 97% (López et al. 2017). Las secuencias de ITS de los morfotipos seleccionados fueron depositadas en GenBank.
Prueba de patogenicidad. Se preparó inóculo a base de alimento para caballo de “Forraje completo”, compuesto de gránulos de alfalfa. Se usó la metodología de Leslie y Summerell (2007). Se manejaron suspensiones de 3,5 x 10⁵ conidios/ml de cada morfotipo para la inoculación del sustrato.
Se utilizaron 25 plantas de fresa variedad Festival, producidas en invernadero, bajo sistema hidropónico, para cada hongo a evaluar y 25 como control, para un total de 100 plantas. Todas se sembraron en bolsas negras de polietileno de 3L con granza quemada esterilizada y mezclada con 10g de sustrato inoculado con las suspensiones conidiales, excepto el sustrato de las plantas control.
Las plantas se mantuvieron durante un ciclo completo de producción de 19 semanas, para exponerlas tanto a la etapa vegetativa como reproductiva.
La prueba se ubicó bajo invernadero, no hubo precipitación desde enero hasta marzo. En abril se registraron 26 mm, en mayo 450 mm y junio 83 mm. El sitio alcanzó una temperatura máxima de 26,2°C y una temperatura mínima de 17,9°C; la humedad relativa varió entre 31,6 y 87,6 (Figura 2).
Trascurrido ese período, se trasladaron al laboratorio para realizar el registro de síntomas internos a nivel de corona y raíz. Se realizaron aislamientos a partir de tejidos con y sin síntomas visibles. Además, se tomó muestra de tejido sintomático para el procesamiento en microscopía electrónica de barrido.
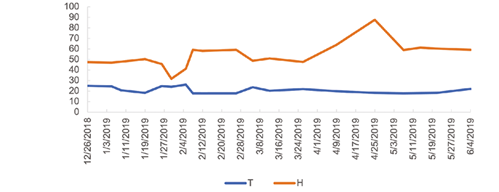
Figura 2 Temperatura (T) en °C y porcentaje de humedad relativa (H) registrada semanalmente durante el período de la prueba de patogenicidad de Fusarium oxysporum, Neonectria sp. y Sydowia polyspora en plantas de fresa (Fragaria ananassa (Weston) Roziersp.) variedad Festival bajo invernadero.
Los aislamientos, extracción y secuenciación de ADN se realizaron de la misma manera que para los aislamientos originales. Las secuencias de ITS de los hongos inoculados fueron depositadas en GenBank. Luego se procedió a comparar las identidades de los hongos inoculados con las de los hongos recuperados.
Descripción ultraestructural del patosistema. Se tomaron secciones de raíz de las plantas enfermas como producto de la prueba de patogenicidad, y se colocaron en solución fijadora de Karnovsky compuesta por glutaraldehído 2,5%, paraformaldehído 2%, sacarosa al 4% en amortiguador de fosfatos de sodio 0,1M pH 7,4. Posteriormente, las muestras se lavaron con amortiguador y se post-fijaron con tetraóxido de osmio 2%. Después se deshidrataron con un gradiente ascendente de etanoles (30º, 50º, 70º, 80º, 90º, 95º, 100º, 100º) y se secaron por punto crítico. Una vez secas, se cubrieron con una capa de 200nm de oro y se observaron con el microscopio electrónico de barrido Hitachi S-3700N.
Resultados
Aislamientos iniciales e identificación molecular. Se obtuvieron 10 aislamientos de tejido proveniente de coronas con manchas de apariencia corchosa, y 22 aislamientos de raíces, a partir de diversos síntomas como necrosis, manchas naranjas y café, que fueron clasificados en 9 morfotipos (Tabla 1), nombrados de acuerdo con las características del cultivo en PDA, como coloración, tipo de conidioma, conidióforos y conidios.
Tabla 1 Características y cantidad de morfotipos recuperados a partir de corona y raíz de plantas de fresa cv. Festival enfermas.
| Morfotipo | Coloración del cultivo* | Conidioma | Conidióforos | Conidios | Cantidad de aislamientos según órgano de la planta | ||
| Corona | Raíz | ||||||
| Cladosporium | gris-oliva | ausente | libres | polimórficos, amero y didimo | 0 | 1 | |
| ab Cylindrocarpon** | café-ambar | ausente | fiálides | macro y micro | 1 | 3 | |
| b Fusarium** | blanco-rosa-violeta | ausente | polifiálides | macro y micro | 0 | 2 | |
| Dothideomycete** | gris oscuro-oliva | picnidios | célula conidiógena | amero | 5 | 2 | |
| Mucoral | gris | ausente | esporangióforo-columela | unicelular | 0 | 1 | |
| No identificado | blanco-beige | ausente | libres | amero | 0 | 4 | |
| Penicillium | verde-gris | ausente | libres- penicilados | amero | 1 | 1 | |
| Pestalotiopsis | blanco | acérvulos | célula conidiógena | fragmo | 3 | 5 | |
| Trichoderma | verde | ausente | libres | amero | 0 | 3 | |
a Cylindrocarpon
bProdujeron clamidosporas
*Siete días de crecimiento en PDA a la oscuridad, ±24°C
**Morfotipos seleccionados para la prueba de patogenicidad
La prueba de patogenicidad se realizó con los aislamientos: F2 del morfotipo Fusarium, F33 del morfotipo anamorfo tipo Cylindrocarpon, ambos recuperados de raíz, y el aislamiento F238 del morfotipo Dothideomycete, proveniente de corona. La secuenciación del producto de amplificación del ITS indicó que las unidades taxonómicas operativas para esos aislamientos corresponden a Fusarium oxysporum (F2), Neonectria sp. (F33) y Sydowia polyspora (F238), respectivamente (Tabla 2).
Tabla 2 Código de aislamiento, morfotipo, identificación molecular, número accesión en GenBank, accesión de comparación y % de similitud, de la secuencia de ITS de individuos aislados a partir de plantas enfermas de fresa (Fragaria ananassa (Weston) Roziersp.) variedad Festival.
| Código aislamiento | Morfotipo | Identificación molecular | Número de accesión en GenBank | Accesión de comparación | % de similitud |
| F2 | Fusarium | Fusarium oxysporum | MW622035 | EU849584 | 99,6 |
| F33 | Cylindrocarpon | Neonectria sp. | MW622037 | JX243950 | 99,2 |
| F238 | Dothideomycete | Sydowia polyspora | MW622039 | KF993419 | 99,8 |
Prueba de patogenicidad. La sintomatología del follaje fue inespecífica, ya que todas las plantas a nivel foliar expresaron los síntomas de enrojecimiento, manchas foliares, quema de bordes y senescencia, incluso se presentó en las plantas control (Figura 3A).
En las coronas el daño se presentó de distintas maneras, en las plantas inoculadas con Sydowia polyspora, 58% de las coronas presentaba puntos cafés o amarillos en el centro o hacia los lados, el 42% restante no presentó síntomas visibles. Las plantas inoculadas con F. oxysporum presentaron 55% de lesiones cafés con aspecto corchoso y el 45% restante no presentó síntomas. En las inoculadas con Neonectria sp. los síntomas en la corona fueron de un 50% con puntos cafés de aspecto corchoso y la otra mitad no presentaba síntomas visibles. Las plantas sin inocular no presentaron síntomas visibles (Figura 3B, D, F, H).
Las plantas inoculadas con F. oxysporum presentaron raíces secundarias abundantes, lesiones cobrizas aleatorias y coloración rojiza generalizada. Las plantas inoculadas con Neonectria sp. perdieron importante volumen radical (no cuantificado), las raíces que permanecieron mostraron necrosis intensa tipo tizón y muy poco sistema absorbente. Por su parte, las plantas inoculadas con S. polyspora mostraron daños radicales intermedios, siempre con presencia de necrosis y coloración rojiza; además las plantas en general se observaron de menor tamaño. Mientras que, las plantas sin inocular tenían raíces abundantes y asintomáticas (Figura 3C, D, G, I).

Figura 3 Apariencia de plantas de fresa (Fragaria ananassa (Weston) Roziersp.) variedad Festival, luego de 19 semanas en invernadero. A. Síntomas en follaje. B-C. Corona y sistema radical de planta control (sin inocular). D-E. Corona y sistema radical de planta inoculada con Fusarium oxysporum s.l (F2). F-G. Corona y sistema radical de planta inoculada con Neonectria sp. (F33). H-I. Corona y sistema radical de planta inoculada con Sydowia polyspora (F238).
De los aislamientos obtenidos a partir de tejido enfermo de plantas inoculadas, se recuperaron aislamientos con los mismos morfotipos inoculados (Figura 4). Se eligieron 3 aislamientos: F2_52, F33_50 y F238_49 (Tabla 3) para realizar la identificación molecular, la cual indicó que los aislamientos F2_52 y F238_49 corresponden a los mismos organismos aislados de las plantas de campo, F. oxysporum y S. polyspora, respectivamente. En el caso del aislamiento F33_50, la secuencia del ITS lo asoció con una especie de Dactylonectria.
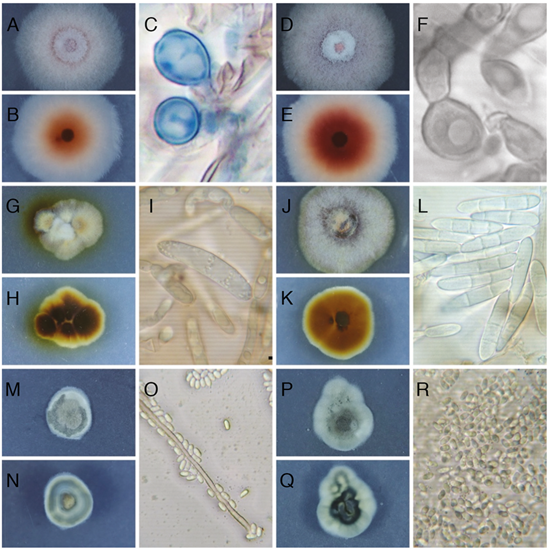
Figura 4 Características morfológicas de los aislamientos inoculados y recuperados a partir de plantas de fresa (Fragaria ananassa (Weston) Roziersp.) variedad Festival, luego de 19 semanas en invernadero. A, B y C. Aislamiento F2, Fusarium oxysporum s.l., luego de 7 días de crecimiento en PDA. A Colonia anverso. B Colonia reverso. C Clamidosporas. D, E y F. Aislamiento F2_52, Fusarium oxysporum s.l., luego de 7 días de crecimiento en PDA. A Colonia anverso. B Colonia reverso. C Clamidosporas. G, H e I. Aislamiento F33, Neonectria sp. luego de 7 días de crecimiento en PDA. A Colonia anverso. B Colonia reverso. C Macroconidios. J, K y L. Aislamiento F33_50, Dactylonectria sp., luego de 7 días de crecimiento en PDA. A Colonia anverso. B Colonia reverso. C Macroconidios y un microconidio. M, N y O. Aislamiento F238, Sydowia polyspora, luego de 7 días de crecimiento en PDA. A Colonia anverso. B Colonia reverso. C Hifa y conidios. P, Q y R. Aislamiento F238_49, Sydowia polyspora, luego de 7 días de crecimiento en PDA. A Colonia anverso. B Colonia reverso. C Conidios.
Tabla 3 Código de aislamientos a partir de plantas inoculadas, identificación molecular, número de accesión en GenBank, accesión de comparación y % de similitud, de las secuencias de ITS de individuos de los morfotipos recuperados a partir de plantas de fresa (Fragaria ananassa (Weston) Roziersp.) variedad Festival inoculadas para la prueba de patogenicidad.
| Código de aislamientos a partir de plantas inoculadas | Identificación molecular | Número de accesión en GenBank | Accesión de comparación | % de similitud |
| F2_52 | Fusarium oxysporum | MW622036 | EU849584 | 99,6 |
| F33_50 | Dactylonectria sp. | MW622038 | JX244050 | 99,4 |
| F238_49 | Sydowia polyspora | MW622040 | KF993419 | 99,8 |
Descripción ultraestructural. Las observaciones en el microscopio electrónico de barrido mostraron que las raíces de plantas enfermas presentaron desintegración de la epidermis, lo que deja al descubierto la corteza radical, además adherencia y germinación de esporas, así como colonización del parénquima cortical (Figuras 5, 6 y 7).
En el caso de las plantas inoculadas con Fusarium oxysporum y anamorfos tipo Cylindrocarpon fue posible observar la presencia de conidióforos tipo fiálides (Figuras 5C y 7C). Para S. polyspora se apreció el desarrollo de una densa red de hifas (Figura 6B). En todas se notó la presencia de material tipo granular.
En plantas colonizadas por el aislamiento F33 (anamorfos tipo Cylindrocarpon) se observó desprendimiento de la corteza y exposición de la endodermis cerca de la caliptra (Figura 7A), el daño se pudo observar tanto en raíces primarias como en pelos absorbentes (Figura 7A, D).

Figura 5 Microscopía electrónica de barrido (MEB) de raíces de plantas de fresa (Fragaria ananassa (Weston) Roziersp.) variedad Festival inoculadas con el aislamiento F2 (Fusarium oxysporum s.l), luego de 19 semanas en invernadero. A. Raíz principal con pérdida casi total de epidermis (Ep) y exposición del parénquima cortical (Pc). B. Presencia de macroconidios (Mc) y microconidios (mc) en las zonas sin epidermis, algunos en proceso de germinación (mcg). C. Presencia de conidióforos tipo monofiálide (Cf) con cabeza de microconidios (c).
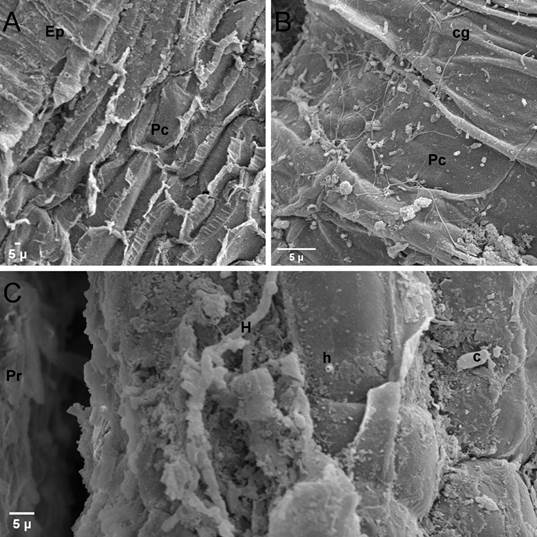
Figura 6 Microscopía electrónica de barrido (MEB) de raíces de plantas de fresa (Fragaria ananassa (Weston) Roziersp.) variedad Festival inoculadas con el aislamiento F238 (Sydowia polyspora), luego de 19 semanas en invernadero. A. Pérdida de epidermis (Ep) y exposición del parénquima cortical (Pc). B. Germinación de conidios (cg) sobre parénquima cortical. C. Desarrollo de hifas (H y h) cerca del punto de inserción de un pelo radical (Pr). Presencia de un conidio (c).

Figura 7 Microscopía electrónica de barrido (MEB) de raíces de plantas de fresa (Fragaria ananassa (Weston) Roziersp.) variedad Festival inoculadas con el aislamiento F33 (Neonectria sp./Dactylonectria sp.), luego de 19 semanas en invernadero. A. Ápice radical con pérdida de epidermis (Ep), exposición de parénquima cortical (Pc). B. Detalle del área dañada. C. Presencia de hifas (H) y conidióforo (Cf) en la epidermis. D. Daño en la superficie de un pelo radical.
Discusión
Las pruebas de patogenicidad realizadas en invernadero demostraron la reproducibilidad de los síntomas observados en campo. Mostró que es posible diferenciar por medio de la sintomatología a nivel de corona cual hongo está asociado a una sintomatología en particular; mientras que, los síntomas expresados en follaje, no son decisivos, ya que incluso para las plantas no inoculadas, fue posible registrar la aparición de enrojecimiento, bordes quemados y senescencia prematura (Figura 3).
Esto indica que, dichas alteraciones están más relacionadas a algún tipo de estrés abiótico que a un hongo de forma específica, aunque la infección puede acrecentar los síntomas. Weber y Entrop (2017) indicaron que plantas expuestas a estrés por sequía o saturación de humedad presentan síntomas más severos.
También, se comprobó que los 3 hongos inoculados provocan el deterioro del sistema radical y que hay algunas diferencias en la magnitud de la sintomatología expresada de acuerdo con el género de hongo que cause la infección. El aporte en las plantas inoculadas con anamorfos tipo Cylindrocarpon (Neonectria/Dactylonectria) y S. polyspora se notó mayor disminución en el volumen del sistema radical, lesiones más severas y pérdida casi total de los pelos absorbentes, en comparación con las inoculadas con F. oxysporum y las no inoculadas (Figura 3C, E, G, I).
La sintomatología observada, tanto en campo como en la prueba de patogenicidad, concordó con los síntomas documentados por varios autores. Al respecto, Koike (2008) y Hutton et al. (2013) mencionaron que pueden deberse a Macrophomina phaseolina; además, Williamsom et al. (2012) y Koike et al. (2013) indican que los síntomas se asocian a Fusarium oxysporum f.sp. fragariae, mientras que Adhikari et al. (2013), así como, Weber y Entrop (2017) señalan que anamorfos tipo Cylindrocarpon son responsables de estos síntomas. En igual forma, CABI (2019) informa que Neonectria radicicola provoca la podredumbre negra del fresal, con síntomas como plantas pequeñas, crecimiento pobre a nivel radical, decoloración y retraso en el crecimiento de los tallos y las coronas.
En esta investigación se determinó que los aislamientos recuperados de campo y clasificados como morfotipos de Fusarium (F2), Cylindrocarpon (F33), y Dothideomycete (F238) corresponden a las unidades taxonómicas operativas Fusarium oxysporum, Neonectria/Dactylonectria, y Sydowia polyspora, respectivamente. Esto concuerda en parte por lo expuesto anteriormente, referente a los posibles agentes causales de la enfermedad. Fang et al. (2011) mencionan que tanto Fusarium oxysporum como Cylindrocarpon destructans pueden ser recuperados a partir de raíces y coronas de plantas de fresa. Para S. polyspora, no hay reporte en el cultivo de fresa en ninguna parte del mundo, por lo que esta sería la primera vez que se registre este hongo que causa daño en el cultivo.
Fusarium oxysporum ha sido relacionado a marchitez de fresa desde 1965 por Winks y Williams, desde entonces, se han realizado caracterizaciones morfológicas, bioquímicas y moleculares del patógeno y se ha mantenido vigente que es la forma especial fragariae la causante de la pudrición de corona y raíz de la fresa (Henry et al. 2021).
Sin embargo, existen diferencias en susceptibilidad por parte de las variedades, como Fang et al. (2012a y b, 2013) y Paynter et al. (2014, 2016) indican que la variedad Festival es resistente a FOF, por lo que es posible que el aislamiento utilizado en esta investigación no corresponda a esta forma especial. Incluso, es posible que ni siquiera corresponda a la especie F. oxysporum en el sentido estricto, y más bien sea otra especie dentro del complejo de especies “Fusarium oxysporum” (FOSC) o que pertenezca a otro complejo.
Cabe decir que, en 2018 Salazar et al., determinaron por medios bioquímicos (BIOLOG) que los aislamientos identificados morfológicamente como F. oxysporum correspondieron no solo a esta especie, sino también a cepas de F. lateritium, F. udum y F. sacchari, así como a otras no identificadas. Por otro lado, mediante los marcadores tef-α1 y β-tubulina, Ayoubi y Soleimani (2016) reportaron que las especies F. solani, F. acuminatum, F. equiseti y el complejo F. incarnatum-equiseti tienen la capacidad de infectar plantas de fresa en Irán.
Lo que indica la necesidad de realizar una identificación molecular más precisa, con el uso de varios marcadores como tef-α1, rpb2 y β tubulina. Se deberían utilizar adicionalmente, marcadores específicos para FOF como FofraF y FofraR diseñados por Suga et al. (2013), para corroborar si se trata de F. oxysporum f. sp. fragariae.
Sin embargo, también existe la posibilidad de que efectivamente se trate de FOF, y que el aislamiento inoculado haya tenido la posibilidad romper la resistencia de la variedad. Recientemente, Henry et al. (2021) especula acerca de la posibilidad de razas para este patógeno, basados en que las plantas de fresa solamente tienen un locus que confiere resistencia a Fusarium oxysporum f.sp. fragariae, el gen FW1, por lo que es factible que el patógeno supere la resistencia de un cultivar específico.
Esto podría explicar por qué los conidios del aislamiento F2 (F. oxysporum sensu lato) tuvieron la capacidad para germinar, desarrollarse, penetrar y desintegrar la epidermis radical y colonizar el parénquima cortical de las raíces de plantas variedad Festival (Figura 4) considerada resistente a la infección por este hongo, sin embargo, en esta investigación la variedad se comportó como susceptible al aislamiento de F. oxysporum inoculado.
Según observaciones por medio de microscopía electrónica de barrido (MEB) realizadas por Fang et al. (2012b) en la variedad Festival la penetración de FOF se restringió a la epidermis radical y el patógeno no ingresó al tejido vascular, por lo que no se presentó decoloración de la corona ni marchitamiento de plantas, comportamiento opuesto al hallado en este trabajo. Estos investigadores indican que en la variedad Festival la germinación de las esporas, la penetración, crecimiento de las hifas y colonización de la superficie radical fue impedida debido a que las plantas exudan metabolitos secundarios, compuestos fenólicos y enzimas que inhiben estos procesos, mientras que en la variedad susceptible Camarosa se produjo menor cantidad de metabolitos inhibitorios, lo que permitió la colonización de las raíces y los haces vasculares, que provocan enfermedad.
Otras observaciones realizadas por los mismos autores indican que las uniones y depresiones de la epidermis son los sitios preferidos de acumulación de esporas y penetración de este hongo y que esta tendencia puede deberse a la acumulación de nutrientes en estas zonas. Por el contrario, Yuan et al. (2014), en observaciones realizadas por medio de microscopía de fluorescencia, mencionan que las esporas se pueden adherir de forma aleatoria en cualquier zona de la raíz, comportamiento evidenciado en esta investigación.
En otros patosistemas, por ejemplo, en arveja-F. oxysporum f.sp. pisi raza 2, se ha encontrado que las accesiones resistentes establecen barreras estructurales que impiden la penetración del hongo, como reforzamiento de las paredes, formación de papilas y acumulación de diversas sustancias a nivel radicular (Bani et al. 2018).
Otro caso del proceso de penetración relacionado a patosistemas raza específicos es el de banano-F. oxysporum f.sp. cubense raza 1 y raza 4. En estos sistemas patológicos se observó por medio de MEB que la raza 4 (FOCR4) tiene la capacidad de ingresar a las raíces de banano (Musa AAA) variedad Cavendish a través de heridas y de espacios intercelulares; mientras que FOCR1 solo puede hacerlo mediante heridas (Li et al. 2017), lo que está directamente relacionado con la susceptibilidad de la variedad, según la raza presente.
Según lo expuesto, se hace relevante definir con exactitud la identidad del aislamiento de Fusarium utilizado en esta investigación, y de esta forma entender mejor el patosistema y las posibilidades de manejo.
De igual manera, se debe profundizar en la identificación de los aislamientos F33 y F238, ya que aunque se utilizó el código de barras para hongos (ITS), este no permitió resolver las especies de géneros crípticos como Cylindrocarpon. Al respecto, Cabral et al. (2012) usaron además del ITS, β tubulina, histona y el factor de elongación 1-α para discriminar entre especies de este género. En este sentido, Lombard et al. (2014) hicieron una re-evaluación minuciosa de la familia Nectriaceae, la cual posee gran cantidad de anamorfos tipo Cylindrocarpon, por medio de análisis multigénico, usaron 10 marcadores, LSU, ITS, acl1, rpb1, rpb2, act, tub2, cmdA, his3 y tef-α1 para distinguir entre géneros.
Cylindrocarpon y las especies tipo Cylindrocarpon son organismos con distribución mundial, mayormente patógenos de suelo, que sobreviven en residuos de cosecha y sustratos en descomposición, aunque también, pueden mantenerse como endófitos. Normalmente causan pudre basal y radical, algunas ocasionan cancros en árboles. Las formas asexuales de Cylindrocarpon fueron asociadas con la forma sexual conocida como Neonectria Wollenw. (Gordillo y Decock 2017, Lawrence et al. 2019).
De acuerdo con Chaverri et al. (2011) Neonectria sp. es un género cosmopolita y capaz de provocar pudriciones radicales. Estos autores ubican el género dentro de los grupos 1 y 4 de Cylindrocarpon según la clasificación de Booth (1966), y en el mismo clado que Ilyonectria. En 2013, Rosmann et al. propusieron mantener el nombre genérico de Neonectria sobre el de Cylindrocarpon. De acuerdo con Jayawardena (2019) tanto Cylindrocarpon sensu stricto como Neonectria sensu stricto pertenecen a la familia Nectriaceae, al igual que Dactylonectria. Indicaron también que, este último es similar morfológicamente a Ilyonectria y Neonectria.
Lawrence et al. (2019) identificaron, por medio de análisis filogenético (ITS+tub2+tef-α1), a partir de 12 aislamientos con morfología tipo Cylindrocarpon (provenientes de pie negro de la uva) especies tanto de Neonectria sensu stricto como de Dactylonectria sensu stricto, lo que confirmó que es posible recuperar ambos géneros asociados a morfotipos de Cylindrocarpon y que es necesario un análisis multigénico para determinar con certeza la identidad de los aislamientos.
De acuerdo con estas personas autoras, las especies tipo Cylindrocarpon causan pudriciones necróticas tanto en coronas como en raíces. En las coronas se observa decoloración y daño vascular, mientras que en las raíces se producen lesiones hundidas y pérdida de biomasa, en general se produce disminución progresiva del vigor del cultivo. Síntomas análogos a los observados en esta investigación y en plantas de campo, hace pensar que podría ocurrir lo mismo en el cultivo de fresa en Costa Rica.
Al respecto, Jayawardena (2019) anota como hospedero de Dactylonectria al género Fragaria L., y concuerda con Lawrence et al. (2019) en la sintomatología que este patógeno provoca en uva, describen severas necrosis radicales, marchitamiento, clorosis, pardeamiento y senescencia prematura del follaje.
Habibi y Ghaderi (2020), Chen et al. (2021), así como, Erper et al. (2021), comprobaron que las especies D. torresencis, D, macrodidyma, D. novezelandica y D. pausiseptata son las responsables de la pudrición radical necrótica en fresa. También mencionaron que provoca severos daños radicales, decoloración de coronas y colapso de plantas, lo que reafirma la idea de que en Costa Rica este hongo tiene la capacidad de provocar los daños obtenidos a partir de la prueba de patogenicidad.
Adicionalmente, y aunque para Sydowia polyspora solo se hallaron reportes de identificación molecular con ITS (Talgø et al. 2010, Thambugala et al. 2014, Silva et al. 2020), es importante ratificar su identidad debido a que no ha sido reportado con anterioridad como patógeno de fresa. Este hongo ha sido mayormente asociado a especies de coníferas (Pan et al. 2018), que ha causado daños en plantaciones forestales.
En BLAST hay varias secuencias de ITS cercanamente relacionadas a las secuencias depositadas en esta investigación y a secuencias identificadas como S. polyspora que fueron aisladas a partir de infecciones necróticas en varias angiospermas, e incluyen gramíneas y especies leñosas. Otra razón, para corroborar la identidad, es que el sinanamorfo hifal (conocido como Hormonema dematioides) está reportado como patogénico en humanos (Coldiron et al. 1990, Jong Hee Shin et al. 1998), lo que podría representar un riesgo para la salud de los productores.
El aislamiento F238, colectado de coronas enfermas en campo, fue capaz de colonizar las raíces primarias y secundarias (Figura 5) y de causar enfermedad en plantas de fresa variedad Festival (Figura 2H, I). El hongo degradó la epidermis radical y colonizó el parénquima cortical, lo que provocó lesiones necróticas y pérdida de pelos absorbentes, así como, necrosamiento de los haces vasculares, amarillamiento foliar y menor crecimiento de las plantas.
Asimismo, las raíces de plantas colonizadas por el aislamiento F33 también mostraron desintegración de la epidermis, tanto en raíces primarias como pelos absorbentes, hasta el punto de dejar expuesta la endodermis de la caliptra de raíces principales, además, se evidencia la digestión de las paredes celulares epidérmicas (Figura 6), lo que indica la capacidad del hongo para penetrar de forma directa por medio de la secreción de enzimas.
Todo lo anterior, comprueba la capacidad de estos 3 hongos para inducir enfermedad en plantas de fresa variedad Festival. Los daños observados tienen impacto en la producción, ya que tanto las alteraciones en la parte aérea como radical, disturban la producción de asimilados y la adquisición de agua y nutrientes requeridos para el desarrollo de las plantas, debido a la pérdida de área fotosintéticamente activa y raíces absorbentes. Dicho aspecto cobra relevancia cuando la planta entra en estado reproductivo.
En este sentido, los productores indican que en la etapa de reproducción es donde se observa la enfermedad con mayor intensidad, fenómeno que se observó también en esta investigación y fue confirmado por Husaini y Neri (2016) al indicar que, síntomas como marchitamiento del follaje, secado de las hojas viejas y retraso del crecimiento de las plantas, provocan disminución en la producción de frutos.
La diferenciación de síntomas expresados en corona de acuerdo con el hongo inoculado podría suministrar información en condiciones de campo, ya que, los productores al disectar la planta tendrían un acercamiento al posible agente causal, lo que permitiría elegir la estrategia de manejo de forma más acertada. Sin embargo, no todas las plantas expresan sintomatología en corona, como se registró en este estudio, lo que puede afectar el diagnóstico.
Finalmente, se debe mencionar que existe la posibilidad de que las plantas hijas desarrolladas a partir de estolones de plantas enfermas, puedan transmitir la enfermedad, ya que el fenómeno fue observado en esta investigación (datos no suministrados). Al respecto, Pastrana et al. (2019) encontraron que las raíces y los peciolos de plantas hijas de la segunda generación, presentaron infección con Fusarium oxysporum f.sp. fragariae (FOF) aunque no con síntomas. Se observó en las plantas inoculadas en esta prueba de patogenicidad, que alrededor del 50% de las plantas no presentaban síntomas en la corona, aunque estaban colonizadas por los hongos; lo que significa que mediante observación visual se subestima la incidencia real de la enfermedad. Esto es sumamente riesgoso, debido a que los productores pueden usar este material para iniciar nuevas plantaciones al asumir que se encuentra sano.
Conclusión
Estos hallazgos permiten asociar la muerte de plantas de fresa a los hongos estudiados, ya que tuvieron la capacidad de dañar la epidermis radical, multiplicarse internamente y provocar síntomas visibles; sin embargo, es relevante continuar con investigaciones tendientes a comprender la relación que existe entre estos patógenos y posibles condiciones de estrés que predisponen las plantas al ataque.
Adicionalmente, se sientan las bases de próximos estudios destinados a conocer la diversidad e interacciones de otros patógenos de fresa, así como, la posibilidad de identificar especies poco estudiadas asociadas a estos complejos que podrían representar enfermedades emergentes con alto potencial patogénico.















