Introducción
La alta eficiencia polinizadora de las abejas melíferas (Apis mellifera L.), ha conllevado a una demanda creciente de este servicio a nivel mundial en diversos cultivos agrícolas, como el melón, la sandía y el almendro, entre otros. Sin embargo, se ha reportado en diferentes países como España, Francia, Suiza y Alemania, pérdidas considerables de colmenas. Asimismo, se ha indicado una severa disminución de colonias en diferentes zonas de los Estados Unidos (Botíaset al. 2012, Eiriet al. 2015). Sin conocer con exactitud la causa de la pérdida de colmenas, algunos investigadores lo atribuyen a ciertos factores como el uso excesivo de plaguicidas en la agricultura y a la presencia de enfermedades en las abejas melíferas, como la Nosemiasis (Sorokeret al. 2011,Botíaset al. 2012, Tozkaret al. 2015).
La Nosemiasis o Nosemosis, es una enfermedad diseminada por todo el mundo que causa pérdidas económicas en la apicultura (Frieset al. 1996, Fries 2010). En Costa Rica, la Nosemosis es causada por N. ceranae, se determinó por primera vez en el 2006 (Calderón et al. 2008). Es ocasionada por 2 especies de microsporidios, Nosemaapis y Nosemaceranae, ambas forman esporas y al ser ingeridas por la abeja llegan al intestino, donde infectan las células epiteliales, se desarrollan y multiplican, luego pasan al recto y son liberadas con las heces (Traver y Fell 2011, Muñoz et al. 2014).
La Nosemosis se transmite entre las abejas a través del intercambio de alimento (trofalaxis), durante la limpieza de panales por parte de las obreras o mediante la ingestión de esporas presentes en el agua y/o alimento contaminado (Higeset al. 2007, Chihuet al. 2013). La abeja reina se infecta a través de la jalea real proporcionada por las abejas nodrizas enfermas, mientras que los zánganos se contagian al recibir de las obreras, alimento con esporas (Maside et al. 2015). Entre colmenas, la Nosemosis se transfiere por pillaje, deriva, manejo inadecuado por parte del apicultor, o por la introducción de colmenas enfermas a los apiarios (Calderón y Pichardo 2011, Prendas et al. 2018).
La intensidad de la infección varía con la época del año, las condiciones ambientales (temperatura, humedad relativa y precipitación) y la ubicación del apiario (sombra o semisombra) (Fries 2010, Traver y Fell 2011, Jack et al. 2016, Ptaszynskaet al. 2016). Se ha reportado, que apiarios ubicados en lugares húmedos y con exceso de sombra, son propensos a presentar niveles elevados de Nosemaspp. (Biganskiet al. 2017). La Nosemosis puede permanecer latente durante todo el año y manifestarse después de periodos de hacinamiento de las abejas dentro de la colmena, debido a lluvias persistentes, fríos intensos o fuertes vientos, ya que estas condiciones favorecen el contacto y contagio entre las abejas (Calderón y Ramírez 2013). Algunos de los principales síntomas que se observan en abejas, A. mellifera, altamente infectadas por Nosemaspp., son abejas arrastrándose en frente de la colmena debido a la imposibilidad de volar por la compresión de los sacos aéreos abdominales, así como deyecciones diarreicas de color café sobre los marcos, bastidores y frente a la piquera (Chihuet al. 2013). Lo anterior causa disminución en la población de abejas adultas y en la cantidad de cría, reducción en la producción de miel y en casos muy severos, perdida de la colmena (Chihuet al. 2013).
El diagnóstico de laboratorio de la Nosemosis, consiste en el análisis de una muestra grupal de aproximadamente 30 a 60 abejas adultas por colmena, mediante el cual se obtiene un estimado de la cantidad de esporas por abeja (Calderón y Sánchez 2011, Botíaset al. 2012). Sin embargo, se ha reportado que, al aplicar esta metodología, en condiciones particulares, podrían obtenerse resultados muy variables en la medición de infección entre individuos de una misma colmena (Mulholland et al. 2012). Algunas personas autoras mencionan que el análisis individual de abejas es un indicador más confiable del nivel de infección de la colonia. No obstante, estudios sobre la presencia de Nosemaspp. en abejas individuales, son escasos (Higeset al. 2008, Mulholland et al. 2012).
Debido a la poca investigación relacionada con la Nosemosis en abejas africanizadas bajo condiciones tropicales, se realizó el presente estudio con el objetivo de determinar la cantidad de esporas y el nivel de infección del microsporidio Nosemaspp. en muestras grupales e individuales de abejas adultas y su relación con las condiciones de precipitación y humedad relativa.
Materiales y métodos
Ubicación del apiario. La investigación se realizó en un apiario constituido por 10 colmenas de abejas africanizadas (A. mellifera), ubicado en el cantón de Atenas (09°57'45'' N y 84°21'50'' O, 535 msnm), provincia de Alajuela. Atenas se clasifica como bosque húmedo premontano, con una temperatura promedio anual de 25°C y una precipitación entre 1011 y 2022 mm (IMN 2017). El estudio se llevó a cabo de julio a noviembre 2017 (época lluviosa), meses en los cuales se ha reportado una mayor incidencia de Nosemosis en las colmenas (Calderón y Pichardo 2011, Pichardo et al. 2012, Calderón y Ramírez 2013). Se confirmó la presencia de Nosemaspp. mediante análisis de laboratorio de las abejas adultas, las cuales adquirieron el microsporidio de manera natural.
Colecta de abejas. Para realizar el diagnóstico de Nosemosis, se muestrearon 10 colmenas con un intervalo de 30 días entre los muestreos. De cada colmena se colectaron aproximadamente 100 abejas adultas de la piquera (entrada), con el fin de muestrear abejas pecoreadoras (con más de 21 días de edad) (Higeset al. 2010, OIE 2013, Medina et al. 2014). Para obtener la muestra de abejas, la piquera de la colmena se cerró temporalmente con papel periódico, durante unos 20 - 30 minutos en horas de la mañana (9:00 am - 11:00 am) (Higeset al. 2008). Al observarse un número considerable de abejas pecoreadoras agrupadas frente a la piquera, se procedió a colectarlas en un frasco de boca ancha con alcohol etílico al 70%. Las muestras se identificaron con la fecha y el número de la colmena.
Análisis de abejas. Las abejas adultas se analizaron en el Laboratorio de Patología Apícola del Centro de Investigaciones Apícolas Tropicales (CINAT), Universidad Nacional, ubicado en el Campus Benjamín Núñez, Lagunilla de Heredia. Para determinar la presencia de esporas de Nosemaspp., las abejas se analizaron mediante el método de Cantwell (método directo) (Molina et al. 1990, Calderón y Sánchez 2007). De cada muestra se tomaron 30 abejas adultas, se procedió a cortar los abdómenes, los cuales se maceraron en un mortero y se añadió 1 ml de agua destilada por cada abdomen (total 30 ml). El macerado se agitó constantemente durante un minuto y luego se colocó una gota de la suspensión en un portaobjetos. Para identificar la presencia del microsporidio, la muestra se revisó en el microscopio a un aumento de 40x. Las esporas se identificaron por ser ovaladas, brillantes y refringentes.
Cuantificación del nivel de infección de Nosemaspp. Se procedió a cuantificar las esporas y determinar el nivel de infección de cada colmena mediante el hemocitómetro (Calderón y Pichardo 2011). Se realizó el análisis grupal de 30 abejas y el examen individual de 30 abejas provenientes de la misma colmena.
Evaluación de una muestra grupal de abejas. Para cuantificar las esporas de Nosemaspp. presentes en una muestra grupal de abejas, se procedió a agitar de manera mecánica el líquido sobrenadante para homogenizarlo y con una micropipeta se tomó una alícuota de 200 µl, la cual se colocó en el hemocitómetro y se dejó reposar durante 3 minutos, para permitir la sedimentación de las esporas. La muestra se observó en el microscopio a un aumento de 40x y se procedió al conteo de esporas de 5 bloques del hemocitómetro (los 4 de las esquinas y el central) (Molina et al. 1990).
El nivel de infección se determinó con la siguiente fórmula:
Número de esporas por abeja = (total de esporas contadas / 80) x 4 000 000.
El total de esporas contadas, son las presentes en los 5 bloques del hemocitómetro.
El 80, representa el total de campos contados en los 5 bloques del hemocitómetro.
Los 4 000 000, corresponde al volumen de dilución de la muestra.
Examen de abejas individuales. Para analizar el nivel de infección de Nosemaspp. en 30 abejas por colmena (n= 10 colmenas), igualmente se utilizó la técnica del hemocitómetro. Se analizó cada una de las abejas de manera individual (n= 300 abejas analizadas por mes), con el macerado del abdomen y se agregó 1 ml de agua destilada. Luego se colocó 10 µl del líquido sobrenadante en el hemocitómetro, se observó en el microscopio a un aumento de 40x y se procedió al conteo de las esporas. Para obtener el nivel de infección se utilizó la fórmula indicada anteriormente.
El procedimiento se repitió hasta determinar el nivel de infección de cada una de las 30 abejas analizadas individualmente por colmena.
Nivel de infección de Nosemosis. Para categorizar el nivel de infección de Nosemaspp., el número de esporas de cada muestra, determinado mediante la fórmula, se comparó con la tabla de Jaycox (Tabla 1).
Tabla 1: Nivel de intensidad de infección por Nosemosis en abejas melíferas (Jaycox).
| Nivel de infección | Intensidad | Cantidad de esporas |
| Nulo | 0 | Menos de 10 000 |
| Muy leve | 1 | 10 000 - 1 000 000 |
| Leve | 2 | 1 000 001 - 5 000 000 |
| Moderado | 3 | 5 000 001 - 10 000 000 |
| Semifuerte | 4 | 10 000 001 - 20 000 000 |
| Fuerte | 5 | Superior a 20 000 000 |
Datos meteorológicos. Los datos de precipitación, humedad relativa y temperatura en el cantón de Atenas durante julio a noviembre, se proporcionaron por el Instituto Meteorológico Nacional (IMN 2017). La precipitación y humedad se relacionaron con el número de esporas del microsporidio Nosemaspp. en muestras grupales e individuales de abejas adultas.
Análisis estadístico. La cantidad de esporas, obtenida en el análisis de muestras grupales, se digitó en una tabla de Microsoft Excel®, la cual se ingresó al programa estadístico Minitab®, siendo clasificadas por el número de colmena y el mes de evaluación. Asimismo, se digitó el número de esporas determinadas en muestras de abejas individuales, se incluyeron como variables el número de abeja, el número de colmena y el mes de evaluación. En este último caso, se obtuvo el promedio de esporas presentes en abejas individuales por colmena. Para la cantidad de esporas, se calcularon estadísticas descriptivas (promedio e intervalos de confianza, la mediana, el valor máximo y mínimo) y medidas de variación (desviación estándar, error estándar y el coeficiente de variación) por mes y para cada método de evaluación. La dinámica de la infección de Nosemaspp. durante el estudio, se presentó en gráficos de líneas, en los que se utilizó el promedio de esporas de abejas individuales por colmena. La precipitación y humedad relativa se relacionaron con el número de esporas de Nosemaspp., determinadas mediante los métodos grupal e individual.
Resultados
Nosemosis en muestras grupales de abejas
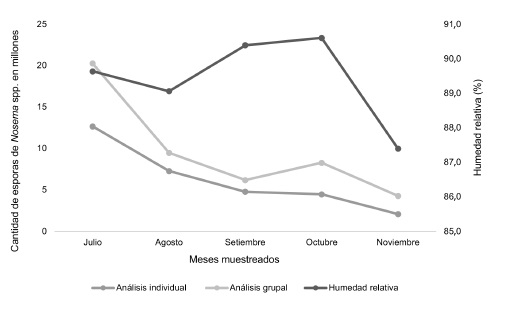
Se determinó la presencia del microsporidio Nosemaspp. en todas las colmenas analizadas (n= 10), durante la época lluviosa. En julio, se determinó la mayor cantidad de esporas de Nosemaspp. en el apiario, con un promedio de 20 360 000 ± 1 586 957 por abeja. En el mes siguiente la infección fue significativamente inferior, encontrándose en promedio 9 595 000 ± 2 602 866 esporas (p<0,0001). En setiembre, se cuantificaron 6 230 000 ± 1 396 945 de esporas por abeja, mientras que en octubre se registró un leve incremento. Finalmente, en noviembre, se obtuvo la menor cantidad de esporas, con un promedio de 4 375 000 ± 874 132 (Figura 1). No se encontraron diferencias significativas de agosto a noviembre (ANOVA - significancia 0,05) (Figura 2).
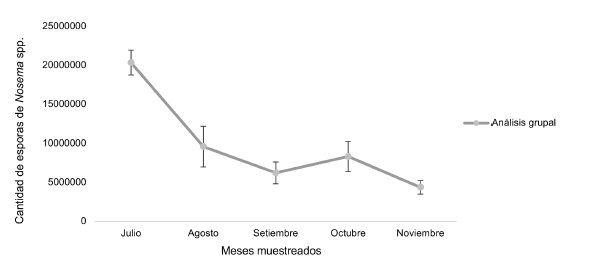
Figura 1. Esporas de Nosemaspp. en muestras grupales de abejas adultas durante la época lluviosa (x̄ ± SE).
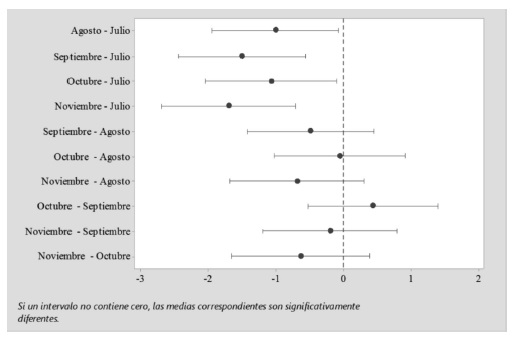
Figura 2 . Análisis de la cantidad de esporas de Nosemaspp. durante los meses muestreados (ANOVA= Prueba de Tukey, significancia 0,05).
Nosemosis en muestras individuales de abejas
Se determinó la presencia del microsporidio Nosemaspp. en muestras de abejas individuales(240 a 300 abejas por mes) durante el periodo de estudio. En julio se contabilizó la mayor cantidad de esporas, con un promedio de 12 749 733 ± 867 232 por abeja, y resultó significativamente mayor que los siguientes meses analizados, en los cuales la infección por Nosemiasis fue menor a 10 000 000 de esporas. En agosto se cuantificó la segunda cifra más alta de esporas, siendo de 7 367 267 ± 716 697 por abeja. Durante setiembre y octubre el promedio continuó con disminución, hasta noviembre donde se alcanzó la menor cantidad 2 087 708 ± 398 895 de esporas por abeja (Figura 3).
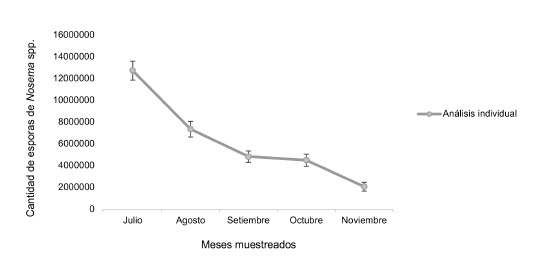
Figura 3 Promedio del conteo de esporas de Nosemaspp. en muestras individuales de abejas durante los meses de la época lluviosa (x̄ ± SE).
Relación de las condiciones de precipitación y humedad relativa con la cantidad de esporas de Nosemaspp.
De acuerdo con la información suministrada por el Instituto Meteorológico Nacional (IMN), las variables meteorológicas que presentaron cambios en los meses de estudio, son la precipitación y la humedad relativa, mientras que la temperatura se mantuvo constante entre 23,9°C y 24,2°C. Al relacionar la precipitación y el porcentaje de humedad relativa con la cantidad de esporas, tanto en el análisis grupal como en el individual, se observa que setiembre presentó la mayor cantidad de lluvia (650 mm) y un alto porcentaje de humedad (90,4%); sin embargo, no correspondió con los mayores niveles de infección del microsporidio, los cuales se observaron en julio. Mientras que noviembre, fue el mes menos lluvioso (126 mm) y húmedo (87,5%), y a su vez presentó la menor cantidad de esporas por abeja (Figuras 4 y 5).
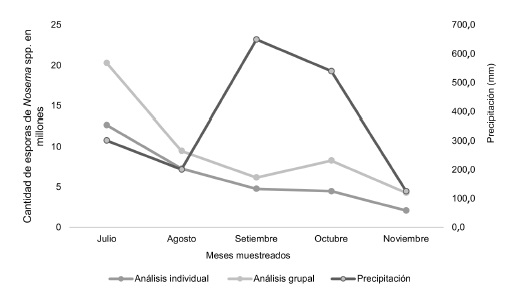
Figura 4. Esporas de Nosemaspp. obtenidas en muestras grupales e individuales de abejas y nivel de precipitación entre julio y noviembre.
Discusión
Como se mencionó, la Nosemosis es una de las enfermedades que más pérdidas económicas causa en la apicultura mundial (Frieset al. 2013, Grupe y Quandt 2020). Diversos estudios en España, indican un aumento considerable en la pérdida de colmenas de abejas de tipo europeo infectadas con N. ceranae (Higeset al. 2010, Botíaset al. 2013). En esta investigación con abejas africanizadas, se determinó la presencia de Nosemosis en todas las colmenas (prevalencia= 100%), tanto en el análisis grupal como en el individual, con diferentes niveles de infección, desde muy leves hasta fuertes. Algunos factores que favorecen a la Nosemosis están relacionados con la ingesta de esporas. Se menciona que las abejas jóvenes adquieren las esporas cuando realizan actividades de limpieza en colmenas contaminadas (Martínez et al. 2011). Según Ritter (2001) panales viejos en la cámara de cría, propician la presencia de Nosemosis. En el presente ensayo, se observaron panales muy oscuros en las colmenas, con mucho tiempo de no cambiarse. En estas condiciones, podrían ser una fuente de contaminación de Nosemaspp., ya que las esporas suelen permanecer viables, hasta por un año (DeGrandi-Hoffman y Chen 2015, Rodríguez et al. 2021).
El mayor conteo de esporas obtenido en ambos métodos durante la época lluviosa se registró en julio. Una de las posibles causas podría estar relacionada con el hacinamiento de las abejas debido a lluvias prolongadas. Aun en julio que no fue el mes con mayor precipitación (302 mm), ocasionalmente se presentaron lluvias persistentes desde horas de la mañana, y permanecieron durante todo el día. Debido a que las abejas en estas condiciones no pueden defecar fuera de la colmena y al estrecho contacto entre ellas, probablemente favoreció la diseminación del microsporidio. Se ha reportado que largos periodos de encierro de las abejas en la colmena (hacinamiento), ocasionados principalmente por lluvias persistentes, promueven la presencia de Nosemaspp. Entre más extensa es la duración del hacinamiento, mayor es la cantidad de esporas, ya que los niveles de infección se elevan considerablemente, debido al contacto estrecho entre las abejas (Frieset al. 2013).
En los siguientes meses (agosto - octubre), hubo un descenso en la cantidad de esporas con respecto a julio, tanto en el análisis grupal como en el individual. Lo anterior representa un cambio considerable respecto a lo esperado, ya que las condiciones de precipitación y humedad, que se han reportado, favorecen el incremento de la Nosemosis, en setiembre (650 mm, 90,4%) y octubre (540 mm, 90,6%) (IMN 2017). Las causas de esta disminución, no se conocen con exactitud, no obstante, se debe mencionar que durante esos meses se presentaron las condiciones propias de la época lluviosa, con mañanas soleadas y tardes lluviosas. Esta condición, permitió que las abejas realizaran sus actividades fuera de la colmena durante horas tempranas del día, sobre todo la defecación. Estos resultados coinciden con los reportados por Tapia et al. (2017) con abejas africanizadas en México, donde determinaron una disminución en el conteo de esporas durante la estación lluviosa, comparado con la época seca. Igualmente, Emsenet al. (2015) indicaron bajos niveles de infección de Nosemaspp. durante el invierno, los cuales aumentaron en el verano. Adicionalmente, Retschniget al. (2017) indican que la mayor intensidad del microsporidio se presentó en invierno.
En noviembre, se registró con ambos métodos, el conteo más bajo de esporas. Se debe señalar que, durante este periodo, se observó una reducción en la cantidad de lluvia, con el inicio de la transición hacia la época seca, con las condiciones más bajas de precipitación (126,2 mm) y humedad (87,4%) (IMN 2017). Lo anterior coincide con Calderón y Ramírez (2013), quienes indican que a menor cantidad de lluvia las esporas de Nosemaspp. disminuyen.
Precipitación y humedad relativa
Al relacionar el número de esporas del microsporidio Nosemaspp. (obtenido en ambos métodos) con la precipitación y humedad, se evidenció durante julio la cifra más elevada de esporas en el apiario, mientras que la humedad y precipitación correspondieron a la tercera más alta registrada durante el periodo de investigación. Como se indicó, el conteo elevado de esporas en julio, podría relacionarse con el hacinamiento de las abejas como consecuencia de lluvias persistentes.
Cueto et al. (2020) indicaron una alta prevalencia y distribución de Nosemosis entre marzo y junio, lo cual corresponde a las temporadas de primavera e inicio del verano (mayor actividad estacional de las abejas melíferas) en 4 regiones geográficas del noroeste de México.
Setiembre, presentó la mayor cantidad de lluvia y un alto porcentaje de humedad, no obstante, no correspondió con los mayores niveles de infección de Nosemaspp. en las colmenas. Según Rangel et al. (2015) esto obedece a que la lluvia, no es un factor que determina el nivel de infección de Nosemosis en el apiario. Pacini et al. (2016) indican que apiarios ubicados en distintas eco-regiones de Argentina, mostraron diferencias en la cantidad de esporas, al registrar conteos menores en condiciones de bosque y en lugares con suelo cubierto de pasto. Sobre esta condición Calderón y Ramírez (2013), reportaron que apiarios ubicados en sitios húmedos y con mucha sombra, tienden a presentar niveles más elevados de infección, que los situados en lugares donde predominen las condiciones secas y soleadas.
Se comprobó que en noviembre se cuantificó la menor cantidad de esporas de Nosemaspp. por abeja. En ese mes se observó una reducción considerable en la cantidad de lluvia y el inicio de la floración. Lo anterior coincide con lo observado por Calderón y Ramírez (2013), quienes encontraron que, a menor cantidad de lluvia, se reduce el número de esporas en el apiario.
En conclusión, se observó que, al relacionar la precipitación y el porcentaje de humedad relativa con la cantidad de esporas, tanto en el análisis grupal como el individual, el mes de setiembre presentó la mayor cantidad de lluvia y un alto porcentaje de humedad, sin embargo, no correspondió con los mayores niveles de infección de Nosemosis, los cuales se presentaron en julio. Mientras que noviembre, fue el periodo menos lluvioso y húmedo, y a su vez presentó la menor cantidad de esporas de Nosemaspp. por abeja.