Introducción
El "picudo negro", Cosmopolites sordidus (Gemar), (Coleoptera: Dryophthoridae), es la plaga más importante de los cultivos de banano y plátano (Musa spp.) a nivel mundial. Este insecto es originario del Sudeste de Asia y se ha propagado a todas las regiones productoras de banano y plátano en el trópico y subtrópico (Gold y Messiaen 2000). Las larvas del picudo forman, durante el proceso de alimentación, galerías en el cormo que obstruyen el transporte de agua y nutrientes que debilitaron las plantas haciéndolas más susceptibles al volcamiento y baja productividad lo cual puede permitir la entrada de fitopatógenos (Collins et ál. 1991, Gold et ál. 2001, Gold et ál. 2004, Vallejo et ál. 2007, Bortoluzzi et ál. 2013).
Los ataques más severos se producen en plantaciones viejas y en plantas debilitadas por la sequía, deficiencias nutricionales u otras plagas. En las plantas afectadas se da una reducción de crecimiento, amarillamiento de hojas, pérdida de sistema radical, volcamiento de los seudotallos, prolongación del ciclo de producción y disminución en el rendimiento. El daño causado por el insecto puede resultar en reducción del tamaño de fruto, menor peso del racimo y acortamiento de la vida de anaquel (Collins et ál. 1991, Gold et ál. 2004, De Graaf et ál. 2008, Bortoluzzi et ál. 2013).
El control de esta plaga en los sistemas intensivos de producción comercial se basa principalmente en la aplicación de insecticidas cuyo uso induce resistencia, emergencia de plagas secundarias, afecta especies benéficas y tiene un alto costo, lo que provoca un incremento en los costos de producción (Collins et ál. 1991, Carballo 2001, Bortoluzzi et ál. 2013). Ante este panorama, surge la necesidad de investigar alternativas como el uso de nematodos entomopatógenos (NEP) para el control biológico del picudo. Los NEP son seguros para el agricultor y el ambiente y presentan la ventaja de que pueden buscar activamente la larva que se encuentra protegida dentro del cormo (Treverrow et ál. 1991, Treverrow y Bedding 1993, Gold et ál. 2001, Bortoluzzi et ál. 2013).
Los nematodos entomopatógenos son organismos parásitos letales y obligados de insectos, presentan una distribución ubicua y se utilizan como agentes de control biológico. Estos microorganismos establecen una relación mutualista con bacterias de la familia Enterobacteriaceae, las cuales requieren de este hospedero para obtener protección y lograr diseminarse de un insecto a otro. Las 2 familias más importantes y estudiadas son Steinernematidae quien se asocia con bacterias del género Xenorhabdus y Heterorhabditidae que establece su relación con bacterias del género Photorhabdus (Liu et ál. 2000, Boemare 2002, Stock y Goodrich 2008, Vashisth et ál. 2013).
El ciclo de vida de Heterorhabditis sp., inicia cuando el estadío juvenil infectivo (JI) busca e ingresa al insecto por las aberturas naturales (espiráculos, boca, ano) o por áreas delgadas de la cutícula. El JI viaja por la hemolinfa y regurgita a la bacteria Photorhabdus desde el interior de su intestino, probablemente como respuesta al reconocimiento y ataque por parte del sistema inmune del insecto hacia el nematodo (Wang y Bedding 1996, Ciche y Ensign 2003, Ciche et ál. 2008).
La bacteria prolifera en el hemocele y produce toxinas que matan al insecto, enzimas que degradan los tejidos, antibióticos que preservan el cadáver del ataque de otros microorganismos y señales o nutrientes esenciales para el crecimiento y desarrollo de Heterorhabditis. Después de 1 a 3 generaciones del nematodo, los nutrientes empiezan a disminuir y el estadío JI con la bacteria simbionte en su intestino abandona la larva y permanece en el suelo hasta encontrar un hospedero adecuado (Burnell y Stock 2000, Daborn et ál. 2002, Ffrench et ál. 2003, Au et ál. 2004, Dowling et ál. 2004, Brugirard et ál. 2005, Waterfield et ál. 2005, Ciche et ál. 2008, Goodrich y Clarke 2007, Clarke 2008).
Se han utilizado diferentes cepas de NEP como agentes de control biológico de insectos plaga económicamente importante (Bedding y Miller 1981, Shapiro et ál. 2006, Vashisth et ál. 2013), entre ellos C. sordidus (Treverrow y Bedding 1993, Treverrow 1994, Gold et ál. 2001, Carvajal 2009, Padilla et ál. 2010, Mwaitulo et ál. 2011). En Australia Treverrow (1994) encontró que la aplicación de NEP a plantaciones bananeras infectadas por C. sordidus fue lo suficientemente eficaz para mantener las poblaciones del coleóptero en un nivel bajo y evitar daños importantes en el cultivo en aquellos puntos donde los niveles de infección eran moderados. En Costa Rica no se ha evaluado el uso de NEP en el control de C. sordidus. El objetivo de la presente investigación fue evaluar la susceptibilidad de Cosmopolites sordidus a la cepa de Heterorhabditis atacamensis CIA-NE07 en condiciones in vitro.
Materiales y métodos
Organismos utilizados en el estudio
Se utilizó el nematodo Heterorhabditis atacamensis CIA-NE07 de la colección de cepas del Laboratorio de Microbiología Agrícola del Centro de Investigaciones Agronómicas (CIA) así como larvas de Galleriamellonella y Tenebrio mollitor de un pie de cría que se mantiene en el laboratorio en la forma descrita en Rodríguez et ál. (2009). Las larvas de C. sordidus se extrajeron a partir de cormos de banano infectados provenientes de la Finca San Pablo, ubicada en el cantón de Siquirres, provincia de Limón, Costa Rica (Figura 1). Los adultos se colectaron en trampas tipo cuña sobre plantas recién cosechadas. Adicionalmente, los cormos usados para dicha investigación fueron suministrados por el departamento de entomología de CORBANA.
Preparación de los nematodos
Para la cría de nematodos in vivo, se colocó papel filtro sobre la base de una placa Petri de 8,5 cm de diámetro y se inoculó con 1 ml de una suspensión con 200 JI.ml-1 de la cepa H. atacamensis CIA-NE07, posteriormente, se colocaron 4-5 larvas de G. mellonella (Figura 2a) y se selló la placa Petri con papel Parafilm(tm), estas se almacenaron a temperatura ambiente para que se desarrollara la infección y muerte de las larvas. Los cadáveres se colocaron en una trampa White (Figura 2b) para la extracción de los nematodos (Stock 2008, Rodríguez et ál. 2009). Los juveniles infectivos se almacenaron en botellas plásticas de cultivo celular de 25 cm2 con solución Ringer por un período no mayor a 30 días.
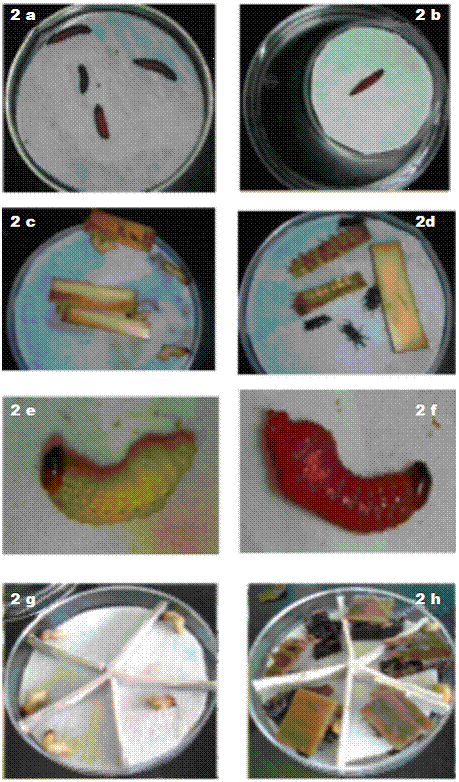
Figura 2: Inoculación de las larvas de Galleria mellonella y Cosmopolites sordidus en los diferentes ensayos. 2a Larvas de G. mellonella, 2b Trampa de White, 2c Larvas de C. sordidus primer ensayo. 2d Adultos de C. sordidus, 2e Larvas de C. sordidus sin inocular. 2f Larvas infectadas con Heterorhabditis. 2g Larvas de C sordidus segundo ensayo, 2h Larvas con secciones de cormo.
Para determinar la cantidad de nematodos presentes en las botellas y preparar las concentraciones necesarias para el ensayo, se realizaron recuentos por triplicado. Para ello, se colocó 1 ml de la suspensión en una placa Petri cuadriculada de 5 cm de diámetro, 2 ml de agua desionizada y 3 gotas del surfactante polisorbato-80 al 1%.
Evaluación del efecto del nematodo entomopatógeno sobre larvas y adultos de Cosmopolites sordidus
Se evaluó la susceptibilidad de larvas y adultos de C. sordidus a la infección con NEP. La unidad experimental consistió en un plato de petri con 5 individuos. En cada plato petri se colocó papel filtro que fue inoculado con 1 ml de una suspensión con 200 JI.ml-1 (40 JI.larva-1), para los tratamientos inoculados y 1 ml de agua desionizada para los no inoculados. En cada plato se colocaron 5 ejemplares, larvas o adultos del insecto según correspondiera (Figura 2c y 2d). Además a cada plato se le agregó entre 4 y 6 secciones de aproximadamente 2,0 x 2,5 cm (2,07 g) del cormo de la planta de banano. Los platos se revisaron diariamente hasta que la totalidad de las larvas murió, los adultos se evaluaron durante 1 mes. Posteriormente se colocaron las larvas muertas en trampas White con el fin de corroborar que la muerte se debió a la infección por NEP. Se determinó el porcentaje de larvas y adultos vivos en los tratamientos sin inocular (Figura 2e) y en los tratamiento inoculados (Figura 2f). Para la evaluación del efecto de la aplicación de nematodos sobre larvas y adultos de picudo, se utilizó, por separado, un diseño irrestricto al azar con 5 repeticiones.
Efecto de 5 concentraciones de la cepa Heterorhabditisatacamensis CIA-NE07 sobre larvas L5 de Cosmopolites sordidus en platos petri
Se evaluaron concentraciones de 0, 25, 50, 100, 500 y 1000 JI.larva-1 (0, 2, 4, 9, 44 y 88 JI.cm-2). Para cada concentración se utilizaron 5 larvas de C. sordidus y se realizaron 5 repeticiones por tratamiento. Las larvas se colocaron en una placa de Petri sobre un papel filtro previamente humedecido con 1 ml de la suspensión de nematodos según la concentración evaluada. Se utilizó 1 ml de agua desionizada para el tratamiento 0 JI.cm-2.
Para separar las larvas entre sí, a cada placa se le colocó una estructura de cartón duro que dividió la superficie en 5 secciones iguales (Figura 2g). Además, se agregaron 5 porciones del cormo de la planta de banano, que sirvieron de alimento para las larvas (Figura 2h). Las placas de Petri se sellaron con Parafilm(tm) y se incubaron a temperatura ambiente. Se evaluó la mortalidad de las larvas a las 24 horas para las diferentes concentraciones de nematodos.
Para comprobar que la muerte de las larvas se debió a la infección por el nematodo, la mitad de las larvas que adquirieron la coloración rojiza característica de la infección por Heterorhabditis (Figura 2f) se colocaron individualmente en una trampa White y a la otra mitad se les realizó una disección a los 12 ddi (días después de la inoculación), para observar los nematodos adultos con ayuda de un estereoscopio. Todas las larvas muertas con una coloración distinta fueron colocadas en trampas White para determinar si estaban infectadas o no. Las trampas se incubaron a temperatura ambiente y se disectaron a los 16 ddi. La Dosis Letal Media (DL50) se determinó mediante un análisis de regresión del logaritmo de la concentración del nematodo y el porcentaje de mortalidad por medio del programa EXCEL, para contabilizar únicamente las larvas donde se comprobó la presencia de NEP.
Efecto de cuatro concentraciones de la cepa H.atacamensis CIA-NE07 sobre larvas L5 de Cosmopolites sordidus en cormos de banano
Se evaluaron concentraciones de 0, 250, 500, 1000 y 2000 nematodos por larva (0, 8296, 16593, 33186, 66372 JI.m-2). Se utilizaron cormos de plantas de banano de 50 cm de alto que fueron lavados para reducir los restos de suelo adherido. A cada cormo se le realizaron 3 cortes de forma triangular de 3 cm de lado y con una profundidad aproximada de 5 cm, con un cuchillo esterilizado a la llama (Figura 3). Se extrajo la sección del cormo y en cada corte se colocó una larva de C. sordidus, posteriormente a la sección extraída se le redujo la profundidad en aproximadamente 2 cm, con el fin de que al colocarla nuevamente no dañara la larva. Esta sección se sujetó al cormo y se colocaron 2 porciones de alambre alrededor para evitar que se desprendiera. Cada cormo se colocó en una bolsa plástica negra de 16x20 cm con orificios y se agregó 500 g de suelo previamente autoclavado por 1 hora y empleado 4 días después. Las bolsas que contenían los cormos, se colocaron sobre bandejas plásticas en el laboratorio y se incubaron a temperatura ambiente 23,8ºC (min 22,4ºC, max 25,5ºC) y con una humedad relativa de 70,3 (min. 69,8, max 71,3). Se utilizaron 7 repeticiones por tratamiento.
Cada cormo se inoculó con 10 ml de la suspensión de nematodos correspondiente a cada concentración y 10 ml de agua desionizada para la dosis 0 nematodos por larva, los nematodos se aplicaron al suelo. A los 10 días se extrajeron las larvas de cada uno de los cormos, se determinó el porcentaje de mortalidad para las diferentes concentraciones de nematodos. A todas las larvas muertas se les realizó una disección para observar los nematodos adultos con ayuda de un estereoscopio, lo anterior para verificar que la muerte de las larvas se debió a la infección por el nematodo. El porcentaje de mortalidad se determinó al 10 ddi y se contabilizaron únicamente las larvas en las que se comprobó la presencia de NEP y la DL50 mediante un análisis de regresión entre la concentración del NEP y el porcentaje de mortalidad.
Análisis Estadístico
Para la determinación del efecto de los nematodos sobre larvas y adultos de C. sordidus, se realizó a los datos de las larvas, un análisis de varianza (ANDEVA) para un nivel de significancia de p≤0,05. Para la separación de medias se utilizó LSD FISHER (p≤0,05). El efecto de las diferentes concentraciones de nematodos sobre las larvas L5 de C. sordidus en platos petri, se evaluó mediante un diseño irrestricto al azar con 5 repeticiones y una unidad experimental de 5 individuos. En la evaluación de la patogenicidad de la cepa sobre el estadío L5 del picudo en cormos de banano, se utilizaron 7 repeticiones y una unidad experimental de 3 individuos. Se realizó un análisis de varianza (ANDEVA) para un nivel de significancia de p≤0,05. Para la separación de medias se utilizó LSD FISHER (p≤0,05). Se utilizó el paquete estadístico Infostat (2011).
Resultados y discusión
Efecto de Heterorhabditis atacamensis CIA-NE-07 sobre larvas y adultos de Cosmopolites sordidus
El tratamiento inoculado con la cepa CIANE-07 causó la muerte del 24% de las larvas al día 1, 88% al día 2 y del 100% al día 3, diferenciándose del tratamiento control (sin inocular), los días 2 y 3, en los que se observó una mortalidad de 20% y 28% respectivamente (Figura 4). Todas las larvas muertas en el tratamiento inoculado presentaron la coloración roja característica de la infección por Heterorhabditis (Figura 2f), y su presencia fue corroborada, mediante la técnica de trampas de White. Asímismo, en ninguno de los casos la muerte de las larvas en el tratamiento control se debió a infección por H. atacamensis. El aumento en la mortalidad observado en el control (8% a 28%), puede deberse a las condiciones de estrés a las que fueron sometidas las larvas durante el transporte desde el campo, extracción del cormo de banano e incubación, al ser expuestas a diferentes condiciones de humedad ambiental, disponibilidad de alimento, espacio y luz.
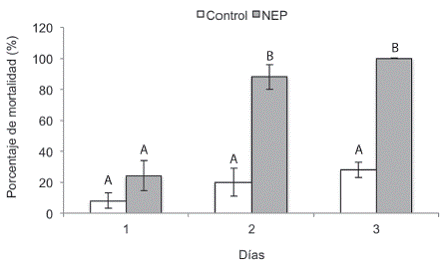
Figura 4: Porcentaje de mortalidad de larvas de C. sordidus expuestos a Heterorhabditis atacamensis CIA-NE07. Barras con letras diferentes implican diferencias estadísticamente significativas según LSD p<0,05.
En el caso de los adultos de C. sordidus, no se encontró diferencia entre la población inoculada y la utilizada como control. Ambos grupos se encontraban vivos después de un mes de realizada la inoculación. Gold y Messiaen (2000) señalan que en sustratos húmedos el adulto puede sobrevivir sin alimentarse durante varios meses. Así mismo, el adulto del picudo del banano es uno de los insectos más resistentes a los nematodos entomopatógenos, al parecer el principal factor que determina la susceptibilidad del picudo es la dificultad de los nematodos para entrar al hospedero, lo anterior debido a que el aparato bucal es demasiado estrecho para el ingreso del nematodo y a que el insecto mantiene el ano cerrado lo que impide la entrada de los NEP (Forschler et ál. 1990, Treverrow y Bedding 1993, Sánchez 2002). Por otro lado, el adulto a diferencia de las larvas, presenta una capa de cutícula muy gruesa que dificulta la entrada del nemátodo y aunque Heterorhabditis posee un diente cuticular que podría penetrar la cutícula, las articulaciones esqueléticas de este insecto están muy unidas y la membrana interesqueletal está poco expuesta (Sirjusingh et ál. 1992, Teverrow y Bedding 1993). Otro factor que favorece la resistencia del adulto a la infección por los NEP son los élitros, estas estructuras cierran el abdomen de manera que es poco probable que los nematodos sean capaces de penetrarlos para llegar a los espiráculos del insecto (Teverrow y Bedding 1993). Carvajal (2009) evaluó la efectividad de H. bacteriophora sobre adultos de C. sordidus in vitro con 3 distintas concentraciones de nematodos que permitió alcanzar una mortalidad de 35% con la dosis de 1500 JI.adulto-1 de picudo, Teverrow y Bedding (1993) obtuvieron por medio de diferentes cepas de NEP, una mortalidad promedio de 38% al día 8, mientras que a los 16 días se incrementó al 94%. Los mismos autores indican que de 32 cepas de Steinernema y Heterorhabditis evaluadas, la cepa BW de S. carpocapsae fue la más infectiva a C. sordidus aunque se ocuparon 250 000 JI del nematodo por trampa para obtener altos nieveles de mortalidad en adultos. Treverrow (1994) sugiere el uso de aditivos que induzcan al adulto a levantar los élitros más frecuentemente, aspecto que favorece el ingreso de NEP. Por su parte, Mwaitulo et ál. (2011) encontraron que 9 aislamientos obtenidos a partir de plantaciones de banano en Tanzania causaron la muerte de los estadíos larvales, mientras que los adultos fueron resistentes.
En el caso de los adultos podría utilizarse la combinación con otros métodos de control biológico como el uso de B. bassiana la cual se ha observado que alcanza mortalidades cercanas al 80% de control de adultos en plantaciones comerciales (Navas 2011).
Efecto de 5 concentraciones de la cepa Heterorhabditis sp. CIA-NE07 sobre larvas L5 de Cosmopolites sordidus en condiciones de laboratorio
Como se observa en la Figura 5, las larvas del estadío L5 de C. sordidus fueron susceptibles a las diferentes concentraciones de H. acatamensis utilizadas, como las dosis más altas y que causaron la mayor mortalidad. Las concentraciones de 100, 500 y 1000 JI.larva-1 (9, 44 y 88 JI.cm-2) presentaron un porcentaje de mortalidad de 60%, 80%, y 84%, respectivamente y se diferenciaron significativamente del tratamiento 0 JI.larva-1 donde las dosis de 500 y 1000 JI.larva-1 presentaron el mayor efecto sobre C. sordidus.
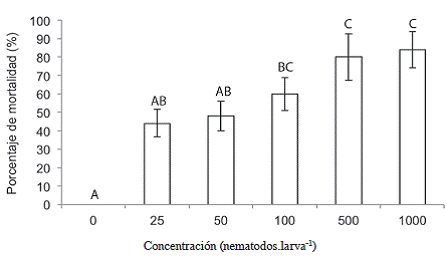
Figura 5: Mortalidad del estadío L5 de C. sordidus expuestos a Heterorhabditis atacamensis CIA-NE07 en platos petri 1 ddi. Barras con letras diferentes implican diferencias estadísticamente significativas según LSD p<0,05
El tratamiento control (0 JI.larva-1), presentó una mortalidad no debida a NEP de 24% sin que ninguna de las larvas presentara síntomas de infección por Heterorhabditis, ni se detectó la presencia de nematodos adultos en su interior al observarlas al estereoscopio. Este valor fue mayor al observado en el experimento anterior, probablemente porque el espacio para cada larva fue más limitado al colocar las separaciones en las placas.
Padilla et ál. (2010) en estudios in vitro realizados con cepas de H. bacteriophora y S. feltiae aisladas en las Islas Canarias, encontraron que a los 5 días la mayor mortalidad fue obtenida con la concentración 25 JI.cm-2 para Steinernema (85%) y 5 JI.cm-2 para Heterorhabditis (100%), a los 10 días todos los tratamientos (2,5, 5, 25, 50 y 100 IJI.cm-2) de ambas especies causaron la mortalidad de las larvas.
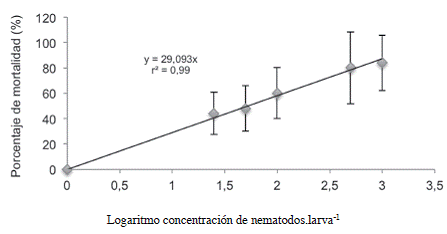
La DL50 para este estadío en condiciones de laboratorio al ddi 1 fue de 52 JI.larva-1; la cual se obtuvo con base en la ecuación de la curva de regresión presentada en la Figura 6. Los resultados indican que esta cepa fue capaz de infectar y provocar la muerte de las larvas de C. sordidus, lo que concuerda con lo expuesto por Ardon y Kurt (2003), quien afirma que para el caso de los coleópteros, los nematodos del género Heterorhabditis son altamente infectivos.
Efecto de cuatro concentraciones de la cepa H. atacamensis CIA-NE07 sobre larvas L5 de C. sordidus en cormos de banano
Cuando se evaluó el efecto de los tratamientos sobre la mortalidad de las larvas L5 de C. sordidus debida a Heterorhabditis, se encontró que los tratamientos inoculados con una concentración mayor o igual a 500 JI.larva-1 aumentaron significativamente el porcentaje de mortalidad debida a NEP con respecto al tratamiento 0 JI.larva-1 (Figura 7). Según el análisis de la curva de regresión presentada en la Figura 8, la DL50 para las larvas L5 del picudo correspondió a 375 JI.larva-1, (12444 JI.m-2), menor que la DL50 de 425 JI.larva-1 encontrada por Rodríguez et ál. (2009) por medio de la misma cepa de nematodo para controlar larvas L2 de P. elenans en condiciones de invernadero, lo que indica que las larvas de Cosmopolites fueron más susceptibles a los nematodos que las de P. elenans a pesar de que se encontraban dentro de los cormos. La concentración para alcanzar la mayor mortalidad posible correspondería, según la primera derivada de la ecuación (Figura 8) a 1523 JI.larva-1 (5,0 x 104 JI.m-2).
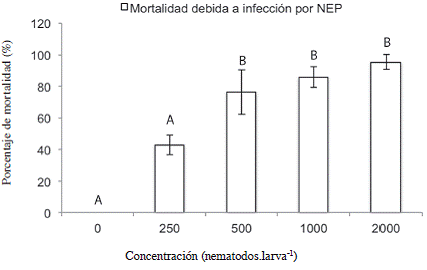
Figura 7: Mortalidad del estadío L5 de C. sordidus expuestos a Heterorhabditis atacamensis CIA-NE07 en cormos de banano 10 días después de la inoculación. Barras con letras diferentes implican diferencias estadísticamente significativas según LSD p<0,05.
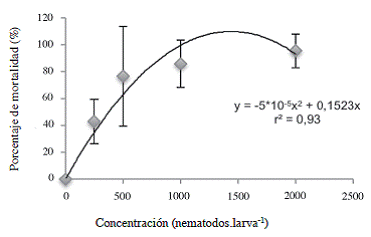
Figura 8: Porcentaje de mortalidad del estadío L5 de Cosmopolites sordidus expuestos a diferentes concentraciones de Heterorhabditis atacamensis CIA-NE07. Las barras corresponden a la desviación estándar
En los cormos, la DL50 fue de 375 JI.larva-1 a los 10 ddi; mientras que en platos petri fue de 52 JI.larva-1 al 1 ddi. Lo anterior evidencia un aumento de 7,2 veces el número de nematodos necesarios para infectar y matar a las larvas de picudo dentro del cormo; fenómeno que también fue descrito por Tavares et ál. (2007), al evaluar el efecto de 2 especies de nematodos entomopatógenos sobre las larvas del gorgojo de la caña de azúcar y atribuyó este aumento en la dosis de nematodos necesaria para infectar, a la posibilidad de las larvas de desplazarse a través del tallo para huir del nematodo, en este ensayo las larvas cuentan con el interior del cormo para alimentarse y desplazarse, no así en el plato petri, en el que en una superficie de 56,7 cm2 se colocaron 5 larvas, mientras que en el ensayo con cormos, los nematodos tuvieron que desplazarse en el suelo en un área mayor (904 cm2), enfrentarse a factores abióticos del suelo y encontrar sitios vulnerables en el cormo para poder penetrar a su interior y una vez adentro, localizar al insecto para infectarlo; todos éstos aspectos contribuyeron a que el número de nematodos que entran en contacto con las larvas de picudo sea menor al inoculado. La posible mayor susceptibilidad de las larvas a los NEP en los platos Petri pudo también contribuir a esta diferencia.
El porcentaje de mortalidad no debida a NEP de las larvas del tratamiento 0 JI.larva-1 fue de 24% a los 10 ddi, menor que lo observado en los ensayos en platos petri; esto se debe probablemente a que las larvas dentro del cormo se encuentran en su hábitat, al respecto, Gold y Messiaen (2000), señalan que el picudo es más activo en condiciones de oscuridad y es altamente susceptible a la desecación.
Un factor a considerar es que se utilizó suelo autoclavado con el fin de eliminar los depredadores del nematodo y de las larvas de picudo, además de eliminar insectos que pudieran ser infectados por el NEP disminuyendo la cantidad de nematodos disponibles para afectar al picudo, sin embargo a nivel de campo el nematodo debe enfrentarse a condiciones adversas como la presencia de depredadores, competencia con otros nematodos, aplicación de agroquímicos, riego y precipitación; que aumentarían el número de nematodos necesarios para controlar el picudo (Kaya y Gaugler 1993).
Este estudio permitió determinar las DL50 de H.atacamensis CIA-NE07 para el estadío L5 de C. sordidus ycomprobar que el nematodo es capaz de infectar y matar a uno de los estadíos larvales más desarrollados (L5) aún cuando las larvas se encuentran dentro del cormo de banano. Los resultados de este trabajo concuerdan con lo encontrado Mwaitulo et ál. (2011) quienes observaron un aumento en la mortalidad de las larvas al aumentar la dosis de nematodo y que estos fueron capaces de penetrar y establecerse en las larvas de picudo de banano. Cabe enfatizar la importancia del efecto adverso de los JI hacia las larvas de C. sordidus, al ser la fase larval la que cava túneles longitudinales en la superficie de la planta para luego penetrar hacia su interior (Ardon y Kurt 2003), sin embargo antes de la utilización de estos nematodos como controladores biológicos es necesario un estudio en campo que corrobore los resultados obtenidos en esta investigación. Por último es importante destacar que el adulto de C. sordidus,el cual esel foco de infestación presenta una alta resistencia a la infección del nematodo (Sirjusingh et ál. 1992, Carvajal 2009, Sánchez 2002, Mwaitulo et ál. 2011), por lo que es necesario combinar el uso de los NEP con otras técnicas como trampas de pseudotallo, empleo de semilla sana y hongos entomopatógenos como parte de un manejo integrado del picudo del banano (Gold et ál. 2001, Sirjusingh et ál. 1992, Treverrow y Bedding 1993).