Introducción
Las enmiendas orgánicas estimulan la acción antagónica de las poblaciones de hongos nematófagos depredadores (HND) del suelo (Stirling 1991, Akhtar y Malik 2000, Oka 2010), lo cual es requerido en una estrategia de control biológico de nematodos parásitos de plantas o de animales. Las enmiendas orgánicas que han sido utilizadas para estimular la actividad depredadora de los HND son de diversa naturaleza, por ejemplo residuos vegetales, estiércoles animales, materiales quitinosos, o compost (Akhtar y Mahmood1996 , Akhtar y Malik 2000, Dong y Zhang 2006, Oka 2010). Sin embargo, en la práctica el uso de dichas enmiendas orgánicas para estimular el control biológico de nematodos parásitos mediante HND frecuentemente presenta resultados inconsistentes (Siddiqui y Mahmood 1996, Dong y Zhang 2006, Oka 2010, Tabarant et ál. 2011). Este comportamiento ha sido atribuido entre otros aspectos a la composición química de la enmienda orgánica empleada y cellulose, chitin, pectin, a la fisiología particular de los HND (Akhtar y Malik 2000, Jaffee 2004a, Nguyen et ál. 2007, Tabarant et ál. 2011). Diversos experimentos han evidenciado un incremento en la actividad depredadora de algunos HND por la adición de enmiendas orgánicas al suelo, mientras que la misma enmienda orgánica puede no producir el mismo efecto en otras especies de HND (Jaffee et ál. 1998, Jaffee 2004a, Nguyen et ál. 2007). En este escenario, resulta una necesidad investigar aspectos nutricionales de HND específicos de una manera detallada. Dicha información permitiría manipular las condiciones ambientales del suelo donde los HND van a actuar para proporcionarles ventajas competitivas para llevar a cabo su función como biocontroladores.
Las enmiendas orgánicas usadas para estimular las poblaciones de HND pueden contener diversos tipos de fuentes de carbono. Sin embargo, es probable que estos hongos presenten preferencias nutricionales por algunas fuentes de carbono, es decir, los HND pueden ser capaces de metabolizar eficientemente algunas fuentes de carbono, pero no otras (Satchuthananthavale y Cooke 1967, Tabarant et ál. 2011). Esto resulta relevante, ya que diversas investigaciones reportan que la competencia entre los HND y otros microorganismos del suelo por sustratos orgánicos, es el fenómeno que activa o inactiva la fase depredadora de los HND (Cooke 1962, Pramer 1964, Quinn 1987). En una estrategia de control biológico de nematodos, es precisamente la fase depredadora la que nos interesa activar y mantener por sobre la fase saprofítica.
En suelos de Costa Rica los HND se encuentran ampliamente distribuidos, hongos como Arthrobotrys oligospora, A. conoides, A. dactyloides, Candelabrella musiformis y Monacrosporium sp., han sido aislados de diversos tipos de sustratos, sistemas productivos, y áreas geográficas (Peraza et ál. 2011, Soto et ál. 2011), por lo que su uso como biocontroladores de nematodos parásitos de plantas y animales a nivel local es viable. Los HND nativos de Costa Rica han demostrado ser biocontroladores eficientes de nematodos parásitos (Orozco et ál. 2009, Soto et ál. 2011); sin embargo, para mejorar su desempeño en una estrategia de control biológico en el suelo, métodos apropiados de aplicación/ inoculación o incremento de las poblaciones autóctonas deben ser desarrollados, dentro de los cuales el uso de enmiendas orgánicas es factible. El presente trabajo tiene por objetivo determinar el crecimiento diferencial de HND nativos de Costa Rica en fuentes de carbono diversas, mediante la determinación de la rapidez (velocidad de crecimiento) con que colonizan medios de cultivo artificiales con dichas fuentes de carbono.
Materiales y métodos
Hongos nematófagos depredadores
Quince cepas de HND nativos provenientes de 5 provincias de Costa Rica (Alajuela, Cartago, Heredia, Limón y San José) fueron utilizadas en el presente trabajo. Las cepas fueron aisladas de diversos tipos de sustratos provenientes de sistemas productivos con manejos diferentes, y de varias áreas geográficas distintas (Cuadro 1). De las 15 cepas, 9 fueron identificadas como C. musiformis, que es un HND formador de redes adhesivas bidimensionales, y 6 fueron identificadas como A. oligospora, que es un HND formador de redes adhesivas tridimensionales (Watanabe 1937, Haard 1968, De Hoog 1985, Rubner 1996). Para la obtención del inóculo para el experimento, todos los hongos fueron reproducidos en agar-agua (AA) e incubados a temperatura ambiente (23-26°C) y luz artificial por una semana.
Cuadro 1: Hongos nematófagos depredadores utilizados y su origen
| Cepa | Especie | Sustrato | Origen del sustrato |
|---|---|---|---|
| BBP1 | C. musiformis | Bocashi elaborado a partir de estiércol de bovino | Poasito, Alajuela |
| BBP2 | A. oligospora | Bocashi elaborado a partir de estiércol de bovino | Poasito, Alajuela |
| C4 | A. oligospora | Estiércol de cabra | Coronado, San José |
| DAP | A. oligospora | Suelo de potrero, ganado vacuno, finca lechera orgánica | Moravia, San José |
| DEPG | C. musiformis | Suelo de potrero rotativo de gallinas, producción orgánica | África, Limón |
| FDH1 | C. musiformis | Suelo sistema agroforestal de producción de cacao | Talamanca, Limón |
| G1 | A. oligospora | Estiércol de bovino, finca ganadera | Guápiles, Limón |
| G3 | C. musiformis | Estiércol de bovino, finca ganadera | Guápiles, Limón |
| LS | C. musiformis | Suelo y hojarasca bosque secundario | Sarapiquí, Heredia |
| MEG | C. musiformis | Estiércol de bovino, manejo ecológico | Pococí, Limón |
| MO1 | A. oligospora | Suelo de plantación de morera orgánica, abonada con lombricompost de cabra | Santa Lucía, Heredia |
| PFC | C. musiformis | Suelo de potrero, finca diversificada en transición | Coronado, San José |
| PFSL1 | C. musiformis | Suelo de potrero proyecto lechero, ganado bovino | Santa Lucía, Heredia |
| UCR1a | A. oligospora | Estiércol ganado bovino lechero | Turrialba, Cartago |
| UCR1b | C. musiformis | Estiércol ganado bovino lechero | Turrialba, Cartago |
Determinación de la velocidad de crecimiento de los hongos nematófagos depredadores en medios de cultivo artificiales con fuentes de carbono diversas
La determinación de la velocidad de crecimiento de los HND se realizó en cajas petri de 9 cm de diámetro con medios de cultivo formulados con las siguientes fuentes de carbono: celulosa (Villena y Gutiérrez 2003), pectina (Malvessi y Moura 2004), leche descremada, quitina y almidón (Sánchez 2000). En las bases de todas las cajas petri se trazaron 2 ejes perpendiculares, en cuya intersección se depositaron de 4000 a 6000 conidios de cada una de las cepas de HND. La velocidad de crecimiento de los hongos en cada medio de cultivo diferente se realizó por triplicado. Todas las cajas, se incubaron a temperatura ambiente (23-26°C) y luz artificial. A partir de las 24 h y hasta que los hongos cubrieron toda la superficie del medio se midió (en cm) el crecimiento fúngico sobre los ejes (French y Hebert 1980). Posteriormente se calculó el promedio de las 3 repeticiones y con los datos obtenidos se construyó la curva de crecimiento de cada una de las cepas en los diferentes medios de cultivo. La curva de crecimiento permitió calcular la velocidad de crecimiento (en cm.h-1) por medio de la determinación de la pendiente de la curva en la fase logarítmica. La velocidad de crecimiento de los HND se midió también en los medios papa-dextrosa agar (PDA) y AA, los cuales fungieron como testigos, ya que en el primero los HND crecen rápidamente y producen gran cantidad de biomasa, en el segundo los hongos crecen lentamente y producen una baja cantidad de biomasa debido a que se trata de un medio de cultivo extremadamente pobre.
Análisis estadísticos
Para determinar diferencias en las velocidades de crecimiento desarrolladas por las cepas de C. musiformis y A. oligospora en los medios de cultivo a partir de fuentes de carbono diversas, análisis permutacional multivariado de varianza (PERMANOVA) y análisis de varianza de una vía (ANOVA) fueron utilizados. El PERMANOVA fue llevado a cabo por medio del set completo de velocidades de crecimiento desarrolladas por las cepas de HND en todos los medios de cultivo; para visualizar diferencias evidenciadas por el PERMANOVA, un escalamiento multidimensional se utilizó el análisis de coordenadas principales (PCO; Anderson 2001) fue construido. Posteriormente, ANOVAs de una vía fueron llevados a cabo para comparar las velocidades desarrolladas por C. musiformis y A. oligospora en cada medio de cultivo de manera individual. Para realizar todos los análisis estadísticos, el software PRIMER v6 +PERMANOVA (PRIMER-E Ltd) fue utilizado.
Resultados
Las cepas de C. musiformis y A. oligospora desarrollaron velocidades de crecimiento diferentes en los medios de cultivo que contemplan las diversas fuentes de carbono y las diferencias fueron estadísticamente significativas (F 1, 21=11, p=0,001; Figura 1). Al analizar la velocidad de crecimiento desarrollada en cada uno de los medios de cultivo, fue evidente que las diferencias observadas en el análisis multivariado fueron el resultado de las diferencias desarrolladas por C. musiformis y A. oligospora específicamente en los medios con celulosa y PDA donde las cepas de ambas especies crecieron significativamente más rápido en comparación con los medios que contenían otras fuentes de carbono. En el medio con celulosa, las cepas de C. musiformis crecieron más lentamente en comparación con las cepas de A. oligospora y estas diferencias fueron estadísticamente significativas ( F 1, 12=21,29, p=0,002 para el medio con celulosa; F 1, 7=38,7, p=0,001 para el medio PDA; Cuadros 2 y 3). Las cepas de C. musiformis desarrollaron velocidades de crecimiento promedio en el siguiente orden descendente: celulosa > quitina > PDA > AA > pectina > almidón > leche descremada (Cuadro 2). Las cepas de A. oligospora desarrollaron velocidades de crecimiento promedio en el siguiente orden descendente: celulosa > PDA > quitina > AA > pectina > almidón > leche descremada (Cuadro 3). Excepto por los testigos (PDA y AA), el patrón de comportamiento que siguieron C. musiformis y A. oligospora en cuanto a velocidades de crecimiento en las diferentes fuentes de carbono fue similar.
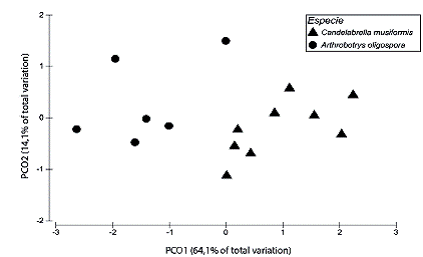
Figura 1: Escalamiento multidimensional por medio del análisis de coordenadas principales de las velocidades de crecimiento desarrolladas por cepas de hongos nematófagos depredadores de las especies Candelabrella musiformis y Arthrobotrys oligospora en medios de cultivo con celulosa, quitina, pectina, almidón y leche descremada como fuentes únicas de carbono.
Cuadro 2: Velocidades de crecimiento promedio desarrolladas por las cepas de Candelabrella musiformis en medios de cultivo con fuentes de carbono diversas.
| Velocidad de crecimiento (cm.h-1) | ||||||||
|---|---|---|---|---|---|---|---|---|
| Fuentes de carbón | Testigos | |||||||
| Cepa | Pectina | Celulosa | Leche descremada | Quitina | Almidón | PD A | AA | |
| BBP1 | 0,036 | 0,067 | 0,017 | 0,061 | 0,041 | 0,059 | 0,051 | |
| DEPG | 0,047 | 0,054 | 0,011 | 0,055 | 0,030 | 0,050 | 0,052 | |
| FDH1 | 0,045 | 0,062 | 0,013 | 0,057 | 0,029 | 0,058 | 0,053 | |
| G3 | 0,038 | 0,068 | 0,018 | 0,060 | 0,037 | 0,059 | 0,060 | |
| LS | 0,042 | 0,062 | 0,018 | 0,059 | 0,035 | 0,059 | 0,057 | |
| MEG | 0,035 | 0,075 | 0,019 | 0,055 | 0,044 | 0,053 | 0,061 | |
| PFC | 0,039 | 0,067 | 0,012 | 0,044 | 0,031 | 0,046 | 0,051 | |
| PFSL1 | 0,044 | 0,055 | 0,017 | 0,054 | 0,037 | 0,052 | 0,047 | |
| UCR1b | 0,041 | 0,071 | 0,019 | 0,060 | 0,038 | 0,057 | 0,056 | |
| Media | 0,041 | 0,064 | 0,016 | 0,056 | 0,036 | 0,055 | 0,054 | |
| Desviación estándar | 0,004 | 0,007 | 0,003 | 0,005 | 0,005 | 0,005 | 0,005 | |
| Valor máximo | 0,047 | 0,075 | 0,019 | 0,061 | 0,044 | 0,059 | 0,061 | |
| Valor mínimo | 0,035 | 0,054 | 0,011 | 0,044 | 0,029 | 0,046 | 0,047 | |
| Coeficiente de variación (%) | 10,3 | 11,0 | 19,6 | 9,0 | 13,8 | 8,7 | 8 , 6 | |
Cuadro 3: Velocidades de crecimiento promedio desarrolladas por las cepas de Arthrobotrys oligospora en medios de cultivo con fuentes de carbono diversas.
| Velocidad de crecimiento (cm.h-1) | ||||||||
|---|---|---|---|---|---|---|---|---|
| Fuentes de carbon | Testigos | |||||||
| Cepa | Pectina | Celulosa | Leche descremada | Quitina | Almidón | PD A | AA | |
| BBP2 | 0,034 | 0,096 | 0,022 | 0,065 | 0,03 | 0,069 | 0,054 | |
| C4 | 0,041 | 0,082 | 0,017 | 0,066 | 0,034 | 0,068 | 0,057 | |
| DAP | 0,041 | 0,070 | 0,014 | 0,045 | 0,028 | 0,070 | 0,062 | |
| G1 | 0,037 | 0,084 | 0,023 | 0,065 | 0,036 | 0,068 | 0,055 | |
| MO1 | 0,045 | 0,083 | 0,017 | 0,056 | 0,039 | 0,064 | 0,063 | |
| UCR1a | 0,035 | 0,083 | 0,015 | 0,065 | 0,022 | 0,074 | 0,063 | |
| Media | 0,039 | 0,083 | 0,018 | 0,061 | 0,032 | 0,069 | 0,059 | |
| Desviación estándar | 0,004 | 0,008 | 0,004 | 0,008 | 0,006 | 0,003 | 0,004 | |
| Valor máximo | 0,045 | 0,096 | 0,023 | 0,066 | 0,039 | 0,074 | 0,063 | |
| Valor mínimo | 0,034 | 0,070 | 0,014 | 0,045 | 0,022 | 0,064 | 0,054 | |
| Coeficiente de variación (%) | 10,8 | 10,2 | 19,8 | 13,2 | 19,5 | 4,5 | 7 , 1 | |
Discusión
Las cepas de HND desarrollaron velocidades de crecimiento significativamente mayores en el medio con celulosa en comparación con los otros medios de cultivo. Las cepas de C. musiformis y A. oligospora desarrollaron un patrón de velocidades de crecimiento similar en los medios de cultivo con fuentes de carbono diversas. Sin embargo, en el medio con celulosa, las cepas de A. oligospora crecieron significativamente más rápido con respecto a las cepas de C. musiformis. Por otro lado, las cepas de ambas especies crecieron más lentamente en los medios con almidón y leche descremada.
Los HND presentan una fase depredadora durante la cual se alimentan de nematodos vivos, y una fase saprofítica que les permite crecer en muchos sustratos orgánicos (Jairajpuri 1990, Persson et ál. 2000, Nguyen et ál. 2007, Swe et ál. 2009). Durante la adición de una enmienda orgánica al suelo, la fase depredadora de los HND se presenta inmediatamente pero declina a niveles bajos entre los 7 y 9 días, tras lo cual los hongos regresan a su fase saprofítica (Satchuthananthavale y Cooke 1967). Los HND han sido reportados como competidores poco eficientes por sustratos orgánicos. Durante periodos de competencia intensa, como por ejemplo durante la adición de enmiendas orgánicas al suelo, se genera estrés por competencia en los HND, los cuales optan por utilizar una fuente de energía alternativa inaccesible para otros hongos del suelo, por ejemplo, los nematodos (Cooke 1962). Por lo tanto, la depredación de nematodos por parte de los HND puede considerarse como una estrategia de supervivencia durante los periodos de actividad microbiana intensa (Cooke 1962, Quinn 1987, Jairajpuri 1990, Stirling 1991).
Durante el ensayo, las cepas de C. musiformis y A. oligospora presentaron la mayor velocidad de crecimiento en el medio con celulosa, lo que indica que ambos hongos poseen la maquinaria enzimática para metabolizar dicha fuente de carbono (Satchuthananthavale y Cooke 1967, Persson et ál. 2000, Jaffee 2004b). Este hallazgo resulta lógico, ya que estos hongos habitan el suelo (Watanabe 1937), donde la celulosa es depositada con regularidad en forma de residuos vegetales. Los HND probados presentaron diferencias particulares en la rapidez con la que colonizaron el medio con celulosa, específicamente las cepas de A. oligospora presentaron una mayor velocidad de crecimiento en esta fuente de carbono con respecto a las cepas de C. musiformis. Este resultado sugiere que diferentes especies de HND pueden presentar diferentes capacidades de asimilación de la celulosa, lo cual contribuiría a explicar por qué ciertos materiales vegetales estimulan la fase depredadora en algunos HND, mientras que en otros HND el mismo material vegetal estimula la fase saprofítica (Scholler y Rubner 1994, Jaffee 2004a). En otras palabras, algunos tipos de residuos vegetales son capaces de producir estrés por competencia en algunas especies de HND, que a su vez activan de esta manera, la fase depredadora, mientras que en otras especies de HND los mismos materiales no producen dicho estrés que promueve la fase saprofítica. De acuerdo con los resultados, la celulosa produce estrés por competencia tanto en C. musiformis como en A. oligospora, pero en menor grado en la última especie.
Tanto las cepas de C. musiformis como las de A. oligospora presentaron una velocidad de crecimiento similar en el medio con quitina. Después del medio con celulosa, el medio con quitina fue colonizado con mayor rapidez por los HND, aunque la velocidad de crecimiento desarrollada en este medio no difirió significativamente de las velocidades desarrolladas en otras fuentes de carbono, como pectina, almidón o leche descremada. Los HND producen enzimas quitinolíticas que les permiten degradar la cutícula de los nematodos (Tikhonov et ál. 2002, Gortari y Hours 2008, Yang et ál. 2013). Por lo tanto, los HND pueden considerarse buenos competidores por sustratos que contienen material quitinoso, de tal manera que es probable que este material produzca bajo estrés por competencia en los hongos. En consecuencia, la adición al suelo de una enmienda orgánica constituida de material quitinoso promovería la fase saprofítica de los HND por sobre la fase depredadora (Nguyen et ál. 2007). Sin embargo, varios mecanismos de control de nematodos, además de la depredación directa por parte de los HND, han sido descritos como resultado de la adición de quitina al suelo (Oka 2010), por lo que la adición de quitina al suelo ha presentado resultados aceptables en el control de nematodos parásitos (Akhtar y Malik 2000, Nguyen et ál. 2007, Gortari y Hours 2008).
Las cepas de C. musiformis y A. oligospora desarrollaron las velocidades de crecimiento más bajas en los medios con almidón y leche descremada, lo que sugiere que ambas especies son competidoras poco eficientes por estos sustratos orgánicos en comparación con otros grupos de microorganismos del suelo. Este resultado indica que sustratos orgánicos como el almidón o algún subproducto lácteo adicionados al suelo podrían producir estrés por competencia en las poblaciones de C. musiformis y A. oligospora, que provoca su fase depredadora y que a la vez favorece el control biológico de nematodos parásitos. Sin embargo, esta hipótesis debe explorarse más a fondo.
En conclusión, para un control biológico eficiente de nematodos parásitos de plantas o animales mediante HND es necesario conocer aspectos nutricionales de los últimos. Esto es relevante en el caso de los agroecosistemas de Costa Rica, donde los HND están ampliamente distribuidos en los suelos. En este caso, es ideal desarrollar métodos para incrementar la densidad de inóculo de los HND durante periodos no críticos del cultivo, por ejemplo por medio de la adición de enmiendas orgánicas ricas en celulosa o quitina. Por otro lado, es necesario desarrollar métodos para favorecer la fase depredadora de los HND durante periodos críticos del cultivo, por ejemplo mediante la adición de enmiendas orgánicas ricas en almidón o algún subproducto lácteo.














