Introducción
La literatura sobre azul de mata es escasa y el conocimiento generado por otros estudios se ha enfocado principalmente en el campo de la medicina. Justicia tinctoria pertenece a la familia Acanthaceae, es una planta sub-leñosa, tipo arbustiva, perenne y erecta, muy ramificada, que alcanza una altura promedio que varía entre 1 y 2 metros. Nativa de América, esta planta se localiza desde México hasta Colombia, se localiza en zonas altas y frescas. En Costa Rica crece de 0 hasta 1300 msnm. La planta ha sido utilizada como cerca viva, tapa viento, colorante para paredes de casas de adobe y como colorante textil. Además, posee propiedades medicinales, y ha sido utilizada como expectorante y contra problemas pulmonares así mismo ha mostrado ser útil contra problemas gastrointestinales como la diarrea y la disentería. Se propaga por semilla y principalmente por medio de estacas (Ocampo 1987, Rodríguez 2006).
La propagación vegetativa o asexual se define como la multiplicación de una planta a partir de una célula, un tejido o un órgano, permitiendo la reproducción de individuos a partir de secciones vegetativas, obteniendo clones de la planta que se está propagando, conservando las características propias de cada individuo (Hartmann et ál. 2011). Dentro de la multiplicación asexual, es la propagación por estacas la técnica más común para la propagación de especies de importancia en la floricultura (Dole y Hamrick magnitude of each of those 2006). Esta técnica permite desarrollar proyectos de propagación en un espacio reducido, con la ventaja de obtener mucho material a partir de una sola planta (Ocampo y Valverde 2000). El éxito en el enraizamiento por estacas depende de varios factores, que garanticen reducir la transpiración de las estacas, y optimizar el proceso de fotosíntesis, así como el uso de sustratos adecuados y reguladores de crecimiento que favorezcan la formación de raíces (Ruiz y Mesén 2010, Hartmann et ál. 2011).
Por lo general se utilizan auxinas para estimular la formación de raíces adventicias, ya que estas estimulan la división celular, así como también promueven el transporte de carbohidratos y de cofactores foliares hacia las regiones tratadas. Además, estimulan la síntesis de ADN, lo que resulta en una mayor división celular (Ruiz y Mesén 2010). Actualmente el ácido indol3-butírico (AIB) y el ácido naftalenacético son las auxinas más usadas para el enraizamiento de estacas (Hartmann et ál. 2011). Concentraciones de AIB entre 500 y 1500 ppm han sido aplicadas con éxitos a plantas herbáceas y de madera suave, mientras que rangos entre 1000 y 3000 ppm pueden ser usados en plantas con tejido leñoso. Aplicar una concentración adecuada del regulador es de vital importancia, ya que un exceso en la concentración de auxina puede inhibir el desarrollo de la yema, causar amarillamiento e incluso la muerte de la estaca (Whipker et ál. 2006).
Para un enraizamiento exitoso también se debe de mantener un adecuado nivel de humedad tanto ambiental como en el sustrato, con el fin de minimizar el estrés hídrico de las estacas y así evitar el cierre de estomas, lo que a su vez restringe la fotosíntesis y la producción consiguiente de carbohidratos (Loach 1988). Un sustrato adecuado debe brindar una adecuada retención de humedad y aireación, sin dejar de lado que ofrezca un adecuado soporte a las estacas, sin impedimentos a crecimiento radicular (Trejos 1996).
Estudios relacionados con tintes naturales utilizando azul de mata han logrado precisar técnicas de extracción del tinte, cantidad de material a utilizar y los colores que se pueden obtener (Gutiérrez et ál. 2006, Thompson 2009). Sin embargo, no se encontró literatura que se refiera al manejo agronómico que se debe dar a un sistema de producción. Al existir este vacío de conocimiento, es preciso investigar el efecto de la posición de la estaca, la ausencia o presencia de hojas, el sustrato y dosis de ácido indolbutírico sobre el enraizamiento de estacas de azul de mata, para lograr una adecuada propagación y así obtener plantas de buena calidad para el trasplante, pensando en alguna futura explotación de la planta.
Materiales y métodos
El proyecto se llevó a cabo entre febrero y octubre del 2012, en las instalaciones de la Compañía Nacional de Fuerza y Luz (CNFL), cantón de Vásquez de Coronado, en la zona conocida como la Gallera (9º59' latitud norte y 84º00' longitud oeste), a una altitud de 1480 msnm. El material vegetal para los ensayos se obtuvo de una cerca viva ubicada en una finca cafetalera localizada en el distrito de Ipís-Goicoechea (9º57'58'' latitud norte y 84º01'43'' longitud oeste). El material vegetal se tomó al azar en todo el trayecto de la cerca y se colocó en una cámara húmeda hasta el momento de su preparación. Ya en el invernadero, las estacas se cortaron al tamaño deseado según el ensayo, procurando al menos que las estacas tuvieran 2 nudos, y que al menos un nudo estuviese ubicado en la parte basal de la estaca, a una distancia de entre 0,5 y 1,0 cm del corte. Se descartó una porción de entre 15 y 30 cm entre las zonas donde se ubicaban los 3 tipos de estaca a trabajar, en este caso basal (B), medial (M) y terminal (T).
Preparación de soluciones de reguladores de crecimiento
Para la elaboración de la solución madre de AIB se pesó 1,5 g del reactivo puro (AIB >98% de pureza). Esta cantidad se trasvaso en un recipiente cilíndrico y se fue diluyendo con KOH 1 M, mientras todo se homogenizaba en un agitador. Homogenizada la solución, se midió el pH, y se ajustó el valor obtenido a 5,8±0,1. Para ello, se adicionó poco a poco HCl 0,1M. La solución obtenida se colocó en un litro, utilizando agua destilada para obtener una solución a una concentración de 1500 ppm. A partir de esta solución, se prepararon soluciones de 500 y 1000 ppm utilizando la fórmula C1V1=C2V2; donde C1 significa la concentración de la solución madre, V1 significa el volumen de solución madre a extraer, siendo esta la incógnita a determinar, mientras que, C2 significa la concentración que desea obtener y V2 representa el volumen final de la solución que se desea obtener.
Análisis de sustratos
En el Laboratorio del Programa de Hortalizas, ubicado en la Estación Experimental Agrícola Fabio Baubrit Moreno (EEAFBM) de la UCR, se realizó un análisis de la granulometría de los sustratos. Se utilizó una criba mecánica manual, la cual está dividida en diferentes tamices (>2 mm, 1-2 mm, 0,5-1 mm, 0,25-0,5 mm y <0,25 mm). Se tomó material seco de cada sustrato y se llenó el 100% del frasco superior de la criba, evitando dejar espacios vacíos. Se procedió a agitar manualmente la criba por 3 min. Luego, con ayuda de una balanza analítica (Precisa Instrument AG, modelo 202 A, Suiza), se procedió a registrar el peso del material recolectado en cada tamiz. Se procedió a calcular el porcentaje del material recolectado en cada tamiz de acuerdo con la siguiente fórmula:
Siembra del ensayo 1
Se utilizó un diseño irrestricto con un arreglo de tratamientos en parcelas divididas, con 4 parcelas, donde las parcelas grandes fueron las dosis de auxina y las parcelas pequeñas las posiciones de estaca. En todas las parcelas se utilizó fibra de coco como sustrato. En cada parcela pequeña se ubicaron los 3 tratamientos de estacas tomadas de diferentes posiciones (B, M y T). El tamaño de cada una de las estacas fue de 10 cm. Dichas estacas fueron sometidas a una inmersión de la parte basal dosis respectiva de AIB; 0 ppm, 500 ppm, 1000 ppm y 1500 ppm. Se trabajó con estacas sin hojas para mantener la homogeneidad de los tratamientos. Cada parcela grande constó de 6 repeticiones, y cada repetición se ubicó en una bandeja, con un total de 30 estacas por bandeja (10 por cada tratamiento de posición de estaca). Para esta prueba se necesitó un total de 720 estacas.
Siembra del ensayo 2
Se utilizó un diseño irrestricto con arreglo de tratamientos en parcelas divididas, con 4 parcelas, donde las parcelas grandes fueron las dosis de auxina y las parcelas pequeñas las estacas con y sin presencia de hojas. Todas las parcelas contenían fibra de coco como sustrato. Se aplicó el mejor tratamiento obtenido del ensayo 1 según el análisis estadístico efectuado, en este caso solo se utilizó estacas terminales (sin yema apical). El tamaño de cada una de las estacas fue de 10 cm. Las estacas fueron sometidas a los tratamientos de AIB 0 ppm, 500 ppm, 1000 ppm y 1500 ppm en la parte basal de las mismas. Todas las estacas con hojas, poseían un par de hojas y el área foliar se redujo a la mitad. Cada parcela grande constó de 6 repeticiones, y cada repetición se ubicó en una bandeja, con un total de 30 estacas por bandeja (15 por cada tratamiento de con y sin hojas). Para esta prueba se necesitó un total de 720 estacas.
Siembra del ensayo 3
Se probaron 3 longitudes (6, 9 y 12 cm) de estacas terminales sin hojas, sin yema apical con aplicación de 1000 ppm de AIB, combinadas con 3 tipos de sustrato (fibra de coco, arena de río y carbón de granza). Para ello se utilizó un diseño irrestricto con un arreglo de tratamientos de parcelas divididas, con 3 parcelas, donde las parcelas grandes fueron los tipos de sustrato y las parcelas pequeñas fueron el tamaño de las estacas, y en donde se aplicó el mejor tratamiento obtenido del ensayo 1 y 2 según el análisis estadístico efectuado. La aplicación del AIB se realizó de igual manera al ensayo 2. Cada parcela grande constó de 6 repeticiones, y cada repetición se ubicó en una bandeja, para un total de 30 estacas por bandeja (10 por cada tratamiento de longitud de estaca). Se requirieron un total de 540 estacas.
Para todos los ensayos la distancia de siembra fue de 5 cm entre estacas en una misma hilera y de 8 cm entre hileras. Además, la profundidad de siembra fue de 3 cm. La inmersión en la solución de AIB de cada una de las estacas fue aproximadamente de 0,5 a 0,7 cm de la parte basal de la estaca por un minuto en la solución correspondiente al tratamiento. Las dimensiones de las bandejas utilizadas fueron de 51 cm de largo, 27 cm de ancho y 12 cm de fondo.
Riego
Se instaló un sistema de riego por aspersión, con 2 filas de riego cada una con 2 aspersores de 40 litros.hora-1. La distancia entre los aspersores y las bandejas de siembra fue de 80 cm. La frecuencia del riego fue de un minuto (3 veces al día), y se tomó como parámetro para iniciar un nuevo riego cuando la humedad relativa dentro del invernadero estuviese cercana o inferior a 80%. La frecuencia de riego dependió de las condiciones climáticas imperantes, en el caso de días con temperaturas muy elevadas o ventosos, el riego aumentó su frecuencia (máximo 5 veces al día), mientras que, en días lluviosos y con una alta humedad relativa disminuyó su frecuencia a una vez al día.
Evaluaciones y análisis de datos
Las evaluaciones iniciaron 3 semanas después de establecidos los ensayos, y se prolongaron por un período de 2 meses para el ensayo 1 y de un mes para los ensayos 2 y 3. En cada caso se realizaron mediciones de porcentaje de brotación áerea y conteo de brotes aéreos por estaca brotada, porcentaje de enraizamiento, longitud de raíz (la de mayor extensión), conteo de cantidad de raíces por estaca y porcentaje de estacas afectadas por plagas o enfermedades.
Las variables de cantidad de brotes, longitud de raíz y cantidad de raíces fueron evaluadas mediante análisis de varianza y sometidos a la prueba de Tukey (p<0,05), para determinar los tratamientos que presentaban diferencias entre sí, utilizando el programa estadístico InfoStat (Di Rienzo et ál. 2013). Para el análisis del porcentaje de brotación y porcentaje de enraizamiento, por tratarse de variables binomiales, se evaluó mediante la estimación de modelos lineales generalizados mixtos y, posteriormente, se efectuó la prueba LSD Fisher (p<0,05), para determinar los tratamientos que presentaban diferencias entre sí. Todo ello se hizo con el programa estadístico InfoStat (Di Rienzo et ál. 2013).
Para el caso de evaluación de raíces, para el ensayo 1 se realizaron 2 evaluaciones. La primera se realizó 42 días después de la siembra de la prueba. La segunda evaluación se realizó al finalizar el proyecto (70 días después de la siembra de la prueba). Para cada evaluación de raíces se tomó al azar 3 bandejas por parcela. Para los ensayos 2 y 3, la evaluación de raíces se realizó al finalizar el experimento (42 días después de sembrados los ensayos).
Resultados
La temperatura promedio durante todo el proyecto fue de 21,3°C, la máxima de 26,1°C y la mínima de 16,5°C. Mientras que la humedad relativa promedio fue de 81,5%, la máxima fue de 96 ,3% y la mínima fue de 66,6%.
Análisis de los sustratos
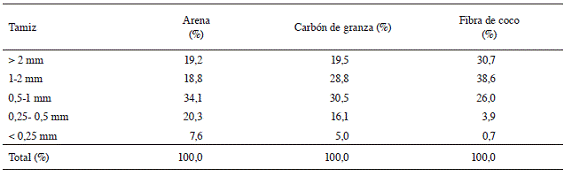
En el Cuadro 1 se presentan los resultados del análisis granulométrico realizado a los 3 sustratos utilizados. La prueba indica que es la arena la que presentó el menor porcentaje de partículas mayores a 1 mm, pero la que mostró los mayores porcentajes de partículas mayores a 0,5 mm. Caso contrario exhibió la fibra de coco, ya que mostró el mayor porcentaje de partículas mayores a 1 mm entre los sustratos evaluados, pero el menor porcentaje de partículas inferiores a 0,5 mm. En el caso del carbón de granza, los porcentajes obtenidos fueron valores intermedios entre los sustratos comentados anteriormente.
Cuadro 1: Análisis de la granulometría para los sustratos evaluados en la propagación de azul de mata (Justicia tinctoria).
Ensayo 1: Evaluación de la posición de la estaca y la dosis de AIB
El Cuadro 2 evidencia que hubo efecto significativo de la posición de la estaca en la rama madre, siendo las estacas terminales las que presentaron los mayores valores para todas las variables, excepto para el porcentaje de enraizamiento. En cuanto a las dosis de AIB, para el porcentaje de brotación se observa un mejor resultado para el tratamiento con 0 ppm que para 500 ppm, mientras que las dosis de 1000 y 1500 ppm no se diferencian con las 2 anteriores. Para la variable de cantidad de brotes la prueba indica un menor valor para el tratamiento con 500 ppm presentando diferencias significativas con respecto a los tratamientos con 0 y 1000 ppm, estos 2 últimos sin diferencias entre sí, mientras que 1500 ppm de AIB no se diferenció de ningún tratamiento. En el caso de la variable de cantidad de raíces, la prueba separó estadísticamente los tratamientos con 1000 y 1500 ppm con los de 0 y 500 ppm, siendo las primeras las que presentaron los valores más altos (0,59 y 0,49, respectivamente). En las demás variables no se observó diferencias entre los tratamientos (Cuadro 2).
Cuadro 2: Efecto de la posición de la estaca y de la dosis de AIB para las variables relacionadas con el enraizamiento de Justicia tinctoria, realizado del 21 de marzo al 28 de mayo del 2012.
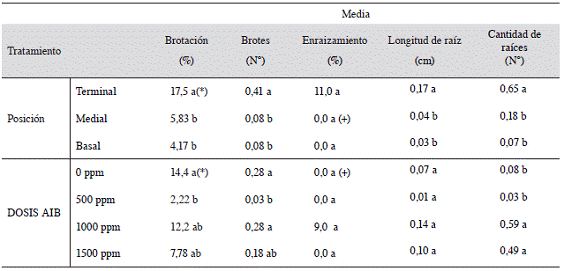
(*) Valores promedio en una misma columna seguida por diferente letra indican diferencias significativas (p<0,05) entre ellas, según la prueba de rango múltiple de Tukey y LSD de Fisher según la variable correspondiente. (+) Valores de porcentaje de enraizamiento con valor de 0,0 si presentaron enraizamiento con valores pertenecientes al orden decimal 0,001 sin embrago por factor de redondeo no se muestra los valores respectivos.
Ensayo 2: Efecto de la dosis de AIB en estacas con y sin hojas
El Cuadro 3 muestra que hubo efecto significativo de la dosis de AIB en los porcentajes de brotación y enraizamiento, siendo 1000 ppm el que presentó las mayores magnitudes (79% y 69% respectivamente). Para el caso de cantidad de raíces, se observa que las dosis de AIB de 1000 y 1500 ppm indujeron una mayor cantidad de raíces por estaca (8,4 y 9,24 respectivamente, pero sin diferencias significativas entre ellas) que al usar dosis menores.
Cuadro 3: Efecto de varias dosis de AIB y de la presencia o ausencia de hojas sobre las variables relacionadas con el enraizamiento de Justicia tinctoria, realizado del 10 al 20 de agosto del 2012.
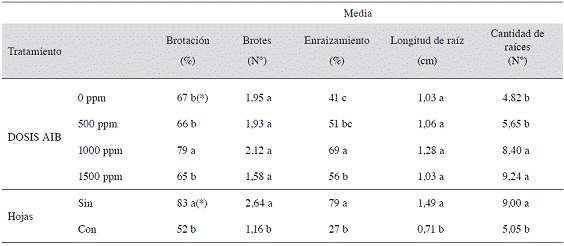
(*)Valores promedio en una misma columna seguida por diferente letra indican diferencias significativas (p<0,05) entre ellas, según la prueba de rango múltiple de Tukey y LSD de Fisher según la variable correspondiente.
Mientras que al trabajar con estacas sin hojas se evidencian claramente, diferencias significativas en todas las variables y se llegó a observar un aumento del porcentaje para todas las variables analizadas, comparado contra el uso de estacas con presencia de hojas (Cuadro 3). En cuanto a la interacción entre ambos factores, las pruebas realizadas no mostraron relación significativa entre ellos.
Ensayo 3: Efecto del sustrato y el tamaño de estaca
El Cuadro 4 muestra que hubo efecto significativo con el uso de arena, siendo este el mejor sustrato ya que se obtuvo un mayor porcentaje de brotación y de enraizamiento así como de longitud de raíz que con los otros sustratos. El segundo mejor sustrato según el análisis fue el carbón de granza, en cuanto a los mismos parámetros.
Finalmente, la fibra de coco fue el sustrato que presentó los valores más bajos en todas las variables estudiadas, con excepción de la cantidad de raíces, donde no se diferenció de los otros sustratos. Por otro lado, no hubo diferencias significativas entre arena y carbón de granza sobre el número de brotes por estaca, los cuales sí fueron mayores que al usar fibra de coco. Es importante mencionar que en carbón de granza se presentó una mayor incidencia de estacas afectadas por larvas de sciaridos (Figura 1).
Cuadro 4: Efecto del sustrato y del tamaño de la estaca sobre las variables relacionadas con el enraizamiento de Justicia tinctoria, realizado del 11 de septiembre al 17 de octubre del 2012.
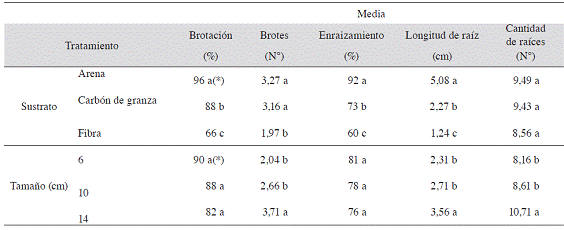
(*) Valores promedio en una misma columna seguida por diferente letra indican diferencias significativas (p<0,05) entre ellas, según la prueba de rango múltiple de Tukey y LSD de Fisher según la variable correspondiente.
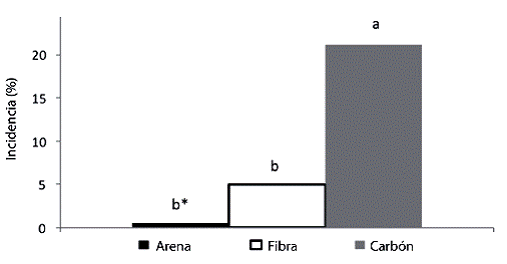
Figura 1: Estacas de Justicia tinctoria dañadas por larvas de sciaridos de acuerdo con el sustrato utilizado, evaluado a los 42 días.
En cuanto al tamaño de las estacas, fueron las de 14 cm las que presentaron, en forma consistente, mayor número de brotes, raíces más largas y en mayor número que las de 10 y 6 cm, sin diferencias entre estas últimas. En cuanto al porcentaje de brotación y de enraizamiento la prueba efectuada no determinó diferencias entre los tratamientos (Cuadro 4).
Discusión
Ensayo 1: Evaluación de la posición de la estaca y la dosis de AIB
Efecto de la posición de la estaca
Es evidente que tomar estacas provenientes de la zona terminal, garantiza mejores resultados que tomar estacas de la zona media o basal de la planta, puesto que las estacas terminales fueron las que obtuvieron los mayores valores en todas las variables analizadas excepto en el porcentaje de enraizamiento. La mayor capacidad de enraizamiento en estacas terminales pudo ser influenciada por distintos factores, como tejido joven, lignificación del tejido, nivel endógeno de fitohormonas y/o contenido de reservas (Ruiz et ál. 2005). Es posible que dichos factores también posean una fuerte influencia positiva en las estacas terminales de azul de mata, lo que generó un mayor enraizamiento de las mismas. Esto podría deberse a que las zonas terminales concentran el crecimiento de la planta y los puntos de diferenciación, por lo tanto, en estos puntos se producen y se translocan más auxinas que son esenciales para el proceso de enraizamiento, comparado con regiones mediales o basales (López et ál. 2008).
Se puede observar un mayor número de brotes y de mayor longitud y cantidad de raíces en las estacas terminales, lo que podría estar asociado con una mayor velocidad de enraizamiento y brotación de este tipo de estacas, comparado con estacas basales y mediales (Cuadro 2). Como indican Ruiz et ál. (2005) la velocidad de enraizamiento es un factor de éxito en un programa de propagación, ya que entre más tiempo duren las estacas en el propagador aumentan los riesgos y los costos, mientras que la calidad del material propagado puede disminuir. En este caso, estacas terminales de Justicia tinctoria mostraron esta característica favorable.
Es importante destacar que los valores de todas las variables evaluadas fueron muy bajos en el primer ensayo (Cuadro 2). Esto puede obedecer a varios factores. El primero de ellos fue la época de cosecha de las estacas que se efectuó en marzo, en plena estación seca. Dependiendo de la época en la cual se recolecten las estacas, se puede observar una mayor o menor capacidad de enraizamiento por parte del mismo tipo (posición) de estaca, ya que probablemente esté relacionado con la fluctuación de carbohidratos en el tallo (Hartmann et ál. 2011). Además durante esta época del año, se observó que en algunas plantas ya se estaba iniciando el proceso de floración. Como indican Hartmann et ál. (2011), el proceso de floración puede provocar un detrimento en el enraizamiento, ya que este proceso actúa como sumidero. A estos factores se debe sumar el efecto del sustrato, el cual solamente fue fibra de coco y, como se comentará más adelante en el ensayo 3, ese sustrato obtuvo valores de porcentaje más bajos comparados con otros medios estudiados, lo cual parece indicar que este material no brindó las mejores condiciones para el enraizamiento y brotación de esta planta.
Efecto de la dosis de AIB
No hubo una clara relación entre las dosis de AIB y las variables analizadas (Cuadro 2). Se considera que esta situación pudo haber sido influenciada por efecto de la época de cosecha, así como del proceso de floración y otros factores durante el manejo de las estacas, tal y como se indicó anteriormente al discutir el bajo enraizamiento observado en el Cuadro 2. Por lo tanto, se consideró volver a evaluar esta variable.
Ensayo 2: Efecto de la dosis de AIB en estacas con y sin hojas
Efecto de las dosis de AIB
La ausencia de aplicación de auxina en las estacas de Justicia tinctoria permitió obtener estacas enraizadas, pero con porcentajes menores con respecto a estacas a las que sí se les aplicó auxinas. Es evidente el efecto significativo de la aplicación exógena de 1000 ppm de AIB en las estacas de azul de mata (Cuadro 3). Esta concentración de AIB probablemente permitió un adecuado balance hormonal entre auxinas y citoquininas, junto con otras hormonas y otros compuestos implicados en el enraizamiento y en la brotación de yemas, como por ejemplo inhibidores, flavonoides, peroxidasas, fenoles, entre otros (Hartmann et ál. 2011), lo que permitió un buen desarrollo tanto de raíces como de nuevas hojas. Una alta relación de auxina con una baja de citoquinina favorece el enraizamiento, mientras que si su relación es inversa se favorece la formación de yemas. Al favorecerse el enraizamiento, se estimula la producción de citoquininas, ya que son las raíces los principales sitios de sintesís de esta regulador de crecimiento (Hartmann et ál. 2011), por lo que se considera que la dosis de 1000 ppm de AIB junto con la concentración de citoquinina producida en las raíces de las estacas, indujo un mejor enraizamiento y, posteriormente, un mejor desarrollo aéreo de las mismas en azul de mata.
Para la variable cantidad de raíces (Cuadro 3), los datos revelan que las dosis de AIB de 1000 ppm y 1500 ppm fueron las que mostraron los mayores valores. Esto pudo deberse al efecto positivo que tiene este regulador de crecimiento en el enraizamiento, estimulando un mayor número de raíces. Las auxinas poseen efectos positivos sobre la división celular, en el aumento en el transporte de carbohidratos y cofactores, en la estimulación de la síntesis de ADN de las células tratadas, entre otros (Ruiz y Mesén 2010, Hartmann et ál. 2011, Pop et ál. 2011). Ruiz y Mesén (2010) indican que la cantidad de raíces que produce una estaca depende de la habilidad de la misma para transportar carbohidratos, ya sea de reserva o los que se produzcan durante el proceso de fotosíntesis; y que estos sean dirigidos hacia la base de la estaca, donde se formarán las nuevas raíces. Por lo tanto, el estímulo dado por las dosis mayores de AIB permitió un aumento en la cantidad de raíces, como se presentó en el presente estudio.
Según las observaciones realizadas durante las evaluaciones, a partir de la tercera semana de sembradas las estacas, estas iniciaron el proceso de brotación. Por lo que se considera que el proceso de formación de raíces en azul de mata ocurrió en un lapso menor a 21 días, esto porque, como lo mencionan Hartmann et ál. (2011) y Vignolo et ál. (2012), en general las estacas producen primero raíces antes de iniciar la formación de la parte aérea. Este comportamiento es muy importante, ya que si la brotación de las yemas se produce antes de la emisión de raíces, estas competirían y podrían agotar las reservas hídricas y nutricionales de la propia estaca (Díaz 1991, Ruiz y Mesén 2010). Por lo tanto, las reservas serían utilizadas para formación de nuevos brotes, y no así para raíces, lo que generaría una eventual muerte de la estaca. Por lo tanto, se puede asumir que la aplicación de AIB en las estacas no posee ningún efecto en adelantar el proceso de enraizamiento, ya que el testigo (0 ppm de AIB) presentó brotación aérea en un tiempo similar que los tratamientos con regulador de crecimiento. Otro indicador que evidencia que la velocidad de enraizamiento de las estacas se dio en un tiempo similar, es la longitud de raíz (Ruiz et ál. 2005). En este caso, como se presenta en el Cuadro 3, la longitud de raíz fue parecida en todos los tratamientos, lo que indica que el proceso de formación de raíces se inició en un tiempo similar.
Efecto de ausencia o presencia de hojas
La presencia de hojas en estacas en algunas especies favorece el enraizamiento, puesto que las hojas en crecimiento suministran auxinas, vitaminas, carbohidratos, nitrógeno orgánico y cofactores que son requeridos para el enraizamiento, pero que, por otro lado, también contribuyen a la desecación de la estaca al ofrecer una mayor superficie para que ocurra la transpiración (Hartmann et ál. 2011) Por lo anterior, se recomienda recortar el área foliar para que haya un balance entre la fotosíntesis y la traspiración (Mesén 1998). En el caso de las estacas de Justicia tinctoria, según este estudio, la presencia de hojas influyó negativamente en el enraizamiento, a pesar de que a éstas se les redujo su área foliar (Cuadro 3). El efecto negativo de las hojas en las estacas de azul de mata podría estar relacionado con problemas de desecación de las mismas, debido al proceso de transpiración. La pérdida de agua provoca, entre otros efectos, una reducción en la fotosíntesis debido al cierre estomático (Loach 1988, Díaz 1991). Mientras que el éxito de enraizamiento en estacas sin hojas es debido a que éstas en sus tallos contienen reservas de carbohidratos, auxinas y cofactores que son usados para iniciar el proceso de formación de raíces, en lugar del desarrollo de hojas. Además, las pérdidas de agua por evapotranspiración son reducidas, debido a que poseen menor superficie de exposición, lo que contribuyó a que la tasa de transpiración fuera menor con respecto a las estacas con hojas, por lo que todas las reservas fueran dirigidas a promover el proceso de rizogénesis.
Posiblemente, un factor que pudo haber ayudado a mejorar el enraizamiento en estacas con hojas, hubiera sido contar con un sistema de riego con nebulizadores (López et ál. 2008, Hartmann et ál. 2011), ya que este permite aumentar y mantener la humedad relativa por más tiempo, en comparación con el sistema de riego implementado durante este experimento. Sin embargo, este estudio demuestra que al trabajar con estacas sin hoja, se logró obtener estacas con un alto porcentaje de enraizamiento a un costo mucho menor, comparado con la utilización de un equipo de riego con nebulizadores.
Ensayo 3: Efecto del sustrato y el tamaño de estaca
Efecto del sustrato
El mejor comportamiento de las estacas en la arena de río (también en el carbón de granza), posiblemente se debió al buen drenaje que ofrecen estos sustratos, comparado con fibra de coco quien puede almacenar agua hasta 8 - 9 veces con base en su peso seco, limitando la capacidad de aireación entre el sustrato y en la base de la estaca. Como indica Zanoni (1975), una formación rápida de raíces se presenta al utilizar un sustrato ligero, suelto, esterilizado, de temperatura abrigada y con humedad continua pero no excesiva ya que la falta de oxígeno es perjudicial. Las características físicas propias de la arena de río y el carbón de granza, facilitaron que el exceso de humedad fuera rápidamente drenado, permitiendo la oxigenación necesaria para el desarrollo de raíces, y permitiendo mantener turgentes a las estacas en los momentos donde las condiciones ambientales eran adversas.
Una adecuada relación entre la capacidad de aireación, la retención de humedad y el drenaje está directamente influenciada por el tamaño de partícula que posee el material (granulometría). La distribución de tamaños de partículas determinará el balance entre el contenido de agua y de aire (Quesada y Méndez 2005). En general, entre mayor sea el grosor de la partícula, mayor será la aireación y por ende menor la retención de humedad, facilitando el drenaje. Alvarado y Solano (2002) mencionan, que para el caso de la arena, es importante seleccionar un tamaño de partícula adecuado, ya que de contar con un porcentaje elevado de partículas medias (0,25-0,5 mm) y finas (0,05-0,25 mm), se corre el riesgo de generar compactación, lo que limitaría la disponibilidad de oxígeno para las raíces. De acuerdo con lo mostrado en el Cuadro 1, la arena utilizada presentó un bajo porcentaje de partículas finas; sin embargo, las partículas medias representan 20,3%. A pesar de esto, como se aprecia en el Cuadro 3, la arena obtuvo los mayores porcentajes de brotación, enraizamiento y longitud de raíz, lo que parece indicar que el contenido de partículas inferiores a 0,5 mm presentes en este medio, no fue suficiente para generar compactación, facilitando el drenaje y permitiendo así un desarrollo normal de la parte aérea y radical de las estacas. En el caso del carbón de granza y la fibra de coco, el riesgo por compactación fue mucho menor, puesto que el porcentaje de partículas medias y finas fue más bajo que el presentado en el sustrato de arena.
En cuanto al carbón de granza, el análisis muestra que éste fue el segundo mejor sustrato (Cuadro 4). Sin embargo, se considera que el porcentaje de enraizamiento pudo ser similar o superior al de arena de río, puesto que 21,1% de las estacas sembradas en este medio presentaron daños provocados por las larvas de sciaridos (Figura 1). Las larvas de este insecto afectan directamente a las estacas debido a que crean galerías, causando daños en los tejidos y provocando una eventual muerte de la estaca. La mayor incidencia de larvas de sciaridos en el sustrato de carbón de granza fue posiblemente debida a la alta retención de humedad que presentó este medio comparado con el de arena de río, junto con la alta humedad relativa que se presentó durante el transcurso del proyecto, lo cual le permitió al insecto completar su ciclo de vida. Otro factor que pudo incidir en una mayor incidencia de esta plaga, fue el color del sustrato, negro. Esta coloración posiblemente permitió un mayor camuflaje para el adulto, el cual posee la misma coloración del sustrato, por lo que posiblemente, exista una preferencia del insecto por este sustrato para pasar desapercibido.
Tamaño de estaca
Las estacas de 14 cm fueron las que presentaron mayor cantidad y longitud de raíces, así como mayor cantidad de brotes. Es posible que este comportamiento se deba a que estacas de mayor longitud contengan mayor contenido de sustancias de reserva que intervienen en el proceso de enraizamiento y crecimiento de las raíces. Además, al tener mayor longitud es posible que existan mayor número de yemas, las cuales son los principales sitios de síntesis de auxinas y, como se ha mencionado, estas sustancias son responsables de favorecer los procesos de rizogénesis (Álvarez et ál. 2007).
En relación con la longitud de raíces, Mesén (1998) comenta que cuando las raíces de especies forestales poseen una longitud de entre 1 y 2 cm, es un buen momento para extraer las estacas del propagador y trasplantarlas. En el caso del presente trabajo, a los 42 días de sembradas las estacas, éstas ya superaban la longitud de raíz para el trasplante así como la cantidad de raíces (Cuadro 4) sugeridas anteriormente. Los resultados indican que se requería de una menor cantidad de días para obtener estacas con las características mencionadas por Mesén (1998), lo que permitiría aumentar la producción y reducir los costos de mantenimiento de las estacas en el propagador.
Conclusiones
Es posible propagar vegetativamente Justicia tinctoria a través de estacas. Según los resultados, los mejores rendimientos se obtienen al utilizar estacas terminales. Las estacas terminales de esta especie fueron capaces de enraizar sin aplicación de AIB, pero los porcentajes de enraizamiento y de brotación fueron significativamente inferiores a los de las estacas tratadas con AIB. Al trabajar con estacas terminales sin hojas, las variables de porcentaje de brotación, cantidad de brotes, porcentaje de enraizamiento y cantidad y longitud de raíces, se vieron muy favorecidas en comparación con estacas con presencia de hojas.
En cuanto a los sustratos evaluados, la arena de río fue la que presentó los mejores rendimientos en cuanto a porcentaje de brotación (96%), porcentaje de enraizamiento (92%), cantidad de brotes (3,27) y longitud de raíz (5,08 cm).
Según este estudio, estacas terminales sin yema apical y sin hojas de 14 cm de longitud, sometidas a una dosis de 1000 ppm de AIB y utilizando arena como sustrato, fueron las que presentaron mayor cantidad y longitud de raíces así como mayor cantidad de brotes.















