Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Costarricense de Ciencias Médicas
versión impresa ISSN 0253-2948
Rev. costarric. cienc. méd vol.25 no.3-4 San José dic. 2004
Prevalencia de anticuerpos contra el Trypanosoma cruzi en donantes de sangre de la Seguridad Social- Costa Rica, Setiembre 2003 - Setiembre 2004.
Lorena Torres1*, Zaida García2, Patricia Arauz3, Lizeth Taylor3.
Resumen
La enfermedad de Chagas es una infección ocasionada por el Trypanosoma cruzi, este parásito es responsable de 16 a 18 millones de personas infectadas en América Latina de las cuales 50,000 mueren cada año. Una de las principales fuentes de transmisión es por transfusión sanguínea.
A partir de setiembre del 2003 en los Bancos de Sangre de la CCSS se implementó la tamización del 100 % de los donantes de todo el territorio nacional. Cincuenta y tres mil trescientos treinta y siete muestras de suero, fueron recolectadas de setiembre del 2003 a setiembre del 2004, y analizados por EIA con tres diferentes fuentes antigénicas (proteínas recombinantes, péptidos homólogos y lisado proteico de la Cepa Brenner para el WB)
De las muestras analizadas, 305 (0,6 %) fueron inicialmente reactivas. De estas, 176 (58%) resultaron repetidamente reactivas (RR) por el EIA-ICMRT de tamizaje. De las RR 122 (69%) mostraron resultados discrepantes entre los dos EIA realizados, 42 (24%) fueron positivos por los dos ensayos y 12 (7%) no pudieron ser evaluadas.
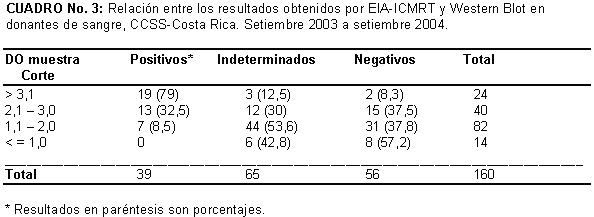
De las muestras RR por el EIA-ICMRT 39 (22%) resultaron positivas por WB, 65 (37%) fueron indeterminadas y 56 (32%) negativas, 15 muestras quedaron pendientes.
En el estudio se obtuvo 0,6% de reactividad inicial, ligeramente mayor a lo reportado en los últimos tres años en el país. La prevalencia obtenida fue 0,08% el porcentaje más bajo del área Centroamericana.
Al comparar los resultados obtenidos en el EIA-ICMRT y el WB, se observa una mayor correlación entre las muestras con DO altas >2,0 y un resultado positivo por WB según el criterio establecido. En general las reacciones negativas o indeterminadas por WB se presentaron en muestras con DO < 2,0 y contra proteínas de pesos moleculares bajos (15-50 kD).
El estudio demuestra la importancia de realizar varias pruebas diagnósticas de alta sensibilidad y especificidad para determinar la prevalencia real y por ende controlar la transmisión de la infección para brindarle así a la población costarricense unidades de sangre segura e insistir en el uso racional de la misma.
Palabras clave: Enfermedad Chagas, Western Blot, Transfusión sanguínea.
Abstract
The Chagass disease is a infection caused by Trypanosoma cruzi parasite; it is responsible of infestation of 16 to 18 people in Latin America with 50,000 deaths every year. The main source of transmission is for blood transfusion.
Since September 2003, Caja Costarricense de Seguro Socials Blood Banks have implemented the screen in about 100% of donors of the country. The 53307 serum samples were collected in the period of September 2003 to September 2004, and they were tested with the EIA with three types of antigenic sources (recombinant protein, homolog peptides, protein lysate of Strain Brenner for WB).
Of the tested samples, 305 (0.6%) were beginning reactives. Of these, 176 (58%) were repeat reactives (RR) for the test EIA-ICMRT. Of the RR, 122 (69%) shown discrepancy between two EIA tested, 42 (24%) were positives for the two assays and 12 (7%) did not have be evaluated.
The RR samples tested for EIA-ICMRT, 39 (22%) were positives for WB, 65 (37%) were indetermined, 56 (32%) were negatives, and 15 samples stayed pending.
The results of the study got 0.6% of initial positive test; it was a light increment with respect to results of the 3 years in the country. The prevalence was 0.08%, It is the lowest in Central America.
Comparing the results between EIA-ICMRT and WB, it was a bigger correlation between the samples with DO highs >2, 0 and a positive result for WB according the established criterion. In general, the negative or indeterminate results for WB correspond to samples with DO<2, 0 and against proteins with low molecular weights (15-50 kD).
The study shown the importance to do certain diagnostic assays of high sensibility and specificity for determine the real prevalence and for the control of transmission of infection with the proposal of offer blood banks to costarican people and rational use of them.
Key words: Chagas disease, Western Blot, Blood Transfusion.
Introducción
La tripanosomiasis americana también llamada enfermedad de Chagas, fue descrita en 1908 por el doctor Carlos Chagas, es una infección ocasionada por el protozoario Trypanosoma cruzi (1, 2) Se estima que de 16 a 18 millones de personas de América Latina están afectadas por esta enfermedad y unos 50,000 mueren cada año. (3, 4)
Existen siete especies de triatominos importantes para la transmisión de Tripanosoma cruzi de los cuales los principales vectores en América Latina, son Rhodnius prolixus, Triatoma dimidiata, Rhodnius pallescens. El vector más eficiente es el Rhodnius prolixus, que ejerce la mayor acción vectorial por su ciclo más corto y las altas densidades que alcanza en las viviendas. Este se encuentra en El Salvador, Guatemala, Honduras y Nicaragua. El segundo vector en importancia es el Triatoma dimidiata considerada la especie autóctona, tiene una mayor dispersión y una amplia variedad de ambientes domiciliares, peri domiciliares y silvestres. Por su adaptación a la condición urbana es el vector más importante en muchas cuidades de América Central, es la especie responsable de transmisión en Costa Rica y es la única de importancia en Belice. El vector Rhodnius pallescens solo se encuentra en Panamá. (5l)
La enfermedad de Chagas afectó principalmente a personas de bajos ingresos de zonas rurales, pero con el desarrollo urbanístico esto ha cambiado (3, 6, 7) La fase aguda de la enfermedad no es grave y usualmente es autolimitante, aunque en ocasiones puede causar la muerte, en niños lactantes. Cerca de un tercio de quienes contraen la infección desarrollan síntomas crónicos después de 10-20 años. Para ellos la expectativa de vida disminuye en promedio 9 años (3, 8) Durante la fase crónica se producen alteraciones cardiacas importantes incluyendo el crecimiento del corazón, alteración de la frecuencia cardiaca, falla coronaria con arresto cardíaco y en el sistema digestivo afecta esófago e intestino con complicaciones que pueden causar la muerte (8).
A pesar de que la enfermedad se describió hace casi un siglo y que se conoce la magnitud y su cuadro clínico, los avances en cuanto al tratamiento y la patogénesis de las lesiones cardíacas y gastrointestinales han sido lentos. En Costa Rica, al igual que en otros países latinoamericanos, no se cuenta con un conocimiento apropiado de la presencia de esta enfermedad; tanto en la población de donantes como en otros grupos poblacionales a pesar de su importancia como problema de salud pública.
Existen varias vías de transmisión, la más común es la infección mediante heces del vector contaminadas con el T. cruzi que entran en contacto con mucosas (ojos, boca) o heridas. Otra es de madre a hijo durante el embarazo, el parto o durante la lactancia, o mediante transfusión de sangre, transplante de órganos o al comer alimentos contaminados con heces infectivas del vector (3, 6)
La transfusión sanguínea es la segunda vía de infección, por lo que es de suma importancia conocer la seroprevalencia en donantes de sangre que son considerados una población sana, lo cual permitiría estimar la prevalencia de la enfermedad en el país (7, 9, 10)
La transmisión puede controlarse eficazmente por medio de la eliminación del vector y del examen sistemático de los donantes de sangre (6, 7)
En la actualidad no hay vacunas ni medicamentos que prevengan esta enfermedad. El tratamiento es eficaz cuando se administra en la fase aguda pero es muy tóxico. Una vez que progresa la infección a fases posteriores, ningún medicamento ha demostrado ser efectivo. En la fase crónica solo se pueden controlar los síntomas asociados con la enfermedad (8)
Desde la época de los años 70 en América Central se han realizado esfuerzos aislados dirigidos para el control de la transmisión vectorial del T. cruzi. En Costa Rica desde el año 1994 la Caja Costarricense de Seguro Social (CCSS) inicia el tamizaje de donantes en el Hospital Nacional de Niños. Durante esta primera fase se encontró una seropositividad cercana al 0,5% (11) En 1997 los países de América Central lanzaron una iniciativa para la eliminación de la transmisión vectorial y transfusional de la Enfermedad de Chagas, y dentro de los objetivos se incluía la tamización del 100% de los donantes de sangre (12) A partir de setiembre del 2003 se implementó la tamización del 100% de los donantes del país. Este artículo tiene como objetivo conocer la prevalencia de la infección por T. cruzi en la población total de donantes de sangre en Costa Rica que acuden a consulta en la CCSS.
Materiales y métodos
Población de estudio
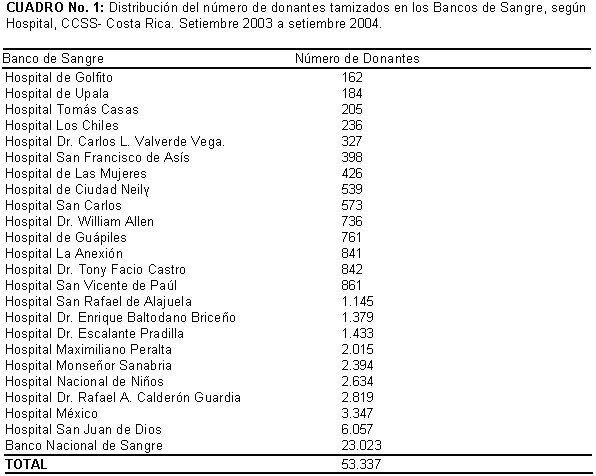
La población analizada consistió de donantes voluntarios y/o de reposición que asistieron a los Bancos de Sangre de los Laboratorios Clínicos de la CCSS en todo el territorio nacional. Cincuenta y tres mil trescientos treinta y siete (53.337) muestras de suero recolectadas de setiembre del 2003 a setiembre del 2004, fueron analizados por diferentes inmunoensayos para detectar agentes infecciosos transmitidos por transfusión sanguínea. Las pruebas para detectar anticuerpos anti T. cruzi fueron realizadas en las instalaciones del Centro Internacional de Investigación y Adiestramiento Médico, conocido por sus siglas en inglés como ICMRT, así mismo las pruebas para anticuerpos contra el virus de Leucemia de células T humanas (HTLVI/II) En los Bancos de Sangre de la CCSS se realizan las pruebas contra otros agentes infecciosos entre ellos: anticuerpos contra Virus de la Inmunodeficiencia Humana 1-2 (VIH 1-2), anticuerpos contra el Virus de la Hepatitis C (VHC), antígeno de superficie del Virus de la Hepatitis B(VHB), anticuerpos contra el T. pallidum.
Ensayo Inmunoenzimático (EIA)
Todas las muestras de suero se analizaron inicialmente con un ensayo inmunoenzimático, EIA-ICMRT, que usa péptidos homólogos de T. cruzi como antígeno de recubrimiento (13, 14) Brevemente, 100 µl de una dilución 1:40 de cada muestra se agregaron al pozo respectivo seguido de una incubación a 40°C por 20 min. Después de tres lavados con amortiguador de fostatos-salino (AFS) con 0,5% Tween 20, se agregaron 100 µl de una dilución 1:20000 de conjugado anti-IgG humana–peroxidasa (Sigma) y se incubó por 20 min a temperatura ambiente. Los pozos se lavaron nuevamente con AFS-0,5% Tween 20 y se dispensaron 100 µl de sustrato 3, 3, 5,5-Tetramethylbenzidine (Sigma), la placa se incubó por 15 min en completa oscuridad a temperatura ambiente. La reacción se detuvo con 50 µl de H2SO4 0,5M y se procedió a realizar la lectura de la absorbancia a 450 mn (Datos del laboratorio ICMRT).
Este ensayo ha sido previamente validado con diferentes paneles y mostró una sensibilidad y un valor predictivo positivo de 98,6 % (9,.6-99,8 %), con una especificidad y un valor predictivo negativo de 99,8 %( 99,2-100%) (Datos no publicados)
Para esta prueba de tamizaje se consideraron positivas aquellas muestras con densidades ópticas (DO) mayores o iguales al punto de corte, definido como el promedio de los controles negativos más 0,250 DO Este factor corresponde a siete desviaciones estándar de una población de muestras negativas. Las muestras repetidamente reactivas se analizaron por un segundo ensayo, EIAgen Trypanosoma cruzi, juego de reactivos IgG-IgM (Adaltis, Italia), siguiendo la recomendaciones del fabricante.
Western Blot (WB)
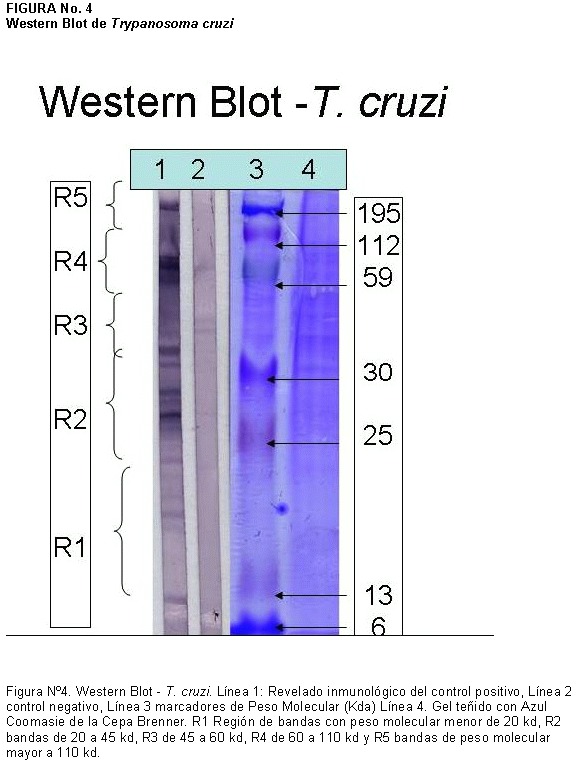
Como prueba complementaria se realizó un Western Blot (15, 16) usando un lisado de epimastogotos de cultivo de T. cruzi de la cepa Brenner como antígeno. La cepa fue donada por el Instituto Oswaldo Cruz, Río de Janeiro, Brasil y cultivada en el Departamento de Parasitología de la Facultad de Microbiología de la Universidad de Costa Rica.
Para la técnica de WB se utilizó el siguiente criterio de interpretación: Un suero fue considerado positivo cuando reconoció al menos una proteína de tres de los cinco grupos presentes en lisados completos de T. cruzi que van de menos de 20, 20 – 45, 45-60, 60-110 y mayores de 110 kD. El resultado se consideró indeterminado cuando la muestra reconoció solo proteínas de dos de los grupos y negativo cuando no se presentó reactividad contra alguno de los grupos de proteínas.
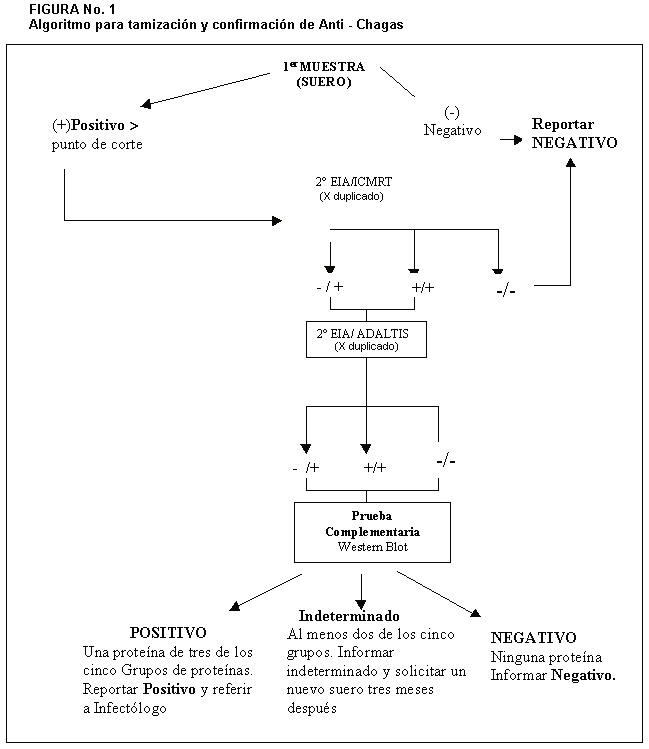
En la figura No. 1 se describe el algoritmo que se siguió para el análisis y reporte de las muestras en estudio.
Resultados
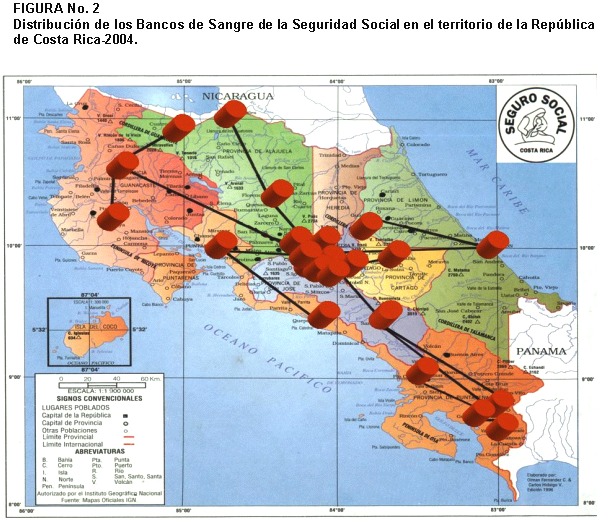
En la figura Nº 2 se muestra la distribución de los Bancos de Sangre en todo el territorio Nacional. El Cuadro Nº 1 muestra la distribución de los donantes analizados según lugar de procedencia, el mayor porcentaje procede del Área Metropolitana que es la principal zona de captación.
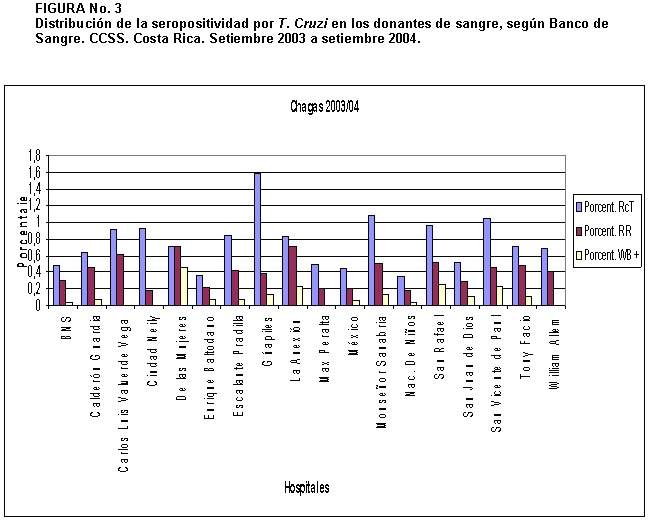
De las 53.337 muestras analizadas, 305 (0,6 %) fueron inicialmente reactivas. De estas, 176 (58%), resultaron repetidamente reactivas por el EIA-ICMRT de tamizaje. De las muestras repetidamente reactivas 122 (69%) mostraron resultados discrepantes entre los dos ensayos inmunoenzimáticos realizados, 42 (24%) fueron positivos por los dos ensayos y 12 (7%) no pudieron ser evaluadas por falta de suero. La distribución de seropositividad de acuerdo con el Banco de Sangre se muestra en la Figura Nº 3.
De las muestras repetidamente reactivas por el EIA-ICMRT 39 (22%) resultaron positivas por WB, 65 (37%) fueron indeterminadas y 56 (32%) negativas, 15 muestras quedaron pendientes de realizarles el WB al momento de preparar este artículo. En la Figura Nº 3 se muestra la distribución de las bandas de acuerdo con el peso molecular, el control positivo, control negativo y los marcadores de peso molecular en el Western Blot T. cruzi, para que se observe el patrón de bandeo presente.
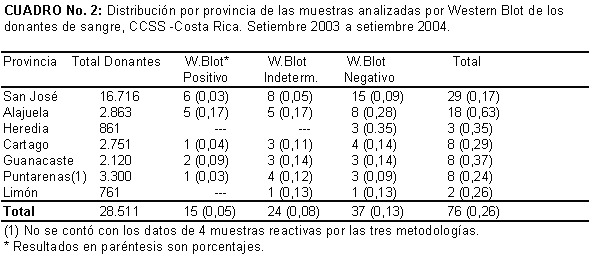
La distribución de 76 (47, 5 %) de estas muestras que tenían información de procedencia por provincia, se observa un porcentaje mayor en Alajuela y Guanacaste específicamente del cantón de Nicoya. En Puntarenas también se presenta un porcentaje semejante al de Alajuela pero no se contó con los datos de la procedencia exacta, Cuadro Nº 2. La relación entre las DO del EIA-ICMRT y el WB se muestran en el Cuadro Nº 3.
La importancia de tamizar todas las unidades de sangre por anticuerpos contra T. cruzi es que se controle la transmisión de la infección por medio de la transfusión sanguínea, junto con otros agentes infecciosos que pueden poner en peligro la salud de los receptores de estas donaciones (VIH 1-2, HTLV I/II hepatitis B, hepatitis C, Sífilis) Para ello es necesaria la implementación de procesos de diagnóstico con alta sensibilidad y especificidad, uniformando los métodos de tamización y realizando la cobertura total en todos los donantes.
En Costa Rica se atendió un promedio de 48.625 donantes de sangre durante el año 2003 (17), un 49 % fueron donantes voluntarios altruistas y 51 % donantes de reposición. En otros países centroamericanos la donación altruista es menor y Costa Rica ocupa el tercer lugar en Latinoamérica en este tipo de donación (18) Las edades de los donantes oscilan entre los 18 y 65 años, lo que se apega a los requisitos establecidos. El mayor número de donaciones correspondió al Área Metropolitana, como se observa en la Figura Nº 2, dado que en esta área se concentra la mayor densidad de población del país (59 %) (19)
En el presente estudio se obtuvo un 0,6% de reactividad inicial lo cual es ligeramente mayor a lo reportado en los últimos tres años en el país, 0,2 % a 0,5 % (17) La prevalencia obtenida fue 0,08% en la población analizada, lo que corresponde al porcentaje más bajo del área Centroamericana ya que para El Salvador en el año 2000 se reporta un 3 %, en Guatemala un 1 %, en Honduras un 0,87 % y en Nicaragua un 0,49 % en donantes de sangre (18)
La baja prevalencia encontrada en los donantes de sangre pueden estar relacionada con una menor capacidad de transmisión del vector, ya que se ha demostrado que el T. dimidiata es un mal transmisor (20), debido a la falta de un hábitat adecuado para su adaptación. Costa Rica es el país con los mejores índices socioeconómicos del área centroamericana, lo que se refleja en las condiciones de vivienda y el menor grado de pobreza (19)
Según la distribución de seropositivos por Banco de Sangre (BS), Figura Nº 3, se observa que en algunos Bancos de Sangre hay un mayor porcentaje de muestras inicialmente reactivas que no confirman. Estas reacciones podrían estar relacionadas con el rompimiento en la cadena de frío ya que todas las muestras deben ser transportadas al laboratorio de referencia desde los diferentes BS donde son colectadas, o a la presencia de reacciones cruzadas con otros agentes etiológicos como la leihmaniasis, sífilis y alteraciones inmunológicas como el factor reumatoide (13,21) Se observó un bajo porcentaje de muestras inicialmente reactivas que dieron positividad por un segundo ensayo. Se conoce por la literatura que en regiones de baja prevalencia, por cualquier agente infeccioso, es de esperar un alto porcentaje de falsos positivos por la prueba de tamizaje utilizada (4) Estos resultados también se observaron en un pequeño estudio realizado en el año 2001, donde se evaluaron 982 muestras de niños por anticuerpos anti-T. cruzi, usando dos ensayos simultáneamente, el EIA-ICMRT y el Chagatest (Wiener Laboratorios) En ambas pruebas se obtuvo un 0,8% de reactividad inicial, aunque no todas las muestras pudieron ser confirmadas, la mayoría de ellas resultaron negativas o indeterminadas por Western Blot (LSU-ICMRT datos no publicados)
Al comparar los resultados obtenidos en el EIA-ICMRT y el resultado de Western Blot, se observa que hay una mayor correlación entre las muestras con DO altas, mayores de 2,0 y un resultado positivo por WB según el criterio establecido. En general las reacciones negativas o indeterminadas por WB se presentaron en muestras con DO menores de 2,0 y esto se puede asociar a reacciones inespecíficas o cruzadas con proteínas del huésped u otros agentes infecciosos, como se ha descrito por otros autores (4, 13, 21) La mayoría de las reacciones indeterminadas por WB se presentaron contra proteínas de pesos moleculares bajos (15-50 kD)
Con la presente investigación se demuestra una baja prevalencia de anticuerpos contra T. cruzi en los donantes que asisten a los bancos de sangre de la CCSS, y que representan a todo el territorio nacional. Hasta hace muy pocos años Costa Rica incluyó la tamización por T. cruzi en su esquema de sangre segura, sin embargo es uno de los pocos países de Centroamérica que en tan poco tiempo ha logrado la cobertura total de sus donantes con respecto a esta infección.
Es de suma importancia para el país continuar con este esfuerzo para la eliminación de la transmisión de la Enfermedad de Chagas por medio de la transfusión sanguínea, segunda fuente de transmisión más común, y así brindarle a la población costarricense unidades de sangre segura e insistir en el uso racional de la misma, a pesar de que el riesgo no se elimina en los diferentes componentes. Es importante destacar la mayor prevalencia en las zonas de Alajuela, Puntarenas y Guanacaste, en donde aún se pueden encontrar condiciones que favorecen la transmisión del parásito por medio de sus vectores (19), esto evidencia la necesidad de establecer una mayor vigilancia y control en esas zonas.
El estudio demuestra la importancia de realizar varias pruebas diagnósticas de alta sensibilidad y especificidad para determinar la prevalencia real en los donantes de sangre.
Aún cuando los tratamientos actuales no son de ayuda para los pacientes con enfermedad crónica, se debe dar un seguimiento y apoyo médico apropiado. Mientras no exista una metodología confirmatoria estandarizada definitiva se deberá recurrir al menos a tres métodos diferentes para establecer la seropositividad de los inicialmente reactivos por anticuerpos anti-T. cruzi y dar el seguimiento de los indeterminados por Western Blot. Esta metodología sigue siendo preferente como método complementario en los reactivos iniciales (4)
Agradecimiento:
Los autores agradecen al Dr. José Luis Salas Oviedo, de la Dirección Desarrollo Servicios de Salud-CCSS y a los funcionarios que conforman la Red de los Laboratorios Clínicos y Bancos de Sangre por la colaboración otorgada.
A las doctoras Olga Guerrero y Elizabeth Abrahams de la Universidad de Costa Rica por el cultivo de la cepa Brenner utilizada en el Western Blot.
Referencias:
1. Martínez Palomo A [en línea]. Carlos Chagas, o la fuerza de la voluntad. <http://www.geocities.com/fdoch/chagas.htm> [Consulta: 18 junio 2004]. [ Links ]
2. Coutinho M, Freire O. Jr., Pinto Dias JC The Noble Enigma: Chagas Nominations for the Nobel Prize. Mem. Inst. Oswaldo Cruz 1999; 94 (Supl 1): 123-29. [ Links ]
3. Información de Enfermedades Parasitarias. Center for Disease Control [en línea] <http://www.cdc.gov/ucidad/dpd/parasites/chagasdisease>. [Consulta: 18 de junio 2004]. [ Links ]
4. Vissoci E, Cavazzana M, Okamura H, Tagata E, Jankevicius SH, and Jankevicius J. Evaluation of the western blot in the confirmatory serologic diagnosis of Chagas disease. Am J Trop Med Hyg 1998; 59: 750-59. [ Links ]
5. Ponce C. Hacia la eliminación de la transmisión de Tripanosoma cruzi en Honduras y los países de América Central. Medicina 1999; 59 (Supl 2): 117-119 [ Links ]
6. Moncayo A. Chagas Disease: Current Epidemiological Trends after the interruption of vectorial and transfusional transmission in the Southern Cone countries. Mem. Inst. Oswaldo Cruz 2003; 98: 577-91. [ Links ]
7. Schmunis GA. Prevention of transfusional Trypanosoma cruzi infection in Latin America. Mem. Inst. Oswaldo Cruz 1999; 94. (Supl. 1): 93-101. [ Links ]
8. Rodriguez J, Castro de SA Critical Review on Chagas Disease Chemotherapy. Mem Inst Oswaldo Cruz, Rio de Janeiro 2002; 97: 3-24. [ Links ]
9. Ramos A, Padilla V, Reyes P. Detección de anticuerpos contra Tripanosoma cruzi en donantes de sangre. Salud Pública de México 1993; 35:1-11. [ Links ]
10. Moraes H. Chagas infection transmission control: situation of transfusional transmission in Brazil and other Countries of Latin America. Mem. Inst. Oswaldo Cruz 1999; Suppl. 1: 419-23. [ Links ]
11. Caja Costarricense del Seguro Social, Dirección Técnica Servicios de Salud -Sección de Laboratorios. Informe de Bancos de Sangre año 1995. San José Costa Rica; 1996. Serie de Informes Técnicos: 1995. [ Links ]
12. Material mimeográfico: Organización Panamericana Salud /Organización Mundial de la Salud. Informes de las iniciativas de los países andinos y centroamericanos. 1997. [ Links ]
13. Houghton L, Benson R, Reynolds D, et al. A multi-epitope synthetic peptide and recombinant protein for the detection of antibodies to Trypanosoma cruzi in radioimmunoprecipitation-confirmed and consensus-positive sera. J Infect Dis 1999; 179: 1226-1234. [ Links ]
14. Ferreira A, Belem E, Reed S and Campos-Neto. Enzime -linked Inmunoabsorbent assay for Serological Diagnosis of Chagas Disease Employing Trypanosoma cruzi Recombinant Antigen That consist of four different Peptides. J Clin Microbiol 2001; 4390-4395. [ Links ]
15. Laemmli, UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970; 227, 680–685. [ Links ]
16. Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Nat Ac Sci 1979; 76: 4350–4354 [ Links ]
17. Caja Costarricense del Seguro Social, Dirección Técnica Servicios de Salud -Sección de Laboratorios. Informe de Bancos de Sangre año 2000-2003. San José Costa Rica; 2003. Serie de Informes Técnicos: 2000-2003. [ Links ]
18. Organización Panamericana de la Salud. Medicina Tranfusional en América Latina de 1994 a 2002. Washington, DC:OPS; Agosto 2003 ( Documento Oficial OPS/EV/LAB/01-2003). [ Links ]
19. Programa Estado de la Nación. Décimo Informe Estado de la Nación en Desarrollo Humano Sostenible, 1ed; San José Costa Rica: Proyecto Estados de la Nación, 2004:103-105,401. [ Links ]
20. Zeledón R. El Triatoma dimidiata (Latreille, 1811) y su relación con la enfermedad de Chagas; San José Costa Rica: Editorial Universidad Estatal a Distancia, 1981: 149. [ Links ]
21. Oeleman R, Vanderborght M, Verissino Da Costa G, et al. A Recombinant peptide line inmunoassay optimized for the confirmation of Chagas disease. Transfusion 1999; 39: 711-717. [ Links ]
1* Correspondencia. Dirección Desarrollo Servicios de Salud-Laboratorios Clínicos. CCSS.
2. Dirección Desarrollo Servicios de Salud-Laboratorios Clínicos. CCSS.
3. ICMRT. Facultad de Microbiología. Universidad de Costa Rica. San José.