Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.25 n.1-2 San José Jan. 2004
San José, Costa Rica, 2001
Kenia Barrantes 1, Vekoh Pardo 2 y Rosario Achí .1
Resumen
En julio del 2001, un brote de diarrea asociado a transmisión hídrica afectó a más de 7000 personas residentes en el área urbana de San José. Desde su inicio se especuló sobre el papel de Shigella spp., como uno de los posibles agentes etiológicos del mismo, por lo que el objetivo de este estudio fue determinar la presencia de esta bacteria en los casos de diarrea atendidos en una de las clínicas ubicadas en el área del brote y demostrar que Shigella spp. es un agente importante de diarrea en nuestro país asociado a la transmisión hídrica, particularmente por la baja dosis infectante y alta virulencia.
Para este fin, se analizaron especimenes fecales de 49 pacientes con diarrea que acudieron a la clínica de Alajuelita, del 17 al 31 de julio del 2001. Se obtuvo 16 aislamientos de Shigella spp (34,7%), 15 correspondieron a Shigella sonnei en tanto que solamente uno a Shigella flexneri. Los grupos etáreos más afectados fueron niños menores de 10 años y personas mayores de 60 años. El patrón de sensibilidad a los antibióticos de las cepas aisladas mostró resistencia a 8 de los 11 antibióticos probados: trimetoprim/sulfametoxazole, tetraciclina, ampicilina, eritromicina, cloranfenicol, cefalotina, amikacina y amoxicilina; y sensibilidad a norfloxacina, ciprofloxacina y gentamicina.
No fue posible aislar Shigella spp. de las muestras de agua. Los resultados sugieren que este medio de transmisión estuvo relacionado con el brote de diarrea. El presente estudio demuestra la importancia de Shigella spp. como causa de diarrea sobre todo en niños pequeños, adultos mayores y su frecuente asociación a brotes relacionados con agua contaminada. Los resultados también sugieren que el tratamiento contra la shigelosis debería incluir información acerca de los perfiles de resistencia a los antibióticos y de la necesidad de más investigación sobre vías de transmisión por agua y alimentos en la prevención de este tipo de brotes.
Palabras Clave: Shigella sonnei, diarrea, brote.
Abstract
During July of 2001, a diarrheal outbreak affected more than 7000 individuals in the urban area of San José. Even though the origen of the outbreak was not found, faecal pollution of the drinking water from the metropolitan aqueduct it is suspected.
The objetive of the study was to determinate the presence of Shigella spp., as a possible aetiological agent of the outbreak.
Samples were collected during two weeks (july 17th to 31st). Sixteen Shigella isolates were obtained out of 49 patients with diarrhoea (34,7%), 15 of the isolates were Shigella sonnei and 1 corresponded to Shigella flexneri. The most affected age groups were children under 10 and people older than 60.
The antibiotic susceptibility pattern of the Shigella isolates showed that they were resistant to eigth of the antibiotics: trimethoprim/sulfamethoxazole, tetracycline, ampicillin, eritromicine, chloramphenicol, cephalotin, amikacine and amoxicillin. They were sensitive to norfloxacin, ciprofloxacin and gentamicin.
Althought it was not possible to isolate Shigella directly from water, the results highly suggest this pathogen to be the aetiological agent of the outbreak.
This study demonstrates the import role of Shigella spp. as cause of diarrhea affecting mainly small children and elderly people and its frequent association to outbreaks related to drinking water. This study also suggests that guidelines for treatment of shigellosis should include information on the antibiotic resistance pattern and further studies regarding the routes of transmission by water and food, will be required for strategies of prevention of such outbreaks.
Key Words: Shigella sonnei, diarrhea, outbreak.
Introducción
La shigelosis o disentería bacilar es un serio problema de salud pública mundial (1-5) Se estima que esta infección es responsable de 1,1 millones de muertes y más de 163 millones de casos anuales de disentería, predominantemente en niños menores de 5 años (6). Las especies más comunes en países en vías de desarrollo son S. flexneri y S. dysenteriae. Por ejemplo, estas 2 especies son responsables del 66% y 16% de los casos respectivamente en Bangladesh (4) En países desarrollados los brotes epidémicos por esta bacteria se deben fundamentalmente a S. sonnei (4), las razones de esta asociación entre contexto económico y la prevalencia de una especie en particular de Shigella aún se desconocen (4,5). Clínicamente la shigelosis se caracteriza por una diarrea acuosa, que puede progresar a deposiciones mucoides y sanguinolentas debido a la invasión y replicación de Shigella en las células epiteliales del colon, causando una intensa reacción inflamatoria, caracterizada por formación de abcesos y ulceración (1,2,4,5) La vía de infección predominante es fecal-oral por contacto persona a persona (1-5), con una dosis infectante tan baja como 10 a 100 bacterias viables. Existen otras vías de diseminación como la ingesta de agua y alimentos contaminados (6-10) De acuerdo con la red electrónica de vigilancia para enfermedades de transmisión alimentaria (FoodNet) del Centro para Control y Prevención de Enfermedades (CDC) en Atlanta EEUU, la shigelosis fue la tercera enfermedad diarreica relacionada con alimentos detectada en el período 1995-2000 en esa nación (10)
La shigelosis es una de las enfermedades diarreicas agudas para las cuales aún es efectiva la terapia antimicrobiana; sin embargo, el uso indiscriminado de antibióticos y la automedicación han generado cepas de Shigella spp multirresistentes (11-17). Inicialmente este patrón de resistencia era esporádico y se asociaba a viajeros foráneos en países como EEUU y Finlandia, luego, empezó a observarse en hospitales de Bangkok, con cepas endémicas de S. flexneri. Para los años 1999 y 2000, el informe anual de NARMS (National Antimicrobial Resistanse Monitoring System), del CDC en EEUU incluyó a Shigella como resistente a TMX, ampicilina y tetraciclina.
En Costa Rica se detectó Shigella spp. mediante cultivo en 2,4% de niños en una comunidad y 13,6% en niños hospitalizados por diarrea. Empleando la técnica de reacción en cadena de polimerasa con separación inmunomagnética de alta sensibilidad (IMS-PCR) los casos positivos se incrementaron al 8% en la comunidad y a 26% en los niños hospitalizados (18,19). Los estudios serológicos en calostro, leche materna y suero de madres en área urbana y rural de Costa Rica, particularmente de baja condición socioeconómica, muestran además presencia de anticuerpos contra lipopolisacáridos (LPS) y antígenos de invasión (Ipas) de Shigella (20)
En julio de 2001 se presentó un brote de diarrea que se atribuyó a contaminación fecal de la planta de tratamiento de agua de Puente de Mulas, con la posible presencia del agente Shigella, entre otros, y que afectó los cantones de Escazú, Desamparados, Alajuelita, Pavas y Santa Ana. A sólo 5 días de iniciado este brote, se detectaron más de 4000 casos de diarrea, siendo el cantón de Alajuelita el que presentó el mayor número de casos, con 1121 (27,9%) Aunque la cifra de personas atendidas en los centros médicos estatales pasó de 1600 a más de 7000 luego de 13 días de iniciado el brote (Ministerio de Salud, Dirección de Vigilancia de la Salud, San José, Julio del 2001), se podría pensar que el número de individuos afectados pudo ser mucho mayor, si se considera que la planta de tratamiento de agua de Puente de Mulas abastece la población al sur y oeste de la capital y muchas de estas personas pudieron no acudir a servicio médico o haber sido atendidas en instituciones privadas.
No fue posible identificar la fuente de contaminación, aunque se mencionó la posible exposición del manto acuífero de la Fuente Zamora, que alimenta a la planta de tratamiento de Puente de Mulas en San Antonio de Belén.
Este manto acuífero pudo haber estado en contacto con las aguas contaminadas con materia fecal del Río Virilla, en conjunto con la ruptura de la línea de cloración que se encarga de desinfectar el tanque principal de agua en esta planta de tratamiento (Ministerio de Salud, Dirección Protección al Ambiente Humano. Informe General, Sistema de Tratamiento de Agua Potable Guadalupe y Puente Mulas. San José, Julio del 2001) Se realizaron estudios microbiológicos del agua en Acueductos y Alcantarillados (AyA) en el Instituto Costarricense de Investigación y Enseñanza en Nutrición y Salud (INCIENSA, comunicación personal) y en INISA, pero no fue posible demostrar la presencia de Shigella mediante detección de su ADN por el método de Reacción en Cadena de Polimerasa o PCR (INISA e INCIENSA) Por lo anterior, no se puede afirmar que Shigella haya sido transmitida por el agua, aunque se aisló de 16 muestras de heces de 49 individuos con diarrea asociados a este brote, como demuestran los resultados del presente estudio.
Materiales y métodos
Del 17 al 31 de julio del 2001 se analizaron 49 muestras de heces de pacientes afectados por el brote de diarrea, provenientes de la Clínica de Alajuelita. Se contó con información sobre lugar de residencia y edad del paciente.
Las muestras fueron transportadas al laboratorio de Bacteriología del INISA e inoculadas en placas de Agar Desoxicolato Citrato (DC), Agar Xilosa Lisina Desoxicolato (XLD) y Agar Tergitol 7 (T7). Se incubaron por 24 horas a 37ºC. Las colonias típicas de Shigella de cada medio de cultivo fueron inoculadas en agar Triple Azúcar Hierro (TSI) e incubadas por 18-24 horas a 37ºC. A aquellos aislamientos con un patrón característico por pruebas bioquímicas se les realizó serología confirmatoria con antisueros monovalentes (Reagensia, Suecia), para S. dysenteriae (serogrupos A1, A2 y A3), S. flexneri (serogrupo B), S. boydii (serogrupos C1, C2 y C3) y S. sonnei (serogrupo D).
Las cepas aisladas de Shigella spp. se analizaron por su perfil de sensibilidad a antibióticos por difusión en placa (Kirby y Bauer), empleando agar Mueller Hinton (21) y sensidiscos para los siguientes antibióticos: trimetoprim/sulfametoxazole, gentamicina, tetraciclina, ampicilina, cefalotina, amikacina, ciprofloxacina, cloranfenicol, amoxicilina/acido clavulánico, norfloxacina y eritromicina. Se incubaron por 18 horas a 35ºC, y luego se procedió a medir el diámetro del halo de inhibición del crecimiento en las placas.
Resultados
De las 49 muestras de heces analizadas hubo 16 (32,7%) positivas por Shigella spp. de las cuales 15 (94%) correspondieron a S. sonnei y una (2%) a S. flexneri.
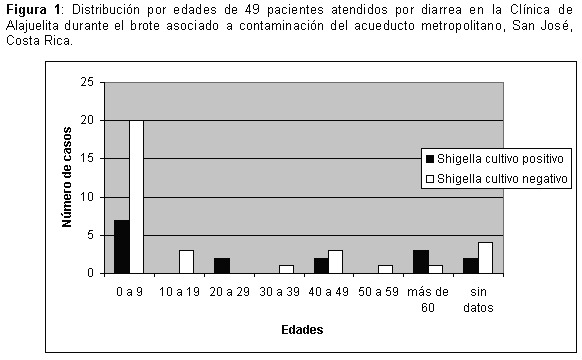
La distribución por edades se muestra en la Figura 1, siendo el grupo etáreo más afectado niños (0 a 9 años)
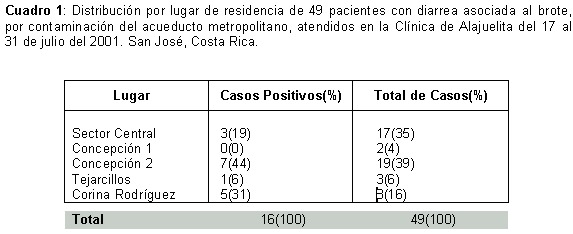
En la distribución de casos por lugar de residencia (Cuadro I), se observa que la mayoría de los pacientes vivían en el barrio Concepción 2 (39%) del distrito de Concepción y el distrito Central (35%), en tanto que la mayoría de los pacientes con aislamientos positivos por Shigella residían, igualmente, en Concepción 2 (44%) y en el distrito de San Felipe, barrio Corina Rodríguez (31%).
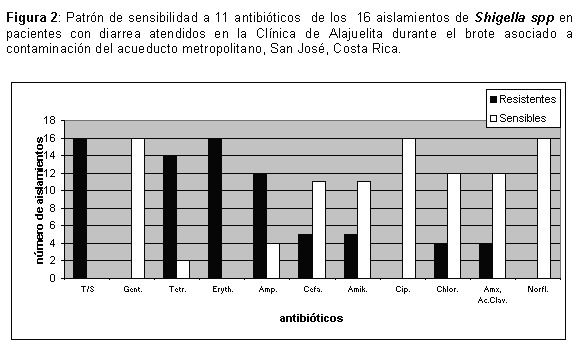
Las cepas aisladas fueron resistentes a 8 antibióticos de uso común (se consideraron como resistentes los perfiles intermedios de acuerdo con la lectura del halo de inhibición): trimetoprim/sulfametoxazole (TMX), tetraciclina, ampicilina, eritromicina, cloranfenicol, cefalotina, amoxicilina y amikacina.
El 100% de las cepas aisladas fueron resistentes a trimetoprim/sulfametoxazole y eritromicina. A su vez, 8 (50%) fueron resistentes a TMX, eritromicina y ampicilina y 12 (75%) a TMX, eritromicina y tetraciclina (Figura 2). Los antibióticos para los cuales las cepas de Shigella mostraron sensibilidad fueron: ciprofloxacina, norfloxacina y gentamicina.
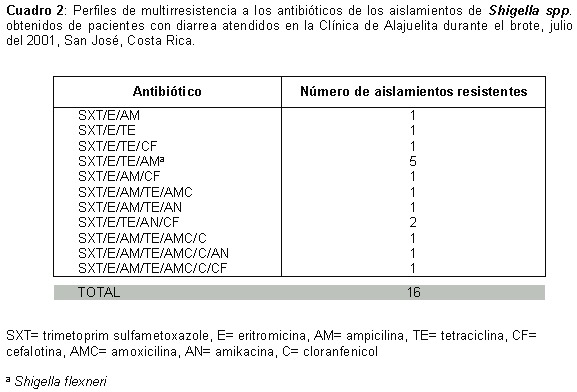
Las 16 cepas mostraron un patrón de multirresistencia a la mayoría de los antibióticos probados (Cuadro 2): Dos (12.5%) fueron resistentes a 3 antibióticos, 7 (38%) a 4 antibióticos, 4 (25%) a 5 antibióticos, 1 (6%) a 6 antibióticos y 2 (12.5%) a 7 antibióticos diferentes.
Discusión
En este estudio se encontró una alta proporción de casos de diarrea positivos por Shigella spp, lo que la ubica como uno de los agentes etiológicos importantes asociados al brote. Sin embargo, dado que el acueducto metropolitano pudo haber estado en contacto con aguas contaminadas con materia fecal del río Virilla, Shigella no sería el único agente de diarrea involucrado en este brote, otros enteropatógenos como E. coli se aislaron de pacientes afectados (INCIENSA comunicación personal).
De las 16 cepas aisladas de Shigella, 15 correspondieron a S. sonnei y 1 correspondió a S. flexneri. Ambas especies son endémicas en nuestro país, probablemente S. sonnei esté más relacionada con el brote dado en mayor número de cepas aisladas (15/16) y S. flexneri constituya, posiblemente, un caso endémico de diarrea.
Se observa que de las 5 comunidades del cantón estudiado, la mayoría de los casos positivos por Shigella (49%) y el 39% de casos de diarrea provenían de Concepción 2, del distrito de Concepción, lo que fortalece la idea de una fuente común de contaminación en esta zona.
La mayor frecuencia de casos positivos por Shigella en niños (7/16, 14%) y adultos mayores (5/16, 10%), sugiere una mayor susceptibilidad de estos grupo etáreos a la infección y a enfermedad diarreica por este microorganismo. Algunas investigaciones en torno al proceso de envejecimiento del sistema inmunológico, establecen que en adultos mayores existe una mayor susceptibilidad a infecciones debido a una disminución parcial en la función del sistema inmunológico, por ejemplo, respuesta deficiente en mucosa intestinal y disminución en la función antibacteriana de células de respuesta innata como los polimorfonucleares neutrófilos. Además en este grupo de edad se ha detectado disminución en la secreción del ácido gástrico, que actúa como barrera física para el establecimiento de infecciones intestinales (22,23) Por otro lado, en relación con la población pediátrica, algunos estudios establecen que paralelamente a la etapa de crecimiento, el niño va desarrollando los mecanismos de inmunidad adquirida a enteropatógenos y así la prevalencia de muchas infecciones edad-específica disminuyen durante la adolescencia y la edad adulta. Se postula que las infecciones repetidas de Shigella en pacientes de edad adulta generan respuesta inmunológicas secundarias que rápidamente actúan como refuerzos para la respuesta inmunológica primaria y proveen una mejor protección contra la infección. En contraste, los niños que sufren la primoinfección por Shigella, no cuentan con una respuesta adaptativa adecuada, y con ello, disminuye la protección sinérgica entre los sistemas innato y adaptativo, presentado mayor sintomatología y complicaciones posteriores (24,25)
La resistencia de Shigella a los antibióticos es otro factor particularmente importante demostrado en este estudio. Los altos porcentajes de aislamientos resistentes a varios antibióticos indican la existencia de cepas multirresistentes. El uso inadecuado de antibióticos en la población en general, permite la expresión de los mecanismos de resistencia adquiridos o secundarios en enteropatógenos como Shigella, pudiendo transmitirse entre las cepas bacterianas por diferentes mecanismos genéticos de transferencia horizontal de genes posiblemente codificados en plásmidos, lo cual limita la estrategia terapéutica contra este tipo de infecciones.
En las 16 cepas aisladas de Shigella se encontraron perfiles de multirresistencia a 3, 4, 5, 6 y hasta 7 antibióticos de uso común en clínica (Cuadro 2) Este patrón de resistencia a los antibióticos es similar a datos de otros estudios realizados en América Latina, EEUU, Asia y África (11-17) El tratamiento recomendado actualmente por la Organización Mundial de la Salud (OMS) para la shigelosis incluye como alternativa terapéutica ampicilina, TMX y adicionalmente ciprofloxacina, norfloxacina, enoxacina, pivmecilina y ácido nalidíxico (26) Los datos de este estudio y otras investigaciones demuestran que existen cepas de Shigella resistentes a ampicilina y TMX (3,12,13,14) y ya se registran cepas resistentes a fluoroquinolonas (15), a ácido nalidíxico (16) y a cefalosporinas de tercera generación (17)
El presente estudio demuestra que Shigella es un agente asociado a un brote de transmisión hídrica en Costa Rica y su importancia no se limita sólo al presente ejemplo. En los últimos años han aparecido situaciones similares. Para el período comprendido entre marzo de 1999 y marzo del 2001, se registraron 22 brotes de diarrea asociados al consumo de agua contaminada, de los cuales Shigella (S. flexneri y S. sonnei) se aisló en 8 (36%) de esos brotes (27) Recientemente, se ha aislado Shigella spp. de pacientes con diarrea residentes de la comunidad de Birrí en Heredia, atendidos en la Clínica de Santa Bárbara, lo que podría incriminar a este microorganismo con el brote de diarrea que afectó a esta población herediana (Clínica de Santa Bárbara, comunicación personal).
La información anterior sugiere realizar diagnóstico etiológico de todos los brotes de diarrea para tomar las medidas preventivas y de vigilancia epidemiológica de las vías de transmisión, garantizando la limpieza del agua y alimentos.
Agradecimientos:
Al Sr. Jorge Quesada Borbón, del Laboratorio de Bacteriología, INISA por su gran ayuda técnica. Al personal del Laboratorio de la Clínica de Alajuelita, por su colaboración. A la Vicerrectoría de Investigación de la Universidad de Costa Rica por su financiamiento por medio del proyecto 742-97-229; al Consejo Nacional para Investigaciones Científicas y Tecnológicas (CONICIT), la International Foundation of Science (IFS) de Suecia, y al proyecto VI-UCR-742-99-527 de SIDA/SAREC/NETRÓPICA.
Referencias
1. Achí R, Mata L, Lindberg AA. Serum antibody titers to Shigella lipopolysaccharide and invasion plasmid antigens in healthy Costa Rican and Swedish women. Scan J Infect Dis 1994; p. 50-55. [ Links ]
2. Subekti D, Oyofo BA, Tjaniad P, Corwin AL, Larasati W, Putri M, et al. Shigella spp. Surveillance in Indonesia: the emergence or reemergence of S. dysenteriae. Emerg Infect Dis 2001;7(1): 137-139. [ Links ]
3. Anvia M, Capitano L, Ruiz J, Vargas M, Urraza H, Schellemberg D, et al. Typing and characterization of mechanism of resistance of Shigella spp. isolated from feces of children under 5 years of age from Ifakara, Tanzania J Clin Microbiol 1999; 37: 3113-3116. [ Links ]
4. Sansonetti P.J, Egile C and Wennerás C. Shigellosis: From symptoms to molecular and cellular pathogenesis. En Groisman E dir. Principles of Bacterial Pathogenesis. United States: Academic Press; 2001. p. 336-343. [ Links ]
5. Sansonetti P.J. Themes: Microbes and microbial toxins: Paradigms for microbial mucosal interactions. III Shigellosis: from symptoms to molecular pathogenesis. Am J Physiol Gastrointest Liver Physiol.2001; 280: G319-G323. [ Links ]
6. Kotloff K.L, Winickoff J.P, Ivanoff B., Clemens J.D, Swerdlow D.L, Sansonetti P.J. et al. Global burden of Shigella infections: Implications for the development of vaccines and application of control strategies. Bulletin of the World Health Organization.1999; 77: 651-666. [ Links ]
7. CDC. Surveillance for waterborne disease outbreaks-United States, 1997-1998. MMWR. 2000; 49: 7-18. [ Links ]
8. CDC. Shigellosis outbreak associated with an unchlorinated fill and drain wading pool. Iowa, 2001. MMWR 2001; 50: 797-800. [ Links ]
9. CDC. An outbreak of Shigella sonnei infection associated with comsuption of iceberg lettuce. 1999. Dispatches. Emerg Infect Dis 1999; 1: 565-8. [ Links ]
10. CDC. Preliminary FoodNet data on the incidence of foodborne illneses-United States, 2001. MMWR 2002; 15: 325. [ Links ]
11. Okeke I.N, Lamikanra A and Edelman R. Socioeconomic and behavioral factors leading to acquired bacterial resistance to antibiotics in developing countries. Emerg. Infect. Dis. 1999; 5(1): 18-24. [ Links ]
12. Lima A, Lima N, Pinho M.C, Barros E.A, Teixeira MJ, Martins MCV et al. High frequency of strain multiply resistant to ampicillin, trimethoprim-sulfametoxazole, streptomycin, chloramphenicol and tetracycline isolated from patients with shigellosis in northeastern Brazil during the period 1988-1993. Antimicrob. Agents Chemother. 1995; 39: 256-259. [ Links ]
13. CDC. National Antimicrobial Monitoring System for Enteric Bacteria. 1999, 2000. Annual Report (en línea)(fecha de acceso: 30 de julio del 2002). URL en : http:/www.cdc.gov/narms/annual/ [ Links ]
14. Bogaerts J, Verhaegen J, Munyabikali J et al. Antimicrobial resistanse and serotypes of Shigella isolates in Kigali, Rwanda (1983 to 1993): Increasing frequency of multiple resistance. Dian Microbiol Infect Dis 1999; 28:165-171. [ Links ]
15. Horiuch S, Inagaki Y, Yamamoto N et al. Redueced susceptibilities of Shigella sonnei strains isolated from patients with dysentery to fluoroquinolones. Antimicrob Agents Chemother 1993; 42:440-443. [ Links ]
16. Chu Yiu-Wai, Hownag TS, Lyon DJ et al. Antimicrobial resistance in Shigella flexneri and Shigella sonnei in Hong Kong, 1986 to 1995. Antimicrob Agents Chemother 1998; 42(2): 440-442. [ Links ]
17. Radice M, González C, Power P, Vidal MC and Gutkind G. Third generation cephalosporin resistance in Shigella sonnei, Argentina. 2001; Emerg Infect Dis 2001; 7(3): 1-2. [ Links ]
18. Achí R and Lindberg AA. Rapid and sensitive detection of Shigella sonnei in feces by the use of an O-specific monoclonal antibody in a immunomagnetic separation-polymerase chain reaction combined assay. Clin Microbial Infect 1996; 2: 55-58. [ Links ]
19. Achí R, Siles X, Mata L and Lindberg AA. Shigellae assays based on immunomagnetic separation in children from urban marginal communities of Costa Rica. J Infect 1996; 32: 211-218. [ Links ]
20. Cam PD, Achí R, Lindberg AA and Pál T. Antibodies against invasion-plasmid coded antigens of Shigella in human colostrums and milk. Acta Microbiol Hung 1992; 39: 263-270 [ Links ]
21. CDC. Chapter 9: Antimicrobial susceptibility testing (Agar disk diffusion method).(en línea) (fecha acceso: 30 de Julio de 2002) p.61-73. URL disponible en: http://www.cdc.gov/ncidod/dbmd/diseaseinfo/cholera/chapter9.pdf [ Links ]
22. Schumacker D, Thoreaux K and Owen R. Aging impairs intestinal immunity. Mech Ageing Dev 2001; 122: 1397-1411. [ Links ]
23. Schroder A and Rink L. Neutrophil immunity of the elderly. Mech Ageing Dev 2003; 124: 419-425. [ Links ]
24. Farthing MJC. Symposium on the treatment of diarrhoeal disease. Diarrhoea: a significant worldwide problem. Int J Antimicrob Agents 2000; 14:65-69. [ Links ]
25. Raqib R, Shahjahan Mia SM, Qadri F et al. Innate immune responses in children and adults with shigellosis. Infect. Immun. 2000; 68: 3620-3629. [ Links ]
26. World Health Organization. Guidelines for the control of epidemics due to Shigella dysenteriae 1. Geneva: WHO;1995. Publication No.WHO/CDR/95. [ Links ]
27. Valiente C y Mora D. El papel del agua para consumo humano en los brotes de diarrea reportados en el período 1999-2001 en Costa Rica.Revista Costarricense de Salud Pública. 2001: 26-40 [ Links ]
1 Sección Infección y Nutrición, Instituto de Investigaciones en Salud (INISA), Universidad de Costa Rica
2 Laboratorio Clínico, Clínica de Alajuelita, Caja Costarricense del Seguro Social (CCSS)
* Correspondencia a: Instituto de Investigaciones en Salud (INISA), Universidad de Costa Rica Ciudad de la Investigación, San Pedro Montes de Oca, San José.