Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.23 n.1-2 San José Jun. 2002
Manuel Jiménez-Díaz*, Karl Schosinsky-Nevermann
Resumen
Se optimizó y validó un método colorimétrico para la determinación de cobre sérico empleando el ácido bicinconínico, el cual forma rápidamente un complejo violeta con el cobre I. El método presenta linealidad hasta 300 µg/dL y el límite de detección es de 8 µg/dL. La recuperación promedio obtenida fue de 99,7 por ciento. La bilirrubina y otros iones como hierro, calcio, magnesio y zinc no producen interferencia. La imprecisión para sueros con valores bajos, medios y altos mostraron coeficientes de variación de 2,6, 1,8 y 1,2 por ciento en un mismo día y 4,8, 3,0 y 1,5 por ciento día a día, respectivamente. El método correlaciona adecuadamente con el análisis de cobre empleando dibencilditiocarbamato de zinc.
Además se comparó la relación cobre total en suero/actividad de cerulopiasmina en pacientes con enfermedad de Wilson y personas normales. Se observó que en pacientes con enfermedad de Wilson esta relación es superior a 2,0 mientras que en heterocigotos y personas que no padecen esta enfermedad la relación es cercana a 1,0. Esta relación podría emplearse como un índice de la concentración de cobre no unido a ceruloplasmina.
Palabras clave: cobre en suero, ceruloplasmina, enfermedad de Wilson, ácido bicinconínico
Abstract
A colorimetric method for the determination of copper in serum that uses bicinchoninic acid was optimised and validated. The reaction is linear,at least up to 300 µg/dL of copper; the lower limit of detection was 8 µg/dL. The average recovery was 99,7 percent. Bilirrubin, iron, calcium, magnesium and zinc do not interfere. Within-run precision (CV) was 2,6, 1,8 and 1,2 percent; and day to day precision was 4,8, 3,0 and 1,5 percent for samples with low, normal and high values of serum copper, respectively. The method highly correlates with the determination of copper with the dibenzyldithiocarbamate method.
The copper/caeruloplasmin ratio in patients with Wilson's disease and normal people was also compared. In patients with Wilson's disease a ratio > 2,0 was observed, while in heterozygotes and people that don't suffer this iliness this ratio was near 1,0. This ratio could be used as an index of the copper not bound to caeruloplasmin.
Key words: copper serum, caeruloplasmin, Wilson's disease, bicinchoninic acid.
Introducción
La determinación de cobre en suero es importante en el diagnóstico de la enfermedad de Wilson y el Síndrome de Menkes, ambos errores innatos del metabolismo del cobre. Concentraciones anormales de cobre en suero se detectan también en pacientes con artritis reumatoide, embarazos anormales y ciertos tipos de cáncer (1-3). Para el diagnóstico clínico de estos trastornos metabólicos, así como para la caracterización bioquímica de las metaloproteínas y enzimas, es esencial un método sensible y específico para la determinación de cobre. Sin embargo, el análisis de cobre en suero y otros fluidos biológicos presenta ciertos obstáculos debido a que el metal se encuentra en cantidades traza. El método de referencia para su análisis es la espectrofotometría de absorción atómica, el cual requiere de equipo sofisticado, lo que aumenta los costos del análisis; además pocos laboratorios cuentan con ese instrumental. De allí, la necesidad de implementar técnicas menos costosas para esta determinación (4-8), las cuales deben reunir los estándares de exactitud, simplicidad y conveniencia. Los métodos espectrofotométricos son los de elección para la determinación de cobre y se han descrito una serie de ellos (4-8). Sin embargo, un problema con las determinaciones colorimétricas, es que muy pocos métodos tienen alta sensibilidad o pueden ser aplicados directamente a una muestra sin sufrir interferencias por detergentes, otros iones metálicos o variaciones en la estabilidad o dependencias del pH (6). Otras metodologías presentan el inconveniente de utilizar reactivos tóxicos y difíciles de adquirir.
En nuestro laboratorio, hemos empleado durante mucho tiempo el método colorimétrico descrito por Giorgio (7) y optimizado por García y colaboradores (8), el cual se basa en la extracción y reacción del cobre con dibencilditiocarbamato de zinc/tetracloruro de carbono. Aunque este método correlaciona fuertemente con el de absorción atómica, no presenta interferencia por otros metales y permite realizar análisis de cobre en fluidos con concentraciones muy bajas de este catión; sufre interferencia por bilirrubina y presenta el inconveniente de utilizar un reactivo de color (dibencilditiocarbamato de zinc/tetracloruro de carbono) que es tóxico y difícil de adquirir por lo que se realiza en muy pocos laboratorios. Por estas razones y para sustituir el método, se realizó la modificación y validación de la determinación de cobre en suero humano empleando el ácido 2, 2-bicinconínico (AcBc), sistema propuesto por Brenner y Harris (6).
En este método el cobre-II (CU+2) presente en las muestras y liberado de sus ligandos con ácido tricloroacético se reduce a cobre-I (Cu+) mediante la adición de ácido ascórbico. Este último, reacciona con el AcBc para dar un compuesto violeta cuya intensidad de color es proporcional a la concentración de cobre en la muestra.
Materiales y métodos
A- Equipo
Para los análisis se utilizó un espectro-fotómetro Shimadzu UV-1600-PC (Shimadzu, Kioto, Japón).
B. Muestras
Se trabajó con muestras de suero enviadas de diferentes partes del país al Departamento de Análisis Clínicos, Facultad de Microbiología, Universidad de Costa Rica; para la determinación de cobre sérico y ceruloplasmina. Como fueron muestras para propósitos clínicos, no se requirió consentimiento informado.
C. Reactivos
Todos los reactivos utilizados se obtuvieron de Sigma (St. Louis,USA)
2- Reactivo A:Disuelva 30 gramos de ácido tricloroacético en 100 mL de agua destilada y desionizada. Este reactivo es estable al menos por un año a temperatura ambiente..
3- Reactivo B. A 100 mL de buffer fosfato 0,5 M agregue 2,25 g de NAOH y 1,11 mL de una solución 1% de ácido bicinconínico. Este reactivo es estable por un mínimo de 1 año en botella ámbar de plástico.
4- Reactivo C. Ácido ascórbico. Disuelva 4,0 mg de ácido ascórbico en 10,0 mL de agua destilada y desionizada. Este reactivo es estable por un mínimo de 3 días a temperatura ambiente.
5- Solución patrón de cobre de reserva (10,0 mg/100 mL). Disuelva 0,3928 g de CuSO4x 5 H2O en 100 mL de agua destilada y desionizada.
6- Solución patrón de cobre de trabajo 200 µg/dL: diluir la solución patrón de cobre de reserva 1:50 con agua destilada y desionizada.
2- Centrifugue los tubos durante 5 min a 3000 rpm.
3- Transfiera 0,5 mL del sobrenadante de cada tubo a tubos limpios.
4- Agregue a cada tubo 0,1 mL del reactivo C, mezcle en vortex.
5- Finalmente agregue 0,4 mL del reactivo B y mezcle. Después de 2 min determine la absorbancia a 358 nm contra blanco de reactivos.
Se realizó mediante el método de Schosinsky (9) que se basa en la reacción de oxidación de la o-dianisidina.
F) Análisis Estadístico
Se llevaron a cabo análisis de regresión lineal simple y análisis de correlación del método en estudio con la determinación de cobre empleando dibencilditiocarbamato de zinc. También se realizó el análisis de correlación de la actividad de ceruloplasmina con la concentración de cobre.
Resultados
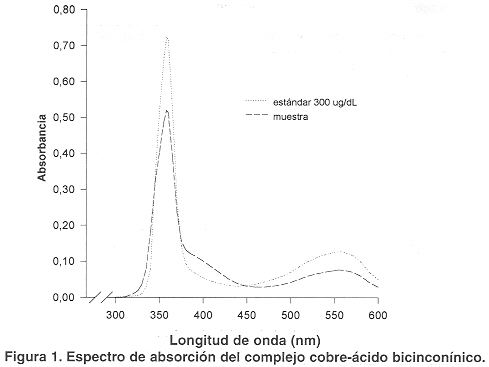
Espectro de absorción. Como puede observarse en la figura 1, el complejo Cu+1 - AcBc en amortiguador de fosfatos, presenta en la región visible del espectro un amplio pico de absorción con un máximo cercano a los 555 nm, por otro lado en el ultravioleta cercano presenta un pico estrecho con un máximo a 358 nm. En ausencia de cobre el AcBc casi no absorbe a esta longitud de onda. La absorbancia del complejo a 358 nm es 5,5 veces mayor a la observada a 555 nm.
Efecto del pH. Se evalúo el efecto del pH sobre el desarrollo del complejo coloreado, se constató que la absorbancia del complejo Cull-AcBc varía muy poco en el intervalo de 4 a 8 unidades de pH. Este en la solución tiene poco efecto sobre el desarrollo del color, ya que conforme aumenta la concentración de cobre, aumenta la absorbancia en forma lineal.
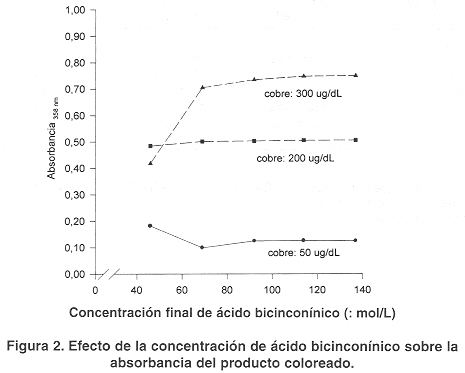
Efecto de la concentración de ácido bicinconínico. En la figura 2 se muestra el efecto de la concentración de AcBc sobre la absorbancia del producto coloreado. Se analizaron diferentes concentraciones del compuesto en la mezcla final en el intervalo de 46 a 140 µmol/L. Como se puede observar los mejores resultados se obtuvieron en el intervalo comprendido entre 90 y 140 µmol/L, a concentraciones inferiores hay variación en la absorbancia de concentraciones bajas de cobre. Se eligió la concentración de 114 µmol/L por presentar un adecuado intervalo de linealidad.
Efecto de la concentración ácido ascórbico. Se analizaron diferentes concentraciones de ácido ascórbico en el intervalo de 0 a 50 mg/dL. Se observó que con concentraciones superiores a 7,5 mg/dL se obtienen valores similares de absorbancia. Por lo tanto, se decidió utilizar como reductor una concentración de ácido ascórbico de 35 mg/dL.
Estabilidad del producto coloreado. La reacción del cobre 1 con el AcBc ocurre en forma inmediata y el producto formado es estable por un periodo mínimo de 30 minutos (tiempo evaluado).
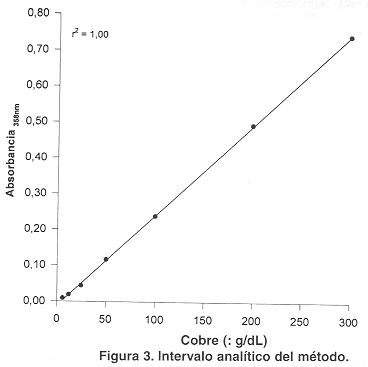
Linealidad del método. Se comprobó la linealidad del método analizando diluciones de un calibrador de cobre, la curva de calibración mostró una respuesta lineal entre 8 y 300 µg/dL. Se determinó que el límite de detección del método es de 8 µg/dL (Fig. 3).
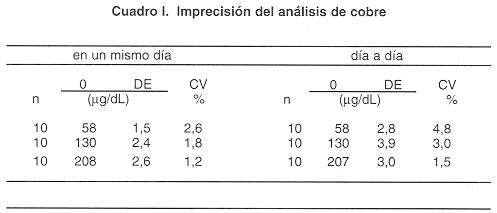
Imprecisión. El cuadro I muestra las imprevisiones obtenidas en un mismo día y día a día, con mezclas de sueros conteniendo concentraciones de cobre baja, media y alta. Las precisiones en un mismo día para muestras con valores de cobre de 58, 130 y 208 µg/dL, mostraron coeficientes de variación de 2,6, 1,8 y 1,2 por ciento y día a día de 4,8, 3,0 y 1,5 por ciento, respectivamente.
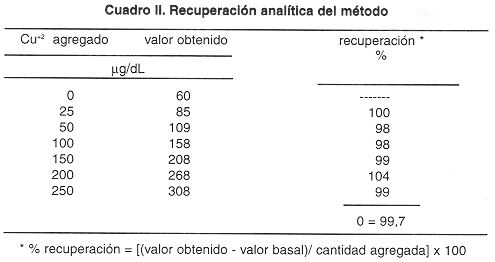
Recuperación: El cuadro II muestra los resultados del estudio de recuperación, al agregar de 25 a 250 µg de cobre por decilitro de suero se obtuvieron porcentajes de recuperación comprendidos entre 98 y 104 con un promedio de 99,7 por ciento.
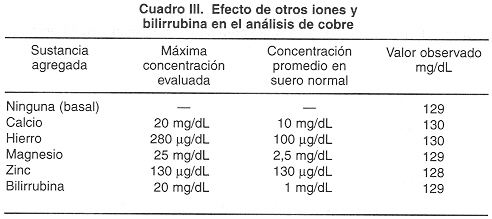
Efecto de sustancias interferentes. Se evaluó el efecto de diferentes iones e interferentes encontrados en suero. Como se observa en el cuadro III, otros iones metálicos en concentraciones mucho mayores que aquellas encontradas en suero no interfieren con el análisis cuantitativo de cobre. Además, se evaluó el efecto interferente de bilirrubina en la determinación; los resultados indican que la bilirrubina en concentración de 20 mg/dL, tampoco presenta interferencia en este método.
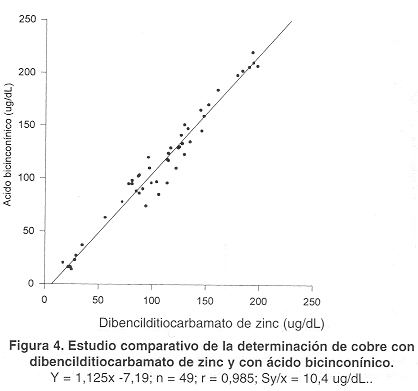
Estudio comparativo. En la Figura 4 se observan los resultados del estudio comparativo del método propuesto con la determinación de cobre empleando dibencilditiocarbamato de zinc, el cual fue empleado como referencia. Se analizaron 49 sueros con valores de cobre entre 14 y 253 µg/dL. La ecuación de regresión obtenida fue: y = 1, 125x - 7,19. El coeficiente de correlación (r) fue de 0,985 y el error estándar del estimado (Sy l x) de 10,4 µg/dL.
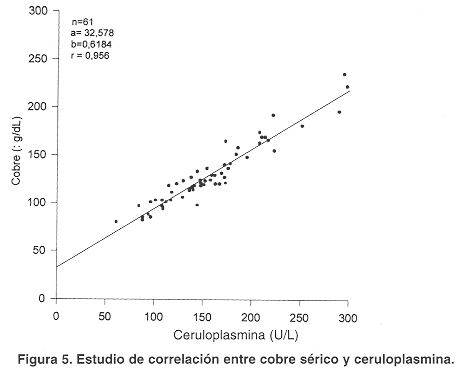
Correlación entre actividad de ceruloplasmina y niveles de cobre. En la figura 5 se presenta el estudio de correlación entre los niveles de cobre y la actividad de ceruloplasmina en personas con niveles normales para ambos parámetros. Se analizaron 61 muestras con valores de ceruloplasmina entre 61 y 298 U/L y de cobre entre 80 y 235 mg/dL. Como puede observarse, la correlación es r = 0,956.
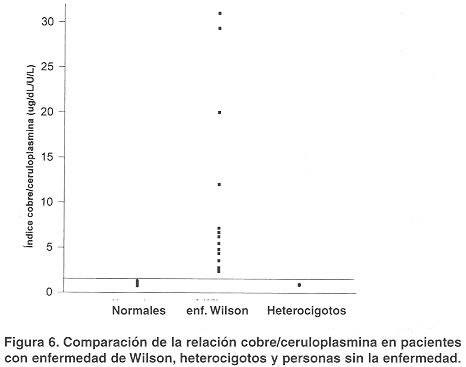
Comparación de la relación cobre/ceruloplasmina entre enfermos de Wilson y personas sin esta enfermedad. Como un indicador de la concentración de cobre no unido a ceruloplasmina se determinó el índice cobre/cerulopiasmina (concentración de cobre/actividad de ceruloplasmina) en personas sin enfermedad de Wilson y pacientes con dicha enfermedad. Como se observa en la figura 6, este índice es cercano a 1,0 (0= 0,85; DS= 0,1123) en personas sin la enfermedad y en los heterocigotos fue de (0= 0,9; DE=0,15); mientras en los pacientes con enfermedad de Wilson esta relación es superior a 2,0 (0 = 9,9; DE = 9,8).
Discusión
El cobre es considerado como un elemento traza esencial para el organismo. Este metal posee un amplio espectro de funciones en los procesos biológicos, tales como influenciar la expresión específica de genes y servir como cofactor o grupo prostético para varias enzimas (10, 11). La ruta metabólica y distribución en plasma del cobre, han sido motivo de estudios durante varios años (12,14), con el fin primordial de buscar solución a desórdenes metabólicos inherentes a este metal, como lo son el síndrome de Menkes y la enfermedad de Wilson. La determinación de cobre en suero y orina se realiza fundamentalmente en el diagnóstico de la enfermedad de Wilson. En los pacientes con esta patología se presenta una acumulación de cobre en tejidos, principalmente en hígado, córnea, riñón y cerebro (15, 16). Los análisis de laboratorio en estos pacientes muestran una disminución de la actividad de la ceruloplasmina y una concentración de cobre total disminuida en relación con personas normales, aunque el cobre no unido a ceruloplasmina está aumentado. Además presentan aumento en el cobre hepático y una excreción aumentada de cobre en orina (15, 16).
En Costa Rica la enfermedad de Wilson se presenta con una alta frecuencia (1/25000) (16). Sin embargo son pocos los laboratorios clínicos hospitalarios que realizan las pruebas necesarias para su diagnóstico. Por este motivo se consideró necesario el validar un método sencillo, rápido, sensible, preciso y exacto que pueda ser utilizado en todos los laboratorios clínicos del país como un análisis rutinario. Para tal fin se modificó el método propuesto por Brenner (6) que emplea AcBc. El método original emplea un amortiguador de Hepes (ácido N-2-hidroxietilpiperazina-N-2-etanosulfónico) y como reductor emplea ácido deshidroascórbico, para la modificación se empleó amortiguador de fosfatos y ácido ascórbico como reductor, los cuales son más baratos y fáciles de conseguir.
El espectro de absorción del complejo cobre-ácido bicinconínico muestra dos picos de absorción, uno máximo y estrecho a 358 nm y un pico menor y ancho a 555 nm. La sensibilidad obtenida a 358 nm es 5,5 veces mayor a la obtenida a 555 nm, por lo cual se eligió la longitud de onda de mayor sensibilidad (358 nm) como la más adecuada para el análisis. Realizando la determinación en estas condiciones el método es lineal hasta 300 µg/dL y tiene un límite de detección de 8 µg/dL, intervalo dentro del cual se espera encontrar las concentraciones de las muestras de suero.
Los estudios de recuperación mostraron una buena exactitud del método, ya que el porcentaje de recuperación (cuadro II) para cada concentración de cobre agregado es cercano al 100% y el valor promedio resultante es de 99,7%. Para otras técnicas se informan porcentajes de recuperación similares. García y Schosinsky (8) informan un 102% de recuperación promedio, Williams y colaboradores (5) un 95%; Abe (4) un 98% y Makino e ltoh (17) un 101,7%.
Se llevaron a cabo estudios de imprecisión en un mismo día y en días consecutivos, utilizando mezclas de sueros con diferentes concentraciones de cobre. En un mismo día se obtuvieron coeficientes de variación (CV) de 2,6; 1,8 y 1,2 por ciento, para concentraciones de cobre de 58, 130 y 208 µg/dL y los CV día a día fueron de 4,8; 3,0 y 1,5 por ciento respectivamente. La imprecisión obtenida con este método es adecuada y similar a la informada para otros sistemas: Abe informa CV de 1,6 y 3,3 para concentraciones de 103 y 72 µg/dL (4) y Makino e ltoh (17) informan CV en un mismo día de 2,8; 1,9 y 1,6 y día a día CV de 2,8; 2,0 y 2,2 para muestras con concentraciones de 69; 107 y 166, respectivamente. Por su parte García y Schosinsky informan CV día a día de 9,0, 5,7 y 2,5 por ciento para concentraciones de cobre de 52; 107 y 207 µg/dL, respectivamente (8).
Estos datos muestran que el AcBc, un reactivo soluble en agua puede ser altamente sensible, versátil y específico para la determinación de cobre. Se ha informado que el AcBc es uno de los pocos reactivos altamente específicos para cobre (6). El presente estudio confirma esta conclusión mostrando que el hierro, el manganeso y el zinc, otros tres metales de primera transición, así como calcio y magnesio, prácticamente no interfieren con la formación del complejo. Debe resaltarse que el zinc en particular, el cual tiene la misma configuración electrónica que el cobre, no muestra interferencia con la formación del complejo Cu+2AcBc.
La estabilidad relativa del complejo al pH demostrada en este estudio, es una característica deseable, ya que para liberar el cobre de los ligandos biológicos se emplea frecuentemente la desproteinización con ATA o la adición de pequeñas cantidades de ácido. La insensibilidad al pH significa que no es necesario un ajuste muy exacto del pH de la solución antes de agregar el reactivo de AcBc.
La interferencia por bilirrubina y hemoglobina es despreciable ya que el tratamiento con ATA elimina estas sustancias, lo cual representa una gran ventaja sobre otros métodos que sí se ven afectados por estos interferentes, en especial la bilirrubina, la cual va a estar presente en casos de problemas hepáticos, que corresponden a muchas de las muestras enviadas para la determinación de cobre.
Se observa una buena correlación entre el método del AcBc y el método de dibencilditiocarbamato de zinc, lo que refuerza la exactitud delanálisis. Al realizar estudios comparativos con la determinación de cobre con dibencilditiocarbamato de zinc la ecuación de regresión obtenida fue: y = 1,125x - 7,19; el coeficiente de correlación (r) fue de 0,985 y el error estándar delestimado (Sy*x) de 10,4 µg/dL.
En cuanto a la relación cobre/ceruloplasmina se observa una marcada diferencia entre los valores obtenidos en aquellos casos de enfermedad de Wilson (promedio 9,9 y desviación estándar 9,8) y personas heterocigotos o sin esta condición (promedio 0,85 y desviación estándar 0,11). Aunque en este estudio se evaluaron pocos casos de pacientes con la enfermedad (n = 11), los resultados ameritan un estudio más amplio ya que esta relación podría ser un buen indicador del cobre no unido a ceruloplasmina y convertirse en una herramienta muy útil para el diagnóstico de la enfermedad de Wilson.
En resumen, el método evaluado constituye una alternativa precisa y exacta para la determinación de cobre en suero. Los datos obtenidos indican que el método es lineal y reproducible dentro del intervalo en el que se espera encontrar los valores de las muestras. El estudio comparativo mostró una buena correlación. Y posee la gran ventaja sobre otros métodos, de no sufrir interferencia por pH, ni bilirrubina. Por otro lado, la relación cobre/ceruloplasmina parece ser un buen indicador del cobre no unido a ceruloplasmina y puede ser de ayuda en el diagnóstico de la enfermedad de Wilson.
Referencias
1- Youssef AR, Wood B, Baron DN. Serum copper: a marker of disease activity in rheumatoid arthritis. J Clin Pathol 1983; 36:14-17. [ Links ]
2- Buamah PK, Russell M, MilfordWard A, et al. Serum copper concentration significantly less in abnormal pregnancies. Clin Chem 1984; 30:1676-1677. [ Links ]
3- Lightman A, Brandes JM, Binur N. Use of the serum copper/zinc ratio in the different diagnosis of ovarian malignancy. Clin Chem 1986; 32:101-103. [ Links ]
4- Abe A, Yamashita S, Noma A. Sensitive, direct colorimetric assay for copper in serum. Clin Chem 1989; 35 (4): 552-554. [ Links ]
5. Williams HL, Johnson DJ, Haut MJ. Simultaneous spectrophotometry of Fe2+, and CU2+, in serum denatured with guanidine hydrochloride. Clin Chem 1977; 23:237-240. [ Links ]
6. Brenner AJ, Harris DE. A quantitative test for copper using bicinchoninic acid. Analytical Biochem 1995; 226: 80-84. [ Links ]
7. Giorgio AJ, Cartwright GE, Wintrobe MM. Determination of urinary copper by means of direct extraction with zinc dibenzildithiocarbamate. Am J Clin Pathol 1964; 41: 22-26. [ Links ]
8. García M, Holst I, Schosinsky K, Rodriguez R. Optimización de un método colorimétrico para la cuantificación de cobre en suero. Rev Cost Cienc Med 1993; 14(3,4): 33-42. [ Links ]
9. Schosinsky K, Lehmann HP, Beeler MF. Measurement of ceruloplasmin fron its oxidase activity in serum by use of o-dianisidine dihydrochloride. Clin Chem 1974; 20: 1556-1563. [ Links ]
10. Luza SC, Speisky HC. Liver copper storage and transport during development: implications for cytotoxicity. Am J Clin Nutr 1996; 63: 812-820. [ Links ]
11. Olivares M, Uauy R. Copper as an essential nutrient. Am J Clin Nutr 1996; 63:791S-796S. [ Links ]
12. Bingham MJ, Ong TJ, lngledew WJ, McArdle HJ. ATP dependent copper transportar in the Golgi apparatus of rat hepatocytes, transports Cu (II) not Cu (1). Am J Physiol 1996; 271: 741-746.
13. Fife RS, Moody S, Houser D, Proctor C. Studies of copper transport in cultured bovine chondrocytes. Biochim Biophys Acta 1994; 1201: 19-22. [ Links ]
14. Linder MC, Hazegh-Azam. Copper biochemistry and molecular biology. Am J Clin Nutr 1996; 63: 797-811.
15. Scheinberg HI, Sternlieb I. Wilson disease and idiopathic copper toxicosis. Am J Clin Nutr 1996; 63: 842S-845S. [ Links ]
16. Schosinsky K, Vargas M, Esquive¡ A, Grant S, Chavarría M. Hallazgos de laboratorio en 61 casos de enfermedad de Wilson en Costa Rica. Rev Cost Cienc Med 1989; 10 (3): 11-21.
17. Makino T, Itoh JI. A highly sensitive colorimetric determination of serum copper using ,
,
, -tetrakis (4N-trimethylaminophenyl)-porphine. Clin Chim Acta 1981; 11:1 -8. [ Links ]
Universidad de Costa Rica, Facultad de Microbiología
Departamento de Análisis Clínicos. San José, Costa Rica Tel. (506)-2075440.
* correspondencia, correo electrónico:
mejimene@cariari.ucr.ac.cr