Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.22 n.3-4 San José Dec. 2001
Jorge García1,2
Resumen
Macrófagos alveolares de rata se obtuvieron mediante lavado pulmonar, y se usaron como modelo para estudiar el daño en la membrana causado por exposición a ozono (O3, 0,594 ppm durante 60 min), usando como índice la liberación de 51Cr, cargado previamente en las células. La preincubación de los macrófagos en presencia de vitamina C (ascorbato de sodio) o de vitamina E (DL tocoferol) disminuyó significativamente la liberación de51Cr en respuesta a O3; el efecto protector fue más pronunciado al aumentar la dosis de vitamina E. Se presenta una explicación del efecto protector de las vitaminas E y C, y se propone una hipótesis que relacionaría nuestros hallazgos con otros recientes que demuestran que la ingesta de suplementos antioxidantes contribuye al mantenimiento de la función pulmonar en sujetos voluntarios normales y asmáticos expuestos a ozono.
Abstract
The damaging effects of a 60 minute ozone exposure (0,594 ppm) on the cell membrane of rat alveolar macrophages was assessed by measuring specific release of51Cr label from the cells. Preincubation of the macrophages in the presence of vitamin C (sodium ascorbate) or vitamin E (DL tocoferol) prior to ozone exposure significantly diminished 51Cr release. The protective effect of vitamin E was dose dependent. A proposal accounting for the protective effect of vitamins E and C on the cell membrane is presented, and our findings are discussed in relation to recent reports showing that antioxidant supplementation contributes to preserve pulmonary function in ozone-exposed normal and asthmatic volunteers.
Introducción
El ozono (O3) es un gas incoloro, cuya inhalación puede causar daño severo en el tracto respiratorio, ya que su capacidad oxidante (potencial redox de +2,07 voltios) es de las más altas que se conocen (1). Sin embargo, ha jugado un papel fundamental en la evolución de la vida terrestre, ya que, al formarse y permanecer en la estratosfera, constituye una barrera que filtra la casi totalidad de la luz ultravioleta de longitudes cortas (UV-C, 200-290 nm). Los efectos de esta radiación a nivel superficial interferirían seriamente con procesos biológicos, por su capacidad de inducir mutaciones y deprimir la respuesta inmune (2).
En la estratosfera, el O3 aparece como resultado de la fotólisis del oxígeno, causada por luz ultravioleta de longitud corta (UV C, < 242 nm); su formación se equilibra de manera dinámica con su descomposición, debida a radiaciones UV de longitud intermedia ( > 310 nm), e infrarroja (< 1140 nm) (3).
En la superficie, su formación se debe también a procesos fotolíticos, diferentes de los estratosféricos, que requieren, además de la luz solar, oxígeno, óxidos de nitrógeno, y compuestos orgánicos volátiles, presentes estos dos últimos en emisiones automotrices e industriales (3), pero en contraste con los beneficios de la formación de O3 en la atmósfera, su formación en las capas inferiores de la atmósfera es dañina y en algunas zonas metropolitanas representa un problema serio de salud pública (4). Este proceso de formación superficial de O3se inicia con la fotólisis de NO2:
(295-400nm)
NO2 ______ > NO + O
Seguido por reacción entre oxígenos molecular y atómico.
O2 + O ________ > O3
El ozono así formado puede reaccionar con NO, descomponiéndose:
O3 + NO ______ > NO2 + O2
Por lo tanto, la formación superficial de ozono y su descomposición constituyen también un equilibrio dinámico, en el cual la acumulación de O3 depende de la relación entre las concentraciones de NO2 y NO (NO2 / NO); mientras mayor sea esta relación, mayor será también la acumulación neta de O3. Otros componentes de emisiones automotrices e industriales, como aldehídos e hidrocarburos, pueden también formar radicales por fotólisis. Estos radicales tienen la capacidad de oxidar el NO hasta NO2 de manera directa, con lo cual incrementan la relación NO2 / NO, y favorecen la acumulación de O3(3).
En zonas metropolitanas altamente contaminadas, la concentración de O3puede subir por encima del nivel atmosférico basal de 0,04 ppm, y mantenerse constantemente a niveles de 0,1-0,2 ppm. Ocasionalmente, las condiciones atmosféricas, aunadas a contaminación ambiental, pueden provocar ascensos hasta niveles de 0,4 ppm, que pueden afectar adversamente la función del pulmón, órgano blanco de daño por inhalación de O3(5-7). En animales de laboratorio, concentraciones de O3de 1-2 ppm causan daño pulmonar considerable, y la dosis letal es de 4 – 10 ppm (8).
El daño causado por inhalación de O3 se caracteriza por puntos focales de inflamación, e hiperplasia epitelial en vías respiratorias (3). Estos cambios se acompañan de pérdida de cilios en células epiteliales, y pueden llegar incluso a la descamación de las mismas (9). Dependiendo de la dosis inhalada, las lesiones pueden interesar incluso los bronquiolos terminales y ductos alveolares (10). Se presenta infiltración leucocítica, con un porcentaje importante de macrófagos alveolares, así como incremento en la permeabilidad vascular y en la reactividad bronquial. Se detectan asimismo eicosanoides en el fluido de lavado broncoalveolar (7). A nivel celular, el O3 oxida directamente biomoléculas, induce formación de radicales libres (3), y la generación de moléculas tóxicas como el 4 hidroxinonenal (11).
Por su facilidad de recolección, los macrófagos alveolares se han usado como modelo para estudiar los efectos celulares del O3. En macrófagos alveolares de rata, la exposición a O3 causa protrusiones en la membrana plasmática (12), y en macrófagos alveolares humanos, la capacidad fagocítica y la producción de superóxido (O2-) disminuyen, pero aumenta la movilización de araquidonato y la producción de eicosanoides, lo que es congruente con la propuesta de que la membrana plasmática es un blanco principal de la acción oxidativa del O3 (13); las cadenas poliinsaturadas de los fosfolípidos de membrana, en particular, sufren ataque oxidativo por O3 y otros radicales, lo que conduce a pérdida de la permeabilidad selectiva (3). La entrada de calcio al citoplasma, por su efecto desorganizador del citoesqueleto, puede explicar las protrusiones de la membrana y la síntesis aumentada de eicosanoides, en razón de la activación de fosfolipasas, ciclooxigenasa y lipooxigenasa (14).
Aunque la función de los macrófagos se afecta negativamente por la exposición a O3, su acumulación en el sitio de lesión, y su producción aumentada de mediadores de inflamación, los convierte en agentes amplificadores de la respuesta inflamatoria (15). Por tanto, la posibilidad de proteger a los macrófagos alveolares del daño oxidativo aumentando su reserva de antioxidantes es de sumo interés y relevancia. La vitamina E ( tocoferol) se localiza en la membrana celular, y su acción antioxidante puede disminuir el daño oxidativo a membranas celulares (16). La vitamina C también posee acción antioxidante (17), y aunque se localiza en el citoplasma, la evidencia experimental sugiere que puede contribuir directamente a la regeneración de la vitamina E de las membranas (16,17). En este estudio se incubaron macrófagos alveolares de rata en presencia de vitamina E o C previo a su exposición a ozono. Como los resultados lo demuestran, la preincubación de las células con cualquiera de las dos vitaminas disminuye significativamente el daño causado por O3 a la membrana celular.
Materiales y Métodos
Aislamiento de macrófagos alveolares.
Los macrófagos alveolares se obtuvieron de ratas macho Sprague-Dawley, sacrificadas con una inyección intraperitoneal de pentobarbital sódico (65 mg/ kg). Se efectuó de inmediato canulación traqueal, seguida por lavado pulmonar con 8 alícuotas de 10 ml c/u de solución salina fría amortigüada con fosfatos (0,1 M, pH 7,4), sin calcio ni magnesio. Las células se centrifugaron a 550 x g durante 10 minutos a 4 °C (centrífuga Sorvall RC 3, Sorvall Instruments, Newton, CT), y se lavaron usando amortiguador de HEPES sin calcio (HEPES 10 mM, glucosa 5 mM, KCl 5 mM, NaCl 145 mM, pH 7,4); se suspendieron luego en 1 ml de amortiguador de HEPES con calcio (igual al anterior pero con CaCl2 1 mM). El conteo de macrófagos en la suspensión se efectuó utilizando un contador electrónico ( Coulter Counter, modelo ZBI, con canalizador 256, Coulter Instruments, Hialeah, FL). El porcentaje de macrófagos en la suspensión celular fue de 87,8 + 2,9 %, y el porcentaje de células viables, estimado mediante exclusión de azul tripán, fue de 86,8 + 3,0 % (porcentaje + 1 desviación standard).
Exposición de macrófagos alveolares a ozono.
Los macrófagos alveolares se colocaron en botellas de poliestireno para cultivo de tejidos (GIBCO, 25 cm2, 3 – 4 x 10 6 células / botella), junto con 4 mL de medio mínimo esencial (Eagle, sin indicadores de pH), conteniendo suero fetal bovino (10% v/v). Cada botella se incubó a 37 °C en una atmósfera con 5% de CO2, durante 50-60 minutos, para permitir la adherencia de los macrófagos. Luego de la incubación, las monocapas celulares se lavaron tres veces con amortigüador HC para eliminar las células no adherentes, y se añadieron 3 ml del mismo amortigüador antes de proceder a la exposición a ozono.
Las botellas de poliestireno se modificaron previo a los experimentos practicando 2 perforaciones, una en la pared lateral cerca del cuello, para salida de gases, y otra en la pared inferior, para entrada. Se adhirieron acoples de polietileno a las perforaciones usando pegamento epóxico, para posibilitar el empate de mangueras de teflón por las que fluyeron las mezclas gaseosas de entrada y salida. La manguera de entrada en las botellas se conectó a un generador de ozono (Modelo 1000, McMillan Electronics Corp., Houston , TX), mientras que la manguera de salida se conectó a un detector de ozono (Modelo 1003-AH, Dasibi Environmental Corp., Glendale, CA). Las botellas con las conexiones descritas y conteniendo las células se colocaron sobre una plataforma Buchler con mecanismo de inclinación alterna a 22 cambios por minuto. Al tiempo que el generador impulsó una corriente de aire enriquecido con ozono hacia la botella, la inclinación alterna permitió el contacto intermitente de la monocapa de macrófagos con la atmósfera en el interior de la misma durante el período de exposición de 60 min. La concentración de O3 en la mezcla gaseosa de salida fue de 0,594 + 0,005 ppm (promedio + desviación estándar). En cada experimento, se utilizaron controles no expuestos al ozono, que consiste en monocapas celulares en botellas igualmente modificadas puestas sobre la misma plataforma, y con entradas y salidas expuestas al aire ambiental.
Evaluación de la permeabilidad de membrana
Los cambios en la permeabilidad de la membrana de los macrófagos se estimaron midiendo 51Cr liberado al sobrenadante por células precargadas con el isótopo y expuestas a ozono. Para cargar las células con 51Cr, los macrófagos luego del lavado pulmonar, se suspendieron en medio mínimo con 10% suero fetal bovino y 100-250 L de solución de Na251CrO4 (New England Nuclear, 100
Ci / 107 macrófagos)hasta un volumen final de 1 ml, en un tubo de ensayo cónico de polietileno de 50 ml. Se incubó a continuación a 37 °C durante 50 minutos en una atmósfera con 5% de CO2, con agitación suave cada 10 minutos, para permitir la incorporación del isótopo a las células; las que se lavaron luego tres veces con amortigüador HC (1 mL) para descartar el isótopo del sobrenadante, y se colocaron en las botellas para permitir su adherencia. Se procedió luego a la exposición a ozono, según se describió previamente. A los 0, 20, 40, y 60 minutos de exposición, se tomaron alícuotas de 100
L del amortigüador sobrenadante para conteo de radioactividad (cpm, o cuentas por minuto), usando un contador de centelleo (Modelo LS 6500, Beckman Instruments, Fullerton, CA). Cada experimento incluyó cuatro botellas; una sirvió de control expuesto a la atmósfera ambiental; otras dos se expusieron a ozono, cuyos conteos se promediaron, y otra sirvió para la estimación del 100% de liberación de isótopo. En ésta última, se decantó el amortigüador a tiempo 0 minutos y se añadió un volumen de 3 mL de solución de Triton al 1% en agua, para lisar las células, y se tomó una alícuota de 100
L a tiempo 60 minutos; el conteo de radioactividad en este caso representó un 100% de liberación de isótopo. El porcentaje de liberación específica de 51Cr para cada uno de los tiempos de lectura se calculó mediante la fórmula:
% liberación específica = promedio cpm (expuestos a O3) – cpm (no expuesto) x 100
cpm ( 100% de liberación)
Los valores promedio de cpm en todas las botellas a tiempo 0 minutos se restaron a los de cpm en expuestos y no expuestos en todos los puntos de lectura. Los conteos de controles expuestos a la atmósfera ambiental no presentaron variación cuando se midieron nuevamente al final del período experimental de 60 minutos.
Preincubación de macrófagos alveolares con vitamina E o C.
Las células se preincubaron con vitamina E o C inmediatamente después de su carga con 51Cr, previo a la exposición a O3. Para la preincubación con vitamina E, una solución madre de DL tocoferol (Aldrich) 0,75 M se preparó añadiendo 340
l a 660
l de etanol anhidro, mezclando de manera sostenida. A continuación se preparó una suspensión coloidal 1 mM de
tocoferol añadiendo lentamente 40
l de la solución 0,75 M a 28 ml de MEM mantenido en baño de hielo con sonicación constante, la cual se mezcló finalmente con suero fetal bovino hasta un volumen de 32 ml. Concentraciones más bajas de
tocoferol se obtuvieron disminuyendo el volumen de la solución madre usado para la preparación de la suspensión coloidal. El MEM enriquecido con
tocoferol se colocó en la botellas de poliestireno para exposición a O3 (4 ml / botella) y se agregaron luego los macrófagos alveolares cargados con 51Cr, incubándose a 37C en atmósfera de 5% CO2 durante 80 min para permitir la adherencia de las células y la incorporación del
tocoferol. Luego de este período de incubación, el MEM en las botellas se decantó, y las monocapas celulares se lavaron cuatro veces con volúmenes de 2 ml de amortigüador HC a temperatura ambiente para descartar el ? tocoferol en suspensión. Se procedió luego a la exposición a O3 según se describió con anterioridad.
Para preincubar con vitamina C, se añadió la cantidad de vitamina C (ascorbato de sodio, Sigma), ésta se añadió en cantidad necesaria para lograr la concentración deseada, en un volumen de 50 ml de MEM conteniendo 10% suero fetal bovino. Este se distribuyó en las botellas para exposición y los macrófagos alveolares precargados con 51Cr se adicionaron, incubándose luego durante 60 min a 37C en atmósfera con 5% CO2 para permitir la adhesión celular y la incorporación de la vitamina C por parte de las células. Las monocapas celulares se lavaron luego 3 veces con volúmenes de 2 ml de amortigüador HC para eliminar la vitamina C en el sobrenadante, se añadieron luego 3 ml de amortigüador HC y se procedió a la exposición a O3.
Resultados
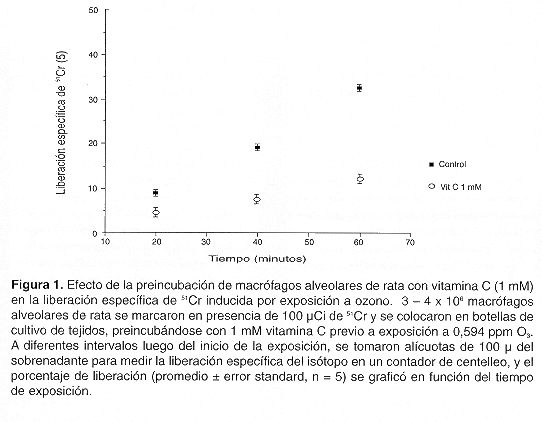
El daño causado a los macrófagos alveolares por exposición a O3 se evaluó midiendo liberación específica de 51Cr, un indicador indirecto de daño en membrana, ya que las membranas intactas retienen el marcador en el citosol, y su salida es sumamente lenta. La liberación de 51Cr aumentó de manera lineal a lo largo de la exposición hasta alcanzar 32,60 % a los 60 min (Fig.1). En macrófagos preincubados en presencia de vitamina C 1 mM la liberación de isótopo fue también lineal, pero disminuyó de manera importante, llegando solo a 12,15 % a los 60 min, lo que representa una disminución de más del 60% de la liberación registrada en ausencia de vitamina C (Fig. 1).
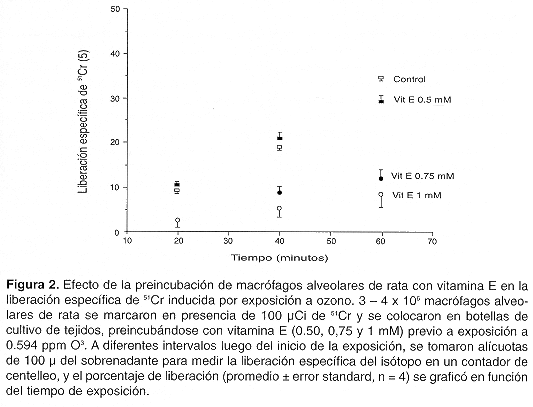
En macrófagos preincubados con vitamina E (Fig. 2), la liberación específica de 51 Cr disminuyó de manera significativa con respecto a la liberación en ausencia de vitamina E a dosis de 0,75 mM y 1 mM (prueba t, p< 0,05); la respuesta inhibida mantiene su linealidad, y la disminución es proporcional a la dosis de vitamina E. La liberación específica de isótopo a 0,75mM y 1 mM de vitamina E no difiere significativamente entre las dos concentraciones (prueba t, p< 0,05) A dosis de 0,5 mM de vitamina E, se presenta disminución significativa con respecto al control sin vitamina E únicamente a los 60 min de incubación (prueba t, p< 0,05).
Discusión
Aunque el O3 no es un radical, el daño que causa a sistemas biológicos es de tipo oxidativo, debido a su adición a componentes celulares, que posteriormente oxida (3); además induce la generación concomitante de radicales libres (alquilo y peroxilo), y derivados tóxicos, como el 4 hidroxinonenal (11).
A partir de experimentos efectuados con macrófagos alveolares humanos y de rata, se ha propuesto que el blanco principal de la acción del O3 en la célula es la membrana plasmática (13). Los radicales pueden iniciar reacciones peroxidativas en cadena, las cuales, al afectar los ácidos poliinsaturados en los fosfolípidos de membrana, conducen a alteración de la permeabilidad selectiva (3), y a la liberación de peróxidos al fluido extracelular (18). La oxidación de residuos de cisteína, lisina, tirosina, triptofano o histidina en proteínas de membrana, afecta moléculas tales como la ATPasa de Na+-K+, y contribuye a perturbar aún más la fisiología celular (18).
En concordancia con la idea de que el daño causado por O3 en el tracto respiratorio es de carácter oxidativo, hay evidencia de que su inhalación reduce la concentración de vitamina C en el fluido que recubre el epitelio respiratorio en humanos (19). Asimismo, en estudios con voluntarios normales se ha demostrado recientemente que la suplementación dietética con antioxidantes (vitaminas C y E, y jugos vegetales) atenúa la disminución en los parámetros de función pulmonar VEF y CVF causada por inhalación de O3, aunque no hay reducción de la acumulación de neutrófilos y de IL-6 en fluido de lavado bronco alveolar (20). Se ha reportado el mismo efecto protector de vitaminas E y C en el VEF de asmáticos expuestos a O3 (21).
Los resultados de este estudio indican que la suplementación directa de macrófagos alveolares con vitamina C o E atenúa los efectos de exposición a O3 en la permeabilidad de la membrana plasmática, enfoque experimental que no ha sido descrito previamente. La preincubación de los macrófagos con vitamina E enriquece el contenido de ésta en las membranas celulares (22), y su capacidad para actuar como antioxidante a ese nivel ha sido documentado previamente; a saber, interrumpe la reacción de peroxidación en cadena causada por el ataque de radicales a la membranas, proceso durante el cual la vitamina E se oxida y radicaliza, pero debido a su baja reactividad, detiene peroxidaciones ulteriores (17). Aunque en este caso no se cuantificó el aumento del contenido de vitamina E en la membrana de los macrófagos alveolares de rata, su efecto protector sobre la membrana se manifestó como una clara reducción de la permeabilidad inducida por el O3, con disminución concomitante de la liberación del marcador radioactivo. La especificidad del efecto de la vitamina E en nuestros experimentos es sugerida por el incremento en el grado de protección al aumentar la concentración de vitamina a la que se expusieron los macrófagos.
El efecto protector de la vitamina C (1 mM) fue tan efectivo como el de la vitamina E a la misma concentración. Aunque los experimentos descritos no permiten establecer con certeza el mecanismo protector de la vitamina C, la evidencia en la literatura permite hipotetizar que el efecto de economía de la vitamina E de membrana, asociado al incremento de la vitamina C, contribuye a la protección (16), así como su capacidad de inhibir la peroxidación de la membrana al reaccionar directamente con radicales formados extra e intracelularmente (17).
Por razones obvias, no es posible correlacionar directamente los resultados de esta investigación, usando macrófagos alveolares de rata, con experimentos efectuados en humanos. Sin embargo, nuestros datos, en conjunto con los de investigaciones previas, permiten postular un mecanismo hipotético que explicaría la acción protectora de las vitaminas E y C en la función pulmonar de sujetos expuestos a O3. En ellos, la disminución del FEV se debe a broncoconstricción causada por eicosanoides, en particular leucotrienos provenientes de células inflamatorias, entre ellas macrófagos alveolares (7).
El daño oxidativo causado por O3 en la membrana altera la permeabilidad selectiva y permite la entrada de calcio externo al citoplasma (14). El aumento del calcio citoplásmico es un inductor efectivo de la síntesis de eicosanoides, porque activa el metabolismo de araquidonato en dichas células (23). Es muy probable que las vitaminas E y C, al atenuar la pérdida de permeabilidad selectiva de membrana, disminuyan la entrada de calcio externo al citoplasma, lo que se traduciría en a su vez en menor síntesis de eicosanoides, entre ellos leucotrienos, acarreando como consecuencia menor grado de broncoconstricción.
Referencia
1) Weast RC, ed. Handbook of Chemistry and Physics. 51st edition. The Chemical Rubber Co.Cleveland, OH, 1970; D67, D68, D112. [ Links ]
2) Jones RC. Ozone depletion and cancer risk. Lancet 1987; 8556: 443-445. [ Links ]
3) Mustafa MG. Biochemical basis of ozone toxicity. Free Radical Biol Med 1990; 9: 245-265. [ Links ]
4) National Academy of Sciences. Ozone and other photochemical oxidants. Committee on Medical and Biologic Effects of Environmental Pollutants. Subcommittee on Ozone and Other Photochemical Oxidants. National Academy of Sciences, Washington, D.C. Vol. 19, 1977. [ Links ]
5) South Coast Air Quality Management District. Seasonal and diurnal variation in air quality in California's South Coast Air Basin. El Monte, CA. SCAQMD; 1980. [ Links ]
6) Scannell C, Chen L, Aris RM, Tager I., Christina D, Ferrando R., Welch B, Kelly T, Balmes JR. Greater ozone-induced inflammatory responses in subjects with asthma. Am. J Resp Crit Care Med 1996; 154: 24-29. [ Links ]
7) Coffey MJ, Wheeler CS, Gross KB, Eschenbacher WL., Sporn PH, Peters-Golden, M. Increased 5-lipoxygenase metabolism in the lungs of human subjects exposed to ozone. Toxicology 1996; 114: 187-197. [ Links ]
8) Coffin, D.L., Stokinger, H.E. Biologic effects of air pollutants. En Stern, A.C., Ed. Air pollution, Vol II, Academic Press, New York 1977: 231-360. [ Links ]
9) Barry, B.E., Miller, F.J., Crapo, J.D. Alveolar epithelial injury caused by inhalation of 0.25 ppm ozone. En Lee. S.D., Mustafa, M.G., Mehlman, M.A. (eds.) International Symposium on the biomedical effects of ozone and related photochemical oxidants. Princeton Scientific Publishers, Princeton; N.J. 1983; p 299-309. [ Links ]
10) Stephens RJ, Sloan MF, Evans MJ, Freeman G. Early response of lung to low levels of ozone. Am J Pathol 1974; 73: 711-726. [ Links ]
11) Hamilton RF Jr, Li L, Eschenbacher WL, Szweda L, Holian A. Potential involvement of 4-hydroxynonenal in the response of human lung cells to ozone. Am J Physiol 1998; 274: L8-L16.
12) Dormans JA, Rombout PJ, van Loveren H. Surface morphology and morphometry of rat alveolar macrophages after ozone exposure. J Toxicol EnvironHealth 1990; 31: 53-70. [ Links ]
13) Becker S, Madden MC, Newman SL, Devlin RB, Koren HS. Modulation of human macrophage properties by ozone exposure in vitro. Toxicol Appl Pharmacol 1991; 110: 403-415. [ Links ]
14) García J. La exposición a ozono disminuye la adherencia y aumenta la permeabilidad de membrana de macrófagos alveolares de rata. Rev Cost Cienc Med 2001; 22 (1,2) En Prensa. [ Links ]
15) Laskin DL, Pendino KJ. Macrophages and inflammatory mediators in tissue injury. Ann Rev Pharmacol Toxicol 1995; 35:655-677. [ Links ]
16) Niki E, Noguchi N, Tsuchihashi H., Gotoh N. Interaction among vitamin C, vitamin E, and b carotene. Am J Clin Nutr 1995; 62( Suppl): 1322S-1326S. [ Links ]
17) Sies H, Stahl W. Vitamins E and C, b carotene, and other carotenoids as antioxidants. Am J Clin Nutr 1995; 62 (Suppl): 1315S-1321S. [ Links ]
18) Banks MA, Porter DW, Martin WG, Castranova V. Effects of in vitro ozone exposure on peroxidative damage, membrane leakage, and taurine content of rat alveolar macrophages. Toxicol Appl Pharmacol 1990; 105: 55-65. [ Links ]
19) Mudway IS, Krishna MT, Frew AJ, MacLeod D, Sandstrom T, Holgate ST., Kelly FJ. Compromised concentrations of ascorbate in fluid lining the respiratory tract in human subjects after exposure to ozone. Occup Environ Med 1999; 56: 473-481. [ Links ]
20) Samet JM, Hatch GE, Horstman D, Steck-Scott S, Arab L, Bromberg PA., Levine M, McDonnell WF, Devlin RB. Effect of antioxidant supplementation on ozone-induced lung injury in human subjects. Am J Respir Crit Care Med 2001; 164: 819-825. [ Links ]
21) Trenga CA., Koeing JQ, Williams PV. Dietary antioxidants and ozone-induced bronchial hyperresponsiveness in adults with asthma. Arch Environ Health 2001; 56:242-249. [ Links ]
22) Bjornson LK, Gniewkowski C, Kayden HJ. Comparison of exchange of - tocoferol and free cholesterol between rat plasma lipoproteins and erythrocytes. J Lipid Res 1975; 16: 39-53. [ Links ]
23) Palmer RMJ., Salmon JA. Release of leukotriene B4 from human neutrophils and its relationship to degranulation induced by N-formyl-methionyl-leucyl-phenylalanine, serum-treated zymosan and the ionophore A23187. Immunology 1983; 50:65-73. [ Links ]
1 Escuela de Medicina
2 Facultad de Microbiología, Universidad de Costa Rica