Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.21 n.1-2 San José Jun. 2000
Resumen
Leucocitos polimorfo-nucleares neutrófilos (PMN) y monocitos (MN) humanos fueron expuestos a la alfa hemolisina (AH) de Escherichia coli, y los cambios en calcio citoplásmico se evaluaron mediante espectrofluorometría, usando como indicador el fluorocromo fura 2, previamente incorporado a las células. La AH causó un aumento en el calcio citoplásmico, que fue proporcional a la dosis hemolítica, y que también se observó en células expuestas a los ionóforos de calcio ionomicina y 4 Br A23187. La quelación de calcio extracelular previno los incrementos en calcio citoplásmico inducidos por 2 HU50/ ml de AH; sin embargo, bajo estas condiciones, PMN expuestos a 5 µM de ionomicina mostraron una alza pequeña en fluorescencia, sugiriendo movilización de calcio citoplásmico; ello indica que la mayor parte del incremento en el calcio citoplásmico en respuesta a ionóforos y AH se debió al ingreso de calcio externo al citoplasma. La AH, así como el ionóforo de calcio A23187 y el péptido quimiotáctico FMLP, causaron liberación de mieloperoxidasa (MPO) al medio externo de PMN, lo que evidencia que el incremento en el calcio citoplásmico causó degranulación de éstas células.
Palabras clave
Leucocito polimorfonuclear, calcio intracelular, alfa hemolisina
Abstract
Escherichia coli alpha hemolysin (AH) and the calcium ionophores ionomycin and 4 Br A23187 caused increases in cell fluorescence, indicative of elevations in cytoplasmic calcium, in fura 2- loaded human polymorphonuclear leukocytes (PMN) and monocytes (MN). The increase in fluorescence caused by AH was dose dependent. Quelation of extracellular calcium with EGTA prevented fluorescence increases in PMN exposed to 2 HU50/ml AH, but did not prevent a small increase in 4 µM, ionomycin-treated PMN, indicating that ionomycin treatment under conditions of calcium quelation can mobilize calcium from internal stores, and that entry of external calcium accounts for most of the increases in cell fluorescence in cells treated with both AH and calcium ionophores. AH, as well as calcium ionophores and the chemotactic peptide FMLP caused release of myeloperoxidase (MPO) from PMN, suggesting that increments in intracellular calcium cause degranulation with release of granule contents.
Key words
polymorphonuclear leukocytes, cytoplasmic calcium, alpha hemolysin.
Introducción
La hemolisina alfa (AH) es una exotoxina producida por cepas de Escherichia coli causantes de infecciones extra-intestinales y de tracto urinario (1). Se la considera como factor de virulencia (2,3), aunque su papel en la patogénesis de la infección no ha sido dilucidado totalmente (4).
La AH excreta al medio externo como una lipoproteína (5), pero se la purifica inicialmente como un complejo que incorpora además cantidades variables de lipopolisacárido (6), cuyo posible papel biológico en asociación con AH se desconoce (4). La AH sufre una transición anfifílica al formar complejos con iones calcio extracelulares (7), y es entonces capaz de insertarse en las membranas de células blanco, incluyendo eritrocitos, células epiteliales, y fagocitos (1).
La inserción de AH en las membranas celulares puede conducir a la lisis osmótica, particularmente en eritrocitos, aunque existen dudas acerca de si éste es su verdadero mecanismo de acción (4). Resulta paradójico que la investigación realizada durante más de veinte años no haya establecido con claridad el mecanismo por medio del cual la AH afecta células en el organismo invadido. Se estableció desde hace mucho que el eritrocito es susceptible de lisis por parte de AH (7), y posteriormente que tal lesión es causada por un único evento, irreversible y no enzimático (8). Jorgensen et al (9) propusieron que la AH ejercía un efecto análogo, pero no idéntico, al del ionóforo de calcio A23187, y que existía la posibilidad de que la AH formara poros transmembrana, ya que les fue posible medir flujos de calcio, sodio y potasio, a través de las membranas de eritrocitos expuestos a AH. Los poros han sido caracterizados por medio de métodos indirectos, midiendo cambios en conductancia (10), o el paso de cationes, monosacáridos y polisacáridos a través de membranas expuestas a AH (11). Sin embargo, es sorprendente que el tamaño aparente del poro varíe de acuerdo a las condiciones del ensayo hemolítico (4), y más aún, que nunca se haya podido comprobar su existencia por medio de microscopía electrónica.
Soloaga y colaboradores (12) han propuesto recientemente que la AH puede insertarse en membranas a la manera de una proteína integral, pero interactuando únicamente con una de las capas fosfolipídicas, sin formar una estructura transmembrana. Esta propuesta es sumamente interesante, ya que permite explicar observaciones previas dentro de una perspectiva coherente. La propuesta de Jorgensen et al (8) en el sentido de que la acción de la AH sobre las membranas celulares presenta analogías con la del ionóforo de calcio A23187, es congruente con la de Soloaga et al (12), ya que es posible que la inserción de la AH perturbe la organización de los fosfolípidos de membrana y altere así la permeabilidad celular, de manera análoga a la que se ha propuesto para el ionóforo de calcio A23187 (13). Concretamente, la evidencia experimental indica que éste último interfiere con la organización de los fosfolípidos en la interfase con las proteínas integrales de membrana, debido a su capacidad para unirse a ambos. La desorganización de los fosfolípidos sería responsable del aumento en la permeabilidad a cationes causado por el ionóforo (y la AH ) en membranas, y podría representar la lesión hemolítica original causada por AH. Una eventual aceptación de este modelo obligaría al abandono del actual, que postula que la AH es una toxina formadora de poros estables en la membrana (4). En apoyo del modelo propuesto por Soloaga, debe señalarse que la lesión de membrana causada por AH parece agrandarse conforme transcurre el tiempo luego de la exposición inicial (14), permitiendo que moléculas de mayor peso molecular atraviesen la membrana; esto último se logra también si se expone la célula a concentraciones altas de AH (4, 14). Este agrandamiento de la lesión podría no ser consecuencia directa del daño a la membrana causado por la AH, sino de los mecanismos celulares activados en repuesta al incremento en calcio intracelular, tales como acción de fosfolipasas, y la producción de radicales libres en fagocitos, mecanismos que amplifican el daño a la misma membrana. En membranas artificiales, el poro formado por la AH parece ser estático (10) , lo que también sugiere que la lesión de membrana aumenta de tamaño debido a mecanismos celulares, activados luego de la exposición a la AH.
El incremento en el calcio intracelular causado por la AH reviste particular importancia, habida cuenta del papel fundamental del mismo como regulador de la fisiología y metabolismo celulares (15). Los aumentos no fisiológicos en la concentración intracelular del calcio inducidos por AH conducen a la liberación de superóxido en células de tubulares renales (16), de leucotrienos y moléculas relacionadas de fagocitos (17), y también causan una respuesta quimioluminiscente aberrante en éstos últimos, asociada a defectos en la acción bactericida y la quimiotaxis de neutrófilos (18); los defectos en la quimiotaxis de deben probablemente a la desorganización del citoesqueleto inducida por el mismo aumento en el calcio citoplásmico.
Ya que se ha demostrado que la AH posee actividad selectiva contra leucocitos polimorfonucleares neutrófilos ( PMN) (19), es de interés estudiar los efectos de la AH en éstas células. En esta investigación se expusieron PMN y monocitos (MN) humanos a la AH, y se estimó de manera indirecta el aumento de calcio citoplásmico mediante espectrofluorometría, usando el fluorocromo fura-2, y midiendo incrementos en la fluorescencia de los complejos citoplásmicos de calcio –fluorocromo al irradiar células en las que el calcio citoplásmico aumenta. Se demostró que, tal y como sucede en otras células, la AH causó aumentos en el calcio citoplásmico de PMN y MN.
Materiales y Métodos
Cepas de Escherichia coli
Las cepas usadas en esta investigación fueron donadas por el Dr. R.A. Welch (U. of Wisconsin, Madison, WI), y son derivadas de Escherichia coli DH1. La cepa hemolítica WAM 589 se transformó con el plásmido pWAM04, (plásmido pUC 19, en el cual se subclonaron los genes de hemolisina, hly CABD, provenientes del plásmido pSF4000). La cepa control WAM 675 no es hemolítica y fue transformada con el plásmido pUC 19 desprovisto de genes de hemolisina. La cepa control WAM 783 es la DH1 transformada con un derivado del plásmido pWAM04, que posee una deleción en el gen hlyC, el cual codifica la información necesaria para la acilación de la pro HlyA (5). En consecuencia, WAM 783 secreta una hemolisina no acilada, incapaz de insertarse en membranas de la célula blanco.
Sobrenadantes de cultivos bacterianos.
Se usaron sobrenadantes crudos de cultivos de la cepa WAM 589 como fuente de hemolisina y sobrenadantes crudos de las cepas WAM 675 y 783 como controles, a diluciones elevadas con respecto a los volúmenes de reacción (más de 1:200).
Las cepas de Escherichia coli se cultivaron en caldo Luria-Bertani (LB), con ampicilina (100 µg/ml) para seleccionar las cepas WAM 589 y 675, y cloramfenicol (20 µg/ml) para seleccionar la cepa WAM 783. Volúmenes de 100 ml de caldo LB se inocularon con 1-3 ml de un cultivo estacionario de la cepa correspondiente ( incubado a 37ºC durante 8-12 horas), luego de lo cual se incubaron a 37ºC con agitación (200 rpm) en un incubador rotatorio G25 (New Brunswick, Edison, NJ). Se tomaron muestras de 10-15 ml de los cultivos cuando éstos alcanzaron una densidad óptica (D.O, 600 nm) de 0,3-0,4, y las bacterias se sedimentaron por centrifugación (7 min., 800 x g) en una centrífuga Sorvall SS1 (Dupont Instruments, Wilmington, DE). El sobrenadante se esterilizó por filtración a través de una membrana estéril con porosidad de 0,4 µm (Millipore) , y se mantuvo en hielo previo a su utilización.
Determinación de actividad hemolítica
A cada ml de diluciones dobles seriadas de sobrenadante bacteriano crudo y estéril en solución salina 0,85% con calcio (10 mM CaCl2) se añadió 1 ml de suspensión al 1% de eritrocitos de carnero suspendidos solución salina, y se incubaron a 37º C durante 1 h. Al finalizar la incubación, se añadió a cada dilución 2 ml de solución salina fría; se centrifugó a 700 xg por 5 min. en una centrífuga Sorvall GLC-2B (Dupont Instruments, Wilmington, DE) y se leyó la D.O. del fluido sobrenadante a 545 nm para estimar la liberación de hemoglobina. Se determinó la dilución de sobrenadante que causó 50% de lisis eritrocitaria mediante interpolación en papel semilogarítmico, en el cual se había trazado una curva patrón de hemólisis, obtenida independientemente por lisis hipotónica (en agua destilada) con el mismo lote de eritrocitos. El título hemolítico (HU50/ml) se definió como el inverso de la dilución de sobrenadante de cultivo bacteriano que causó 50% de hemólisis. Dado que los ensayos con células se efectuaron en amortigüador HC (descrito a continuación), se hicieron titulaciones de sobrenadantes hemolíticos en el mismo. El título hemolítico no varió con respecto al obtenido en solución salina con calcio.
Obtención de leucocitos polimorfonucleares neutrófilos (PMN) y monocitos (MN).
Se usó sangre venosa heparinizada obtenida de voluntarios sanos, la cual se estratificó en tubos de ensayo sobre medio Mono Poly (ICN-Flow) y se centrifugó de acuerdo a instrucciones del fabricante. Se recogió la banda de PMN y éstos se lavaron usando 20 ml de amortigüador HEPES sin calcio (HNC: HEPES 10 mM, NaCl 144 mM, KCl 5 mM, Glucosa 5,5 mM , gelatina para cultivo de tejidos 0,5% p/v, pH 7,4). Los PMN se resuspendieron luego en solución de NH4Cl (al 0,83% en HEPES 10 mM, pH 7,4) durante 7 minutos a 37º C, para lisar eritrocitos contaminantes. Los PMN se lavaron una vez más con HNC y se resuspendieron en 1 ml de amortigüador (0,8 ml de HNC + 0,2 ml de amortigüador HEPES con calcio, o HC, de composición idéntica a HNC, pero adicionado de 1 mM Ca Cl2 y con 0,1% gelatina, pH 7,4). El conteo de células en la suspensión se efectuó usando una cámara para contar glóbulos (Hemacytometer).
El aislamiento de monocitos (MN) se efectuó mezclando primero 10 volúmenes de sangre venosa (anticoagulada con EDTA) con 1 volumen de Dextran 500 (6% en NaCl 0,85%) y permitiendo la sedimentación de eritrocitos. Del sobrenadante obtenido, o sea plasma rico en leucocitos, se estratificaron a continuación 5-7 ml sobre 3 ml de Nycodenz Monocytes (Accurate Chemical and Scientific, Westbury, NY), un derivado no iónico del ácido yodo benzoico en solución amortiguada y levemente hipertónica. Se centrifugó a continuación (600 x g, 15 minutos), de manera que los MN formaron una banda aislada en la interfase del medio y el plasma. Las células se recolectaron, se lavaron y resuspendieron de acuerdo a las instrucciones del fabricante.
Medición de incrementos en calcio citoplásmico en PMN y MN.
Los aumentos en calcio citoplásmico fueron estimados por medio de espectrofluorometría. Los PMN se resuspendieron a una densidad de 5-6 x 106/ ml, y se incubaron en presencia del fluorocromo Fura 2 AM (Molecular Probes, Eugene, OR), a una concentración de 4 µM, a temperatura ambiente, durante 50 minutos, para incorporar el fluorocromo al interior de la célula. Las células se lavaron y se resuspendieron a la misma densidad en amortiguador HEPES con 1 mM de calcio. Las mediciones de espectrofluorometría se efectuaron a temperatura ambiente usando un espectrómetro de fluorescencia Perkin Elmer LS 50 (Perkin Elmer, Beaconsfield, Buckinghamshire, Inglaterra). Las longitudes de onda para la excitación intermitente fueron 340 y 380 nm, y se detectaron emisiones a 510 nm, con ranura abierta a 5 nm. Los PMN (2 x 106/ml) se colocaron en cubetas para fotómetro de fluorescencia, con un volumen de reacción de 3 ml, y agitación magnética. Los niveles basales de fluorescencia se midieron durante 2 minutos, y luego de añadir el estimulante, se midió la fluorescencia durante 3 minutos, o hasta alcanzar el valor máximo.
Los incrementos en calcio citoplásmico en MN se estimaron en células adheridas. Los MN aislados se lavaron, se resuspendieron en medio de cultivo de tejidos RPMI 1640 (Whittaker, Walkersville, MD) y se colocaron sobre cubreobjetos de vidrio, incubándolos a 37C en una atmósfera de 5% CO2 durante 60 minutos para permitir adherencia. Luego de un lavado adicional, las células se incubaron con fura 2 AM (según se describió para los PMN), para permitir la incorporación del fluorocromo. La fluorescencia se midió usando un sistema fabricado por Spex Inc. (Edison, NJ), el cual consiste en un microscopio adaptado a un sistema óptico de excitación y detección de fluorescencia. Se pueden medir incrementos en la fluorescencia de varias células a la vez, con excitación intermitente a 340 y 380 nm y detección de fluorescencia a
510 nm.
Los estimados del aumento en calcio citoplásmico de PMN y MN se expresaron como valores máximos de la fracción
F = emisión 510nm (excitación 340) / emisión
510nm (excitación 380 nm)
Detección de mieloperoxidasa (MPO) en sobrenadantes de PMN.
La actividad de MPO en sobrenadantes de PMN estimulados con el ionóforo de calcio A23187, péptido quimiotáctico (FMLP), o sobrenadante hemolítico, se hizo mediante una modificación de la técnica de quimiluminiscencia descrita por Ardekani (20); la actividad enzimática se tomó como indicio de degranulación celular (la MPO está contenida en gránulos primarios de PMN).
La suspensión de PMN (10 x 106 / ml) se expuso al estímulo apropiado y se incubó a 37º C durante 15 minutos. Los PMN se separaron seguidamente por centrifugación a 22 000 rpm durante 30 segundos (Beckman Microfuge E, Beckman Instruments, Palo Alto, CA) para permitir la recolección del sobrenadante. Para el ensayo de actividad de MPO, 400 µl de sustrato ( 0,25 ml H2O2 30%, añadido a 10 ml de solución 2,8 x 10 –5 M de luminol , llevado a 125 ml con amortiguador HC y mezclado con 400 ml de LiCl 1 M) se colocaron en cubetas para luminómetro (Berthold LB 9505C, Berthold Instruments, Wildbad, Alemania). La quimioluminiscencia (QL) basal se midió durante 2 minutos, luego de lo cual se inyectó un volumen de 100 µl de sobrenadante de suspensión de PMN, estimulados o control, directamente a la cámara de reacción, sin interrumpir el registro del instrumento. La medición finalizó cuando la QL alcanzó nuevamente niveles basales. Para asegurar la especificidad de la señal quimioluminiscente, se midió la CL de muestras en procesadas en paralelo, a las que se adicionó azida de sodio (10–5 M), que inhibe la actividad de MPO.
Resultados
En células en las que se ha incorporado el fluorocromo-fura 2, y en las cuales el calcio citoplásmico aumenta, los complejos calcio-fura 2 son responsables del incremento en fluorescencia cuando las células son irradiadas con luz ultravioleta. PMN y MN con fura 2 incorporado, y expuestos a sobrenadante hemolítico, manifestaron incrementos en fluorescencia, dependientes de la dosis de sobrenadante hemolítico, indicando incremento del calcio citoplásmico (Fig. 1). En PMN, la señal fluorescente fue detectable a dosis hemolíticas bajas de 0,1 HU50/ml, alcanzó un máximo a 2 HU50/ml, y disminuyó levemente a 5 HU50/ml. En MN expuestos a AH también se notó un incremento en fluorescencia (Fig. 2), que alcanzó un máximo entre 5 y 10 HU/50 ml. En ambos casos, la exposición a sobrenadantes no hemolíticos no causó aumento alguno en la señal fluorescente.
Los ionóforos de calcio ionomicina (4 µM) y 4-Br-A 23187 (5 µM) se usaron como controles positivos para incrementar el calcio citoplásmico, y causaron incrementos en fluorescencia en PMN y MN (Figs.1 y 2).
En PMN, el valor máximo de fluorescencia causado por el sobrenadante hemolítico alcanzó un 85% de la respuesta fluorescente causada por los ionóforos de calcio, mientras que en MN la respuesta máxima al sobrenadante hemolítico superó en un 10% la respuesta a 4 uM de ionomicina ( Figs 1 y 2).
Al exponer PMN resuspendidos en amortigüador HEPES sin calcio (adicionado con 5 mM EGTA para quelar el calcio extracelular), a ionomicina (4 µM), se observó un incremento de poca magnitud (0,25) en fluorescencia, lo que sugiere movilización del calcio intracelular. Sin embargo, PMN expuestos bajo las mismas condiciones a sobrenadante hemolítico (2HU50/ml), no mostraron ningún incremento en la señal fluorescente.
Los incrementos en calcio citoplásmico se asocian a diferentes tipos de respuesta celular, como degranulación en PMN. En la tabla 1 se ilustran los resultados del ensayo quimioluminiscente de actividad de mieloperoxidasa (MPO) en sobrenadantes de PMN estimulados con sobrenadantes hemolítico o no hemolítico, el ionóforo de calcio A23187 y el péptido quimiotáctico FMLP. Tanto el ionóforo A23187, como el péptido quimiotáctico y el sobrenadante hemolítico, causan liberación de MPO al medio extracelular, indicando que la degranulación es uno de los efectos de estímulos que incrementan el calcio intracelular de PMN. El estímulo más efectivo para la liberación de MPO es A23187, que causa una señal cuatro veces mayor que la obtenida con la dosis hemolítica más efectiva (5 HU50/ml). El péptido FMLP causa una liberación baja pero detectable de MPO, mientras que los sobrenadantes no hemolíticos no causaron liberación de la enzima.
Discusión
La AH ocasiona flujos iónicos de calcio, sodio y potasio a través de las membranas en células blanco (9), los cuales podrían efectuarse a través de poros estables formados por la AH (11), o más probablemente, a través de sitios de la membrana cuyo ordenamiento lipídico es alterado por la inserción de la AH (12). Existe la posibilidad de que la toxina, por lo tanto, actúe sobre las células despolarizando sus membranas e interfiriendo de ésta manera con la fisiología celular; como consecuencia del aumento ulterior en tamaño de la lesión, pueden escapar metabolitos esenciales para la célula (19), y sobrevenir, ya sea lisis osmótica, o escape al exterior de porciones citoplásmicas (21). En eritrocitos, esta elevación del calcio citoplásmico se asocia a cambios en el citoesqueleto que afectan la morfología celular, y que se pueden inducir exponiendo los eritrocitos a ionóforos de calcio (8).
Algunos de los efectos de la AH en PMN son similares a los causados por el ionóforo A23187 . Entre ellos se encuentran la respuesta quimioluminiscente (22) la producción de metabolitos de araquidonato (17) y la degranulación celular (19, 21). Por lo tanto, la elevación en el calcio citoplásmico de PMN y MN causada por AH, y reportada por primera vez en este estudio, es relevante. Tal elevación es similar en magnitud a la causada por los ionóforos de calcio ionomicina y 4Br A23187, tal y como se señala en las leyendas de las figuras 1 y 2.
La elevación del calcio citoplásmico en PMN se manifiesta a dosis hemolíticas bajas de 0,1 HU50/ml en PMN. Esta observación es congruente con hallazgos previos que muestran que el volumen celular medio de PMN aumenta cuando se les expone a esa dosis hemolítica (21), indicando que la célula ha entrado en equilibrio Donnan en razón del flujo iónico a través de la membrana. También concuerda con la observación previa (14) de que marcadores de mayor peso molecular, como el propidio, no ingresan a PMN expuestos a esa dosis de hemolisina, probablemente porque el tamaño inicial de la lesión de membrana no permite su paso.
La hemolisina (2 HU50/ml) no indujo la liberación del calcio de reservas intracelulares de PMN, lo que se evidencia ya que la quelación del calcio externo, con células resuspendidas en HNC, no causó fluorescencia alguna, como sí la indujo el ionóforo de calcio 4Br A23187. Sin embargo, debe tomarse en cuenta que la quelación de calcio externo incrementa el daño causado por AH a la membrana (14), y el daño en la membrana a esta dosis hemolítica podría interferir con una posible movilización de calcio interno a dosis hemolíticas menores. Estas observaciones evidencian también que es la entrada de calcio externo la responsable de la mayor parte del incremento en fluorescencia observado en células expuestas a AH y a los ionóforos de calcio.
A dosis hemolíticas mayores de 2 HU50/ml la señal fluorescente decae en PMN pero no en MN. Es posible que la disminución en la señal de PMN se deba al escape del fluorocromo a través de las lesiones en la membrana, que al aumentar en tamaño permiten el paso de moléculas de mayor peso molecular (14, 19).
La detección de actividad de MPO en sobrenadantes de PMN expuestos a hemolisina y otros estímulos revela que el incremento en calcio interno, como es de esperarse, fuerza la degranulación de PMN, en concordancia con datos previos (21), que muestran evidencia de tal degranulación como disminución de la granularidad citoplásmica de PMN, medida por citometría de flujo.
En resumen, la evidencia obtenida en este estudio demuestra por primera vez que la AH causa elevaciones del calcio citoplásmico en PMN y MN, y en conjunto con observaciones previas, reitera el papel fundamental que tales elevaciones cumplen en las respuestas celulares al efecto de la hemolisina.
Referencias
1) Cavalieri, S.J., Bohach, G.A., Snyder, I.S. Escherichia coli alpha hemolysin: characteristics and probable role in pathogenicity. Microbiol Rev 1984; 48: 326- 343. [ Links ]
2) Welch, R.A., Dellinger, E.P., Minshew, B., Falkow, S. Haemolysin contributes to virulence of extra-intestinal E. coli infections. Nature 1981; 294:665-667. [ Links ]
3) Minshew, B.H., Jorgensen, J., Counts, G.W., Falkow, S. Association of hemolysin production, hemagglutination of human erythrocytes, and virulence for chicken embryos of extraintestinal Escherichia coli isolates. Infect Immun 1978; 20:50-54 [ Links ]
4) Welch, R.A. Holistic perspective on the Escherichia coli hemolysin. En Miller,V.I, Kaper, J.B., Portnoy, D.A., Isberg, R.R. (eds.) "Molecular Genetics of Bacterial Pathogenesis", American Society for Microbiology, Washington, D.C.; 1994 :351-364. [ Links ]
5) Issartel, J.P., Koronakis, V., Hughes, C. Activation of Escherichia coli prohaemolysin to the mature toxin by acyl carrier protein-dependent fatty acylation. Nature 1991; 351: 759-761. [ Links ]
6) Bohach, G.A., Snyder, I.S. Chemical and immunological analysis of the complex structure of Escherichia coli alpha hemolysin. J Bacteriol 1985; 164: 1071-1080. [ Links ]
7) Rennie, R.P., Freer, J.H., Arbuthnot, J.P. The kinetics of erythrocyte lysis by Escherichia coli haemolysin. J Med Microbiol 1974; 7:189-195. [ Links ]
8) Jorgensen, S.E., Hammer, R.F., Wu, G.F. Effects of a single hit from the alpha hemolysin produced by Escherichia coli on the morphology of sheep erythrocytes. Infect Immun 1980; 27: 988-994. [ Links ]
9) Jorgensen, S.E., Mulcahy, P.F., Wu, G.K., Louis, C.F. Calcium accumulation in human and sheep erythrocytes that is induced by Escherichia coli hemolysin. Toxicon 1983; 21:717-727. [ Links ]
10) Benz, R, .Schmid, A., Wagner, W., Goebel, W. Pore formation by the Escherichia coli hemolysin: evidence for an association-dissociation equilibrium of the pore-forming aggregates. Infect Immun 1989; 57: 887-895. [ Links ]
11) Bhakdi, S., Mackman, N., Nicaud, J.M., Holland, I.B. Escherichia coli hemolysin may damage target cell membranes by generating transmembrane pores. Infect Immun 1986; 52: 63-69. [ Links ]
12) Soloaga, A., Veiga, M.P., García-Segura, L.M., Ostolaza, H., Brasseur, R., Goñi, F.M. Insertion of Escherichia coli alpha hemolysin in lipid bilayers as a non-transmembrane integral protein: prediction and experiment. Mol Microbiol 1999; 31: 1013-1024. [ Links ]
13) Klausner, R.D., Fishman, M.C., Karnovsky, M.J. Ionophore A23187 disrupts membrane structure by modifying protein-lipid interactions. Nature 1979; 281: 82-83. [ Links ]
14) García, J.D. Detección del efecto citotóxico de la alfa hemolisina de E. coli (Hly A) en leucocitos polimorfonucleares neutrófilos mediante citometría de flujo. Rev Cost Cienc Med (En prensa) [ Links ]
15) Campbell, A.K. Calcium as an intracellular regulator. En Nordin, B.E.C. (ed.) Calcium in Human Biology, Springer-Verlag, Berlin, Heidelberg; 1988: 261-316. [ Links ]
16) Keane, W.F., Welch, R.A., Gekker, G., Peterson, P.K. Mechanism of Escherichia coli alpha hemolysin induced injury to isolated renal tubular cells. Am J Pathol 1987; 126:350-357. [ Links ]
17) Suttorp, N., Seeger, W., Zucker-Reimann, Lutz, F., Bhakdi, S. Stimulation of leukotriene B4 and prostacyclin formation in granulocytes and cultured endothelial cells by channel forming bacterial toxins: new aspects of stimulus response coupling. Adv Inflammation Res 1986; 10: 333-335. [ Links ]
18) Cavalieri, S.J., Snyder, I.S. Effect of Escherichia coli alpha hemolysin on human peripheral leukocyte function in vitro. Infect Immun 1982; 37: 966-974. [ Links ]
19) Bhakdi, S., Greulich, S., Muhly, M., Eberspacher, B., Becker, H., Thiele, A., Hugo, F. Potent leukocidal action of Escherichia coli hemolysin mediated by permeabilization of target cell membranes. J Exp Med 1989; 169: 737-754. [ Links ]
20) Ardekani, A.M., Van Dyke, K. Myeloperoxidase involvement in PMA-induced chemiluminiscence in retinoic acid-differentiated HL-60 cells. Microchem J 1989; 39:317-329. [ Links ]
21) García, J. Medición del aumento en volumen celular inducido por alfa hemolisina de E. coli (Hly A) en leucocitos polimorfonucleares neutrófilos: efecto del calcio extracelular. Rev Cost Cienc Med 1999; 20: 141-152. [ Links ]
22) García; J. Caracterización de la respuesta quimioluminiscente de neutrófilos humanos a la hemolisina alfa de Escherichia coli. Rev Cost Cienc Med 2000; 21:.31-42). [ Links ]
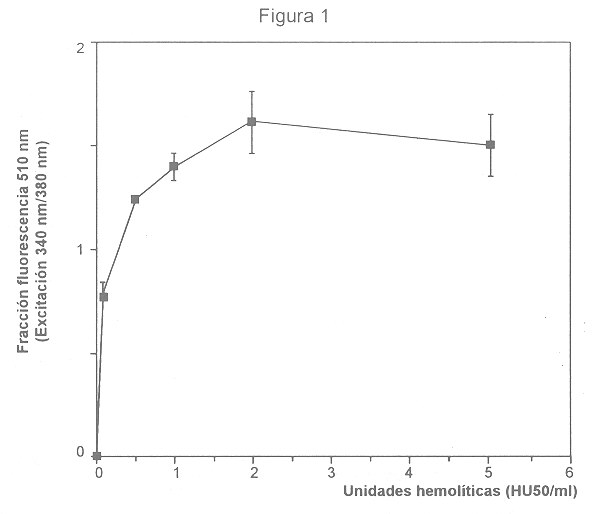
Figura 1. Incrementos en calcio citoplásmico en PMN.
Los niveles basales de fluorescencia de PMN (2 x 106 /ml) conteniendo fura 2 se midieron con excitación intermitente a
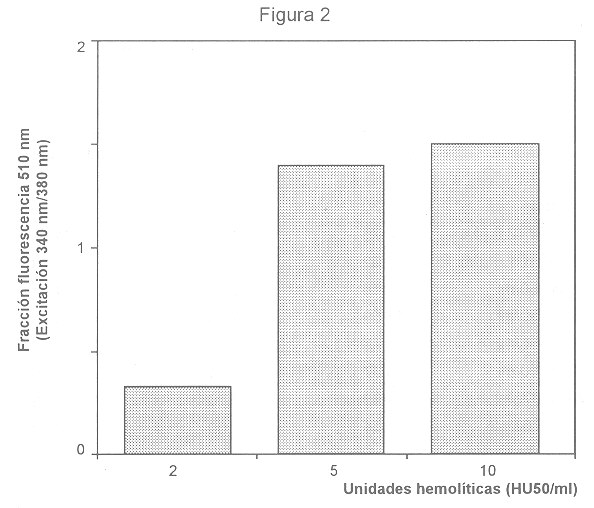
Figura 2. Incrementos en calcio citoplásmico en monocitos.
La fluorescencia basal de monocitos (3 células) con fura 2 incorporado, y adheridos a cubreobjetos, se midió con excitación intermitente a 340 y 380 nm y emisiones detectadas a
510 nm. Las células se estimularon con sobrenadante hemolítico o no hemolítico, o con 4 µM del ionóforo de calcio ionomicina, y se registraron los cambios en fluorescencia. El gráfico ilustra valores máximos de la fracción f = emisión
510nm (excitación 340 nm) / emisión
510 nm ( excitación 380 nm), menos la fluorescencia basal, luego de 5 minutos de exposición. Los sobrenadantes no hemolíticos causaron in incremento en fluorescencia de 0,1 y el ionóforo de calcio ionomicina (4 µM) causó un incremento en fluorescencia de 1,48. Se ilustran resultados de un experimento representativo de 3 realizados.
| Tratamiento | |
| | |
| | | | |
| Control | | | |
| A23187 (2,0 µM) | | | |
| FMLP ( 1,6 µM) | | | |
| 2 HU50/ml | | | |
| 5 HU50/ml | | | |
| 10 HU50/ml | | | |
| 20 HU50/ml | | | |
| WAM 6755 | | | |
| WAM 7835 | | | |
| | |||
1 El ensayo midió la quimioluminiscencia generada cuando el OCl -, producto de la acción de MPO sobre H2O2 y Cl -, reaccionó con luminol (según Materiales y Métodos).
2 cpm x 10 -6 ; los valores son promedios de mediciones por duplicado en un experimento representativo de 4 que proporcionaron resultados similares.
4 ( Sin inhibidor – Con inhibidor)
5 Sobrenadantes no hemolíticos, de los que se añadió un volumen equivalente a 10 HU50/ml de sobrenadante hemolítico.
* Departamento de Bioquímica. Escuela de Medicina.
Universidad de Costa Rica













