Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.20 n.1-2 San José Jun. 1999
Resumen
Brucella abortus es un parásito intracelular capaz de infectar una gran variedad de mamíferos incluyendo al hombre. Esta bacteria provoca su internalización en células epiteliales induciendo rearreglos locales del esqueleto celular. Una vez en el interior de la célula hospedero, Brucella reside inicialmente en un compartimiento temprano de la cascada de endocitosis/ fagocitosis; sin embargo, rápidamente el patógeno se desliga de este mecanismo de transporte intracelular y se asocia a la cascada de autofagocitosis. En los estadíos tardíos de la infección Brucella prolifera en el retículo endoplasmático de las células infectadas. Las brucelas poseen un sistema regulador de la transcripción de genes de virulencia formado por una proteína sensora de membrana y una proteína reguladora citoplasmática: este sistema de dos componentes permite a las bacterias adaptarse a los diferentes microámbientes por los cuales transita durante el proceso de infección intracelular. Estas propiedades biológicas podrían favorecer el uso de Brucella abortus como modelo útil para el diseño de vacunas recombinantes.
Palabras clave
Brucella abortus, Parásito, Tráfico intracelular, Fagosoma, Autofagocitosis, Retículo endoplasmático, Sistema regulador, Lipopolisacárido, Péptidos canónicos, Vacuna recombinante.
Abstract
Brucella abortus is an intracellular parasite that infects a broad range of mammals, including humans. This bacterium promotes its own internalization in epithelial celis inducing local cytoskeletal rearrangements. Within the intracelular space, Brucella locates initially to an early compartment of the endocytic/phagocytic cascade; however, the pathogen rapidly escapes from this intracellular pathway and associates to the autophagocytic cascade. During the late stages of infection, Brucella proliferases within the endoplasmic reticulum of infected celis. Brucellae posses a system for the regulated transcription of virulence genes that includes a sensor transmembrane protein and a cytoplasmic regulatory protein: this two-component regulatory complex allows the bacteria to adapt to the different microenvironments that the parasite confront at each step during the process of intracelular infection. These biological properties might favor the use of Brucella abortus as a recombinant vaccinal vector.
Keywords
Brucella abortus. Parasite. lntracellular trafficking. Phagosome. Autophagocytosis. Endoplasmic reticulum. Regulatory system. Lipopolysaccharide. Cationic peptides. Recombinant vaccine
Introducción
A lo largo de la evolución, bacterias pertenecientes a diferentes taxones han desarrollado mecanismos diversos de supervivencia en asociación a células eucariotas (1). Si bien algunas de estas asociaciones han dado origen a relaciones simbióticas (la mitocondria es un ejemplo extremo de una interacción de este tipo), muchas especies bacterianas han explotado el espacio intracelular en detrimento de la célula hospedera (2). Patógenos tan importantes como Mycobacterium tuberculosis, Salmonella typhi, Shigella dysenteriae, Listeria monocytogenes o Legionella pneumophila son sólo algunos de los muchos parásitos que han desarrollado la capacidad de invadir y proliferar en las células del huésped (3). Por esta razón, un gran esfuerzo se realiza actualmente en investigación biomédica básica para comprender los mecanismos de adaptación que han permitido a estos microorganismos el conquistar el nicho intracelular, esto con el fin de desarrollar nuevos tratamientos terapéuticos que faciliten el control de las enfermedades causadas por estos agentes infecciosos (esta estrategia es indispensable tomando en cuenta la emergencia de cepas bacterianas altamente virulentas y resistentes a los antibióticos más poderosos del mercado farmacéutico actualmente [4]).
Brucella abortus es un patógeno intracelular gram negativo, agente de una zoonosis conocida como Fiebre del Mediterráneo (o brucelosis) que acarrea importantes pérdidas económicas anualmente y que afecta a un número importante de seres humanos a lo largo del mundo (5). La etiología de la brucelosis se conoce relativamente bien (6): las bacterias invaden al organismo huésped a través de membranas como la conjuntiva o a través de mucosas como el tracto digestivo; las brucelas son internalizadas entonces por células fagocíticas del sistema inmune que acarrean a estos patógenos hacia los nodos linfáticos; en estas estructuras los parásitos pueden asociarse a polimorfonucleares y macrófagos circulantes que poseen la capacidad de distribuir finalmente estos microorganismos en sus tejidos blanco (los órganos sexuales en el caso de-los huéspedes primarios -como ciertos ungulados domésticos- y el sistema reticuloendotelial en el caso de los huéspedes secundarios como el hombre). En los individuos grávidos, Brucella alcanza el útero e invade a los trofoblastos, donde la bacteria prolifera masivamente ocasionando el aborto; en otros individuos la infección induce esterilidad o conduce a una extensiva septicemia (7-9).
Los miembros del género Brucella están estrechamente relacionados en el plano filogenético con patógenos peri- o intracelulares como Agrobacterium tumefasciens, Rhizobium meliloti o Bartonella quintana, capaces de parasitar tanto células vegetales como animales (10, 11). Sin embargo, muchas de las adaptaciones que permiten a estos microorganismos el proliferar en asociación a células eucariotas no se conocen con exactitud en la actualidad. En el presente trabajo discuto algunos de los hallazgos recientes a nivel molecular que permiten una mejor comprensión de la supervivencia de Brucella en el ambiente intracelular de sus células hospedero.
Invasión de las células hospedero
Las etapas iniciales de adhesión e invasión de las células eucariotas por parte de Brucella han sido poco caracterizadas hasta el momento. Estructuras tales como pilis o fimbrias, necesarias para la adhesión de otros patógenos gram negativos (como Escherichia coli uropatogénica o Neisseria gonorrhoeae) a sus sustratos respectivos (12), no han sido descritas en el género Brucella. Tampoco se han puesto en evidencia proteínas bacterianas que puedan mediar la internalización de este parásito en sus células hospedero, como sí se ha hecho en el caso de patógenos como Listeria monocytogenes o Yersinia pestis, donde las proteínas de las familias internalinas e invasinas, respectivamente, favorecen la adhesión y la invasión de estas bacterias en células epiteliales (13, 14). Algunas de estas proteínas de invasión poseen la capacidad de asociarse con moléculas eucariotas que normalmente son necesarias en interacciones de adhesión intercelular: así, se ha demostrado que la internalina A de Listeria monocytogenes reconoce específicamente a la molécula caderina E, que participa en la formación de uniones fuertes entre las membranas basolaterales de células de la pared intestinal (15, 16); igualmente, la invasina de Yersinia pestis interactúa con la molécula integrina alfa-5-beta-1, necesaria en el proceso de fijación de la matriz extracelular a ciertas células epiteliales (17, 18). En el caso de Brucella, se ha sugerido recientemente que la cepa vacunal de Brucella abortus RB51 es capaz de invadir trofoblastos bovinos precisamente a través de su adhesión a la molécula integrina alfa-5-beta-1 (19); sin embargo, esta observación no ha podido repetirse en otros laboratorios (20).
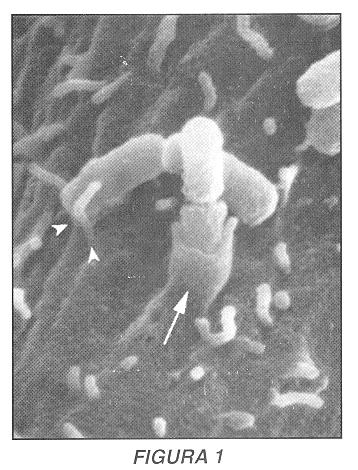
La célula eucariota juega un papel activo importante en el proceso de invasión de patógenos intracelulares, gracias a una fina manipulación de la arquitectura celular por parte de los parásitos (21). Así, gracias a la inyeción de proteínas bacterianas en el citoplasma de la célula huésped a través de un sistema especializado de secreción denominado sistema de secreción de tipo III (22)- bacterias como Shigella flexneri o Salmonella typhimurium inducen repliegues importantes en la membrana de la célula blanco que permitirán la formación de una gran vacuola en la cual estos parásitos son internalizados (23, 24). Brucella abortus, por el contrario, reorganiza sólo localmente la membrana celular en el punto de contacto entre la bacteria y su célula blanco (Figura 1) (25), utilizando un mecanismo de invasión llamado 'fagocitosis por cremallera', observado igualmente durante los procesos de internalización de Listeria monocytogenes y Yersinia pestis (26). De los tres elementos que conforman el esqueleto celular -los filamentos intermedios, los microtúbulos y el citoesqueleto de actina-, se ha podido demostrar que los dos últimos juegan un rol importante durante el -proceso de invasión de Brucella: en efecto, cuando se tratan células blanco con la citocalacina D -un inhibidor de la polimerización de la actina- o con el nocodazol -un inhibidor de la polimerización de la tubulina- se inhibe significativamente la entrada de las brucelas (20, 25).
Tráfico intracelular
La internalización de material extracelular se lleva a cabo en la célula gracias a una serie de mecanismos que se han denominado conjuntamente bajo el nombre de endocitosis o fagocitosis, dependiendo de la naturaleza y las dimensiones del material internalizado (27, 28). Estos procesos implican una compleja interacción del material internalizado con diferentes poblaciones de compartimientos intracelulares definidos por criterios morfológicos, topológicos y/o estructurales (29, 30). Así, luego de interactuar con la superficie celular, el material endocitado (o fagocitado) entra en contacto con una red dinámica de túbulos y vesículas conocida con el nombre de endosomas tempranos: en estos compartimientos se clasifica y se ordena el material extracelular, permitiendo el reciclaje de ciertos elementos (como receptores) a la membrana celular (31). En seguida, el material extracelular continúa su internalización interactuando con una serie de compartimientos reticulares localizados principalmente en la región perinuclear de la célula y que se denominan endosomas tardíos: en estas estructuras se inicia la degradación de una gran parte del material endocitado (32). Sin embargo, no es sino en los lisosomas -estructuras densas con un bajo pH intraluminal- donde se acumula y degrada totalmente el material que proviene de la cascada de endocitosis/ fagocitosis, gracias a la presencia de proteasas, nucleasas y hexosaminidasas con alto poder hidrolítico (33).
Algunos patógenos intracelulares destruyen rápidamente la membrana,de sus vacuolas de internalización y proliferan libremente en el citoplasma de la célula hospedero, evitando el contacto con el sistema de degradación celular (es el caso de Listeria monocytogenes, Shigella flexneri y Rickettsia [34]). Sin embargo, un gran número de parásitos permanecen asociados a estructuras intracelulares delimitadas por membranas, lo que ha obligado a estos microorganismos a desarrollar estrategias diversas para evitar su destrucción en los compartimientos profundos de la cascada de endocitosis/ fagocitosis (35). Así, Mycobacterium tuberculosis es internalizado en un compartimiento con características iniciales de endosoma temprano; sin embargo, la bacteria modifica posteriormente las propiedades fusogénicas de esta estructura impidiendo que el fagosoma se transforme en endosoma tardío o lisosoma, y el microorganismo prolifera de esta forma en un nicho desligado completamente de los sistemas de transporte intracelular (36, 37). Salmonella typhimurium, por el contrario, no inhibe la maduración de su compartimiento de internalización, el cual eventualmente es transformado en un lisosoma; sin embargo, Salmonella ha desarrollado mecanismos de supervivencia que le permiten proliferar aún en presencia de enzimas de degradación (38): uno de sus más importantes mecanismos de adaptación es un sistema regulador que permite a la bacteria ser sensible a cambios en el medio ambiente -como variaciones de pH o fluctuación en la concentración de iones divalentes- y modificar, en respuesta a estos cambios, la estructura de su membrana externa para así resistir la acción lítica de las enzimas celulares (39).
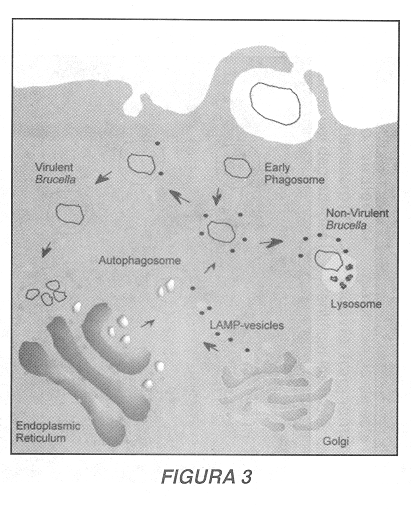
Recientemente, el tráfico intracelular de la cepa virulenta Brucella abortus 2308 y de la cepa atenuada B. abortus 19 ha sido estudiado exhaustivamente a través del empleo de la microscopía electrónica de transmisión y la microscopía confocal utilizando como modelo de infección la línea celular humana HeLa (40, 41). Durante los primeros minutos de su internalización las brucelas residen en estructuras caracterizadas por la presencia de marcadores típicos de endosomas tempranos tales como la proteína rab5, una molécula perteneciente a la subfamilia de GTPasas Rab conocida por regular la vectorialidad en el transporte de compartimientos intracelulares (rab5 es específica de endosomas tempranos y regula la fusión homotípica de estas estructuras, mientras que rab7 se localiza en endosomas tardíos y regula la fusión heterotípica de estos compartimientos con los lisosomas [42]). Posteriormente, luego de 30 minutos de internalización, las brucelas (tanto la cepa vacunal como la cepa virulenta) se desligan progresivamente de la cascada de endocitosis: los marcadores de endosomas tempranos (como rab5 y el receptor de la transferrina) desaparecen del compartimiento bacteriano, y no se observa en estas estructuras la aparición de marcadores de endosomas tardíos (como rab7 o el receptor de la manosa6-fosfato). Por el contrario, las bacterias se localizan en una estructura atípica caracterizada por la presencia de la proteína lisosomal LAMP ('Iisosomal-associated membrane protein': proteína de membrana asociada a los lisosomas'), estructura que a su vez carece de enzimas de degradación como la catepsina D, lo que sugiere que las brucelas interatúan con un compartimiento de naturaleza no lisosomal (41).
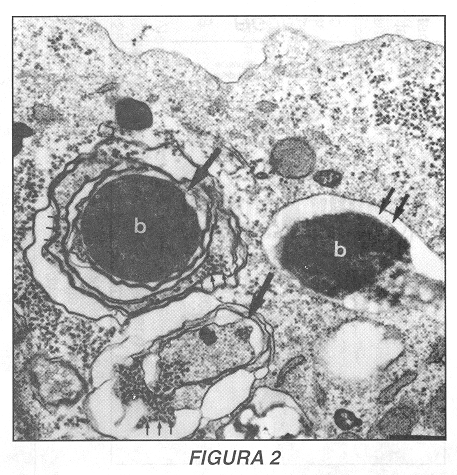
Morfológicamente, el compartimiento que contiene las brucelas durante esta etapa del proceso de infección es una estructura multilamelar con muchas similitudes a las vacuolas autofagocíticas tempranas (Figura 2) (40). Los autofagosomas son organelas generadas cuando el suministro extracelular de materia prima para la síntesis de proteínas disminuye significativamente: en estas circunstancias la autofagocitosis permite a la célula generar nuevos aminoácidos y péptidos a partir del reciclaje de moléculas citoplasmáticas (43). Los compartimientos autofagocíticos aparecen gracias a la invaginación de membranas del retículo endoplasmático alrededor de organelas y solutos; las vacuolas multilamelares así formadas maduran gradualmente hasta fusionar con los lisosomas, donde se degradará el material aislado para su reciciaje intracelular (44, 45). La interacción entre Brucella y la cascada de autofagocitosis esta sustentada por varias evidencias (41): primero, y como se acaba de mencionar anteriormente, el compartimiento que contiene al parásito posee morfológicamente las características de un autofagosoma (multiples membranas en una sola estructura vacuoiar); segundo, una molécula con capacidad de acumularse específicamente en los autofagosomas -la monodansilcadaverina (46)- se acumula igualmente en las vacuolas bacterianas; tercero, una molécula característica del retículo endoplasmático -el translocador sec61 (47)- se localiza también en el fagosoma bacteriano, lo que sugiere que en efecto esta estructura se origina en el retículo endoplasmático; finalmente, la modulación de la autofagocitosis gracias al tratamiento con drogas como la 3-metiladenina (que inhibe la formación de autofagosomas [48]) o a la depleción de aminoácidos (que aumenta la formación de autofagosomas [49]) conduce de la misma manera a una modulación en el crecimiento intracelular de las brucelas (40). La presencia de la molécula lisosomal LAMP en los autofagosomas (y en la vacuola bacteriana) sugiere que esta proteína puede interactuar directamente con otros sistemas de transporte intracelular probablemente gracias a una comunicación directa entre la cascada de autofagocitosis y el aparato de Golgi (a partir de donde LAMP es distribuida a las organelas intracelulares [50]). Estas observaciones sugieren entonces que, luego de un pasaje transitorio por los compartimientos precoces de la cascada de endocitosis/fagocitosis, las brucelas interactúan con la cascada de autofagocitosis y residen en autofagosomas multilamelares. Sin embargo, esta estructura no constituye el nicho final de proliferación (o de degradación) de B. abortus.
En efecto, durante los períodos tardíos de la infección (24 horas luego de la inoculación de las bacterias en las células huésped), se observa una diferencia importante en el tráfico de la cepa virulenta y de la cepa atenuada de Brucella (41). La cepa atenuada 19, luego de transitar por los autofagosomas, colocaliza con los lisosomas ricos en catepsina D y las bacterias presentan a partir de este momento una morfología irregular, lo que sugiere que esta cepa no es capaz de detener la maduración de las vacuolas autofagocíticas, que finalmente fusionan con los lisosomas, lo que conduce a una degradación de las brucelas atenuadas. Por otra parte, la cepa virulenta 2308 presenta una trayectoria distinta: el compartimiento bacteriano pierde el marcaje LAMP, lo que sugiere que esta brucela transita a partir de los autofagosomas hacia un nueva estructura intracelular. La presencia de la proteína sec61 en este nuevo compartimiento indica que este está relacionado con el retículo endoplasmático. Un análisis detallado demuestra que otros marcadores del retículo endoplasmático como lo son la proteína disulfuro isomerasa o el chaperón molecular calnexina también están presentes en el compartimiento bacteriano, donde se observa en este momento la proliferación de Brucella (41). Estos datos sugieren entonces que la cepa virulenta 2308 logra inhibir la maduración de los autofagosomas y gracias a un mecanismo de transporte retrógrado logra alcanzar el retículo endoplasmático (a partir del cual los autofagosomas se originan) y prolifera finalmente en este nicho intracelular (Figura 3) (41). Otras evidencias confirman esta hipótesis: el tratamiento de células infectadas con la droga proaerolisina de Aeromonas hydrophila, que normalmente induce una vacuolización específica del retículo endoplasmático (51), conduce a la vacuolización del compartimiento de proliferación de Brucella. Igualmente, el tratamiento de células infectadas con la droga brefeldina A, que induce la reorganización del aparato de Golgi sobre el retículo endoplasmático (52), conduce a una reorganización de las cisternas golgianas sobre el compartimiento de replicación de la cepa 2308 (41).
El mecanismo molecular que permite a las brucelas el inducir el transporte retrógrado de su compartimento autofagocítico hacia el retículo endoplasmático no se conoce actualmente. Evolutivamente esta estrategia de supervivencia parece exitosa ya que otro parásito intracelular, Legionella pneumophila, ha desarrollado un mecanismo similar de proliferación en células fagocíticas del sistema inmune (53). Toxoplasma gondii igualmente prolifera en última instancia en el retículo endoplasmático de las células huéspedes (54). Estos parásitos intracelulares probablemente aprovechan la, maquinaria biosintética presente en el retículo endopiasmático para obtener aminoácidos y/o péptidos que pueden ser utilizados como nutrientes (55). Igualmente, este nicho esta totalmente aislado de los mecanismos de degradación celular asociados a la cascada de endocitosis/ fagocitosis, lo que permite una proliferación no restringida de estos microorganismos, que eventualmente lisan mécanicamente a las células huéspedes a partir de períodos superiores a las 72 horas de inoculación (40).
Adaptación a los parámetros físico-químico-biológicos del medio intracelular
Brucella posee un estrategia de supervivencia intracelular que le permite evadir el contacto con los compartimientos de degradación celulares gracias a una interacción breve con los endosomas tempranos y a un tránsito retrógrado por la cascada de autofagocitosis para finalmente proliferar en el retículo endoplasmático de la célula huésped (40, 41). En todas estas etapas las bacterias tienen que ser capaces de reaccionar a cambios en los parámetros físico/químico/biológicos del medio intracelular (tales como acidez, presión osmótica, concentración de iones divalentes y/o actividad enzimática, por ejemplo) que permitan a estos microorganimos determinar su precisa ubicación intracelular y así poder expresar los genes adecuados para la supervivencia en cada uno de los diferentes contextos por los cuales transitan las brucelas.
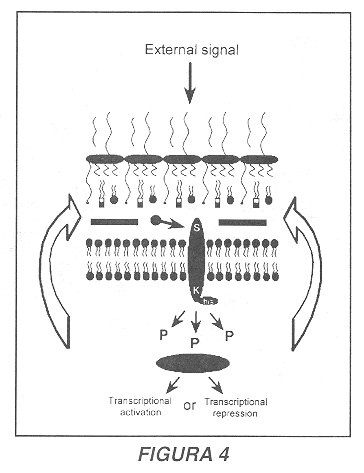
Una adaptación que permite a Brucella hacer frente a estos cambios es la presencia de un sistema regulador de dos componentes que confiere a la bacteria la capacidad de percibir variaciones en el microambiente externo y adaptarse a los nuevos parámetros ambientales (56). Este sistema, denominado BvrS/R ('Brucella virulence-related sensor and regulator': sensor y regulador asociados a la virulencia de Brucella) consta de dos proteínas: una molécula sensora de membrana que tiene acceso al espacio periplasmático de la membrana externa, y una molécula reguladora citoplasmática. Frente a cambios en los parámetros externos, el dominio externo del sensor expuesto en la región periplasmática sufre un cambio conformacional que induce una autofosforilación de la proteína, gracias a la presencia de un dominio interno que posee una actividad enzimática histidina quinasa. El grupo fosfato ubicado sobre el residuo histidina es enseguida transferido a un residuo aspartato presente en el regulador citoplasmático, que adquiere entonces la capacidad de actuar como activador o como represor transcripcional (Figura 4) (56, 57). Sistemas similares han sido descritos en otros patógenos intracelulares, y uno de los mejor documentados es el regulador PhoP/PhoQ de Salmonella typhimurium, que es activado por una disminución en la acidez del compartimiento bacteriano, así como por una disminución en la concentración de iones divalentes como el calcio y el magnesio (58, 59). Estos estímulos conducen, entre otros efectos, a una modificación en la estructura del lípido A de la molécula de lipopolisacárido, lo que confiere a Salmonella la resistencia a moléculas microbicidas como los péptidos canónicos (60).
En el caso del sistema BvrS/R de Brucella abortus, todavía no se conocen los estímulos que llevan a su activación; sin embargo, se ha observado que la mutación de tanto la proteína sensora como de la proteína reguladora conducen a un cambio en las propiedades biológicas de la membrana externa de Brucella y afectan profundamente la virulencia estos microorganismos (56). La membrana externa de Brucella juega, en efecto, un papel preponderante en la virulencia y en la supervivencia intracelular de estos parásitos: esta membrana es permeable a hormonas hidrofóbicas (61) pero es resistente a antibióticos canónicos presentes en los gránulos azuráfilos de células fagocíticas del sistema inmune (62). El lipopolisacárido (LPS) de la membrana es el principal responsable de esta resistencia, como ha podido demostrarse en experimentos en los cuales se ha transferido el LPS de brucelas resistentes a bacterias sensibles a la acción microbicida de los péptidos canónicos: las bacterias receptoras adquieren el fenotipo resistente (63). El LPS de Brucella presenta igualmente otras propiedades biológicas particulares: es una molécula muy poco tóxica en relación a las endotoxinas de enterobacterias (64) y su internalización en células fagocíticas del sistema inmune es lenta (65), lo que representa claras adaptaciones a la vida intracelular.
Las bacterias mutantes del sistema BvrS/R se adhieren en forma aparentemente inspecífica a la superficie de las células blanco y poseen una limitada capacidad para invadirlas; igualmente, estos mutantes son altamente sensibles a la acción microbicida de péptidos canónicos, lo que sugiere que la estructura de la membrana externa de estas bacterias está particularmente alterada (56). Como el LPS es el principal responsable de la resistencia a los péptidos canónicos, el sistema BvrS/R probablemente controla los elementos estructurales del lipopolisacárido necesarios a esta resistencia, lo que permite aproximar funcionalmente este sistema al regulador PhoP/PhoQ de Salmonella (60).
El sistema BvrS/R es también necesario para un adecuado tráfico intracelular de las brucelas: los mutantes de este sistema son incapaces de acceder a los autofagosomas y son rápidamente degradados en lisosomas ricos en catepsina D (41). Esta observación sugiere que, tal y como se ha demostrado en el caso de otros sistemas reguladores de dos componentes, el sistema BvrS/R probablemente regula un vasto grupo de genes cuyas funciones todavía deben caracterizarse. En efecto, se ha observado que cuando Brucella prolifera en el medio intracelular, el patrón de expresión de al menos 147 proteínas cambia con respecto al patrón de proteínas expresadas en el medio de cultivo (66, 67). Una compleja regulación génica debe acompañar claramente el paso del medio extracelular al medio intracelular, y varios laboratorios se dedican actualmente a caracterizar los estímulos que activan esta regulación, así como los genes que son activados en cada una de las distintas etapas del proceso de infección.
Vacunas recombinantes: una nueva perspectiva en el estudio del parasitismo intracelular
El estudio de los mecanismos patogénicos de parásitos intracelulares está suministrando herramientas moleculares que permiten caracterizar las funciones fundamentales de las células procariotas y eucariotas (68-70). Recientemente, estas herramientas comienzan a ser empleadas en el campo de la investigación aplicada, particularmente en la producción de vacunas (71). Por ejemplo, la propiedad de Listeria monocytogenes de romper su vacuola de internalización y de proliferar en el espacio citoplasmático de las células hospedero ha favorecido el uso de bacterias recombinantes atenuadas que fungen como vectores para dirigir antígenos tumorales o virales al citoplasma de las células hospedero (72). Estas moléculas pueden ser degradadas y transportadas al retículo endoplasmático, donde se asocian a las proteínas del complejo mayor de histocompatibilidad de clase I; los antígenos así procesados pueden posteriormente ser presentados en la superficie de la célula hospedero a linfocitos T citotóxicos, cuya activación es capaz de inducir la regresión de tumores (73). Un principio similar ha sido utilizado para controlar infecciones virales mediante la manipulación del sistema de secreción de tipo III de Salmonela typhimurium: cepas recombinantes atenuadas de este patógeno son capaces de inyectar antígenos del virus de la coriomeningitis en el citoplasma de células hospederas de ratón y así proteger a este animal de una infección que de otro modo sería mortal (74). La propiedad de Brucella de proliferar en el retículo endoplasmático de las células hospedero podría ser igualmente empleada para dirigir antígenos virales o tumorales hacia las proteínas del complejo de mayor de histocompatibilidad de clase I, gracias al uso de cepas atenuadas de este parásito (75).
Conclusión
Si bien algunas de las adaptaciones más importantes de Brucella a la vida intracelular han sido puestas en evidencia recientemente (su mecanismo de entrada, su tráfico intracelular y su nicho de proliferación en las células eucariotas), la caracterización de la patobiología de este microorganismo es todavía fragmentaria. Es necesario identificar las moléculas bacterianas que inducen la internalización de este patógeno en sus células blanco, así como los receptores celulares asociados a este proceso de invasión; igualmente, debe determinarse la naturaleza de los mecanismos que permiten a este microorganismo el disociarse de la cascada de endocitosis/fagocitosis para asociarse al proceso de autofagocitosis y proliferar finalmente en el retículo endoplasmático de las células hospedero. Sin embargo, las bases genéticas de estas adaptaciones comienzan a conocerse, lo que facilitará la identificación de nuevos factores de virulencia en este modelo de parasitismo intracelular.
Agradecimientos
Agradezco profundamente al Ministerio Costarricense de Ciencia y Tecnología y a la Comisión del Premio Nacional de Ciencia y Tecnología por el reconocimiento al trabajo expuesto en este manuscrito mediante la atribución del Premio Clodomiro Picado Twight 1998. Agradezco igualmente Dr. Enrique Freer Bustamante la invitación a publicar la presente revisión bibliográfica.
Referencias
1.Corsaro D, Venditti D, Padula M, Valassina M. lntracellular life. Crit Rev Microbiol 1999;25:39-79. [ Links ]
2.Pizarro-Cerdá J, Desjardins M, Moreno E, Gorvel JP. When intracellular pathogens invade the frontiers of cell biology and immunology. Histol Histopathol 1997;12:1027-1038. [ Links ]
3.Finlay BB, Falkow S. Common themes in microbial pathogenicity revisite. Mol Biol Microbiol Rev 1997;61:136-169. [ Links ]
4.Binder S, Levitt M, Sacks JJ, Hughes, JM. Emerging infectious diseases: public health issues for the 21 st century. Science 1999;284:1311-1313. [ Links ]
5.Zavala I, Nava A, Guerra J, Quirós C. Brucellosis. Infect Dis Clin N Am 1994;8:225-241. [ Links ]
6.Enright FM. The pathogenesis and pathobiology of Brucella infection in domestic animals. En: Nielsen K, Duncan B editores. Animal brucellosis. Boca Ratón Florida: CRC Press lnc., 1990:301-320. [ Links ]
7.Baldwin CL, Winter AJ. Macrophages and Brucella. Immunol Sem 1994; 60: 363-380. [ Links ]
8.Liautard JP. lnteraction between professional phagocytes and Brucella. Microbiologia 1996;12:197-206. [ Links ]
9.Smith LD, Ficht TA. Pathogenesis of Brucella. Crit Rev Microbiol 1990;17:209-230. [ Links ]
10.Moreno E. Brucella evolution. En: Plommet M editor. Prevention of brucellosis in mediterranean countries. Wageningen: Internacional Centre for Advanced Mediterranean Agronomic Studies, Pudoc Scientific Publishers 1992:198-218. [ Links ]
11. Moreno E, Stackebrandt E, Dorsch M, Wolters J, Brusch M, Mayer M. Brucella abortus 16S rRNA and lipid A reveal a phylogenetic relationship with members of the alpha-2 subdivision of the class Proteobacteria. J Bacteriol 1990; 172:3569-3576. [ Links ]
12.Abraham SN, Jonsson AB, Normark S. Fimbriae-mediated host-pathogen cross-talk. Curr Opin Microbiol 1998;1:75-81. [ Links ]
13.Isberg R, Tran van Nhieu G. The mechanism of phagocytic uptake promoted by invasin-integrin interaction. Trends Cell Biol 1995;5:120-124. [ Links ]
14.Cossart P, Lecuit M. lnteractions of Listeria monocytogenes with mammalian cells during entry and actin-based movement: bacterial factors, cellular ligands and signalin. EMBO J 1998;17:3797-3806. [ Links ]
15.Gaillard JL, Berche P, Frehel C, Gouin E, Cossart P. Entry of Listeria monocytogenes is mediated by internalin, a repeat protein reminiscent of surface antigens from gram-positive cocci. Cell 1991;65:1127-1141. [ Links ]
16.Mengaud J, Ohayon H, Gounon P, Mege MR, Cossart P. E-cadherin is the receptor for internalin, a surface protein required for entry of Listeria monocytogenes into epithelial celis. Cell 1996;84:923-932. [ Links ]
17.Isberg RR, Leong JM. Multiple 1 chain integrins are receptors for invasin, a protein that promoted bacterial penetration into mammalian cells. Cell 1990;60:861-871. [ Links ]
18.Isberg RR, Voorhis DL, Falkow S. Identification o invasin, a protein that allows enteric bacteria to penetrate cultured mammalian cells. Cell 1987;50:769-778. [ Links ]
19.Brees D, Steadham E, Stevens M, Cheville N. Alfa-5-beta-1 integrin mediates Brucella abortus strain RB51 adhesion on bovine trophoblastic celis. Vet Pathol 1996;33:615. [ Links ]
20.Pizarro-Cerdá J, Moreno E, Gorvel JP. Resultados no publicados. [ Links ]
21.Goosney DL, Knoechel DG, Finlay BB. Enteropathogenic E. coli, Salmonella, and Shigella: masters of host cell cytoskeletal exploitations. Emerg Infect Dis 1999;5:216-223. [ Links ]
22.Galan JE, Colimer A. Type III secretion machines: bacterial devices for protein delivery into host cells. Science 1999;284:1322-1328. [ Links ]
23.Goosney DL, de Grado M, Finlay BB. Putting E. coli on a pedestal: a unique system to study signal transduction and the actin cytoskeleton. Trends Cell Biol 1999;9:11-14. [ Links ]
24.Tran van Nhieu G, Sansonetti PJ. Mechanism of Shigella entry into epithelial cells. Curr Opin Microbiol 1999;2:51-55. [ Links ]
25.Pizarro-Cerdá J, Moreno E, Gorvel JP. Brucella abortus: invasion and survival within professional and non-professional phagocytes. En: Tartakoff A, Gordon S editores. Advances in Cell and Molecular Biology of Membranes and Organelles Vol.6: Phagocytosis and Pathogens. Greenwich: JAI Press, 1999:201-232. [ Links ]
26.Dramsi S, Cossart P. lntracellular pathogens and the actin cytoskeleton. Annu Rev Cell Dev Biol 1998; 14:137-166. [ Links ]
27.Mellman I. Endocytosis and molecular sorting. Annu Rev Cell Dev Biol 1996;12:575-625. [ Links ]
28.Riezman H, Woodman PG, van Meer G, Marsh M. Molecular mechanisms of endocytosis. Cell 1997;91:731-738. [ Links ]
29.Desjardins M, Huber LA, Parton RG, Griffiths G. Biogenesis of phagolysosomes proceeds through a sequential series of interactions with the endocytic apparatus. J Cell Biol 1994; 124:677-688. [ Links ]
30.Desjardins M. Biogenesis of phagolysosomes: the 'kiss and run' hypothesis. Trends Cell Biol 1995;5:183-186. [ Links ]
31.Robinson MS, Watts C, Zerial M. Membrane dynamics in endocytosis. Cell 1996;84:13-21. [ Links ]
32.Stoorvogel W, Strous GJ, Geuze HJ, Oorschot V, Schwartz AL. Late endosomes derive from eariy endosomes by maturation. Cell 1991;65:417-427. [ Links ]
33.Cuervo AM, Dice JF. Lysosomes, a meeting point of proteins, chaperons, and proteases. J Mol Med 1998;76:6-12. [ Links ]
34.Theriot JA. The cell biology of infection by intracellular bacteriai pathogens. Annu Rev Cell Dev Biol 1995; 11:213-239. [ Links ]
35.Hackstadt T. The diverse habitats of obligate intracellular parasites. Curr Opin Microbiol 1998;1:82-87. [ Links ]
36.Clemens DL. Characterization of the Mycobacterium tuberculosis phagosome. Trends Microbiol 1996;4:113-118. [ Links ]
37.Deretic V, Fratti RA. Mycobacterium tuberculosis phagosme. Mol Microbiol 1999;31:1603-1609. [ Links ]
38.García del Portillo F. Interaction of Salmonella with lysosomes of eukaryotic cells. Microbiología 1996;12:259-266. [ Links ]
39.Ernst RK, Guina T, Miller SI. How intracellular bacteria survive: surface modifications that promote resistance to host innate immune responses. J Infect Dis 1999; 179:S326-330. [ Links ]
40.Pizarro-Cerdá J, Moreno E, Sanguedolce V, Mège JL, Gorvel JP. Virulent Brucella abortus avoids lysosome fusion and distributes within autophagosome-iike compartments. Infect lmmun 1998;66:2387-2392. [ Links ]
41.Pizarro-Cerdá J, Méresse S, Parton RG, van der Goot G, Sola-Landa A, López-Goñi I, et al. Pathogenic Brucella abortus transits through the autophagic pathway and replicates in the endopiasmic reticulum of non-professional phagocytes. Infect Immun 1998;66:5711-5724. [ Links ]
42.Mohrmann K, van der Sluijs P. Regulation of membrane transport through the endocytic pathway by rabGTPases. Mol Membr Biol 1999;16:81-87. [ Links ]
43.Mortimore GE, Miotto G, Venerando R, Kadowaki M. Autophagy. Subcell Biochem 1996;27:93-135. [ Links ]
44.Dunn WA. Autophagy and related mechanisms of lysosome-mediated protein degradation. Trends Cell Biol 1994;4:139-143. [ Links ]
45.Lawrence BP, Brown WJ. Autophagic vacuoles rapidly fuse with pre-existing lysosomes in cultured hepatocytes. J Cell Sci 1992;102:515-526. [ Links ]
46.Biederbick A, Kern HF, Elsässer HP. Monodansylcadaverine (MDC) is a specific in vivo marker for autophagic vacuoles. Eur J Cell Biol 1995;66:3-14. [ Links ]
47.High S, Anderson SS, Gorlich D, Hartmann E, Prehn S, Rapoport TA, et al. Sec61 is adjacent to nascent type I and type II signal-anchored proteins during their membrane insertion. J Cell Biol 1993;121:743-750. [ Links ]
48.Seglen PO, Gordon PB. 1982. 3-methyladenine: specific inhibitor of autophagic/lysosomal protein degradation in isolated rat hepatocytes. Proc Natl Acad Sci USA 1982;79:1889-1892. [ Links ]
49.Schworer CM, Shiffer KA, Mortimore GE. Quantitative relationship between autophagy and proteolysis during graded amino acid deprivation of perfused rat liver. J Biol Chem 1981;256:7652-7658. [ Links ]
50.Hunziker W, Geuze HJ. lntracellular traficking of lysosomal membrane proteins. Bio Essays 1995;18:379-388. [ Links ]
51.Abrami L, Fivaz M, Glauser PE, Parton RG, van der Goot FG. A poreforming toxin interacts with a GPI-anchored protein and causes vacuolation of the endopiasmic reticulum. J Cell Biol 1998;140:525-540. [ Links ]
52.Lippencott-Schwartz J, Yuan LC, Bonifacino JS, Klausner RD. Rapid redistribution of Golgi proteins into the endoplasmic reticulum in celis treated with brefeldin A: evidence for membrane recycling from Golgi to ER. Cell 1989;56:801-813. [ Links ]
53.Swanson MS, lsberg RR. Association of Legionella pneumophila with the macrophage endoplasmic reticulum. lnfect Immun 1995;63:3609-3620. [ Links ]
54.Sinai AP, Webster P, Joiner KA. Association of host cel endoplasmic reticulum and mitochondria with the Toxoplasma gondii parasitophorous vacuole membrane: a high affinity interaction. J Cell Sci 1997; 110:2117-2128. [ Links ]
55.Sinai AP, Joiner KA. Safe haven: the cell biology of nonfusogenic pathogen vacuoles. Annu Rev Microbiol 1997;51:415-462. [ Links ]
56.Sola-Landa A, Pizarro-Cerdá J, Grillo JM, Moreno E, Moriyón I, Blasco JM, et al. A two component regulatory system playing a criticai role in plant pathogens and endosymbionts is present in Brucella abortus and controls cell invasion and virulence. Mol Microbiol 1998;29:5265-5273. [ Links ]
57.Gross R. Signal transduction and virulence regulation in human and animal pathogens. FEMS Microbiol Rev 1993;104:301-326. [ Links ]
58.Alpuche-Aranda CM, Swanson JA, Loomis WP, Miller SI. Salmonella typhimurium activases virulence gene transcription within acidified macrophage phagosomes. Proc Natl Acad Sci USA 1992;89:10079-10083. [ Links ]
59.García-Véscovi E, Soncini FC, Groisman EA. Mg2+ as an extracellular signal: environmental regulation of Salmonella virulence. Cell 1996;84:165-174. [ Links ]
60.Guo L, Lim KB, Gunn JS, Bainbridge B, Darveau RP, Hackett M, et al. Regulation of lipid A modifications by Salmonella typhimurium virulence genes phoP-phoQ. Science 1997;276:250-253. [ Links ]
61.Martínez de Tejada G, Moriyón I. The outer membrane of Brucella spp. are not barriers to hydrophobic permeants. J Bacteriol 1993; 175:5273-5275. [ Links ]
62.Martínez de Tejada G, Pizarro-Cerdá J, Moreno E, Moriyón I. The outer membrane of Brucella spp. are resistant to bactericidal cationic peptides. Infect Immun 1995;63:3054-3061. [ Links ]
63.Freer E, Moreno E, Moriyón I, Pizarro-Cerdá J, Weintraub A, Gorvel JP. Brucella/Salmonella -LPS chimeras are less permeable to hydrophobic probes and more sensitiva to cationic peptides and EDTA than their native Brucella spp. counterparts. J Bacteriol 1996; 178:5867-5876. [ Links ]
64.Rasool O, Freer E, Moreno E, Jarstrand C. Effect of Brucella abortus lipopolysaccharide on oxidative metabolism and lysozyme release by human neutrophils. Infect Immun 1992;60:1699-1702. [ Links ]
65. Forestier C, Moreno E, Pizarro-Cerdá J, Gorvel JP. lnternalization, accumulation in lysosomes and recycling of LPS at the cell surtace of murine macrophages. J Immunol 1999;162:6784-6791. [ Links ]
66.Lin J, Fitch TA. Protein synthesis in Brucella abortus induced during macrophage infection. lnfect Immun 1995;63:1409-1414. [ Links ]
67.Rafie-Kolpin M, Essenberg RC, Wyckoff III JH. Identification and comparison of macrophage-induced proteins and proteins induced under various stress conditions in Brucella abortus. Infect Immun 1996;64:5274-5283. [ Links ]
68.Cossart P, Boquet P, Normark S, Rappuoli R. Cellular microbiology emerging. Science 1996;271:315-316. [ Links ]
69.Finlay BB, Cossart P. Exploitation of mammalian host cell functions by bacterial pathogens. Science 1997;276:718-725. [ Links ]
70.Pizarro-Cerdá J, Akira S, Desjardins M, Moreno M, Gorvel JP. Endocytosis modulation in activated NF-IL6 (-/-) Macrophages is responsable for a high susceptibility to B. abortus infection. J Inmunol 1999; 162:3519-3526. [ Links ]
71.Milon G, Cossart P. Live recombinant Listeria monocytogenes as an immunotherapeutic agent for experimental tumors. Trends Cell Biol 1995;3:451-452. [ Links ]
72.Jensen, ER, Shen H, Wettstein FO, Ahmed R, Miller JF. Recombinant Listeria monocytogenes as a live vaccine vehicle and a probe for studying cell-mediated immunity. Immunol Rev 1997; 158:147-157. [ Links ]
73.Weiskirch LM, Paterson Y. Listeria monocytogenes: a potent vaccine vector for neoplastic and infectious disease. Immunol Rev 1997; 158:159-169. [ Links ]
74.Rüssmann H, Shams H, Poblete F, Fu Y, Galán JE, Donis RO. Delivery of epitopes by the Salmonella type III secretion system for vaccine development. Science 1998;281:565-568. [ Links ]
75.Comerci DJ, Pollevick GD, Vigliocco AM, Frasch ACC, Ugalde RA. Vector development fot the expression of foreign proteins in the vaccines strain Brucella abortus S19. Infect Immun 1998;66:3862-3866. [ Links ]
1 Unité des Interactions Bactéries-Cellules Departament de Bactériologie, Institut Pasteur 28 rue du Docteur Roux, 75724 Paris Cedex 15, France.













