Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Costarricense de Ciencias Médicas
versão impressa ISSN 0253-2948
Rev. costarric. cienc. méd vol.20 no.1-2 San José Jun. 1999
Resumen
Se describe la modificación de un método para la cuantificación de colinesterasa plasmática mediante monitoreo continuo empleando ferricianuro como indicador. La tiocolina liberada de la propioniltiocolina reduce el ferricianuro a ferrocianuro y la disminución de absorbancia a 405 nm es proporcional a la actividad de la enzima.
Las precisiones día a día para muestras con valores de colinesterasa bajos y altos mostraron coeficientes de variación de 3,2 y 1,2 por ciento y en un mismo día de 1,1 y 0,52 por ciento respectivamente. La bilirrubina no presenta una interferencia importante y cada 50 mg/dL de hemoglobina producen una interferencia de -4 por ciento. El reactivo de ferricianuro almacenado en botella ámbar es estable por al menos 3 meses a temperatura ambiente y 6 meses a 4-8°C.
Al comparar los resultados con un método que emplea la reacción de Ellman se obtuvo una ecuación de regresión lineal de Y = 1,23 (X) - 732, con un coeficiente de correlación (r) de 0,988 y una desviación estándar sobre la línea de regresión (Sy/ x) de 378 U/L.
Palabras clave
Colinesterasa sérica, organofosfatos, carbamatos, pesticidas, métodos colorimétrico, toxicología.
Abstract
A kinetic method for the determination o serum cholinesterase is presented. Th hydrolysis of propionyithiocholine liberates thiocholine, that reduces yellow ferricyanide to colourless ferrocyanide The decrease in absorbance at 405 nm is proporcional to enzyme activity. The CV of the between run precision range from 1,2 to 3,2 per cent. Within-run precision ranged from 0,52 to 1,1 per cent. Bilirrubin do not interfere up to 15 mg/dL and 50 mg/dL hemoglobin cause an interference of -4 percent. The working reagent, stored in an amber-colored bottle, is stable for at least 3 months at room temperatura and 6 months at 4-8°C.
Comparisons with results by a commercial method based on the Ellman's reaction gave a linear regression of Y = 1,23 (X) - 732, with a correlation coefficient (r) of 0.988 and a standard error (Sy/x) of 378 U/L.
Key words
serum cholinesterase, organophosphates, carbamates, pesticides, colorimetric methods, toxicology.
Introducción
La colinesterasa plasmática, butirilcolinesterasa o seudocolinesterasa (colinesterasa, EC 3.1.1.8) pertenece a un grupo de isoenzimas hepáticas con masa molecular de aproximadamente 300000 Da (1). A pesar de su amplia distribución en tejidos humanos y animales, su función fisiológica aún no se conoce claramente. Algunos sugieren que juega un papel importante en el metabolismo de lípidos y lipoproteínas, regulando la concentración de la colina en plasma o evitando la acumulación de butirilcolina, con sus efectos nicotínicos, durante el metabolismo de ácidos grasos y lipogénesis (2).
La determinación de su actividad es de importancia clínica para detectar pacientes con intoxicación por plaguicidas organofosforados y carbamatos, para identificar pacientes con formas atípicas con sensibilidad aumentada hacia el anestésico succinilcolina y también puede ser utilizada en el diagnóstico de desórdenes hepáticos (1, 3). Aunque se señala que la actividad de la colinesterasa es un marcador de metabolismo lipídico anormal, tal como hiperlipoproteinemia, obesidad y diabetes mellitus (2), esto no ha sido totalmente comprobado (1).
La colinesterasa plasmática ha adquirido gran importancia clínica debido a la amplia aplicación de plaguicidas. Para su determinación se emplea su capacidad de hidrolisar los ésteres de colina en sus respectivos ácidos. Se han desarrollado varios métodos, entre los que se incluyen la determinación del cambio de pH que acompaña la hidrólisis de los ésteres de colina (4, 5) y aquellos basados en la detección de la liberación de tiocolina de sus ésteres empleando como indicador el reactivo de Eliman [(5,5-ditiobis-(2-ácido nitrobenzoico)), DTNB] (6, 7) o ferricianuro (8). Aquellos que emplean DTNB tienen mayor aceptación, sin embargo, la alta actividad catalítica de la enzima en suero, aunado a la alta sensibilidad de la reacción indicadora, demandan una predilución o un volumen muy pequeño de la muestra. Ambas medidas contribuyen necesariamente a una imprecisión inevitable y hace difícil la automatización del método (8). En este estudio se presenta una modificación del método con ferricianuro, empleando propioniltiocolina como sustrato, amortiguador de fosfatos, una concentración de 1,22 mmoL/L de ferricianuro de potasio y realizando la determinación por monitoreo continuo. Estas modificaciones hacen que la técnica sea más precisa y barata que aquellas que emplean DTNB.
Bajo las condiciones de reacción, a partir de propioniltiocolina la colinesterasa libera tiocolina, la cual reduce inmediatamente el ferricianuro (de color amarillo) a ferrocianuro (incoloro), permitiendo así el monitoreo directo de la reacción:

Materiales y métodos
Muestras
Las muestras adecuadas son suero o plasma heparinizado o con EDTA. No se debe emplear el fluoruro como preservante. Las células deben separarse del suero o plasma en las dos horas siguientes a su recolección.
La colinesterasa plasmática es muy estable; congelamiento y descongelamiento repetido no afecta su actividad. La enzima no pierde actividad por almacenamiento al menos tres días a temperatura ambiente, dos semanas a 4°C, seis meses a -20°C o dos años a 75°C (9).
Reactivos
Los reactivos utilizados fueron obtenidos de la compañía Sigma, St. Louis, USA.
1. Solución amortiguadora de fosfato, 100 mmol/L, pH 7,6. Disolver 2,33 g de Na2H PO4 y 0,831 g de KH2PO4 en 800 mL de agua destilada, ajustar el pH a 7,6 con NAOH 0,02M y trasvasar a un matraz volumétrico de un litro, aforar hasta la marca con agua destilada y mezclar.
2. Ferricianuro de potasio (K3[FE(CN )6]), 1,22 mmol/L. Colocar 403 mg de ferricianuro de potasio en un matraz volumétrico de un litro, aforar hasta la marca con solución amortiguadora de fosfatos (100 mmol/L, pH 7,6) y mezclar. Almacenar en botella ámbar. Esta solución es estable por lo menos durante 3 meses a 25°C y 6 meses en refrigeración (4 - 8 °C).
3. Sustrato, ioduro de propioniltiocolina, 95,6 mmol/L. Disolver 290 mg de ioduro de propioniltiocolina en 10 mL de agua destilada. Esta solución es estable por lo menos 3 meses en congelación a -20 °C.
Procedimiento
1. Colocar 1,0 mL de la solución de ferricianuro de potasio en un tubo de vidrio de 13 x 100mm.
2. Agregar 20 µL de muestra (plasma o suero). Mezclar e incubar a 37 °C por tres minutos.
3.Agregar 100 µL de sustrato. Mezclar, esperar 90 segundos y determinar la disminución de absorbancia por minuto a 405 nm y a 37 °C, ajustando previamente el cero de absorbancia con agua destilada.
Cálculos
Bajo las condiciones de la prueba, el coeficiente de absortividad molar del ferricianuro de potasio a 405 nm y 37 °0 es 92,40 L mol -1 cm-1.

Resultados
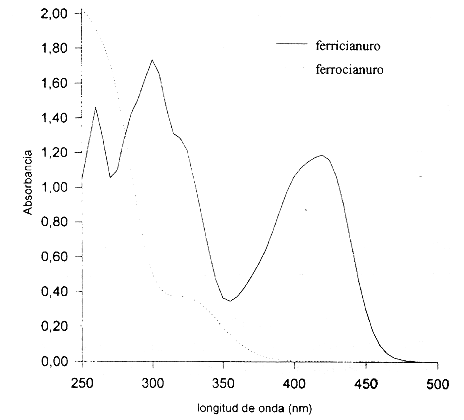
Espectro de absorción del ferricianuro y ferrocianuro de potasio. Se realizó el espectro de absorción del ferricianuro y del ferrocianuro de potasio. Se determinaron las absorbancias en un intervalo que comprendió longitudes de onda de 250 a 500 nm. En la figura 1 se muestran los espectros de absorción de ambos compuestos.
Efecto de la concentración de ferricianuro de potasio. En la figura 2 se muestra el efecto de la concentración de ferricianuro de potasio sobre la velocidad de la reacción. Se analizaron diferentes concentraciones del compuesto en el intervalo de 0,61 a 2,44 mmol/L. Como se puede observar los mejores resultados se obtuvieron con 0,81 y 1,22 mmol/L; a concentraciones superiores se pierde sensibilidad. Se eligió la concentración de 1,22 mmol/L por presentar una mayor absorbancia y proporcionar así un mayor intervalo de linealidad.
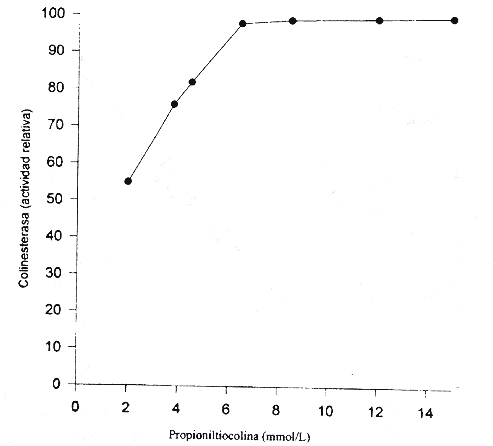
Efecto de la concentración sustrato. El efecto de la concentración de sustrato sobre la actividad de la colinesterasa se muestra en la figura 3. Se analizaron diferentes concentraciones de propioniltiocolina en el intervalo de 2 a 1 5 mmol/L en la mezcla de reacción. Se observa que con concentraciones superiores a 7,5 mmol/L se obtienen valores similares de actividad. Por lo tanto, se decidió utilizar en la mezcla final una concentración de sustrato de 8,5 mmol/L. La evaluación se realizó utilizando una mezcla de sueros con una actividad de colinesterasa de 8800 U/L.
Efecto del volumen de muestra. Se analizó el efecto del volumen de muestra (10, 20, 30,40 y 50 uL) sobre la velocidad de reacción. Se observó que con todos los volúmenes analizados se obtienen resultados similares, por lo que se eligió un volumen de muestra de 20 uL como adecuado.
Imprecisión. El cuadro 1 muestra las imprevisiones obtenidas en un mismo día y día a día, con mezclas de sueros conteniendo actividades de colinesterasa baja y alta. Las precisiones día a día para muestras con valores de colinesterasa de 2603 y 8820 U/L, mostraron coeficientes de variación de 3,2 y 1,2 por ciento y en un mismo día de 1,1 y 0,52 por ciento respectivamente.
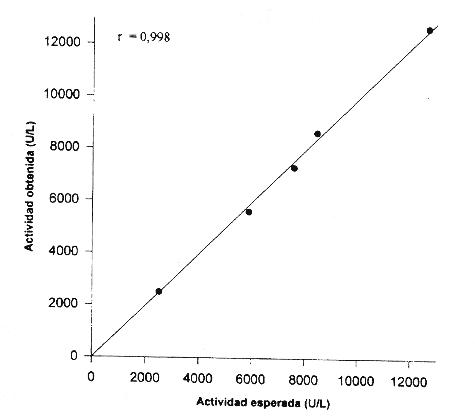
Linealidad del método. Se comprobó la linealidad del método analizando diluciones de un suero con actividad alta, lo cual mostró un coeficiente de correlación (r) de 0,998 (Fig. 4).
Efecto de sustancias interferentes. Se evaluó el efecto interferente de bilirrubina y hemoglobina en la determinación. Como se puede observar en el cuadro 2, cada miligramo de bilirrubina por 100 mL de suero produce una disminución de un 0,2 % en la actividad. En tanto con la hemoglobina se encontró que por cada 50 mg de hemoglobina por 100 mL de suero se produce una disminución de un 4 % en la actividad.
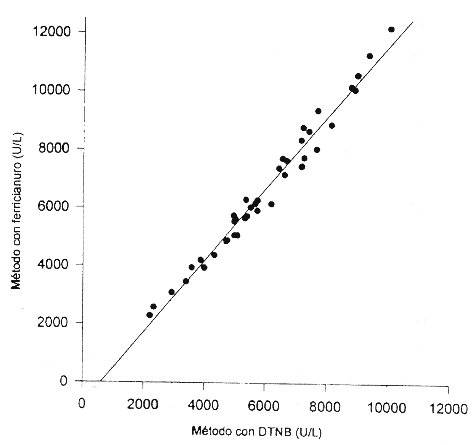
Estudio comparativo. En la Figura 5 se observan los resultados del estudio comparativo del método propuesto con la determinación enzimática de colinesterasa plasmática por un método comercial de amplia utilización en el ámbito nacional que emplea DTNB como indicador (Biotec Internacional S.A.), el cual fue empleado como referencia. Se analizaron 42 sueros con actividades de colinesterasa entre 2200 y 12200 U/L. La ecuación de regresión obtenida fue: y = 1,23x - 732. El coeficiente de correlación (r) fue de 0,988 y el error estándar del estimado (Sy/x) de 378 U/ L.
Discusión
En Costa Rica es común el empleo de plaguicidas organofosforados y carbamatos, que inhiben las colinesterasas (10). La intoxicación por plaguicidas organofosforados puede causar enfermedad severa incluyendo la muerte y daño cerebral permanente en los sobrevivientes (11). Como una medida preventiva, los trabajadores en contacto con tales compuestos deben ser controlados continuamente, para identificar a las personas sobreexpuestas. Esto se realiza mediante la determinación de la actividad de las colinesterasas, ya que la actividad enzimática disminuye antes de que se presenten manifestaciones clínicas (11, 12).
La toxicidad producida por organofosforados y carbamatos es semejante y se asocia con la inhibición de la acetilcolinesterasa, enzima responsable de la interrupción de la actividad biológica del neurotransmisor acetilcolina (13). Dentro del grupo de las colinesterasas se incluyen la acetilcolinesterasa (E.C.3.1.1.7) o colinesterasa eritrocítica y la acilcolina acilhidrolasa (E. C. 3.1.1.8) o colinesterasa plasmática. La enzima plasmática es de importancia clínica para detectar pacientes con intoxicación por plaguicidas, formas atípicas de la misma o disfunción hepática (1, 3). En contacto con plaguicidas la actividad de la enzima plasmática disminuye más rápidamente que la actividad de la enzima eritrocítica, por lo que se considera un índice muy sensible para prevenir intoxicación. La determinación de la actividad de la colinesterasa eritrocitaria es de importancia en los sistemas de vigilancia para intoxicaciones crónicas, por permanecer deprimida mayor tiempo y es considerada como un mejor índice de exposición, ya que puede reflejar en mejor forma lo que ocurre en el tejido nervioso y es menos afectada que la plasmática por otras condiciones (1, 3, 13).
En Costa Rica el sistema de vigilancia relacionado con los plaguicidas inhibidores de las colinesterasas ha adoptado el análisis frecuente de los niveles de estas enzimas como uno de los criterios fundamentales para decidir el diagnóstico. Generalmente los métodos empleados a nivel nacional e internacional se basan en la reacción de Ellman, que como reacción indicadora emplea la reducción del DTNB por la tiocolina liberada del éster de colina. Esta reacción tiene una alta sensibilidad analítica, lo que aunado a la alta actividad catalítica de la enzima en plasma hace necesario la predilución de la muestra o el empleo de volúmenes muy pequeños de muestra. Ambas medidas redundan en un aumento de la imprecisión de los métodos (8). En el método descrito se presenta una modificación en la cual se emplea propioniltiocolina como sustrato, amortiguador de fosfatos y una concentración de 1,22 mmoL/L de ferricianuro de potasio como indicador. En este sistema, la tiocolina liberada reduce al ferricianuro a ferrocianuro, permitiendo la determinación mediante el monitoreo continuo de la disminución de absorbancia a 405 nm. Este método permite la determinación de colinesterasa plasmática de una manera rápida, exacta, más precisa y más económica.
Al realizar el espectro de absorción del ferricianuro y ferrocianuro de potasio se observó que el ferricianuro presenta un pico de absorción a 420 nm, sin embargo se decidió elegir 405 nm como una longitud de onda adecuada ya que permite también el empleo de fotómetros. El coeficiente de absortividad molar del ferricianuro a 405 nm es de 92,40 L mol-1 cm-1, mientras que a 420 nm es de 98,30 L mol-1 cm-1. De manera que si la determinación se realiza a 420 nm el factor sería de 57000.
Se llevaron a cabo estudios de imprecisión en un mismo día y día a día, utilizando mezclas de sueros con diferentes actividades de colinesterasa.
En un mismo día se obtuvieron coeficientes de variación (CV) de 0,52 y 1,1 por ciento para actividades de 8788 y 2557 U/L, respectivamente. Los CV día a día fueron de 1,2 y 3,2 por ciento para actividades de 8820 y 2603 U/L, respectivamente. La imprecisión obtenida con este método es menor a la informada por otros autores empleando métodos basados en la reacción de Ellman (7) o en los panfletos de casas comerciales (14, 15).
En cuanto al análisis de posibles interferentes, se encontró, que cada mg de bilirrubina por decilitro produce una disminución de un 0,2%, lo que indica que la interferencia por bilirrubina en esta prueba es despreciable. Por otro lado, cada 50 mg por decilitro de hemoglobina producen una disminución de actividad de un 4 %, por lo que no es conveniente el análisis de muestras muy hemolisadas. Empleando 20 uL de muestra, el método presenta una buena linealidad en el intervalo dentro del cual se esperan los valores de las muestras. Sin embargo, si se requiere cambiar el volumen de muestra, este puede variarse entre 10 y 50 uL, con el correspondiente cambio en el factor, sin afectar los resultados.
Los reactivos empleados son bastante estables. El ferricianuro de potasio en buffer de fosfatos es estable al menos por 3 meses a temperatura ambiente y en refrigeración (4 a 8 °C) es estable al menos por un periodo de 6 meses. El sustrato es estable en congelación (-20 °C) por lo menos 4 meses.
Al realizar un estudio comparativo con un sistema comercial de amplia utilización a nivel nacional y empleado para determinar los valores de referencia en población costarricense (16), se obtuvo muy buena correlación. El coeficiente de correlación (r) fue de 0,988 y la ecuación de regresión lineal y 1,23x - 732 (n = 42).
En resumen, el método propuesto constituye una alternativa más precisa y más barata para la determinación de colinesterasa plasmática. Los datos obtenidos indican que el método es lineal y reproducible dentro del intervalo en el que se espera encontrar los valores de las muestras. El estudio comparativo con métodos comerciales mostró una buena correlación.
| | | | | ||||
| | | | | | | | |
| | | | | | | ||
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |

Referencias
1- McQueen MJ: Clinical and analytical considerations in the utilization of cholinesterase measurements. Clin Chim Acta 1995; 237: 91-105. [ Links ]
2- Kutty DM: Review: Biological functions of cholinesterase. Clin Biochem 1980; 13:239-243. [ Links ]
3- Trundle D, Macial G: Detection of cholinesterase inhibition. The significance of cholinesterase measurements. Ann Clin Lab Sci 1988; 18:345-352. [ Links ]
4- Michel HO: An electrometric method for the determination of red blood cell and plasma cholinesterase activity. J Lab Clin Med 1949; 34:1564-1568. [ Links ]
5- Ellin RI, Vicario P: A pH method for measuring blood cholinesterase. Arch Environ Health 1975; 30: 263-265. [ Links ]
6- Dietz A, Rubinstein H, Lubrano T: Colorimetric determination of serum cholinesterase and its genetic variants by the propionyltiocholine-dithiobis (nitrobenzoic acid) procedure. In Selected Methods of Clinical Chemistry. Vol. 8. Washington DC: American Association of Clinical Chemistry; 1977. pp. 41-46. [ Links ]
7- Magnotti RA, Eberly JP, Quarm DEA, McConnell RS: Measurement of acetyl-cholinesterase in erythrocytes in the field. Clin Chem 1987; 33: 1731-1735. [ Links ]
8- Schmidt E. Deutsche Gesellschaft für Klinische Chemie. Working Group of enzymes: Proposal of standard methods for the determination of enzyme catalitic concentrations in serum and plasma at 37°C. Il. Cholinesterase. Eur J Clin Chem Clin Biochem 1992; 30: 163-170. [ Links ]
9- Huizenga JR, van der Belt K, Gips CH: The effect of storage at different temperatures on cholinesterase activity in human serum. J Clin Chem Clin Biochem 1985; 23: 283-285. [ Links ]
10- García-González JE: Causas del mal uso de los plaguicidas. Tecnología en marcha 1996; 12: 25-37. [ Links ]
11- Henao S, Corey G: Plaguicidas inhibidores de las colinesterasas. Centro Panamericano de Ecología Humana y Salud. ECO/OPS/OMS. Metepec, Mexico, 1991. [ Links ]
12- McConnell R, Cedillo L, Keifer M, Palomo MR: Monitoring organophosphate insecticide-exposed workers for cholinesterase depression. J Occup Med 1992; 2: 34 - 37. [ Links ]
13- Coye MJ, Lowe JA, Maddy KT. Biological monitoring of agricultural workers exposed to pesticidas: I. Cholinesterase activity determinations. J Occup Med 1986; 28: 619-627. [ Links ]
14- Sigma Diagnostics. Cholinesterase [PTC]. Quantitative, kinetics determination of cholinesterase activity in serum, plasma or whole blood at 405 nm. St. Louis,USA. [ Links ]
15- Biotec Internacional S. A. Colinesterasa sérica. Método colorimétrico cinético. San José, Costa Rica. [ Links ]
16- Schosinsky K, Jiménez M: Valores de referencia de colinesterasa plasmática y eritrocítica en población costarricense. Comparación del desempeño clínico. Pan Am J Public Health En prensa. [ Links ]
1 Departamento de Análisis Clínicos, Facultad de Microbiología, Universidad de Costa Rica.













