Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.19 n.1-2 San José Jun. 1998
Resumen
Se describe un método para determinar en líquido amniótico los fosfolípidos que contienen colina, que se basa en la acción de la fosfolipasa D sobre los fosfolípidos, originando colina, que es oxidada por la colinaoxidasa a betaína con la producción simultánea de peróxido de hidrógeno, este último en presencia de peroxidasa oxida al fenol que se acopla a la 4-aminofenazona produciendo un cromógeno rojo. La intensidad del color a 500 nm es directamente proporcional a la concentración de fosfolípidos que contienen colina. El método es sencillo, rápido, relativamente económico, preciso, exacto y requiere poco volumen de muestra. El análisis comparativo con la determinación de lecitina mediante un método enzimático mostró un coeficiente de correlación (r) de 0,945 y una ecuación de regresión lineal y = 2,595 + 0,929x. El método presenta coeficientes de variación día a día de 2,6 y 4,5 por ciento para concentraciones de fosfolípidos de 12,4 y 4,3 mg/dL, respectivamente. El intervalo analítico es de 25,0 mg/dL. La sangre, la bilirrubina y el ácido ascórbico producen cierto grado de interferencia. (Rev. Cienc. Méd. 1998; 19 (1,2): 71-85).
Palabras clave
Fosfolípidos- líquidos amniótico - madurez pulmonar fetal - síndrome de isuficiencia respiratoria - espectrofotometría
Abstract
We describe a method for determining choline containing phospholipids in amniotic fluid. Phospholipase D is used to liberate choline from phospholipids, and the liberated choline is oxidized to betaine and hydrogen peroxide by choline oxidase. The hydrogen peroxide forms a colored complex with phenol and 4-aminoantipyrene in the presence of horseradish peroxidase, and the color is measured spectrophotometrically at 500 nm. The method is linear up to 25 mg/dL. Comparison of the assay (y) with an enzymatic method (x) demostrated a correlation coefficient of 0,945 (regression equation: y = 2,595 + 0,929x). The CV of the between run precision is 2,6 and 4,5 per cent for concentrations of 12,4 and 4,3 mg of phospholipids per 100 mL of amniotic fluid, respectively. The method is relatively simple, precise, and accurate, requires less time and sample that other methods for assessing fetal lung maturity. The procedure is affected by blood, ascorbic acid and bilirrubin.
Key words
Phospholipids, amniotic fluid, fetal lung maturity; respirstory distress sysdrome spectrophotometry
Introducción
La técnica más ampliamente usada para evaluar la madurez pulmonar fetal es la relación lecitina/esfingomielina (L/S) de Gluck y colaboradores (3, 6, 7) o alguna de sus modificaciones (8-11). Aunque esta técnica relaciona confiablemente fosfolípidos en líquido amniótico a la madurez pulmonar fetal, es muy laboriosa y para obtener una buena precisión se requiere una considerable experiencia y habilidad (2, 12). Algunos otros métodos para estimar madurez pulmonar fetal incluyen: la estabilidad de la espuma (13), la determinación de la absorbancia del líquido amniótitico a 650 nm (14), la fluorescencia polarizada, que mide la microviscosidad de los lípidos en el líquido amniótico (1, 15); métodos de inmunoaglutinación (16, 17) y enzimáticos (18-20) para medir lecitina, esfingomielina y fosfatidilglicerol, así como la cuantificación de cuerpos lamelares (21, 22). Estas pruebas difieren en cuanto a su confiabilidad clínica, tiempo requerido para realizarlo y experiencia del personal, así como en costos de equipo e implementos. De acuerdo a esto, la utilidad clínica varía con los diversos procedimientos (1, 2, 12).
En este artículo se describe un método enzimático para determinar, en líquido amniótico, la concentración de fosfolípidos que contienen colina (FLC), el cual es sencillo, exacto, preciso, los resultados se obtienen rápidamente, requiere poco volumen de muestra y puede realizarse en pequeños laboratorios sin equipos costosos. El método se basa en una reacción propuesta para la determinación de fosfolípidos en suero (23). En este sistema, los FLC presentes en el líquido amniótico son hidrolizados por la fosfolipasa D. La colina liberada es oxidada por la colinaoxidasa a betaína, con la producción simultánea de peróxido de hidrógeno, el cual en presencia de peroxidasa, oxida al fenol que se acopla a la 4-aminofenazona (4AMF) y se produce un cromógeno rojo [4-(p-benzoquinona-monoimino) fenazona]. La intensidad del color es directamente proporcional a la concentración de FLC.
Material y métodos
A. Equipo
Para los análisis se utilizaron espectrofotómetros Shimadzu. Modelo UV-160 y Modelo UV-1601PC; Shimadzu Corporation, Kyoto Japón.
B. Obtención y tratamiento de las muestras
Las muestras de líquido amniótico para este estudio fueron obtenidas de la unidad de Perinatología del Hospital Calderón Guardia, Caja Costarricense de Seguro Social, San José, Costa Rica, entre las 28 y 42 semanas de gestación (determinadas mediante ultrasonido) por medio de amniocentesis transabdominal para disminuir la posibilidad de contaminación. Las muestras fueron procesadas en un periodo no mayor de cuatro horas después de su extracción o congeladas a -20 ºC para análisis posteriores. Los niveles de fosfolípidos disminuyen cuando las muestras son mantenidas a temperatura ambiente por más de 4 horas (24).
El líquido amniótico se centrifugó a 250 g por 5 minutos para remover restos celulares y otros contaminantes. Las muestras contaminadas con sangre o meconio, fueron excluidas de este estudio, a menos que se especifique lo contrario.
C. Lavado de cristalería:
La cristalería utilizada se sumergió durante 12 horas en una solución de ácido nítrico al 25 por ciento (v/v) y posteriormente fue escrupulosamente enjuagada con agua destilada.
D. Reactivos
Los reactivos utilizados fueron obtenidos de la compañía Sigma, St. Louis, USA.
1. Solución amortiguadora de Tris (hidroximetil) aminometano, 50 mmol/L, pH 7,8. Disolver 6,06 g de Tris en 800 mL de agua destilada, ajustar el pH a 7,8 con ácido clorhídrico concentrado y trasvasar a un matraz volumétrico de un litro, aforar hasta la marca con agua destilada y mezclar. Este amortiguador es estable por lo menos durante 12 meses en refrigeración (4- 8 ºC).
2. Reactivo A. Colocar 1,0 g de fenol en un matraz volumétrico de un litro, que contenga 500 mL de solución amortiguadora de Tris (50 mmol/L, pH 7,8), agregar 1 mL de Tritón X-100; aforar hasta la marca con buffer Tris y mezclar. Esta solución es estable por lo menos durante 12 meses en refrigeración (4 - 8 ºC).
3. Reactivo B. En un matraz volumétrico de 500 mL que contenga 300 mL de reactivo A, agregar 0,710 g de 4-aminofenazona (4AMF), 400 U de peroxidasa (EC 1.11.1.7) de rábano, 2500 U de colina oxidasa (EC 1.1.3.17) de Alcaligenes species, 500 U de fosfolipasa D (EC 3.1.4.4) de Streptomyces chromofuscus y 0,2 g de cloruro de calcio anhidro. Disolver y aforar hasta la marca con el reactivo A. Esta solución es estable por lo menos 2 semanas en refrigeración y 4 meses en congelación a -20 ºC.
4. Soluciones patrón de lecitina. Disolver 20 mg de L-a-dipalmitoilfostatidilcolina en 100 mL de solución acuosa de Tritón X-100 (5 g/L). Para la preparación de soluciones patrón de trabajo de 5 a 20 mg/dL, diluya con agua destilada. Guardar en porciones a -20 ºC. Bajo estas condiciones las soluciones son estables al menos por 5 meses. Un patrón alternativo consiste en disolver 54,1 mg de cloruro de colina en 100 mL de agua destilada, lo cual corresponde a una concentración de 300 mg de FLC por decilitro.
E. Procedimiento
1. Centrifugar los líquidos amnióticos obtenidos por amniocentesis a 250 g x 5 min, inmediatamente después de su extracción para su análisis o proceder a congelarlos a -20 ºC.
2. Emplear el sobrenadante para hacer las determinaciones.
3. Colocar 0,8 mL del "reactivo B" en tres tubos de vidrio de 15 x 100 mm, marcados muestra, patrón y blanco reactivos.
4. Agregar 0,200 mL de líquido amniótico, solución patrón o agua respectivamente. Mezclar e incubar a 37 ºC por 30 minutos.
5. Determinar la absorbancia a 500 nm, ajustando previamente el cero de absorbancia con el blanco de reactivos.
6. Para cada especimen analizar un "blanco de muestra", empleando 0,8 mL del "reactivo A" y 0,2 mL de muestra. Determinar sus absorbancias a 500 nm contra el "reactivo A"
F. Cálculos
FLC mg/dL =Am - Abm x CP
AP
donde : Am= absorbancia de muestra
Abm= absorbancia de blanco de muestra
CP = concentración del patrón
AP = absorbancia del patrón
Resultados
1- Espectro de absorción del producto coloreado.
Se realizó el espectro de absorción del complejo coloreado obtenido al final de la reacción. Se determinaron las absorbancias en un intervalo que comprendió longitudes de onda de 400 a 750 nm. Se observó que la máxima absorbancia se obtiene con una longitud de onda de 500 nm.
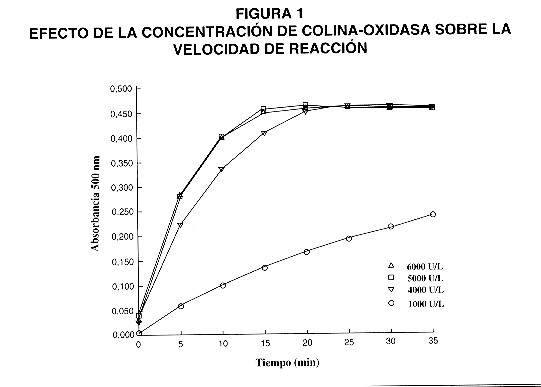
2- Efecto de la concentración de colina-oxidasa.
En la figura 1 se muestra el efecto de la concentración de la enzima colina-oxidasa sobre la velocidad de la reacción. Se analizaron diferentes concentraciones de la enzima en el intervalo de 1000 a 8000 UI/L. Como se puede observar al aumentar la concentración de la colinaoxidasa, disminuye el tiempo necesario para alcanzar el máximo de absorbancia. Con una concentración de 5000 UI de enzima por litro de solución, se alcanza el máximo de absorbancia en 20 minutos a 37 ºC para una concentración de FLC de 20 mg/dL, por lo que esta concentración de la enzima se considera como adecuada.
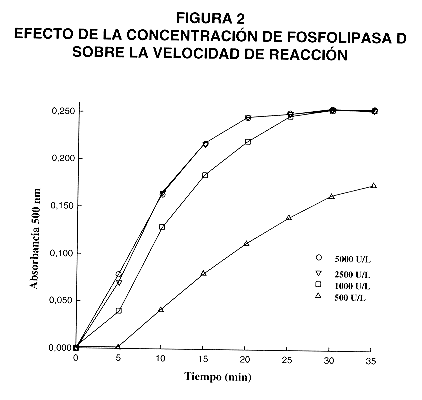
3- Efecto de la concentración de Fosfolipasa D.
El efecto de la concentración de la enzima fosfolipasa D sobre la velocidad de la reacción se muestra en la figura 2. Se analizaron diferentes concentraciones de la enzima en el intervalo de 500 a 5000 UI/L. Se observa que al aumentar la concentración de la fosfolipasa D, disminuye el tiempo necesario para alcanzar el máximo de absorbancia. Con una concentración de 1000 UI/L se alcanza el máximo de absorbancia en 25 minutos a 37 ºC, por lo que se decidió tomar esta concentración como adecuada. La evaluación se realizó utilizando un líquido amniótico con una concentración de FLC de 10 mg/dL.
4- Efecto de la concentración de peroxidasa.
Se analizó el efecto de diferentes concentraciones de peroxidasa (entre 500 y 2500 U/L) sobre la velocidad de reacción. Se observó que con todas las concentraciones analizadas se obtienen resultados similares, por lo que se eligió una concentración de 800 unidades de peroxidasa por litro de solución como adecuada.
5- Efecto de la concentración de fenol y de 4 aminofenazona (4AMF).
Se evaluaron diferentes concentraciones de fenol en un intervalo de 50 a 2000 mg/L y se encontró que con concentraciones entre 500 y 2000 mg/L se obtienen resultados similares. Por tal motivo se eligió una concentración de 1000 mg de fenol por litro de solución como la más adecuada.
En relación a la 4AMF, después de analizar diferentes concentraciones se determinó que 1,42 g/L es la concentración adecuada para lograr cuantificar concentraciones altas de FLC en líquido amniótico.
6- Efecto del Tritón X-100.
El Tritón X-100 se emplea para una mejor solubilización de los fosfolípidos del líquido amniótico en la mezcla de reacción. Se analizaron concentraciones del detergente comprendidas entre 0,5 y 4 mL/L. Se observó que el detergente acelera la reacción pero con todas las concentraciones evaluadas se obtienen resultados similares. Se estableció arbitrariamente una concentración de 1,0 mL del detergente por litro de solución como adecuada.
7- Efecto de la concentración de calcio.
Debido a que el calcio es un activador de las fosfolipasas, se evaluó el efecto de la concentración sobre la velocidad de reacción. Se encontró que la concentración más adecuada de calcio es de 40 mg/dL.
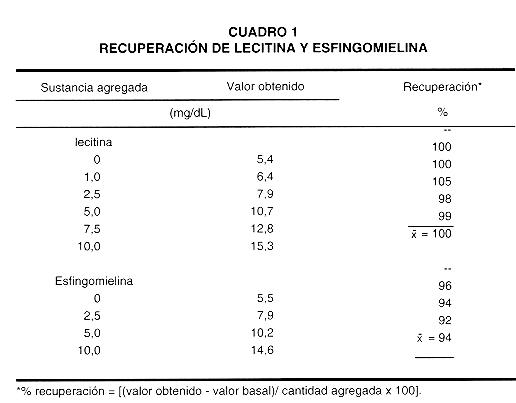
8- Recuperación.
Se evaluó la exactitud del método y se determinó la recuperación analítica de varias cantidades de lecitina o esfingomielina agregadas a una mezcla de líquidos amnióticos. El cuadro 1 se muestran los resultados obtenidos.
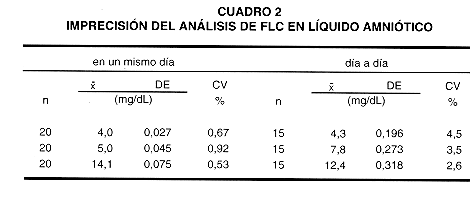
9- Imprecisión.
El cuadro 2 muestra las imprecisiones obtenidas en un mismo día, y día a día, con mezclas de líquidos amnióticos que contenían FLC en concentración baja, media y alta.
10- Efecto del blanco de muestra
Con el fin de eliminar la interferencia por turbiedad se evaluó el efecto del blanco de muestra. Se pudo determinar que el no usar blanco de muestra produce una interferencia positiva significativa.
11- Efecto de sustancias interferentes.
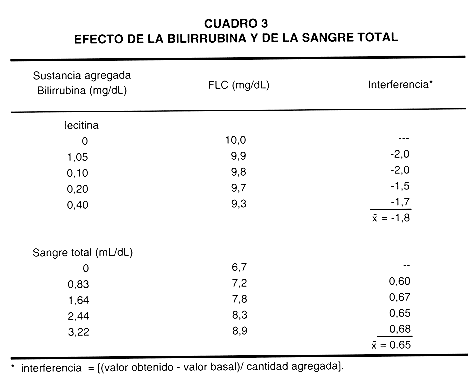
Se evaluó el efecto interferente de algunas sustancias en la determinación de FLC.
a) Bilirrubina. Como se puede observar en el cuadro 3, cada mg de bilirrubina por 100 mL de líquido amniótico produce una disminución de 1,8 mg de FLC por decilitro.
b) Sangre total. se evalúo el efecto de la contaminación con sangre total sobre el resultado del análisis. Se encontró que por cada mL de sangre por 100 mL de líquido amniótico se produce un aumento de 0,65 mg de FLC por decilitro.
c) Ácido ascórbico. Se evaluó el efecto del ácido ascórbico sobre la determinación y se encontró que cada miligramo de ácido ascórbico por 100 mL de líquido produce una disminución de 1,8 mg de FLC por decilitro.
12- Presencia de colina libre en los líquidos.
Se determinó la presencia de colina libre en 10 líquidos amnióticos con concentraciones diferentes de FLC. Los resultados obtenidos mostraron una concentración promedio de 2,5 y una desviación estándar de 0,6 mg de colina libre por decilitro de líquido amniótico .
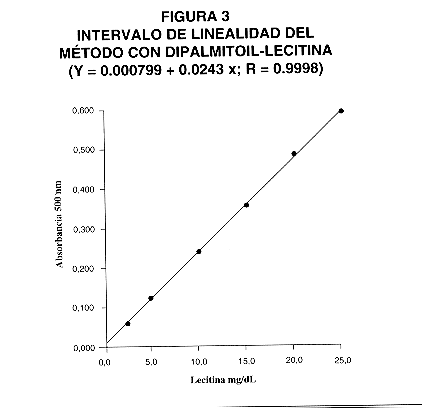
13- Curva de calibración.
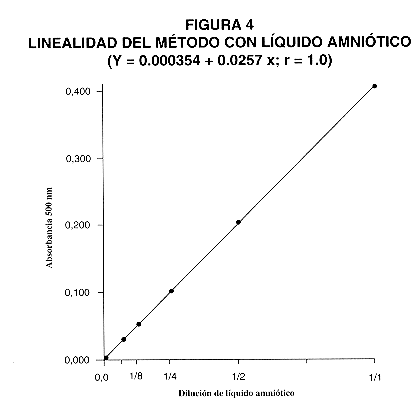
Se utilizó para la estandarización lecitina sintética (DL-dipalmitoil-fosfatidilcolina). Se prepararon diferentes soluciones patrón de 2,5; 5,0; 10,0; 15,0; 20,0 y 25,0 mg/dL. Se observó que se obtiene una linealidad adecuada hasta 25 mg/dL (Fig. 3). Además se comprobó la linealidad analizando diluciones de líquido amniótico, lo cual dio un coeficiente de correlación (r) de 1,0 (Fig. 4).
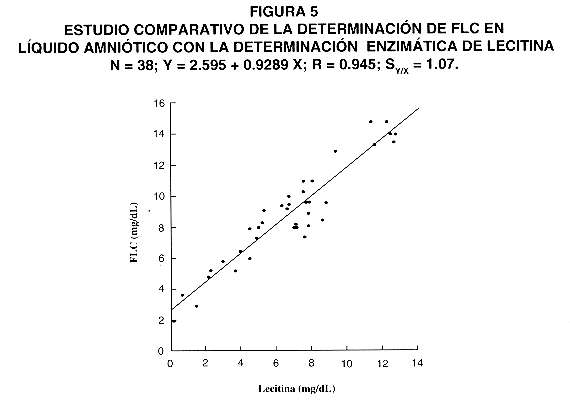
14- Estudio comparativo.
El análisis comparativo se llevó a cabo el mismo día, para evitar variaciones debidas a alteraciones en las muestras por almacenamiento. En la Figura 5 se observan los resultados del estudio comparativo del método propuesto con la determinación enzimática de lecitina mediante un método comercial (Boehringer Mannheim) (25, 26), el cual fue empleado como referencia. Se analizaron 38 líquidos amnióticos con concentraciones de lecitina de 0,2 a 12,4 mg/dL. La ecuación de regresión obtenida fue: y = 2,595 + 0,929 x . El coeficiente de correlación (r) fue de 0,945 y el error estándar del estimado (Sy/x) de 1,07 mg/dL.
También se realizó un estudio comparativo de los valores obtenidos con este método, con los obtenidos por medio del método de lisis eritrocítica por lisolecitina (LLL), el cual determina la concentración de lecitina [27]. Mediante el análisis de correlación se obtuvieron los siguientes resultados: y = 0,305 + 0,834x; (n = 34). El coeficiente de correlación (r) en este caso fue de 0,912.
Discusión
Para el manejo de pacientes obstétricas de alto riesgo es esencial una exacta evaluación de la madurez pulmonar fetal. Generalmente los métodos de cromatrografía en capa fina son los más aceptados para tal efecto. La relación L/E, la cuantificación de los principales fosfolípidos surfactantes y las determinaciones de fosfatidilcolina saturada han demostrado tener el mayor valor predictivo para evaluar la probabilidad de síndrome de insuficiencia respiratoria (3, 26, 28, 29). Aunque estos métodos son exactos tienen varios inconvenientes: requieren mucho tiempo, emplean sustancias tóxicas y requieren de mucha experiencia (1, 2, 12). Además no se ha logrado una adecuada estandarización y su reproducibilidad ha sido criticada [2, 12, 30]. Debido a esto, cada día se hace más necesario el desarrollo de métodos que determinen la madurez pulmonar fetal de una manera rápida, exacta, precisa y económica.
El método descrito utiliza la acción de la fosfolipasa D sobre los FLC presentes en el líquido amniótico, y se produce colina, la cual es oxidada por la colinaoxidasa a betaína y se produce peróxido de hidrógeno, el cual en presencia de peroxidasa, oxida al fenol que se acopla a la 4-aminofenazona (4AMF) y forma un cromógeno rojo [4-(p-benzoquinona-monoimino) fenazona]. La intensidad del color es directamente proporcional a la concentración de FLC. La determinación de FLC se efectúa espectrofotométricamente a una longitud de onda de 500 nm. El método es fácil de realizar y los resultados se obtienen rápidamente y son menos subjetivos que aquellos obtenidos por cromatografía.
El sistema es específico para fosfolípidos que contienen colina; otros fosfolípidos no interfieren. Esta especificidad está dada por la combinación de la fosfolipasa D de Streptomyces chromofuscus y la colina oxidasa. La fosfolipasa D hidroliza todo tipo de fosfolípidos, sin embargo cualquier otro compuesto liberado (etanolamina, serina, etc.) no interfiere ya que la colina oxidasa es específica para colina (23). El empleo de otros tipos de fosfolipasa D, que pueden ser específicas para la hidrólisis de lecitina y presentar menor actividad sobre la esfingomielina y otros fosfolípidos, como por ejemplo la fosfolipasa D de repollo, acarrea ciertos inconvenientes. El pH óptimo para estas enzimas está comprendido entre 5 y 6, mientras que para la colina oxidasa es cercano a 8,0 (31). Por lo tanto para utilizar este tipo de fosfolipasas D habría que utilizar dos reactivos separados y el inconveniente de dos periodos de incubación. Otro inconveniente de estas fosfolipasas es que son muy inestables y son inactivadas por superficies de vidrio (31). Por tales motivos se decidió emplear la fosfolipasa D tipo VI de Streptomyces chromofuscus (pH óptimo cercano a 8,0), la cual demostró ser bastante adecuada para nuestros propósitos. Debido a que la concentración de esfingomielina es estable durante las últimas semanas de gestación y a que los lisofosfolípidos tienen baja concentración en el líquido amniótico, se puede considerar que el uso de la fosfolipasa D de Streptomyces chromofuscus; no presenta inconvenientes desde el punto de vista de la interpretación clínica de los resultados.
Algunos autores señalan que la determinación de la concentración de lecitina por sí sola no es adecuada para evaluar madurez pulmonar fetal, ya que cambios en el volumen de líquido amniótico podrían ocasionar cambios en la concentración de fosfolípidos por lo que prefieren la determinación de la relación L/E (7, 10). Sin embargo otros han demostrado que tales cambios no afectan significativamente la concentración de fosfolípidos (5, 31, 32) por lo que consideran que la concentración de lecitina es una alternativa adecuada para evaluar madurez pulmonar.
Se llevaron a cabo estudios de imprecisión en un mismo día y día a día, utilizando mezclas de líquidos amnióticos con diferentes concentraciones de FLC. En un mismo día se obtuvieron coeficientes de variación (CV) de 0,67; 0,91 y 0,53 por ciento para concentraciones de FLC de 4,0; 5,0 y 14 mg/dL, respectivamente. Los CV día a día fueron de 4,5; 3,5 y 2,6 por ciento para concentraciones de 4,3; 7,8 y 12,4 mg/dL respectivamente. Los resultados obtenidos corroboran la estabilidad de los líquidos amnióticos mantenidos a -20 ºC. La imprecisión obtenida con este método es similar a la informada por otros autores empleando métodos enzimáticos (26, 31). La exactitud del método, obtenida mediante pruebas de recuperación, mostró un promedio de 100 por ciento para la lecitina y de 94 por ciento para la esfingomielina, comparable a la informada para otros métodos enzimáticos (26, 31).
En cuanto al análisis de posibles interferentes, se encontró, que cada mg de ácido ascórbico por decilitro produce una disminución de 1,8 mg/dL en el valor de FLC. Por otro lado, ya que los líquidos amnióticos pueden contaminarse con sangre materna durante la toma de la muestra, se evalúo el efecto de esta posible contaminación sobre el resultado del análisis, se encontró que la presencia de sangre interfiere positivamente, produciendo un aumento de 0,65 mg/dL en la concentración de FLC por cada mL de sangre por decilitro de líquido amniótico, similar a lo que ocurre con el método enzimático y la relación L/E; esto se debe a las altas concentraciones de lecitina y esfingomielina en plasma (24, 26). Otro de los posibles interferentes es la bilirrubina. En embarazos normales, el intervalo de la concentración de bilirrubina en líquido amniótico es estrecho, entre 0 y 0,05 mg/dL (33). Debido a la gran diferencia entre las concentraciones de bilirrubina y fosfolípidos, y debido a que las concentraciones de bilirrubina disminuyen y las de fosfolípidos aumentan durante la gestación, la bilirrubina tiene un efecto despreciable en esta prueba. Sin embargo, en condiciones patológicas tales como incompatibilidad sanguínea pueden alcanzarse concentraciones de bilirrubina superiores a 0,1 mg/dL (33). Los datos del cuadro 3 muestran que concentraciones de bilirrubina mucho mayores que las esperadas aún en casos de incompatibilidad sanguínea tienen poco efecto en la determinación de FLC.
Como los líquidos amnióticos presentan cierto grado de turbiedad, se considera conveniente incluir en la determinación de FLC un blanco de muestra que contenga todos los reactivos excepto las enzimas. Se pudo comprobar, que el no usar blanco de muestra produce una interferencia positiva significativa.
Ya que la colina libre puede producir interpretaciones erróneas (falsos positivos), se determinó la concentración de la misma en 10 líquidos amnióticos con concentraciones diferentes de FLC. Los resultados obtenidos mostraron unas concentraciones de 1,2 a 3,3 mg/dL con un promedio de 2,5 mg de colina libre por decilitro de líquido amniótico.
El reactivo de color en estado liofilizado es estable al menos por 7 meses. El reactivo reconstituido (reactivo completo) y mantenido en refrigeración (4 a 8 ºC) es estable por un periodo máximo de 15 días y en congelación (-20 ºC) por lo menos 4 meses.
Al comparar los resultados de la determinación de FLC con la cuantificación de lecitina mediante un sistema comercial y con el método de lisis eritrocitaria por lisolecitina (LLL) se obtuvieron buenas correlaciones. En el primer caso, el coeficiente de correlación (r) fue de 0,945 y la ecuación de regresión lineal y = 2,595 + 0,929x (n = 38). Para el segundo estudio se obtuvieron los siguientes resultados: y = 0,305 + 0,834x; (n = 34). El coeficiente de correlación (r) en este caso fue de 0,912.
Si se utiliza como referencia el valor crítico de la determinación enzimática de lecitina ( > 5,1 mg/dL), el método propuesto presenta una probable madurez a partir de 7,3 mg de FLC por 100 mL de líquido amniótico. Sin embargo, para aumentar el margen de seguridad en el diagnóstico se puede establecer un valor crítico de >8,0 mg/dL. Actualmente se realizan estudios para reforzar los hallazgos, con el fin de evaluar la utilidad práctica.
En resumen, el método propuesto provee una serie de ventajas sobre las otras metodologías para evaluar madurez pulmonar: poco volumen de muestra, rápido, relativamente económico y reactivos estables. Los datos obtenidos indican que el método es lineal y reproducible dentro del intervalo en el que se espera encontrar los valores de las muestras. Los estudios comparativos con la determinación enzimática de lecitina y con el método de lisis por lisolecitina muestran una buena correlación. Por todo lo anterior, consideramos que la determinación de FLC en líquido amniótico podrìa ser una alternativa adecuada para evaluar madurez pulmonar fetal.
Referencias
1. Herbert WNP, Chapman JFA, Schnoor MM: Role of the TDx FLM assay in fetal lung maturity. Am J Obstet Gynecol 1993;168:808-812. [ Links ]
2. Ashwood ER: Evaluating health and maturation of the unborn: The role of the clinical laboratory. Clin Chem 1992;38 (8):1523-1529. [ Links ]
3. Gluck L, Kulovich MV, Borer RC, et al.: Diagnosis of the respiratory distress syndrome by amniocentesis. Am J Obstet Gynecol 1971;109:440-445. [ Links ]
4. Estol P: Diagnóstico de maduración pulmonar. Salud perinatal. CLAP OPS/OMS 1987; [ Links ]
5. Bhagwanani SG, Fahmy D, Turnbull AC: Prediction of neonatal respiratory distress by estimation of amniotic fluid lecithin. Lancet 1972;i.:159-163. [ Links ]
6. Gluck L, Kulovich MV: Lecithin and sphingomyelin ratios in amniotic fluids in normal and abnormal pregnacy. Am J Obstet Gynecol 1973;115:539-546. [ Links ]
7. Gluck L, Kulovich MV, Borer MC, Keidel WN: The interpretation and significance of the lecithin/sphingomyelin ratio in amniotic fluid.. Am J Obstet Gynecol 1974;120:142-155. [ Links ]
8. Kohl HH, Telander DH, Roberts EC, Elliot HC: Modified method for estimating the lecithin/sphingomyelin ratio in amniotic fluid. Clin Chem 1978;24:174-178. [ Links ]
9. Coch E, Meyer JS, Goldman G, Kessler G: A modified procedure for evaluation of the lecithin/sphingomyelin ratio in amniotic fluid. Clin Chem 1973;19:967-971. [ Links ]
10. Blass KG, Thibert RJ, Draisey TF: Simple, rapid determination of lecithin/sphingomyelin ratio in amniotic fluid. Clin Chem 1973;19:1394-1397. [ Links ]
11. Sarkozi L, Kovacs HN, Fox HA, Karenyi T: Modified method for estimating phosphatidylcholine: sphingomyelin ratio in amniotic fluid, and its use in assessment of fetal lung maturity. Clin Chem 1972;18:956-960. [ Links ]
12. Dubin SB: The laboratory assessment of fetal lung maturity. Am J Clin Pathol 1992;97:836-849. [ Links ]
13. Clements JA, Platzker ACG, Tierney DF, et al.: Assessment of the risk of the respiratory distress syndrome by a rapid test for surfactant in amniotic fluid. N Engl J Med 1972;286:1077-1081. [ Links ]
14. Turner RJ, Read JA: Practical use and efficiency of amniotic fluid OD 650 as a predictor of fetal pulmonary maturity. Obstet Gynecol 1983;61:551-555. [ Links ]
15. Shinitzky M, Goldfisher A, Bruk R: A new method for assessment of fetal lung maturity. Br J Obstet Gynecol 1976;83:833-844. [ Links ]
16. Hallman PR, Gross TL: Laboratory and clinical evaluation of a rapid slide aglutination test for PG. Am J Obstet Gynecol 1985;151:1061-1066. [ Links ]
17. Coapman-Hankin R, Kiechle FL, Epstein E, Artiss JD, Zak B: Three methods compared for determining phosphatidylglicerol in amniotic fluid. Clin Chem 1985;31:1374-1376. [ Links ]
18. Haruld DA, Reed A: Interference by endogenous glicerol in enzimatic assay of PG in amniotic fluid. Clin Chem 1988;34:560-563. [ Links ]
19. Artiss J, et al.: Enzimic colorimetric determination of PG in amniotic fluid. Clin Chem 1984;30:534-537. [ Links ]
20. Mc Gowan WM, Artiss JD, Zak B: Enzimatic colorimetric of lecithin and sphingomyelin in aqueos solution. Clin Chem 1983;29:1513-1518. [ Links ]
21. Ashwood ER, Oldroyd RG, Palmer SE: Measuring the number of lamellar body particles in amniotic fluid. Obstet Gynecol 1990;75:289-292. [ Links ]
22. Bowie LJ, Shammo J, Dohnal JCe: Lamellar body density and the prediction of respiratory distress. Am J Clin Pathol 1991;95:781-786. [ Links ]
23. Takayama M, Itch S, Nagasaki T, Tanimuru I. A new enzimatic method for determination of serum choline containing phospholipids. Clin Chim Acta 1977; 79:93-98. [ Links ]
24. Pesce AJ, Kaplan LA: Amniotic fluid phospholipid, L/S ratio and PG. Methods in Clinical Chemistry, St. Louis, Mosby Company; 1987: [ Links ]
25. Diedrich K, Hepp S, Welker H: Enzymatische Bestimmung von Lecithin in amniotischem Fluid. Geburtsh u Frauenheilk 1979;39:849-856. [ Links ]
26. Diedrich K, Evans SE, Fiebich H, et al: Workshop report. Test combination Lecithin enzymatic: Enzimatic determination of lecithin in amniotic fluid for the assessment of fetal lung maturity, Germany, Boehringer Mannheim; 1981: [ Links ]
27. Schosinsky K, Metzner H, Jiménez M. Cuantificación de lecitina en líquido amniótico mediante el efecto lítico de la lisolecitina. Acta Bioq Clin Lat. En prensa. [ Links ]
28. Kulovich MV, Gluck L: The lung profile: Complicated pregnancy. Am J Obstet Gynecol 1975;135:64-69. [ Links ]
29. Torday J, Carson L, Lawson E: Saturated phosphatidylcholine in amniotic fluid and prediction of the respiratory distress syndrome. N Engl J Med 1979;301:1013-1018 [ Links ]
30. Statland BE, Sher G: Reliability of amniotic fluid surfactant measurements. Am J Clin Pathol 1985;83:382-384. [ Links ]
31. Anaoker S, Garry PJ and Standefer JC. Enzymic assay for lecithin in amniotic fluid. Clin Chem 1978; 25:103-107. [ Links ]
32. Falconer GF, Hodge JS, and Gadd RL. Influence of amniotic fluid volumen on lecithin stimation in prediction of respiratory distress. Br Med J 1973; ii:689-694. [ Links ]
33. Gressner A M und Pick-Kober K-H: Praenatalperiode, in Greiling H und, Gressner AM (eds): Lehrbuch der Klinischen Chemie und Pathobiochemie. Stuttgart, Schattauer; 1989:535-589. [ Links ]
* Correspondencia Departamento de Análisis Clínicos, Facultad de Microbiología, Universidad de Costa Rica.













