Introducción
La especie de coral Orbicella (= Montastraea) annularis (Ellis & Solander, 1786) es representativa de los arrecifes coralinos del Parque Nacional Natural Los Corales del Rosario y de San Bernardo (PNNCRSB), Colombia (Alvarado-Chacón & Acosta, 2009). Es esencial para este ecosistema por su morfología tridimensional, lo que promueve mayores funciones geo-ecológicas (Perry & Álvarez-Filip, 2019). Sin embargo, sus poblaciones se enfrentan a un futuro incierto debido al bajo reclutamiento (Bruckner & Bruckner, 2006; Edmunds & Elahi, 2007; Rogers et al., 2008), así como a la presencia de factores adversos como el incremento en la temperatura del agua (Chua et al., 2013; Levitan et al., 2014), el sedimento suspendido (Restrepo & Alvarado, 2011), la contaminación (Vega-Thurber et al., 2013) y la presencia de algas filamentosas que comprometen la salud de las colonias, la actividad reproductiva y el desarrollo de gametos (Cetz-Navarro et al., 2015). Actualmente se considera como una especie en riesgo (UICN, 2022).
Dentro del portafolio de investigación y monitoreo formulado por la administración del PNNCRSB, como estrategia de restauración de los arrecifes coralinos, se ha considerado prioritario la reproducción de especies de coral por la vía asexual a partir de generación de fragmentos, así como por la vía sexual con crías a partir de zigotos. Con el primer método se obtienen colonias de coral en tiempos cortos (menos de dos años) usando fragmentos o microfragmentos (Page et al., 2018), mientras que con el segundo se promueve la diversidad genética a través de la cría de larvas y reclutas con la consecuente generación de un gran número de individuos. Sin embargo, las bajas tasas de sobrevivencia post-asentamiento de las larvas y reclutas trasplantados al arrecife continúan siendo un desafío en el cual se ha venido trabajando (Cameron & Harrison, 2020; Howlett et al., 2021; Martinez & Abelson, 2013; Szmant & Miller, 2006).
Durante las primeras fases de desarrollo, se estima que por depredación y dispersión de larvas durante su fase planctónica, menos del 0.1-0.001 % de la progenie se asienta y sobrevive a tamaño adulto (Harrison & Wallace, 1990; Jones et al., 2009). Sin embargo, autores como Gouezo et al. (2019) afirman que la baja tasa de asentamiento y reclutamiento se compensa por las grandes cantidades de gametos liberados y millones a trillones de larvas, lo que resulta en un reclutamiento adecuado para el mantenimiento de las poblaciones y permite la recuperación del ecosistema. Aun así, investigaciones recientes en biología reproductiva de corales sugieren que el suplemento de larvas producidas sexualmente no es suficiente para sostener a los arrecifes de coral (Gardner et al., 2003; Hughes et al., 2003; Ritson-Williams et al., 2009).
Precisamente, los cuellos de botella demográficos más severos ocurren durante las fases de desarrollo temprano (Doropoulos et al., 2016), que inician con la fertilización externa o interna con lo cual se forma el embrión. Esta primera fase temprana del desarrollo, i.e., embriogénesis, se evidencia con la presencia de blastómeros producidos durante los clivajes hasta la formación de la mórula, la blástula, la gástrula y finalmente una larva plánula (Fritzenwanker et al., 2007). Durante este tiempo hay una fase crítica de mortalidad entre el clivaje con ocho blastómeros y la gástrula temprana (Randall & Szmant, 2009). Posterior al desarrollo embrionario, la larva inicia la selección de un sustrato para reclutarse y en ese proceso experimenta una metamorfosis, con cambios morfológicos y fisiológicos, para convertirse en pólipo primario bentónico (Ritson-Williams et al., 2009). En esta fase hay dos condiciones importantes que influyen en la tasa de asentamiento. La primera, es que la sobrevivencia, motilidad, diferenciación celular y potencial crecimiento en larvas lecitotróficas no zooxanteladas y sin alimentación, recae en las reservas dadas maternalmente (Gleason & Hoffmann, 2011). La segunda, es que la presencia de algas calcáreas y las biopelículas bacterianas en el sustrato generan señales bióticas fundamentales para estimular el asentamiento y la metamorfosis de las larvas (Peng et al., 2020; Ritson-Williams et al., 2014; Ritson-Williams et al., 2016). En la etapa de post-asentamiento ocurre una segunda fase crítica de mortalidad debida al pequeño tamaño de los pólipos y a su alta vulnerabilidad (Ritson-Williams et al., 2009; Vermeij & Sandin, 2008), así como al efecto de numerosos factores bióticos y abióticos como la depredación, competencia, temperatura, calidad del agua, luz, entre otros (Ricardo et al., 2020; Ritson-Williams et al., 2014).
Actualmente, existe información sobre el desarrollo temprano de algunas especies de corales del Caribe como Acropora sp. (Oken, 1815), Acropora cervicornis (Lamarck, 1816), Diploria labyrinthiformis (Linnaeus, 1758), Dendrogyra cylindrus (Ehrenberg, 1834) y Orbicella faveolata (Ellis & Solander, 1786) (Hayashibara et al., 1997; Marhaver et al., 2015; Chamberland et al., 2016; Alvarado-Chacón et al., 2020; Rada-Osorio et al., 2022). Sin embargo, para otras especies es escasa, así como a nivel local y en diferentes regiones del Caribe. En este sentido, los estudios de las etapas tempranas de desarrollo resultan importantes, especialmente para el cultivo de larvas como estrategia de restauración, ya que, aunque las fases son similares entre especies de los grandes clados (Robusta y Compleja), el proceso tiene duración variable (Okubo et al., 2013). Por otra parte, las bajas tasas de reclutamiento de O. annularis, así como la alta mortalidad actual de colonias adultas en varias localidades del Caribe (Edmunds & Elahi, 2007), realzan la importancia de conocer su desarrollo temprano para contribuir con los esfuerzos de programas de restauración. Por lo anterior, aprovechando el trabajo de propagación larval en alianza con SECORE International, y como parte del proyecto ''Cría de larvas de coral en el Parque Nacional Natural Los Corales del Rosario y San Bernardo (2021-2021)” el objetivo de este estudio fue describir las fases y tiempos del desarrollo del embrión y la larva del coral O. annularis, así como las tasas de asentamiento y sobrevivencia post asentamiento.
Materiales y métodos
Área de estudio: Este estudio se llevó a cabo en el Parque Nacional Natural Los Corales del Rosario y de San Bernardo (PNNCRSB), Cartagena, Colombia. La recolecta de los gametos se realizó en tres sitios en la barrera arrecifal norte de Isla Grande: Latifundio (10°11'6.756”N - 75°44'23.553” W), Ministerio (10°11'1.72”N - 75°43'53.072”W) e Isla Fiesta (10°11'8.711”N - 75°43'4) (Fig. 1)
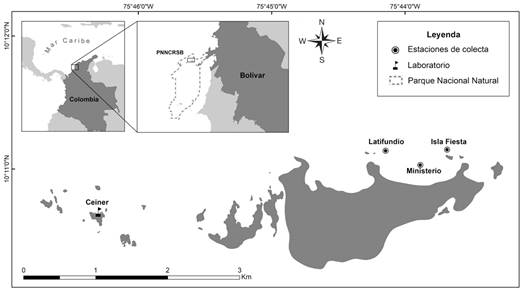
Fig. 1 Ubicación de las estaciones de colecta de gametos y del laboratorio del CEINER dentro del área del PNNCRSB. / Fig. 1. Location of the gamete collection stations and the CEINER laboratory within the area of the PNNCRSB.
Recolección de gametos y fertilización asistida: Para el seguimiento de los desoves de O.annularis se usó el calendario propuesto por Vermeij et al. (2021) para el sur del Caribe. El 26 de septiembre del 2021 (seis días después de luna llena, DLL), entre 185 y 250 minutos después de la puesta de sol, se observó el desove en doce colonias (cuatro en cada sitio), pero solo se recolectaron las bolsas gaméticas de ocho (Tabla 1), utilizando gametotrampas cónicas con tubos falcon de 50 ml en la parte superior. Las bolsas gaméticas fueron transportadas al laboratorio del Centro de Investigación Educación y Recreación (CEINER), en donde se realizó la fertilización cruzada y la observación de la embriogénesis hasta la fase de asentamiento, siguiendo la metodología estándar de cultivo larvario (Marhaver et al., 2017). La fertilización se realizó en cuatro separadores de grasa de 1 litro, en donde se repartieron y mezclaron las bolsas gaméticas de las ocho colonias, agitando suavemente con una pipeta plástica para romperlas. Los ovocitos flotaron mientras que el esperma se dispersó en la columna de agua, la cual tomó un color grisáceo. Después de 30 minutos, para evitar la poliespermia, se ajustó la concentración de espermatozoides utilizando el color del agua como indicador (Banaszak et al., 2018), el cual pasa de grisáceo a color limonada transparente usando recambios de agua de mar filtrada.
La fertilización se confirmó bajo un microscopio después de 1 h y 11 min. Posteriormente, usando una caja de Petri que se introducía en los separadores de grasa, se tomaron pequeñas alícuotas de agua que contenían aproximadamente 1 000 embriones, los cuales fueron transferidos a contenedores plásticos desechables con tapa de 1 000 ml, en una densidad aproximada de 1 embrión por ml. En total se usaron 40 contenedores. Con el fin de evitar la contaminación por bacterias, los contenedores plásticos se limpiaron periódicamente con una pipeta plástica y vinipel (film plástico de polietileno) para extraer el exceso de grasa y materia orgánica. Los recambios de agua total o parcial se empezaron a realizar aproximadamente 8 h después de la fertilización y se continuaron haciendo únicamente en aquellos contenedores en los que se observaba grasa, producto de la mortalidad. Para ello se utilizó un filtro de 100 µm para evitar la pérdida de embriones en el proceso.
Embriogénesis y pre-asentamiento: El desarrollo de embriones y larvas se documentó observando, fotografiando y registrando su comportamiento bajo microscopio y estereoscopio en intervalos de 30 minutos durante las primeras siete horas, cada hora las siguientes 24 horas y cada tres horas de ahí en adelante, hasta la fase de pre-asentamiento. Para lo anterior se tomaron al azar alícuotas de 1 ml con una pipeta pasteur que se disponían en portaobjetos o en cajas de petri, según el tamaño de los embriones/larvas. Cuando las larvas realizaron movimientos verticales en la columna de agua (4 días después de fertilización), se trasladaron a tanques disponibles de 200 l (tanque 1), 18 l (tanque 2) y 50 l (tanque 3) con agua de mar filtrada, obtenida de un sistema de captación de 30 m de profundidad y tamizada por cartuchos de 200, 50 y 5 micras. Previo al traslado de las larvas, se agregaron a los tanques sustratos de baldosas de cerámica tanto lisas como rugosas de aproximadamente 8 cm2, los cuales, durante tres meses previos, habían sido puestos en el arrecife sobre fondos con presencia de algas coralináceas costrosas (ACC) (Rada-Osorio et al., 2022). El número de larvas sembradas se estimó teniendo en cuenta el conteo de larvas competentes por ml, el volumen total de los 40 contenedores y el número de sustratos por tanque (E. Avila, comunicación personal, 2021). Se registró el porcentaje de asentamiento y supervivencia una vez cada 24 h.
Asentamiento y sobrevivencia post-asentamiento: Para el asentamiento se emplearon 126 sustratos distribuidos en tres tanques. Cada sustrato fue rotulado y monitoreado para cuantificar el asentamiento durante los primeros días. Al quinto día después de la siembra, todos los sustratos se monitorearon tanto en la parte superior como en la inferior y se contó el número de larvas asentadas, con lo cual se estimó el porcentaje de asentamiento en relación con el número de larvas sembradas en cada tanque. La preferencia de asentamiento por superficie se analizó por medio de una prueba t para muestras independientes, luego de la transformación de los datos a logaritmo. En total se sembraron 65 840 larvas competentes (54 500 en tanque 1, 4 000 en tanque 2 y 7 340 tanque 3). Adicionalmente, se realizó la introducción de un fragmento vivo de 5 x 5 cm de O. annularis a cada tanque de siembra para promover la adquisición de las zooxantelas. Estos fragmentos fueron extraídos de una misma colonia.
Posteriormente, para facilitar el seguimiento, se realizaron mapas del posicionamiento aproximado de cada recluta sobre las placas. Para evitar la pérdida y desprendimiento de las larvas, diariamente se tomaron entre 5 y 10 sustratos al azar (de acuerdo con el volumen del tanque) y se registró el número de pólipos. La sobrevivencia post-asentamiento tuvo en cuenta las larvas asentadas diariamente en relación con el número total de larvas asentadas al día cinco y el resultado se expresó en porcentaje. Adicionalmente se registró el tiempo (en días), en que las larvas evidenciaron por primera vez metamorfosis, desarrollo del pólipo y la aparición del esqueleto básico, así como la incorporación de simbiontes y la fusión de pólipos.
Resultados
Observación del desove: De las 64 colonias monitoreadas, 12 desovaron el 26 de septiembre de 2021 (día seis DLL). El desove inició a las 20:56 (hora local) y finalizó a las 21:54, con un pico de liberación entre las 21:30 y las 21:45 (Tabla 1). La ventana de tiempo para el desove fue de 186 a 215 minutos después del ocaso.
Tabla 1 Detalle de los tiempos de desove de Orbicella annularis el día seis DLL (26 de septiembre de 2021). / Table 1. Details of Orbicella annularis spawning times six days after a full moon (DAFM) (September 26th of 2021).
| Sitio | Colonias observadas | Colonias que desovaron | Ventana de desove |
| Latifundio | 24 | 4 (4) | 21:02 - 21:50 |
| Ministerio | 20 | 4 (1) | 21:05 - 21:50 |
| Isla Fiesta | 20 | 4 (3) | 20:56 - 21:54 |
En paréntesis se muestra el número de colonias de las que se colectaron gametos. / The number of colonies from which gametes were collected is shown in parentheses.
Embriogénesis y pre-asentamiento: Los oocitos de Orbicella annularis (Fig. 2A) fueron fertilizados a las 23:11 h (tiempo local). La primera división resultó en dos blastómeros iguales (Fig. 2B) 1:11 horas después de la fertilización (hDF). Las divisiones subsecuentes después de 4 hDF produjeron embriones de 4-32 blastómeros (Fig 2C - 2G) y más de 32 (2H). La mórula presentó una forma irregular (Fig. 2I) y a partir de esta, los embriones se volvieron más o menos esféricos, con el pseudo-blastoporo aparente (visto como un espacio blancuzco) después de 7.32 hDF (Fig. 2J). Posteriormente, se observaron las larvas esféricas aun con blastoporo entre 18 y 32 hDF (Fig. 2K - 2M). Los embriones exhibieron una forma irregular con presencia del blastoporo/poro oral (sensu Okubo et al., 2013) a las 36 hDF. La formación de larvas plánulas tempranas completamente alargadas y ectodermo evidente ocurrió después de 58 hDF (Fig. 2N, Fig. 2O). Finalmente, las plánulas presentaron metamorfosis completa, con poro oral evidente luego de 105 hDF (Fig. 2P). Así, la embriogénesis completa se desarrolló en 9 hDF, mientras que el desarrollo de la larva tomó 53 horas más (Tabla 2). Cuatro días DF las larvas comenzaron a nadar hacia el fondo, iniciando la metamorfosis.
Tabla 2 Etapas del desarrollo embrionario de O. annularis. / Table 2. Stages of embryonic development of O. annularis.
| Estadio | Tiempo DF (h) | Porcentaje por estadio | Imagen (Fig. 2) |
| Ooocitos | 0 h DF | A | |
| Primer clivaje, 2 blastómeros | 1:11 h DF | 70 | B |
| Segundo clivaje, 4 blastómeros | 1:26 h DF | C, D | |
| 8 blastómeros | 2:05 h DF | 70 | E |
| 16 o más blastómeros | 3:59 h DF | 60 | F-H |
| Mórula | 4:25 h DF | 70 | I |
| Presencia de pseudo-blastoporo | 7:32 - 8:49 h DF | 100 | J |
| Inicio de larva esférica, presencia de blastoporo | 18:03 - 31:04 hDF | 95 | K, L, M |
| Elongación del embrión, presencia de poro oral | 36:54 h DF | N | |
| Plánula temprana completamente alargada, ectodermo evidente | 58:49 h DF | 100 | O |
| Larva metamorfoseada, blastoporo evidente | 104.59 h DF | P |
DF: Después de la fertilización. / DF: After fertilization.
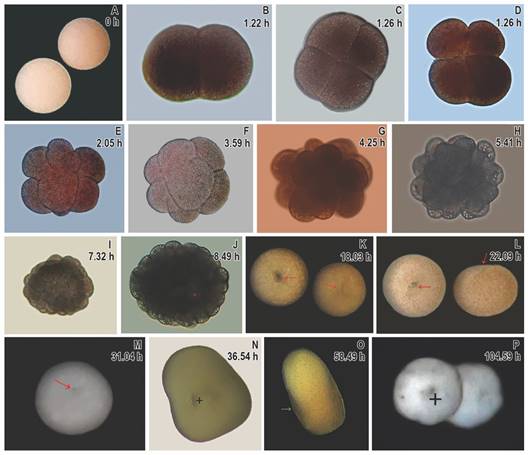
Fig. 2 Desarrollo embrionario de Orbicella annularis. A. oocitos, B. embrión de dos células, C. embrión en segundo clivaje, D. blastómeros completamente divididos, E. 8 blastómeros F. 16 blastómeros, G. embrión con más 32 células, H. embrión irregular con muchas células, I. Mórula, J. embrión con inicio de invaginación, K. embrión esférico con blastoporo claramente visible (flecha roja), L. invaginación del blastoporo, M. embrión en forma esférica, con depresión correspondiente a la invaginación del blastoporo, N. plánula alargada con blastoporo/poro oral visible (+), O. plánula alargada con ectodermo evidente (flecha verde) y P. larva metamorfoseada, con poro oral evidente (+). / Fig. 2. Embryogenesis of Orbicella annularis. A. oocytes, B. two celled embryo, C. second cleavage embryo, D. fully divided blastomeres, E. eight blastomeres, F. 16 blastomeres, G. embryo with more than 32 cells, H. irregular embryo with many more cells, I. morula stage, J. embryo with initial invagination, K. spherical embryo with evident blastopore (red arrow), L. blastopore invagination, M. spherical embryo with depression corresponding to the invagination of the blastopore, N. elongated planula with a visible blastopore/oral pore (+), O. elongated planula with evident ectoderm (green arrow), P. metamorphosed larvae with an evident oral pore (+).
Asentamiento y sobrevivencia post-asentamiento: El asentamiento se observó a partir del día seis y hasta el día diez DF. La metamorfosis se evidenció con la contracción de la plánula alargada con una forma de flor (Fig. 3A) para luego expandirse de forma irregular (Fig. 3B, día 10). Posteriormente se observó una compresión en sentido oral-aboral presentando una forma plana y transparente, con una parte circular incolora en el centro que posteriormente dio lugar a la formación de la boca (Fig. 3C; día 11). Los tentáculos empezaron a crecer alrededor de la boca y a extenderse hacia afuera (Fig. 3D; día 12) y en el día 13 se evidenció el desarrollo de una placa basal calcárea desarrollada alrededor de los pólipos (Fig. 3E). El pólipo primario estuvo completo 12 días después del asentamiento (Fig. 3F; día 18). Entre los días 21 y 25 se inició la incorporación de simbiontes en los tejidos de los pólipos (Fig. 3G y Fig. 3H) y a partir del día 30 y hasta el día 40, se pudo observar la fusión de algunos pólipos adyacentes (Fig. 3I; día 32).

Fig. 3 Desarrollo y crecimiento del pólipo primario. A. larvas inmediatamente después del asentamiento, inicio de la metamorfosis, B. pólipos expandidos de manera irregular, C. pólipos aplanados, formación de boca y brotes de tentáculos, D. crecimiento y extensión de los primeros tentáculos, E. desarrollo del esqueleto básico del pólipo, F. pólipo primario completamente formado, G. incorporación inicial de simbiontes en la superficie oral del pólipo, H. simbiontes presentes en por todo el cuerpo del pólipo exhibiendo pigmentación y, I. evidencia de fusión entre pólipos adyacentes. / Fig. 3. Growth and development of the primary polyp. A. larvae immediately after settlement, metamorphosis start, B. irregularly expanded polyps, C. flattened polyps showing, mouth and tentacles formation, D. growth and extensions of first tentacles, E. polyp basic skeleton development, F. fully formed primary polyp, G. symbionts incorporation on the oral surface of the polyp, H. symbionts present in the polyp body exhibiting pigmentation, and I. evidence of fusion between adjacent polyps.
Se contabilizó un total de 3 467 larvas asentadas (5.27 %) en 80 sustratos de los 126 acondicionados (63.5 %). Las larvas aprovecharon todo el contorno de los sustratos (superficies expuestas, no expuestas y bordes), sobre ACC y sobre sustratos desprovistos (Tabla 3). No se encontró preferencia de asentamiento entre superficie expuesta y no expuesta de los sustratos (t = 1.37, P = 0.169). La sobrevivencia de las larvas recién asentadas se ajustó a un modelo logarítmico negativo, con una rápida disminución en los primeros días y posteriormente una estabilización, con un cambio del 12.36 % al 3.87 % ± 1.93 SE después de 20 días, la supervivencia post asentamiento de las larvas se encontró entre el 30 y 50 % y al día 38 fue de 35 % (Fig. 4).
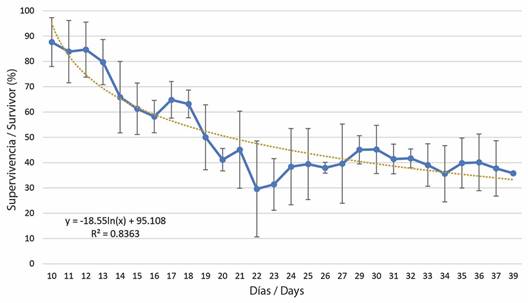
Fig. 4 Sobrevivencia post-asentamiento de las larvas de Orbicella annularis asentadas en sustratos artificiales. Barras representan desviación estándar. / Fig. 4. Post-settlement survival of settled larvae of Orbicella annularis on artificial substrates. Bars represent standard deviation.
Con una densidad de siembra similar entre 0.27 y 0.22 larvas/ml para volúmenes de 200 l (tanque 1) y 28 l (tanque 3), se obtuvo un porcentaje de 50.2 % de sobrevivencia post-asentamiento. De igual manera, con volúmenes de siembra de 0.27 y 0.15 larvas/ml para volúmenes de 200 l (tanque 1) y 50 l (tanque 2) solo se observó una diferencia del 7.8 % (Tabla 3). El conteo final de todas las placas con pólipos se realizó a los 41 días después de la fertilización registrando un total de 955 pólipos vivos, que se estimó como una sobrevivencia post-asentamiento de 27.5 %. Finalmente, 29 sustratos con 772 pólipos fueron trasplantados al arrecife de Isla Grande en un área delimitada de 20 m2.
Tabla 3 Resumen del asentamiento y sobrevivencia de Orbicella annularis. / Table 3. Summary of settlement and survival of Orbicella annularis.
| VTQ | LS | dL | PL | LA | % A | LPA | % SPA | % SS | |
| TQ1 | 200 | 54 500 | 0.27 | 31 | 2 751 | 5.05 | 787 | 28.61 | 1.44 |
| TQ2 | 18 | 4 000 | 0.22 | 16 | 174 | 4.35 | 25 | 14.37 | 0.63 |
| TQ3 | 50 | 7 340 | 0.15 | 33 | 542 | 7.38 | 143 | 26.38 | 1.95 |
| Total | n/a | 6 5840 | n/a | 80 | 3 467 | 5.27 | 955 | 27.55 | 1.45 |
TQ: tanque, VTQ: volumen del tanque (l), LS: número de larvas sembradas, dL: densidad de larvas sembradas (larvas/ml), PL: placas con asentamiento de larvas, LA: número de larvas asentadas, % A: porcentaje promedio de asentamiento, LPA: número de larvas post-asentamiento, % SPA: sobrevivencia post-asentamiento, % SS: sobrevivencia de pólipos desde siembra hasta el día 41. / TQ: tank, VTG: tank volume (l), LS: number of larvae added to each tank, dL: larvae density in each tank (larvae/ml), PL: substrates with settled larvae, LA: number of settled larvae, % A: mean percentage settlement, LPA: number of post-settlement larvae, % SPA: survival post-settlement percentage, % SS: polyps survival form seeding until day 41.
Discusión
Embriogénesis y pre-asentamiento: El desarrollo embrionario de O. annularis sigue el esquema general de los corales, con división de las células que se reconoce por medio del número de blastómeros (2, 4, 8, 16-32, 32-64) y que termina en la formación de la mórula (Okubo & Motokawa, 2007; Okubo et al., 2013; Ying et al., 2018). Estudios previos registran clivajes en lapsos de entre 30 y 50 min (Fritzenwanker et al., 2007; Marhaver et al., 2015) después de la primera división, la cual, a su vez, sucede antes de las dos horas después de la fertilización, e.g., Diploria labyrinthiformis a los 40 min (Chamberland et al., 2016), Orbicella faveolata una hora después (Alvarado-Chacón et al., 2020), Dendrogyra cylindricus a la hora y 10 min (Marhaver et al., 2015) y Acropora cervicornis (Calle-Triviño et al., 2018) y Goniastrea favulus (Okubo et al., 2013) a las 2 horas. En el presente estudio, el 70 % de los embriones presentaba dos blastómeros, una hora y 11 minutos después de la fertilización, y ya presentaba algunos embriones con cuatro células. Antes de las nueve hDF los embriones estaban en fase de mórula, coincidiendo con registros para especies de corales (Okubo et al., 2013), octocorales (Rakka et al., 2021) y anémonas (Fritzenwanker et al., 2007).
Como se esperaba para un coral robusto (sensu Okubo et al., 2013; con calcificación masiva) se presentó uno de los dos patrones de clivaje más comunes en los cnidarios para la gastrulación, que empieza con el aplanamiento de la mórula y la migración de las células hacia la periferia, formando una especie de ''depresión” que es el inicio del blastocele, dándole una apariencia de cuenco vacío, conocido como coeloblastula o blástula hueca (Yuan et al., 2008), que después retoma la forma esférica presentando el pseudoblastoporo. Tal como se evidenció en el proceso embriogénico de O. annularis, y de acuerdo con lo descrito por Yuan et al. (2008), Bhattacharya et al. (2016), Ying et al. (2018), entre otros, a continuación, comienza una segunda invaginación que implica el movimiento masivo de las células internas para formar el endodermo y el blastoporo iniciando así la fase temprana de la gástrula (Technau, 2020; Ying et al., 2018). Este proceso de invaginación-evaginación en ciclos hasta llegar a gástrula, concuerda con la excelente descripción de Fritzenwanker et al. (2007) con un embrión de 64 células-mórula-blástula a gástrula-, presencia de cilios y movimiento circular en 17-20 horas.
El tiempo para llegar a la gástrula tardía con el blastoporo y la elongación en O. annularis a las 40 hDF, coincide con los encontrados por Alvarado-Chacón et al. (2020) para O. faveolata, y la descripción general del fin de la gástrula y de la embriogénesis e inicio de la plánula y la vida larval (Ball et al., 2002) que empieza con movimientos verticales. El tiempo para llegar a esta fase larval (58 hDF), es similar al reporte para otras especies para las cuales se han realizado estudios de embriogénesis y desarrollo larval, por ejemplo, Acropora cervicornis (57 hDF, Calle-Triviño et al., 2018), Montipora capitata (43-80 hDF, Vermeij et al., 2009), Orbicella faveolata (55 hDF, Alvarado-Chacón et al., 2020). Para el día cuatro (4), la mayoría de las larvas ya están nadando en el fondo, dejando atrás la fase pelágica. Los registros para especies como Diploria labyrinthiformis (Chamberland et al., 2016), Acropora cervicornis (Calle-Triviño et al., 2018), y Orbicella faveolata (Alvarado-Chacón et al., 2020), de 103, 106 y 106 horas respectivamente, muestran también el inicio de la fase bentónica a los 4 días. Conocer los tiempos de desarrollo y el comportamiento de las larvas para el inicio del asentamiento, permite orientar los esfuerzos en las siguientes etapas en los programas de restauración, ya que define momentos propicios como el ofrecer los sustratos acondicionados para la fijación de los futuros reclutas.
Asentamiento: Como se indicó en la sección anterior, el inicio del asentamiento se evidenció a los cuatro días (104 hDF) y para el día seis (6), la mayoría de las larvas de O. annularis ya se encontraban en el fondo. Este tiempo coincide con los reportes para esta y otras especies liberadoras de gametos, con una fase larval planctónica de corta duración (4-6 dias) y asentamiento en unos pocos días después de la fertilización (Connolly & Baird, 2010; Doropoulus et al., 2019; Miller & Mundy 2003). Por ejemplo O. faveolata, con plánulas lecitotróficas, tiene una fase pelágica de al menos tres días (Vermeij et al., 2006), en D. labyrinthiformis inicia el día 4 después del desove (Chamberland et al., 2016) y al día cinco en A. cervicornis (Calle-Triviño et al., 2018). La mayoría de las larvas, luego de estos tiempos, son competentes (Connolly & Baird, 2010), después de lo cual la competencia declina (Davies et al., 2017; Miller & Mundy, 2003), indicando una mayor probabilidad de reclutamiento local. Las ventajas asociadas son un bajo gasto energético y el consecuente aumento en la sobrevivencia y crecimiento durante las fases de asentamiento y post-asentamiento (Connolly & Baird, 2010; Graham et al., 2013). No obstante, aunque algunas larvas pueden ser competentes por más tiempo (Miller et al., 2020; Wilson & Harrison, 1998) y por lo tanto, pueden dispersarse a grandes distancias (Davies et al., 2017), los tiempos cortos pueden ser muy significativos para la restauración a través de la propagación larval a gran escala, pues a los cuatro días ya están listas para asentarse, acortando el tiempo para metamorfosis y crecimiento con lo cual los costos y los tiempos de trabajo para la siembra en el arrecife, disminuyen.
La densidad de siembra es considerada igualmente una variable importante al evaluar el éxito del asentamiento. Al respecto, Edwards et al. (2010) aconsejan no exceder una densidad de 0.3 larvas ml-1. Para A. milleporaPollock et al. (2017) utilizaron densidades entre 0.2 y 1.0 larvas ml-1 encontrando baja mortalidad y mayor éxito de asentamiento a menor densidad de siembra. Sin embargo, Cameron & Harrison (2020) encontraron una relación positiva con respecto a la densidad de siembra. En este estudio, el asentamiento para O. annularis con una densidad promedio de siembra de 0.22 larvas ml-1 fue bajo en comparación con los estudios mencionados en la Tabla 4 (5.27 %), sin embargo, este porcentaje pudo haber sido subestimado ya que solamente se consideró la densidad de siembra por volumen sin estandarizar el número de sustratos por tanque. A futuro, es un factor importante por implementar para optimizar el éxito del asentamiento.
Tabla 4
Éxito de asentamiento de diferentes especies de coral bajo condiciones controladas. / Table 4. Settlement success of different coral species under controlled conditions.
Especie
Éxito del asentamiento (%)
Referencia
Acropora tenuis
16
Acropora cervicornis
10 - 15
Acropora millepora
15
Acropora palmata
9 - 15
80
21 - 38
Orbicella annularis
5.27
Este estudio
Orbicella faveolata
8 - 13
Porites astreoides
24
En nuestro estudio, las larvas se asentaron y metamorfosearon tanto sobre las superficies de ACC, como en sitios cercanos, sobre los bordes o en sitios desprovistos de ACC. Lo anterior coincide con lo reportado por van Woesik et al. (2014), aunque otros estudios han encontrado la preferencia adyacente a las ACC (Ritson-Williams et al., 2010) o directamente sobre la superficie de éstas (Morse et al., 1996). Este resultado puede estar relacionado con diferencias en la composición taxonómica de las ACC adheridas a las placas, las señales químicas que sintetizan y la composición microbiana que cohabitan sobre ellas (Jorissen et al., 2021; Tebben et al., 2015). Por lo tanto, definir las condiciones ambientales adecuadas y optimizar la presencia de sustratos aptos para el asentamiento, son procesos fundamentales a la hora de definir protocolos que maximicen la sobrevivencia post asentamiento de los corales (Craggs et al., 2019; Hancock et al., 2021; Pollock et al., 2017; Rahnke et al., 2022; Randall et al., 2020). A pesar de no haber realizado la identificación taxonómica de las ACC o la preferencia de asentamiento por una especie específica de ACC, se pudo observar cómo el previo acondicionamiento de los sustratos en el medio natural es necesario para proveer a las larvas donde asentarse. Lo cual permite a la vez, tener estimaciones cuantitativas para escalar en los esfuerzos en las siguientes etapas de restauración coralina.
Sobrevivencia post-asentamiento: La baja sobrevivencia post-asentamiento representa una dificultad para tener en cuenta en los esfuerzos de restauración. Para especies como O. faveolata, A. palmata y A. cervicornis (Miller et al., 2020) y Montipora capitata (Rahnke et al., 2022), o cuando se ha evaluado en forma generalizada varias especies (Doropoulos et al., 2016), se ha encontrado una alta mortalidad en tiempos similares a los registrados en este estudio para O. annularis (ca. 50 % en las dos primeras semanas), lo que es concordante con nuestros resultados. Este es un cuello de botella para mejorar en los esfuerzos de propagación larval.
Las consideraciones metodológicas que se han abordado para alcanzar restauraciones efectivas han sido numerosas, una de ellas es la densidad de larvas sembradas en los tanques de cultivo. En este estudio, se mostró que con una densidad similar y una gran diferencia en el volumen de los tanques (200 y 18 l), se redujo la sobrevivencia en 50.2 %, mientras que, al reducir densidad de siembra de acuerdo al volumen, se obtuvo sobrevivencias similares (28.61 % tanque de volumen 200 l y 26.38 % tanque volumen 50 l. Finalmente, a pesar de las enormes limitaciones logísticas y económicas, con 1.41 % de sobrevivencia, se obtuvieron 772 pólipos que fueron llevados al arrecife. Este porcentaje es similar al obtenido por Miller et al. (2021) para O. annularis en experimentos ex situ, con porcentajes de supervivencia del 1.41 a 1.45 % dos semanas después del asentamiento.
Consideraciones finales: Este trabajo es el primer acercamiento a la obtención de reclutas (pólipos primarios) de O. annularis a través del proceso de asentamiento de larvas producidas en condiciones de laboratorio en el Caribe colombiano. La información generada resulta importante para la cría de larvas a gran escala y así fortalecer los planes de restauración de arrecifes de coral a nivel regional. Por una parte, conocer los tiempos específicos para cada etapa, facilitan y optimizan los esfuerzos para el manejo de embriones, larvas y pólipos primarios. Por otra parte, saber cuándo se presentan los momentos críticos por mortalidad y, como consecuencia, dedicar mayores esfuerzos para determinar causas y disminuir sus efectos, serán indispensables para aumentar el número de reclutas obtenidos a través de la propagación larval. Por último, el haber obtenido un asentamiento del 5.7 % con una sobrevivencia del 1.4 % hasta el día 39 después de la fertilización, representa un alto número de nuevos reclutas sembrados en un área de restauración (20 m2), los cuales probablemente no se producirían en condiciones naturales. En resumen, el conocimiento del desarrollo de las etapas tempranas de los corales es esencial para poder realizar la cría de larvas.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


