Introducción
Los pulsos de inundación estacionales en sistemas fluviales son reconocidos como fuerzas principales que estructuran los sistemas biológicos en ambientes terrestres y acuáticos dentro de las llanuras aluviales (Junk & Wantzen, 2004; Pereira et al., 2017). Los pulsos de inundación contribuyen a la dinámica funcional, mantenimiento y diversificación de especies, producción y descomposición de biomasa, intercambio de materia orgánica y sólidos entre el canal principal y la llanura aluvial (Benke et al., 2000; Haynes et al., 1989). En ambientes acuáticos permanentes y semipermanentes asociados a llanuras aluviales como las “ciénagas” (lagos palustres poco profundos, con aguas estancadas y abundantes tapetes de vegetación acuática (Castellanos, 2001) el dinamismo hidrológico y geoquímico impulsado por las lluvias es capaz de generar cambios profundos en la estructura biológica de taxones acuáticos (Granado-Lorencio et al., 2012). Estos cambios pueden ser de naturaleza determinista o estocástica, dependiendo de la interacción de las variables ambientales abióticas, la tolerancia de las especies, la disponibilidad de microambientes y nichos ecológicos (Montoya et al., 2011). En la fauna de peces, por ejemplo, los pulsos de inundación promueven interconexiones de hábitat dentro de la llanura de inundación, con distribuciones de especies altamente estocásticas, con un patrón de organización limitado en la estructura de la comunidad (Araújo et al., 2009; Granado-Lorencio et al., 2012). Para el zooplancton, la influencia de los pulsos de inundación en la distribución y la estructura de la comunidad es muy heterogénea (Montoya & Aguirre, 2009), y poco se conoce de esta dinámica en regiones tropicales, donde existe amplia variedad de microambientes.
En Colombia, la región del Magdalena medio se caracteriza por extensas ciénagas, las cuales brindan servicios ecosistémicos como el mantener equilibrio entre ecosistemas terrestres y acuáticos a escalas regionales y brindar bienestar a las comunidades humanas (Garzón Yepes & Gutiérrez Camargo, 2013; Roldán & Ramírez, 2008). El desarrollo económico en Colombia depende en gran medida de las utilidades que se generan a partir de las ciénagas y del río Magdalena, por lo que constituyen sistemas ecológicos estratégicos y son patrimonio natural para el país (Garzón Yepes & Gutiérrez Camargo, 2013). Uno de los lagos palustres más importantes del Magdalena medio es la Ciénaga Río Viejo, un sistema permanente y relativamente grande (~ 4 km2), con una profundidad que no supera 10 m. Esta ciénaga está indirectamente conectada al río Magdalena y se encuentra fuertemente influenciada por el pulso de inundación, la cual determina sus niveles de agua y condiciones físico-químicas (Concejo Municipal Cimitarra Santander, 2016). Río Viejo es particularmente biodiverso en aves, peces y reptiles (Concejo Municipal Cimitarra Santander, 2016) y se caracteriza por abundante vegetación acuática flotante, semisumergida y sumergida que cubren parcialmente la superficie. La vegetación acuática favorece la presencia de microambientes, los cuales son determinantes en las asociaciones de Martens (Choi et al., 2014; Deosti et al., 2021). Los microambientes pueden ser heterogéneos en los ecosistemas tropicales y con alta complejidad estructural, por lo que son fundamentales en el mantenimiento de la estructura trófica, las relaciones micro y macro ecológicas y la conservación de la biodiversidad. A escala local y regional, los microambientes pueden generar un efecto positivo en la biodiversidad por su efecto mosaico (Chick & Mcivor 1994).
Los ostrácodos dulceacuícolas son microcrustáceos bivalvos (0.2 a 5.0 mm) que pueden habitar una variedad de sistemas acuáticos y semiacuáticos. En sistemas lóticos habitan en las zonas litorales, y a través del gradiente de profundidad e incluso en la columna de agua (Echeverría Galindo et al., 2019; Higuti & Martens, 2014; Higuti et al., 2010; Rosa et al., 2020). En sistemas acuáticos tropicales, son particularmente abundantes y diversos y se encuentran frecuentemente asociados a la vegetación flotante y sumergida (da Conceição et al., 2018; Higuti et al., 2007; Higuti et al., 2010).
Los ostrácodos se utilizan con frecuencia como bioindicadores de cambios ambientales recientes y pasados, debido a la sensibilidad del ensamble (diversidad y abundancia) a los cambios climáticos y antropogénicos, y al amplio registro fósil en secuencias sedimentarias lacustres y marinas (Butlin et al., 1998; Martins et al., 2018). A pesar de su importancia, el estudio de los ostrácodos en Colombia aún se encuentra en desarrollo y la comprensión de los aspectos ecológicos del grupo es fundamental para la investigación aplicada en el país. El presente estudio evalúa la relación de las fluctuaciones ambientales (físico-químicas) de microambientes en vegetación acuática flotante en la Ciénaga Río Viejo y los cambios en la composición del ensamble de ostrácodos asociados la vegetación, durante un ciclo anual del pulso de inundación.
Materiales y métodos
Área de estudio: La Ciénaga Río Viejo es un sistema permanente ubicado en el departamento de Santander, municipio de Cimitarra y forma parte de las planicies aluviales de la cuenca media del río Magdalena. La ciénaga se ubica geográficamente entre las coordenadas geográficas (6°34’0” N & 74°16’60” W), a una altitud de 87 m.s.n.m., y cubre un área de 4.17 km2 aproximadamente (ll. 1).
La ciénaga tiene una precipitación anual bimodal de gran amplitud, con dos estaciones lluviosas (abril-mayo y octubre-noviembre) y dos estaciones secas (diciembre-febrero y junio-agosto) (Criales-Hernández et al., 2020; Holdridge, 2000; Ricaurte et al., 2019). La precipitación promedio plurianual en la cuenca de Río Viejo es 3 151.8 mm año-1 (IDEAM, 2019). Según sus características físicas como el tipo de conexión con el río principal (Arias, 1985; Ducharmé, 1975), la Ciénaga Río Viejo es tipo III, esto es, un lago de llanura aluvial primaria indirectamente conectado a la cuenca media del río Magdalena (Roldán & Ramírez, 2008).
Medición de variables ambientales y colecta de material biológico: Los muestreos se realizaron durante cuatro periodos del pulso de inundación caracterizados por variaciones en la cantidad de precipitación pluvial y nivel de agua del sistema. Los periodos evaluados fueron: aguas altas en septiembre 2018, aguas bajas en febrero 2019, aguas en descenso en junio 2019 y aguas en ascenso en agosto 2019. Se establecieron tres sitios de muestreo en la Ciénega Rio Viejo, los cuales se determinaron como los microambientes en estudio (Fig. 1).
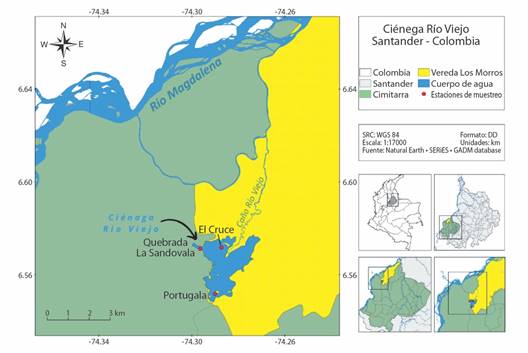
Fig. 1 Ubicación geográfica de la ciénaga Río Viejo, Cimitarra, Santander, mostrando los sitios de muestreo (Sandovala, El Cruce, Portugala). / Fig. 1. Geographic location of the Río Viejo swamp, Cimitarra, Santander, showing the sampling sites (Sandovala, El Cruce, Portugala).
La estación Sandovala se ubicó en el norte del sistema, cerca del afluente Quebrada Sandovala; la estación el Cruce se localizó en el centro de la ciénaga, cerca del efluente conectado al río Magdalena a través del caño Rio Viejo; y la estación Portugala en el sur, cerca del afluente temporal de la localidad de Puerto Olaya. En cada sitio se colocó un cuadrante de PVC de 1 m2 sobre la vegetación acuática flotante, sumergida y enraizada, para delimitar el espacio geográfico del microambiente.
Durante cada fase de inundación y en cada microambiente se midieron siete variables ambientales superficiales a una profundidad de 5 a 10 cm, para determinar la variabilidad ambiental relacionada con los periodos de inundación. Con una sonda multiparamétrica Lovibond SD-320 CON, se registró el oxígeno disuelto (OD mg L-1), saturación de oxígeno (SO %), temperatura (°C), conductividad eléctrica (μS cm-1). El pH se midió con una sonda Hatch a la misma profundidad. La transparencia del agua se registró con un disco Secchi y la profundidad máxima se midió con una ecosonda Hondex PS-7.
Se recolectó material biológico en los mismos microambientes. Dentro de cada cuadrante, se colectaron macrófitas acuáticas sumergidas y parcialmente sumergidas y se realizó el lavado de las raíces en una red de mano con un tamaño de malla de 250 μm. Se colectaron muestras durante los periodos más representativos de cada fase de inundación (e. g. mayor y menor cantidad de precipitación pluvial), asumiendo que serían los periodos con condiciones ambientales más contrastantes y, por lo tanto, con mayor variabilidad en la estructura de especies. Se identificaron y registraron las macrófitas, y las muestras de agua resultantes se fijaron in situ con etanol al 96 % y posteriormente, se conservaron en etanol al 70 % siguiendo el procedimiento de Baltanás (2004). Para evitar un posible incremento en la biodiversidad relacionada con el efecto mosaico, no se tomaron réplicas espaciales en los microambientes.
Identificación y caracterización del ensamble de ostrácodos: Se separaron, clasificaron y contaron ejemplares de ostrácodos adultos bajo un estereoscopio Zeiss SteREO Discovery V12. Individuos representativos de cada morfotipo se diseccionaron para su identificación. Los apéndices se montaron en una mezcla de glicerina y formol al 4 % en una concentración de 1:1. Las disecciones de las partes blandas se cubrieron con un cubreobjetos y posteriormente fueron selladas con el medio de montaje Entellan®. Las valvas se limpiaron manualmente con hidróxido de potasio 3 % y se almacenaron en placas micropaleontológicas. Se realizó el análisis de microscopía electrónica de barrido (MEB) en las valvas de las especies seleccionadas, utilizando el microscopio Jeol Jsm-6010 plus/LA de El Colegio de la Frontera Sur, Unidad Chetumal (México). Los organismos disectados y completos fueron depositados en la Colección Hidrobiológica del Museo de Historia Natural de la Universidad Industrial de Santander (UIS), con los siguientes números de colección MHN-UIS-2695 a MHN-UIS-3119. En este estudio, la colecta de organismos se realizó con el Permiso Marco de Recolección de Especímenes de Especies Silvestres de la Diversidad Biológica con Fines de Investigación Científica No Comerciales Resolución ANLA 004 de 22 enero 2015 de la Universidad Industrial de Santander.
La identificación taxonómica se realizó sobre los ejemplares adultos, con base en las características morfológicas de las valvas y los apéndices. Se consultaron claves taxonómicas proporcionadas por Karanovic (2012) y Meisch (2000), así como descripciones originales. La clasificación taxonómica se realizó siguiendo a Cohuo et al., (2017) y Meisch et al. (2019).
Análisis de datos: Previo al análisis estadístico se estandarizaron y normalizaron las variables en la base de datos, puesto que provienen de diferentes unidades de medida. Posteriormente, se determinó la normalidad usando la prueba de Shappiro-Wilkins y se evaluó la correlación de variables en el conjunto de datos con la prueba de Spearman. La variabilidad ambiental durante las fases hidrológicas del pulso de inundación se evaluó con un análisis de componentes principales (ACP). Se eliminaron variables que mostraron alta correlación y luego se probó la contribución de las variables no correlacionadas durante los cuatro períodos hidrológicos del pulso de inundación. Los cálculos y la ordenación final se realizaron en el software R 4.3.0 (R Core Team, 2023), el ambiente de trabajo RStudio v3.6.0 (RStudio Team, 2019), paquetes Vegan (Oksanen et al., 2022), Factoextra (Kassambara & Mundt, 2020) y ggplot (Wickham, 2016).
Para determinar diferencias significativas entre las abundancias de las especies de ostrácodos por microambiente y durante los periodos del pulso de inundación, se realizó un Análisis de Similitud (ANOSIM, por sus siglas en inglés) cruzado de dos vías con 9999 permutaciones, basado en una matriz de datos de rangos de disimilitud obtenidos mediante el índice de Bray-Curtis. Este análisis utiliza el valor P para evaluar la significancia y el valor R global para determinar la disimilitud entre y dentro de los grupos evaluados, esta prueba se realizó con el software Primer v7 (Clarke & Gorley, 2015). Se realizó una prueba de beta diversidad para determinar el recambio de especies entre periodos del pulso de inundación.
Para evaluar la relación entre las variables ambientales y el ensamble de especies, se realizó inicialmente un análisis de correspondencia sin tendencia (DCA) con tendencia por segmentos y re-escalado no lineal, con el fin de estimar la extensión del gradiente ambiental (Hill & Gauch, 1980). Este análisis permite evaluar si las abundancias de ostrácodos a lo largo del gradiente ambiental seleccionado responden a un patrón lineal o a uno unimodal para, de este modo, elegir el método de ordenación más apropiado para el conjunto de datos. En este caso, no se detectaron evidencias de un patrón unimodal por lo que se procedió a someter el conjunto de datos biológicos y ambientales completos a un análisis de redundancia (RDA). La ejecución se realizó usando los parámetros estandarizados y aplicando el método de selección directa, utilizando la prueba de permutación de Monte Carlo con 999 permutaciones (α = 0.05). Los cálculos de DCA, RDA y gráficos de ordenación se realizaron en el software Canoco V 5.0 (Ter Braak & Šmilauer, 2012).
Resultados
Caracterización y variabilidad ambiental en microhábitats de la ciénaga Río Viejo durante el pulso de inundación: Los microambientes analizados fueron relativamente homogéneos en relación con la composición de plantas parcialmente sumergidas. En todos los periodos de inundación, los sitios de muestreo se caracterizaron por la presencia de vegetación acuática como Eichhornia crassipes (Mart.) Solms, 1883, Azolla L. 1783., Limnobium cf. laevigatum Humb. & Bonpl. ex Willd. Heine., Ludwigia cf. helminthorrhiza (Mart.) Hara, 1953, Salvinia sp Ség. 1754, de hábito flotante, Utricularia L. 1753, de hábito sumergido y Paspalum L 1753, de hábito enraizado. Durante aguas altas se observó que el tapete vegetal estaba caracterizado por casi todas las especies observadas, en todos los microambientes en estudio, mientras que, en los demás períodos del pulso de inundación, el tapete vegetal estaba caracterizado por aproximadamente tres especies vegetales en cada microambiente. La Tabla 1, describe la composición vegetal en los microambientes estudiados.
Tabla 1 Presencia de vegetación acuática durante el pulso de inundación. Table 1. Presence of aquatic vegetation during the flood pulse.
| Periodo | Estación | Eichhornia crassipes | Utricularia sp. | Paspalum sp. | Ludwigia cf. helminthorrhiza | Salvinia sp. | Azolla sp. |
| Aguas altas | Sandovala | X | X | X | X | X | X |
| Portugala | X | X | X | X | X | ||
| Cruce | X | X | X | X | |||
| Aguas en descenso | Sandovala | X | X | X | |||
| Portugala | X | X | |||||
| Cruce | X | X | X | X | X | ||
| Aguas bajas | Sandovala | X | X | ||||
| Portugala | X | X | X | ||||
| Cruce | X | X | |||||
| Aguas en ascenso | Sandovala | X | X | X | X | ||
| Portugala | X | X | |||||
| Cruce | X | X |
Las variables ambientales (Tabla 2), posterior a la estandarización y normalización, denotaron distribución no normal. El análisis de correlación de Spearman demostró correlaciones fuertes entre profundidad y transparencia (⍴ = 0.83, P < 0.05), así como entre oxígeno saturado, con oxígeno disuelto y temperatura (⍴ = 0.84, P < 0.05 y ⍴ =0.83, P < 0.05, respectivamente). Otras variables que demostraron correlación relativamente alta fueron oxígeno disuelto y temperatura (⍴ = 0.79, P < 0.05). Para evitar colinealidad, en los análisis estadísticos posteriores, se eliminaron las variables profundidad y oxígeno saturado, puesto que se consideraron menos influyentes en el ensamble de ostrácodos.
Tabla 2 Variables físico-químicas medidas in situ en la ciénaga Río Viejo (Cimitarra, Santander) a lo largo del pulso de inundación. / Table 2. Physico-chemical variables measured in situ in the Río Viejo swamp (Cimitarra, Santander) throughout the flood pulse.
| Periodo | Estación | Profundidad (cm) | Transparencia (cm) | pH | Cond. (μS/cm) | T (°C) | OD (mg/L) | OS (%) |
| Aguas Altas | Sandovala | 208 | 29 | 6.73 | 45.5 | 27.6 | 0.38 | 5.7 |
| Portugala | 247 | 40 | 6.59 | 41.7 | 30.8 | 0.31 | 5.0 | |
| Cruce | 255 | 30 | 5.61 | 41.9 | 30.4 | 0.53 | 8.1 | |
| Aguas en descenso | Sandovala | 170 | 38 | 6.55 | 57.9 | 31.0 | 0.93 | 14.7 |
| Portugala | 160 | 35 | 6.59 | 48.3 | 30.0 | 0.14 | 2.2 | |
| Cruce | 210 | 40 | 6.65 | 51.2 | 35.5 | 1.79 | 28.7 | |
| Aguas Bajas | Sandovala | 40 | 13 | 7.85 | 73.3 | 28.5 | 1.21 | 12.9 |
| Portugala | 32 | 14 | 7.08 | 105.6 | 34.2 | 1.74 | 28.7 | |
| Cruce | 34 | 8 | 8.40 | 41.6 | 32.4 | 5.67 | 8.91 | |
| Aguas en Ascenso | Sandovala | 55 | 21 | 6.57 | 60.8 | 34.3 | 2.77 | 38.3 |
| Portugala | 50 | 14 | 7.14 | 56.1 | 34.4 | 3.90 | 65.0 | |
| Cruce | 38 | 8 | 5.98 | 40.8 | 35.8 | 7.49 | 134.5 |
En relación con el comportamiento estacional y temporal de las variables físico-químicas, se observaron tendencias relativamente homogéneas a lo largo del pulso de inundación en los microambientes analizados (Fig. 2). El valor mínimo de temperatura del agua se encontró en la estación Sandovala durante el periodo de aguas altas con 27.6 °C y la máxima temperatura del agua fue de 35.8 °C en la estación el Cruce durante el periodo de aguas en ascenso. Las concentraciones de oxígeno disuelto variaron desde 0.14 mg L-1 hasta 7.49 mg L-1 con el mínimo valor registrado en la estación Portugal del periodo de aguas en descenso y el máximo valor obtenido en la estación el Cruce del periodo de aguas en ascenso. Los valores de pH estuvieron entre 5.61 en la estación el Cruce del periodo de aguas altas y 8.4 correspondiente a la misma estación durante el periodo de aguas bajas. La conductividad eléctrica mostró valores desde 40.8 μS cm-1 hasta 105.6 μS cm-1, con el mínimo en la estación el Cruce del periodo de aguas en ascenso. La transparencia tuvo un valor mínimo de 8 cm en la estación del cruce del periodo de aguas bajas y un valor máximo de 40 cm en la estación el Cruce del periodo de aguas en descenso y aguas altas.
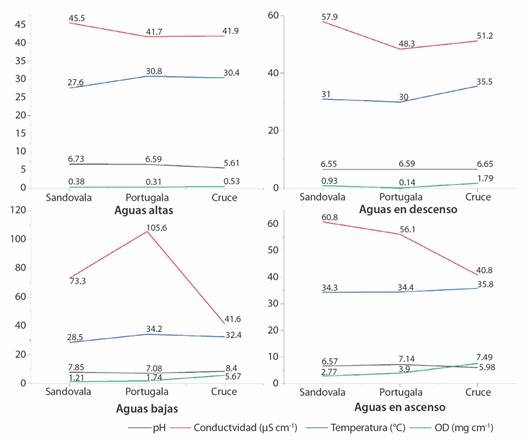
Fig. 2 Representación de la variabilidad ambiental (pH, conductividad, temperatura, oxígeno disuelto) medidos en cada microambiente y fase del pulso de inundación en la Ciénega Rio Viejo. / Fig. 2. Representation of environmental variability (pH, conductivity, temperature, dissolved oxygen) measured in each microenvironment and phase of the flood pulse in the Rio Viejo Wetland.
El ACP explicó el 73 % de la variación de los datos en los dos primeros componentes. La transparencia y oxígeno disuelto se correlacionaron más estrechamente con el primer componente (-0.59 y 0.58, respectivamente), mientras que pH y conductividad con el segundo componente (-0.59 y -0.56, respectivamente), por lo cual estos fueron las variables que mejor explicaron la variabilidad ambiental. El gráfico de ordenación demostró que los microambientes pueden diferenciarse de acuerdo con la fase del pulso de inundación. Los periodos de aguas bajas y aguas en ascenso fueron claramente distinguibles en el ACP. El período de aguas bajas se asoció con valores altos de conductividad eléctrica (105.6 μS cm-1) y pH básico (8.4). El periodo de aguas en ascenso se caracterizó por tener los valores más altos de temperatura (35.8 °C) y oxígeno disuelto (5.98 mg L-1).
Los periodos de aguas altas y en descenso no fueron claramente identificables en el ACP, y ambos mostraron asociación con aguas transparentes. Aunque en ambos periodos se asociaron también a valores más bajos de oxígeno disuelto y temperatura (Fig. 3).
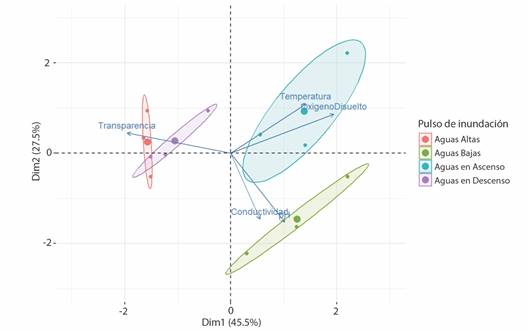
Fig. 3 Análisis de componentes principales explicaron el 73 % (dimensión 1 y 2) de la variabilidad ambiental en microambientes de vegetación durante los cuatro periodos del pulso de inundación en la ciénega Río Viejo: aguas altas. aguas bajas, aguas en ascenso y aguas en descenso. / Fig. 3. Principal components analysis explained 73 % (dimension 1 and 2) of the environmental variability in vegetation microenvironments during the four periods of the flood pulse in the Rio Viejo wetland: high waters, low waters, rising waters, and receding waters.
Composición del ensamble de ostrácodos en microambientes de vegetación, durante el pulso de inundación: Se encontró un total de 4 749 individuos de ostrácodos en los tres microambientes estudiados durante las cuatro fases del pulso de inundación. Los individuos fueron clasificados en tres familias taxonómicas, Cyprididae Baird 1845, Limnocytheridae Klie 1938 y Candonidae Kaufmann 1900. El análisis de las valvas y apéndices permitió identificar seis especies: Stenocypris major Baird, 1859 (Fig. 4K, Fig. 4L). Strandesia cf. sphaeroidea Broodbakker, 1983 (Fig. 4G, Fig. 4H). Diaphanocypris meridana Furtos 1936 (Fig. 4A, Fig. 4B), pertenecientes a la familia Cyprididae; Cytheridella ilosvayi Daday 1905 (Fig. 4C, Fig. 4D, Fig. 4E, Fig. 4F) de la familia Limnocytheridae; Keysercypria sp., y Keysercypria sp. 2 (Fig. 4I, Fig. 4J) de la familia Candonidae. La mayoría de las especies estuvieron representadas por poblaciones exclusivamente de hembras, a excepción de Keysercypria sp. 2 y Cytheridella ilosvayi quienes presentan poblaciones con proporción 5:2 de hembras y machos, respectivamente. A las especies Strandesia cf. sphaeroidea, Keysercypria sp. y Keysercypria sp. 2, se le asignaron identidades taxonómicas provisionales debido a que no fue posible identificarlas a nivel de especie por falta de caracteres taxonómicos, particularmente en estructuras reproductivas de machos y por la variabilidad morfológica que mostraron en comparación con descripciones de especies en la región.
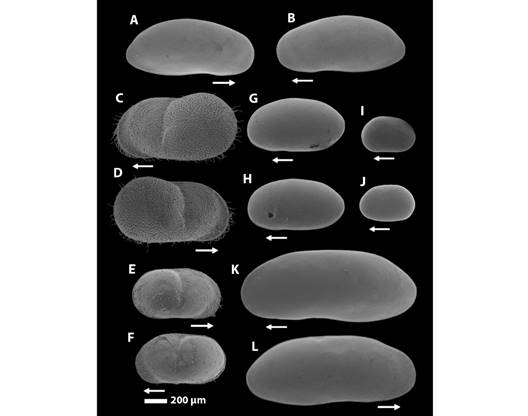
Fig. 4 Análisis SEM de las valvas derecha e izquierda de ostrácodos de la ciénaga Río Viejo. A. y B. Diaphanocypris meridana; C. y D. Cytheridella ilosvayi hembra; E. y F. C. ilosvayi macho; G. y H. Strandesia cf. Sphaeroidea hembra; I. y J. Keysercypria sp. 2 hembra; K. y L. Stenocypris major hembra. Las flechas blancas indican la posición anterior de la valva. / Fig. 4. SEM analysis of the right and left valves of ostracods from the Río Viejo wetland. A. and B. Diaphanocypris meridana; C. and D. Cytheridella ilosvayi female; E. and F. C. ilosvayi male; G. and H. Strandesia cf. Sphaeroidea female; I. and J. Keysercypria sp. 2 female; K. and L. Stenocypris major female. The white arrows indicate the anterior position of the valve.
La mayor abundancia de ostrácodos fue durante el periodo de aguas bajas con 2 351 individuos, la estación Portugala representó el 90 % de la abundancia durante este periodo siendo Keysercypria sp. 2 la especie que representó el 88 % de la abundancia en esta estación. El periodo con menor abundancia fue aguas en ascenso con 182 individuos. El 50 % de abundancia estuvo representado por la estación el Cruce (Tabla 3).
Tabla 3 Abundancia de ostrácodos en tres microambientes durante el pulso de inundación. / Table 3. Ostracod abundance in three microenvironments during the flood pulse.
| Periodo | Estación | Cytheridella ilosvayi | Strandesia cf. sphaeroidea | Stenocypris major | Diaphanocypris meridiana | Keysercypria sp. 2 | Keysercypria sp. |
| Altas | Sandovala | 7 | 489 | 0 | 134 | 0 | 0 |
| Portugala | 43 | 32 | 0 | 23 | 21 | 0 | |
| Cruce | 1008 | 219 | 3 | 8 | 0 | 0 | |
| Bajas | Sandovala | 2 | 5 | 0 | 2 | 100 | 0 |
| Portugala | 16 | 0 | 0 | 19 | 2068 | 20 | |
| Cruce | 30 | 16 | 0 | 31 | 42 | 0 | |
| Descenso | Sandovala | 0 | 7 | 0 | 12 | 0 | 0 |
| Portugala | 9 | 2 | 0 | 3 | 0 | 0 | |
| Cruce | 119 | 65 | 0 | 12 | 0 | 0 | |
| Ascenso | Sandovala | 1 | 2 | 0 | 23 | 0 | 0 |
| Portugala | 4 | 2 | 1 | 42 | 16 | 0 | |
| Cruce | 28 | 0 | 0 | 59 | 4 | 0 |
La prueba ANOSIM de dos vías utilizada para estimar las diferencias significativas entre la composición de especies de las estaciones muestreadas, dio como resultado un R global -0.25 y P de 0.93, indicando que no existen diferencias significativas en la abundancia del ensamble de ostrácodos entre las estaciones. De manera similar, al comparar la composición de especies entre los periodos hidrológicos el valor de R global fue de 0.3 y P de 0.06, no se encontraron diferencias significativas.
Relación entre variables ambientales y el ensamble de ostrácodos: El RDA explica el 73.4 % de la relación entre las variables y especies en los dos primeros componentes con un p de 0.018 para todos los ejes (Fig. 5). Se evidencia que las especies se encuentran relacionadas con los parámetros fisicoquímicos como la temperatura, transparencia y profundidad (Fig. 5). El género Keysercypria se asoció al periodo aguas bajas con alta transparencia. Las especies Stenocypris major, Strandesia cf. sphaeroidea y Cytheridella ilosvayi se asociaron a aguas altas junto a valores bajos de conductividad y temperatura. La especie Diaphanocypris meridiana se encuentra próxima al origen de los ejes, sugiriendo una menor influencia de estos parámetros fisicoquímicos en su abundancia.
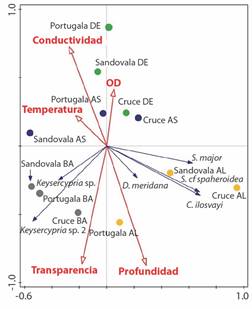
Fig. 5 Análisis de redundancia (RDA) que muestra las asociaciones de los ostrácodos con las variables físico-químicas tomadas en cuatro periodos correspondientes al pulso de inundación. AL: Aguas altas. AS: Aguas en ascenso. DE: Aguas en descenso y BA: Aguas bajas. / Fig. 5. Redundancy analysis (RDA) showing the associations of ostracods with the physico-chemical variables taken in four periods corresponding to the flood pulse. AL: High waters. AS: Rising waters. DE: Receding waters. BA: Low waters.
Discusión
Variabilidad ambiental en los microambientes y fases del pulso de inundación: El ACP demostró que los cambios hidrológicos de la región influencian la estructura físico-químicas de los microambientes en la Ciénaga de Río Viejo, puesto que, en la ordenación claramente se discriminaron los microambientes en respuesta a las cuatro fases hidrológicas (Fig. 3). Esto indica que los microambientes tienen condiciones físico-químicas que se expresan de manera independiente y que podrían estar influenciadas por factores locales, como la cubierta vegetal y el flujo de agua. En las llanuras aluviales del Alto Paraná, se encontró que los cambios ambientales del pulso de inundación no fueron significativamente diferentes entre fases del pulso, pero sí lo fueron a nivel espacial cuando se consideró la asociación de plantas acuáticas (Higuti et al., 2010). Lo anterior ejemplifica, la relevancia de las plantas acuáticas para la modificación de condiciones ambientales a nivel local. En Colombia se ha encontrado que la especie Utricularia sp., puede modificar las condiciones ambientales en un sitio, debido a procesos metabólicos (Solís-Parra & Criales-Hernández, 2016). La ecología y fenología de las plantas acuáticas también pueden modificar el ambiente a nivel local, por ejemplo, la temperatura superficial y disponibilidad de oxígeno son afectados por la cobertura y respiración vegetal, mientras que los procesos metabólicos pueden alterar el pH y conductividad (Sánchez-Lobo, 2017; Tezanos Pinto, 2008).
Si bien, el ACP discriminó los sitios en respuesta a los pulsos de inundación, en términos generales, las variables ambientales fluctuaron dentro de un rango relativamente estrecho. El oxígeno disuelto mostró la mayor variación en el conjunto de datos, puesto que en los periodos aguas altas y aguas en descenso, los valores fueron desde muy bajos a anóxicos (< 1.8 mg L-1), mientras que en los periodos aguas altas y en ascenso los valores alcanzaron hasta 7.49 mg L-1. Además, contrario a la tendencia general, se encontró una correlación positiva entre el oxígeno disuelto y la temperatura en Rio Viejo. La disminución en el oxígeno disuelto durante fases del pulso puede deberse a factores como la respiración vegetal, incremento de N y materia orgánica por efecto antropogénico o por la descomposición de plantas acuáticas (Caraco et al., 2006; Montoya et al., 2011; Sánchez-Lobo, 2017; Stumm & Morgan 1981). Lo anterior podría estar incentivado por la reducción de volumen de agua del sistema que puede ser de hasta 80 cm durante la transición de aguas altas y aguas en descenso. Por el contrario, el incremento en la disponibilidad de oxígeno disuelto ocurre durante las fases más dinámica del sistema, esto es, desde aguas bajas hacia aguas en ascenso, por lo que se asume que las corrientes y turbulencia generadas por el aporte hidrológico de los tributarios como caño Rio Viejo, aumentan la difusión del oxígeno atmosférico. La disponibilidad de oxígeno disuelto, por lo tanto, parece estar más relacionada con la dinámica local del microambiente, y no por factores como la temperatura. En Río Viejo se registró una fluctuación general de ~ 5 °C durante el pulso de inundación anual, excepto por el sitio La Sandovala en aguas altas, donde se registró una variación de hasta 8 °C. Las condiciones de temperatura relativamente homogéneos en la ciénega, podrían estar influenciadas por la cobertura vegetal que en la mayoría de las fases del pulso, abarca casi la totalidad del espejo de agua, disminuyendo la penetración de luz y distribución del calor (Tezanos Pinto, 2008), por lo cual, para los microambientes, la temperatura parece no ser determinante para el incremento o reducción del oxígeno disuelto y la correlación positiva encontrada en este estudio, podría ser un artefacto del limitado número de mediciones. Comparativamente, el oxígeno disuelto mostró valores de concentración menores a las ciénagas del Magdalena Medio (Criales-Hernández et al., 2020; Dulcey, 2012; García-Lozano & Dister, 1990; Gavilán, 2000; Hoyos & Toro, 2007; Plata, 2001; Solís-Parra & Criales-Hernández, 2016).
Los cambios en otras variables ambientales en la ciénaga de Rio Viejo fueron relativamente homogéneos y similares a los observados en otros cuerpos de agua en la región del Magdalena Medio. Los valores de conductividad eléctrica 41.6-105.6 μS cm-1, por ejemplo, estuvieron en el rango observado en la ciénaga de Paredes (Solís-Parra & Criales-Hernández, 2016), el Llanito (Dulcey, 2012; Gavilán, 2000), Chucurí (García-Lozano & Dister, 1990; Plata, 2001), Cachimbero (Hoyos & Toro, 2007) y a los registrados durante el periodo de aguas altas en las ciénagas la Colorada, la Duda, Río Viejo y Limonal (Criales-Hernández et al., 2020). La variabilidad ambiental que se observó en los microambientes de vegetación sumergida podría también estar siendo minimizada por la vegetación acuática.
Diversidad de ostrácodos en microambientes en la ciénega Río viejo y su relación con la variabilidad ambiental: En la Ciénaga Río Viejo, los ostrácodos se encontraron principalmente asociados a las especies de vegetación acuática sumergida y parcialmente sumergida Eichhornia crassipes, Azolla sp., Limnobium cf. laevigatum, Ludwigia cf. Helminthorrhiza, Paspalum sp., Utricularia sp., y Salvinia sp. Estas plantas son típicas en los lagos tropicales de tierras bajas en América del Sur (Alves Ferreira et al., 2011; da Conceição et al., 2020), caracterizadas por mantener complejas asociaciones ecológicas entre tallos y raíces. No obstante, la riqueza fue baja en los microambientes y en general en la ciénaga, en comparación con lo que se ha observado en otros estudios de la región. Los ensambles de ostrácodos asociados a Eichhornia sp., en el Río Alto Paraná, se caracterizaron por 44 especies (Higuti et al., 2017), y en el río Araguaia (Brasil) se encontró un total de 29 ostrácodos durante un periodo anual del pulso de inundación (Pereira et al., 2017). La riqueza de especies en microambientes de la Ciénaga Río Viejo se asemeja al ensamble de especies de lagos aislados en el Neotrópico norte, como el Lago Petén Itzá (Guatemala) con 11 especies (Pérez et al., 2010; Cohuo, 2012). En el embalse en Santa Fe, Antioquia (Colombia) se registraron seis especies (Saldarriaga & Martinez, 2010) y en lagos de elevación media y tierras bajas en el sur de México y Guatemala se registraron entre una y ocho especies de ostrácodos (Echeverría Galindo et al., 2019).
De las seis especies registradas en este estudio, cinco especies son nuevos registros para Colombia y para el Departamento de Santander. La única especie registrada anteriormente en esta región es Cytheridella ilosvayi, que tiene dos registros en el país, una para el departamento de Casanare (Wrozyna et al., 2018) y otra para el departamento de Santander (Ruiz-Jiménez et al., 2020). El análisis de ANOSIM, reveló que entre los microambientes no existen diferencias significativas entre los ensambles, por lo que se asume que las especies encontradas son especializadas en microambientes de plantas acuáticas y que su distribución es relativamente uniforme en los microambientes. De manera similar, los cambios en las fases del pulso no fueron significativas para diferenciar el ensamble de ostrácodos en los microambientes. El RDA, sin embargo, demostró que las especies tienen respuestas diferenciadas a la fluctuación de parámetros ambientales. Las especies Keysercypria sp. y Keysercypria sp. 2 mostraron un incremento de su abundancia durante el periodo de aguas bajas cuando las condiciones de transparencia fueron mayores. De manera general, las especies de la subfamilia Cyclocypridinae Kaufmann, 1900 en la región Neotropical se asocian con vegetación parcialmente sumergida. Por lo que, la exposición de una mayor área de cobertura puede beneficiar a que estas especies incrementen su abundancia (Macario-González et al., 2022). Las especies C. ilovayi, D. meridana, S. cf. sphaeroidea y S. major, mostraron mayor asociación con aguas altas y a valores más bajos de conductividad, temperatura y oxígeno disuelto. Estas especies se reconocen como altamente tolerantes y de amplia distribución en las Américas (Cohuo et al., 2017; Martens & Behen 1994), por lo que su distribución pudiera no estar limitada por la variación climática estacional en la región tropical.
Diaphanocypris meridana ha demostrado una notable tolerancia a variaciones en la conductividad eléctrica del agua. Es un organismo con reproducción asexual que se distribuye en el neotrópico, específicamente en México, Brasil, Ecuador, Argentina y en las Antillas (Martens & Behen, 1994; Meisch et al., 2019; Würdig & Pinto, 1990). En Brasil esta especie se encuentra asociada a valores de conductividad eléctrica con rangos de 51.8 a 66.1 μS/cm (Higuti et al., 2017); en la ciénaga Río Viejo se registró para rangos de conductividad eléctrica 40.8 μS/cm a 105.6 μS/cm, mayores a lo reportado por Higuti et al., (2017), lo que demuestra su amplio rango de tolerancia a este parámetro físico-químico.
La especie Stenocypris major, es de hábito nectobentónico y cosmopolita, se tienen registros de su distribución en Sudamérica, África y Asia. Se ha encontrado en aguas poco profundas y en charcas (Broodbakker, 1984), se encuentra asociado a vegetación acuática como Salvinia (Pérez et al., 2010) y presenta rangos de conductividad eléctrica desde los 0 μS/cm a 600 μS/cm (Echeverría Galindo et al., 2019). Para la ciénaga Río Viejo también se encontró en la planta acuática Salvinia sp., y se registró entre Eichhornia crassipes, Paspalum sp., Utricularia sp., Azolla sp., Ludwigia cf. helminthorrhiza y Limnobium cf. laevigatum, además, esta especie se encontró entre los rangos de conductividad eléctrica reportados por Echeverría Galindo et al., (2019).
La especie Cytheridella ilosvayi es la única especie registrada en este estudio con hábito bentónico y se distribuye ampliamente en Sudamérica, el Caribe y el sureste de México, en particular, se ha registrado la presencia de C. ilosvayi en México, Brasil, Chile, Cuba, Nicaragua, Paraguay, Trinidad y Tobago y Venezuela (Cohuo et al., 2017; Pérez et al., 2010;) y Colombia (Ruiz-Jiménez et al., 2020; Wrozyna et al., 2016). Se ha encontrado habitando entre rangos de temperatura desde los 16 °C y 35.5 °C, pH entre los 6.1 a 8.6 unidades, alta conductividad eléctrica 5,110 (µS/cm) (Meyer et al., 2017; Pérez et al., 2010; Purper, 1974) y asociado a la vegetación acuática como Eichhornia (da Conceição et al., 2018; Higuti et al., 2007; Higuti et al., 2009; Higuti et al., 2010; Higuti et al., 2017). En la ciénaga Río Viejo se encontró que la especie puede habitar aguas con baja conductividad eléctrica (40.8 µS/cm) y entre la vegetación acuática como Utricularia sp., Paspalum sp., Ludwigia cf. helminthorrhiza, Salvinia sp., Azolla sp.
La composición de especies de la Ciénaga Río Viejo está, constituida por una mezcla de especies de amplia distribución en América como C. ilosvayi, D. meridana y S. major (Cohuo et al., 2017; Martens & Behen 1994), y especies con distribuciones restringidas como S. cf. sphaeroidea y Keysercypria sp. En ambos casos, consideramos que la distribución de especies entre los microambientes puede estar relacionada con el efecto buffer que las plantas acuáticas generan y que limitan la variabilidad ambiental. Además, entre los procesos hidrológicos por los que atraviesa el sistema, estos microambientes parecen mantener condiciones propicias para los ostrácodos como suficiencia de alimento y refugio tropicales (Higuti & Martens, 2014). La baja diversidad en estos ambientes podría estar limitada por factores como la competencia intraespecífica y la depredación, para lo cual las especies encontradas podrían ser especialistas en el uso de recurso y la protección contra depredadores, evitando así la colonización de otras especies de ostrácodos.
Conclusiones: Se identificó un total de seis especies de ostrácodos en la Ciénaga de Río Viejo asociados a microambientes en vegetación acuática de hábito flotante, sumergida y enraizada. Cinco especies de ostrácoda son nuevos registros para Colombia. Se requiere una comparación detallada para algunas especies para proporcionar un estado taxonómico definitivo para las especies de la Ciénaga Río Viejo, puesto que existen variaciones morfológicas con especies previamente descritas. Los microambientes se diferenciaron en relación a la fase del pulso, aunque la variación ambiental en cada microambiente fue estrecha. Esta condición aparentemente favorece a la distribución relativamente homogénea de especies de ostrácodos. El ensamble de ostrácodos no presentó diferencias significativas en la abundancia de las especies. Se asume que la vegetación acuática amortigua el dinamismo del sistema hidrológico y crean microambientes aptos para el mantenimiento de las poblaciones durante el pulso de inundación.












 uBio
uBio 


