Introducción
En el Caribe colombiano los bosques se encuentran fuertemente amenazados por cambios en el uso del suelo, principalmente por actividades agrícolas y la expansión de pastizales para ganadería, mediante la tala de árboles y quemas para eliminar la cobertura vegetal original (Pizano & García, 2014). Asimismo, en el departamento del Cesar los ecosistemas bajos de la Serranía del Perijá han sido históricamente transformados por actividades agropecuarias y mineras. Entre los ecosistemas más amenazados se encuentran los bosques subhúmedos y los bosques secos tropicales, que por la fertilidad de sus suelos han sido punto de desarrollo de poblaciones humanas (Pennington et al., 2000). Además, la extracción de carbón mineral como principal ingreso económico en el departamento también ha generado transformaciones en el paisaje (Aguilera, 2016). Con miras a mitigar los impactos asociados a los cambios del uso del suelo causado por las operaciones mineras, un grupo del sector minero implementó un plan de compensación forestal en las subcuencas de los ríos Tucuy y Sororia de acuerdo con la Resolución 1465 de 2008 (Ministerio de Ambiente y Desarrollo Sostenible, 2014). Este plan de compensación, desarrollado hace aproximadamente 12 años en la región, ha propiciado la organización del territorio en distintos usos de suelo como lo son las áreas dedicadas a la conservación de bosques nativos, áreas restauradas (regeneración natural, núcleos de vegetación, corredores biológicos), sistemas agroforestales (principalmente de café), y un alto porcentaje de coberturas destinadas como pastizales para ganadería no intensiva que no fueron intervenidas en el programa de compensación.
Los ecosistemas de la serranía del Perijá y las sabanas del Cesar son fundamentales para la mirmecofauna del Caribe colombiano, debido a la gran variedad de formaciones vegetales y microclimas que pueden albergar una alta diversidad de hormigas (Guerrero & Olivero, 2007). Sin embargo, estos organismos han sido poco estudiados en este sistema montañoso. Además, no se tiene información publicada de estudios realizados a gran escala espacial y en paisajes con distintos usos de suelo. Cabe destacar que las hormigas son importantes para el mantenimiento y funcionamiento de muchos ecosistemas al ofrecer una gran variedad de servicios como organismos bioindicadores, para conocer el estado ecológico de los ecosistemas de la Serranía del Perijá y muchas otras zonas de vida del planeta, debido a su fidelidad ecológica, grado de especialización y alta sensibilidad a los cambios en el uso del suelo, los cuales afectan de forma negativa la riqueza, abundancia, estructura y composición de sus comunidades (Andersen, 1997; Arenas et al., 2015; Armbrecht et al., 2019; Dalle et al., 2018; De Castro Solar et al., 2016; Del Toro et al., 2012; Estrada et al., 2019; Lavelle et al., 2014; Ramírez et al., 2009; Sanabria et al., 2016; Zabala et al., 2013).
Teniendo en cuenta lo anterior, el objetivo del presente estudio fue analizar la riqueza, diversidad y composición de las comunidades de hormigas en cuatro usos de suelo de dos paisajes agroforestales de la Serranía del Perijá, Cesar, Colombia. Se plantea la hipótesis que los usos de suelo con mayor cobertura vegetal natural y estratos vegetativos múltiples (bosques, áreas de regeneración natural, sistemas agroforestales de café), favorecen la riqueza y diversidad de las comunidades de hormigas, debido a que estos usos de suelo ofrecen variedad de sitios para nidificación, microclimas constantes y mayor oferta de recursos alimenticios. Se predijo, además, que la riqueza de especies de hormigas sería mayor en los usos de suelo del paisaje de compensación, comparados con los usos de suelo del paisaje de no compensación, donde se espera que la diversidad y riqueza de hormigas sea menor.
Materiales y métodos
Área de estudio: En la serranía del Perijá el relieve es un determinante del clima. De acuerdo con la altitud, el clima puede ser cálido, templado, frío o de páramo. Generalmente se dan dos periodos de lluvia, uno entre abril y junio y otro entre agosto y noviembre. El periodo seco es de mayor duración y se extiende desde diciembre hasta marzo (Aguilera, 2016).
Este estudio se llevó a cabo en cuatro localidades rurales de la Serranía del Perijá, en el departamento del Cesar (Fig. 1). Las localidades estudiadas presentan elevaciones entre los 800 y 1 600 m.s.n.m., con temperatura promedio entre 19 y 24.3 °C; la vegetación predominante corresponde a bosque seco tropical y bosque subhúmedo tropical. El promedio de precipitaciones anuales oscila entre 1 000 y 2 000 mm (Aguilera, 2016).
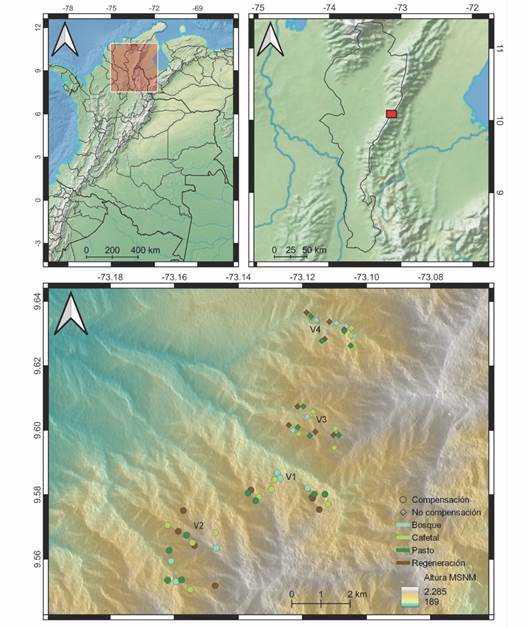
Fig. 1 Área de estudio. Paisaje de compensación: Alto de las Flores (V1), Nueva Granada (V2), Paisaje no compensación: Unión (V3), Manantial (V4). Usos de suelo: Bosques, sistemas agroforestales de café (SAFC), regeneración natural, pastizales. / Fig. 1. Study area. Compensation landscape: Alto de las Flores (V1), Nueva Granada (V2), No compensation landscape: Unión (V3), Manantial (V4). Land uses: forests, coffee agroforestry systems, natural regeneration, pastures.
Las localidades Alto de las Flores (V1) (9°34'45.27'' N & 73°7'1.45'' W) y Nueva Granada (V2) (9°33'33.89'' N & 73°9'39.54'' W) se encuentran incluidas en un plan de compensación forestal. El objetivo de ese plan fue recuperar y proteger los servicios ecosistémicos en áreas específicas de las cuencas de los ríos Sororia y Tucuy, mediante la reforestación de áreas sometidas a explotación, la restauración pasiva de la vegetación secundaria (rastrojeras), la implementación de sistemas productivos sostenibles (sistemas agroforestales) y el pago de incentivos económicos para proteger la cobertura boscosa existente y los nacimientos de agua (Ministerio de Ambiente y Desarrollo Sostenible, 2014).
Las localidades La Unión (V3) (9°35'58.21'' N & 73°6'58.60'' W) y Manantial (V4) (9°37'45.57'' N & 73°6'14.02'' W) no se encuentran incluidas en ese plan de compensación, por lo que no se han implementado estrategias de manejo para su conservación.
De esta forma, se tienen dos paisajes: compensación y no compensación (Fig. 1) que se diferencian en cuanto a las estrategias de conservación.
Diseño del muestreo: En cada paisaje se delimitaron dos ventanas de muestreo de 4 × 4 km, separadas aproximadamente 1.5 km entre sí. Dentro de cada ventana se escogieron cuatro usos de suelo: bosque, sistemas agroforestales de café (SAFC), regeneración natural de áreas deforestadas con tiempos de rehabilitación entre 20 y 30 años, y pastizales con presencia de árboles dispersos, remanentes de la vegetación original, conservados por los finqueros como fuente de sombra, madera o leña. En cada uso de suelo, se seleccionaron aleatoriamente cuatro puntos en los cuales se ubicó un transecto de 100 m de largo. En cada transecto se instalaron seis trampas Pitfall separadas 20 m entre sí (Fig. 2); cuyo tiempo de acción fue 48 h, para un total de 96 trampas Pitfall por ventana. Las trampas Pitfall consistieron en vasos plásticos de 10 cm de profundidad y 8 cm de diámetro (9 oz), los cuales fueron enterrados a nivel del suelo y un cuarto de su volumen contenía solución preservante (agua, sal, alcohol y jabón líquido). Adicionalmente, se tomaron tres muestras de hojarasca por transecto en cada uso de suelo; para ello se realizó la extracción de 1 m2 de hojarasca, raspando la capa superficial del suelo. Este material fue cernido y se depositó en sacos Winkler por 48 h, para un total de 48 muestras Winkler por ventana. El trabajo de campo se realizó entre febrero y marzo del 2021, con una duración de ocho días por localidad. El esfuerzo de muestreo fue de 384 trampas Pitfall y 192 m2 de extracción de hojarasca. En cada paisaje y uso de suelo se midió la temperatura (T, °C) y humedad del suelo (H, %), la cobertura de dosel (CD, %), altura de la hojarasca (AH, cm), la dureza (Dus, kg/cm2) y la densidad aparente del suelo (Das, g/cm3).
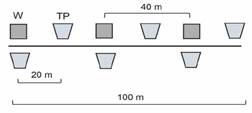
Fig. 2 Diseño del muestreo de hormigas. Cuadrantes de hojarasca para trampas Winkler (W) y Trampas Pitfall (TP). / Fig. 2. Ant sampling design. Leaf litter quadrants for Winkler traps (W) and Pitfall traps (TP).
Las hormigas recolectadas fueron preservadas en alcohol al 75 % e identificadas hasta el nivel taxonómico más bajo posible usando las claves para subfamilias y géneros de Fernández et al. (2019) y la página AntWeb (https://www.antweb.org/). La recolecta de los especímenes se realizó dentro del permiso Marco de recolección de especímenes de especies silvestres de la diversidad biológica con fines de investigación científica no comercial, otorgado a la Universidad del Atlántico por la Autoridad Nacional de Licencias Ambientales, mediante la Resolución N° 01214 del 29 de septiembre de 2017.
Análisis de datos: La completitud del inventario de especies de hormigas se estimó como la cobertura de la muestra para cada uso del suelo y localidad. La cobertura de la muestra establece el porcentaje de la estructura de la comunidad representada por las especies (y sus abundancias) presentes en la muestra. A diferencia del método tradicional de rarefacción, la cobertura de la muestra permite realizar comparaciones a una misma proporción de la comunidad (misma cobertura) y no a igual tamaño de la muestra (Chao & Jost, 2012). La abundancia se estimó teniendo en cuenta la frecuencia de captura, es decir, la presencia de una especie n-veces en cada localidad y uso de suelo, como un parámetro de abundancia relativa (Romero & Jaffe, 1989). La diversidad se estimó utilizando los números de Hill con sus respectivos intervalos de confianza al 95 %. Los órdenes de diversidad evaluados fueron: 0D o riqueza de especies, 1D (exponencial de Shannon) que representa a las especies abundantes en un área o época determinada y 2D (inversa de Simpson) que representa las especies muy abundantes o dominantes en la comunidad (Hill, 1973). La estimación de los órdenes de diversidad y el cálculo de la cobertura de la muestra fueron obtenidos mediante el paquete iNEXT (Hsieh et al., 2016), integrado al programa R (R Core Team, 2017). Para comparar la composición de las comunidades de hormigas entre paisajes se realizó un análisis de similitud (ANOSIM).
Para evaluar el patrón de recambio de especies al nivel de localidades y usos de suelo se usó la estrategia de partición aditiva de Baselga (2010). Para ello se utilizó la familia de disimilitudes de Jaccard, cuyo resultado absoluto (bjac) estuvo compuesto por un componente de recambio de especies (bjtu) y uno de anidamiento (bjne), entendido como la medida de disimilitud entre comunidades debido al efecto de patrones de anidamiento. Este análisis se realizó utilizando el paquete betapart para R (Baselga et al., 2018).
Para evaluar la asociación entre los parámetros ambientales y biológicos, se empleó el análisis de correlación multivariable de Co-inercia. Para las variables biológicas se consideraron taxones frecuentes (presentes más de una vez) y con frecuencias de captura superiores a uno. Este análisis se realizó utilizando el paquete ade4 para R (Bougeard & Dray, 2018). Posteriormente, el análisis de Co-inercia fue validado por el test de permutaciones de Monte-Carlo.
Resultados
Composición general de la mirmecofauna: Se capturaron 15 598 especímenes de hormigas en 576 muestras. Estos se clasifican en nueve subfamilias, 52 géneros y 116 especies (AT1). En los dos paisajes y usos de suelo estudiados se presentaron mayores registros de especies de la subfamilia Myrmicinae (50.8 %), mientras que las subfamilias Formicinae y Ponerinae fueron las segundas en porcentaje de registros (15.5 % cada una), seguidas de Dolichoderinae (5.1 %). Las subfamilias de menor riqueza fueron Amblyoponinae y Agroecomyrmecinae, cada una con una especie. En los pastizales no se recolectaron especies de la familia Amblyoponinae (AT1).
Los géneros de mayor riqueza fueron Camponotus, Pheidole y Strumigenys. Neivamyrmex y Typhlomyrmex, fueron los géneros más raros, pues de cada uno de ellos se encontró una sola especie y un espécimen. Aunque los géneros Tatuidris y Mayaponera son monotípicos, de estos géneros solo se recolectó un individuo (AT1).
La completitud del muestreo fue alta para todos los usos de suelo con valores por encima del 95 % (AT2).
Riqueza y diversidad entre usos de suelo y paisajes estudiados: V1 fue la localidad con mayor riqueza de especies, mientras que V2 fue la localidad con menor riqueza, ambas dentro del paisaje de compensación. El análisis de diversidad mostró que los bosques en los dos paisajes estudiados fueron el uso de suelo con mayor riqueza (0D) y diversidad (1D) de especies, mientras que los pastizales presentaron menor riqueza (Fig. 3).
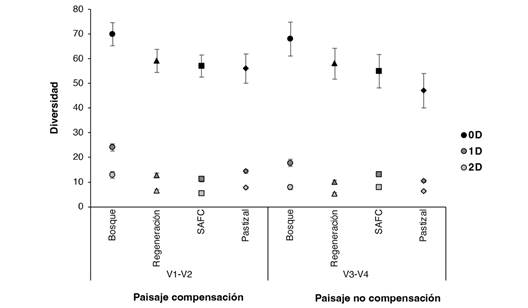
Fig. 3 Análisis de la diversidad 0D, 1D, 2D de hormigas para los diferentes usos de suelo y los dos paisajes agroforestales. Abreviaturas: sistema agroforestal de café (SAFC), Alto de las Flores (V1), Nueva Granada (V2), Unión (V3), Manantial (V4). / Fig. 3. Analysis of the 0D, 1D, 2D diversity of ants for the different land uses and two agroforestry landscapes. Abbreviations: coffee agroforestry system (SAFC), Alto de las Flores (V1), Nueva Granada (V2), Unión (V3), Manantial (V4).
La diversidad de especies muy abundantes o dominantes (2D), mostró que los bosques de V2 (paisaje compensación), V3 y V4 (paisaje no compensación) presentaron mayor número de especies dominantes, mientras que en V1 (paisaje compensación) los usos de suelo con mayor dominancia fueron el pastizal y la regeneración natural.
El uso de suelo con el mayor número de especies exclusivas fue el bosque con 15 especies, y el uso de suelo con menos especies exclusivas fue el pastizal con seis especies. El número de especies compartidas entre los distintos usos de suelo fue mayor entre bosque y regeneración (53.8 %), seguido del bosque y SAFC (47.9 %), regeneración y SAFC (46.1 %).
No se encontraron diferencias significativas entre la composición de hormigas del paisaje de compensación y no compensación (ANOSIM, R = -0.051, P = 0.68).
Diversidad Beta (bjac), anidamiento y recambio de especies: La disimilitud (bjac) en la composición de especies fue inferior a 0.5 entre localidades (Fig. 4) y superior a 0.65 entre usos de suelo (Fig. 5). Para la mayoría de las combinaciones posibles entre localidades y usos de suelo los valores obtenidos de recambio fueron mayores que los de anidamiento, estos resultados indican la presencia de especies exclusivas o de distribución restringida.
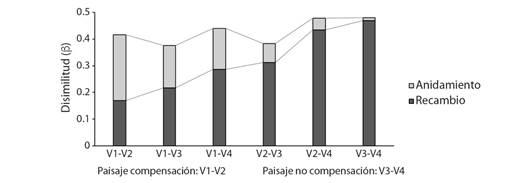
Fig. 4 Diversidad Beta. Medida de disimilitud. Recambio y anidamiento de especies de hormigas entre localidades y paisajes. Abreviaturas: Alto de las Flores (V1), Nueva Granada (V2), Unión (V3), Manantial (V4). / Fig. 4. Beta Diversity. Dissimilarity measure. Ant species turnover and nesting in localities and landscapes. Abbreviations: Alto de las Flores (V1), Nueva Granada (V2), Unión (V3), Manantial (V4).
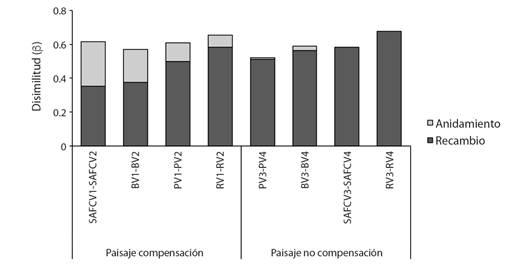
Fig. 5 Diversidad Beta. Medida de disimilitud. Recambio y anidamiento de especies de hormigas entre usos de suelo y paisajes. Abreviaturas: sistema agroforestal de café (SAFC), bosques (B), pastos (P), regeneración natural (R), Alto de las Flores (V1), Nueva Granada (V2), Unión (V3), Manantial (V4). / Fig. 5. Beta Diversity. Dissimilarity measure. Ant species turnover and nesting in lands uses and landscapes. Abbreviations: coffee agroforestry systems (SAFC), forests (B), pastures (P), natural regeneration (R), Alto de las Flores (V1), Nueva Granada (V2), Unión (V3), Manantial (V4).
Al analizar las localidades dentro del paisaje de compensación (V1-V2), se evidenció que el anidamiento (0.24) fue mayor que el recambio de especies (Fig. 4), es decir que la composición de especies entre estas localidades es similar. Esta similitud en la composición de especies se obtuvo principalmente entre los bosques y los SAFC de estas localidades (Fig. 5).
Además, entre las localidades del paisaje de no compensación (V3-V4), se evidenció que el componente de recambio (0.46) fue mayor que el anidamiento (Fig. 4). Es decir que estas localidades difieren ampliamente en la composición de especies. El recambio o ganancia de especies fue total entre las áreas de regeneración y los SAFC de estas localidades (Fig. 5).
Asociación entre variables ambientales y biológicas: El análisis multivariable de Co-inercia mostró que las variables ambientales y biológicas explicaron el 88.45 % de la variabilidad total (R = 0.599). Este análisis fue validado por el test de permutaciones de Monte-Carlo, el cual permite inferir que la relación entre las variables ambientales y biológicas obedecen a un patrón de asociación con significancia estadística (P < 0.001). Las variables ambientales que mostraron una significativa contribución a la abundancia y diversidad de hormigas en el primer eje (77.93 %) fueron: la altura de la hojarasca (AH) y la cobertura de dosel (CD); y de manera inversa la temperatura (Ts) y la dureza (Dus) del suelo. En el segundo eje (10.52 %) las variables ambientales que más influyeron en la abundancia y diversidad de la mirmecofauna fueron la densidad aparente (Das) y la humedad del suelo (Hs) (Fig. 6).
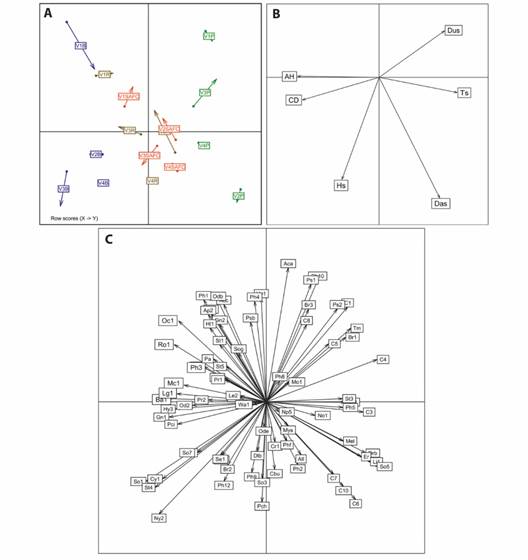
Fig. 6 Análisis de Co-inercia. A. Usos de suelo, B. Variables ambientales, C. variables biológicas (abundancia y riqueza de especies). Abreviaturas: bosque (B), regeneración (R), sistema agroforestal café (SAFC), pastizal (P). Alto de las Flores (V1), Nueva Granada (V2), Unión (V3), Manantial (V4). Humedad del suelo (H, %), temperatura del suelo (T, °C), cobertura de dosel (CD, %), altura hojarasca (AH, cm), densidad aparente del suelo (Das, g/cm3), dureza del suelo (Dus kg/cm2). Las abreviaturas de los nombres de especie se muestran en el AT1. / Fig. 6. Co-inertia analysis. A. Land uses, B. Environmental variables, C. Biological variables (abundance and species richness). Abbreviations: forest (B), regeneration (R), coffee agroforestry system (SAFC), pasture (P). Alto de las Flores (V1), Nueva Granada (V2), Unión (V3), Manantial (V4). Soil humidity (H, %), soil temperatura (T, °C), canopy cover (CD, %), leaf litter (AH, cm), soil apparent density (Das, g/cm3), soil hardness (Dus kg/cm2). Abbreviations for species names are shown in AT1.
Discusión
Composición general de la mirmecofauna: La riqueza total registrada y la completitud del muestreo para los dos paisajes y usos de suelo que fueron objeto de estudio, indican que se obtuvo una buena representatividad de la mirmecofauna del departamento, los porcentajes de completitud ≥ 80 % se consideran satisfactoriamente muestreados (Lobo, 2008). Además de las hormigas epigeas se recolectaron varias especies arbóreas y del dosel de los géneros Camponotus, Pseudomyrmex, Cephalotes, Crematogaster, Dolichoderus, Azteca y Myrmelachista. La mayoría de estas hormigas fueron recolectadas en la hojarasca, en concordancia con Castro et al. (2018), quienes expresan que las especies arbóreas y del dosel pueden ser una parte importante de la densidad de hormigas del suelo, donde ocasionalmente forrajean y el cual les sirve para el abastecimiento de alimentos. También se recolectaron géneros de hábitos subterráneos (Acropyga, Typhlomyrmex y Leptanilloides), estrechamente relacionados con la biomasa de la hojarasca y frecuentemente muestreados por el método Winkler (Castro et al., 2018; Fernández et al., 2019; Silvestre et al., 2003).
La presencia de Tatuidris tatusia en pastizales del paisaje de compensación (V1) es un hallazgo poco consistente con los usos de suelo en los que se ha registrado previamente (bosques, sistemas agroforestales de café y sistemas agroforestales de maíz). Esta especie es poco recolectada en campo y su biología es desconocida (Lacau et al., 2012), aunque se cree que es un depredador especializado del suelo y la hojarasca de los bosques neotropicales (Donoso, 2012; Jacquemin et al., 2014). En Colombia, ha sido reportada en el departamento de Antioquia (García-Cárdenas & Méndez-Rojas, 2013; Vergara-Navarro & Serna, 2013), Quindío (García-Cárdenas & Méndez-Rojas, 2013), Risaralda (Chacón de Ulloa et al., 2012), Valle del Cauca (Arenas et al., 2015; Armenteras et al., 2004; Marín et al., 2015), Magdalena (Donoso, 2012), Caquetá, Guaviare (Donoso, 2019), y este es el primer reporte en el departamento del Cesar. El pastizal donde fue registrada esta especie presentaba cercos vivos y árboles distribuidos de forma dispersa, remanentes de la vegetación anterior. Presentaba además un bajo pastoreo y alta abundancia de Pteridium aquilinum (Dennstaedtiaceae), especie arbustiva conocida comúnmente como helecho marranero, muy común en pastizales, donde confiere cobertura al suelo. Estos árboles, arbustos y su hojarasca proporcionan condiciones microclimáticas adecuadas y amplían la variedad de hábitat y sitios de nidificación para estas hormigas, lo que podría explicar su presencia en este uso de suelo. Además, se ratifica la importancia de la cobertura vegetal natural, como un parámetro ambiental que favorece la diversidad y riqueza de las comunidades de hormigas en los pastizales (Domínguez-Haydar, 2011).
Riqueza y diversidad entre paisajes y usos de suelo: En cada uno de los paisajes analizados las hormigas mostraron alta sensibilidad a los cambios en el uso del suelo. Se evidenció que la riqueza y diversidad disminuyó en los sitios con poca cobertura vegetal, como los pastizales, mientras que los bosques, en ambos paisajes, conservaron la mayor riqueza de especies.
La variabilidad encontrada en la diversidad de hormigas de los usos del suelo del programa de compensación, con valores muy altos para la V1 pero con bajos valores para la V2, no permitió observar diferencias en relación a los resultados obtenidos en el área donde aún no se implementa este programa, la dinámica de transformación del paisaje es un elemento que debe considerarse para entender estos resultados contrastantes. Las hormigas están respondiendo al manejo que se les está dando a estas coberturas, los valores para V1 evidencian que las estrategias de manejo implementadas para la protección y recuperación de las coberturas boscosas y las prácticas de manejo adecuadas en los SAFC (sombra, bajos insumos de agroquímicos), han contribuido a la conservación de la mirmecofauna local. En esta localidad los sistemas agroforestales de café operan como estados intermedios de perturbación entre sitios muy transformados y sitios más conservados, ejerciendo un efecto amortiguador sobre la diversidad de hormigas, especialmente en las especies forestales que se mueven entre fragmentos de bosque, tal y como se ha evidenciado en otros estudios (Arenas-Clavijo & Armbrecht, 2018; Armbrecht et al., 2005).
Por otro lado, la baja riqueza y diversidad de hormigas registradas en V2, sugieren que en esta localidad la mirmecofauna está siendo afectada por el manejo intensivo de los SAFC, donde las prácticas de renovación de los cultivos, la tala frecuente de árboles y la consecuente disminución de la cobertura de dosel (15 %) reducen la disponibilidad de microhábitats y generan condiciones no propicias, sobre todo de temperatura y humedad del suelo para el forrajeo de especies de baja tolerancia (Rodríguez-de León et al., 2019). Sumado a lo anterior, el uso de agroquímicos en fumigaciones constantes (observaciones personales) puede generar pérdidas en la riqueza y diversidad de las comunidades de hormigas asociadas a este sistema productivo. En concordancia con otros estudios en los que se ha evidenciado que la intensificación de los cafetales resulta en una pérdida de biodiversidad asociada (Klein et al., 2002; Rojas et al., 2001).
En el paisaje donde aún no se implementa el programa de compensación (V3, V4), los resultados ratifican que los bosques son hábitats importantes para la mirmecofauna. A pesar de no estar restringidas las actividades agropecuarias (tala de árboles, uso de agroquímicos, pastoreo) que afectan el suelo, aún permanecen remanentes de bosque que albergan gran riqueza y número de especies exclusivas, por tanto, se hace prioritario establecer nuevas áreas destinadas a su regeneración y establecer adecuadas prácticas de manejo agropecuario.
Dada su alta complejidad estructural, los bosques ofrecen variedad de sitios de nidificación, microclima constante y mayor oferta de recursos alimenticios (Cabrera-Córdoba et al., 2021), lo que favorece la riqueza y diversidad de hormigas presentes en este uso de suelo. El total de especies registradas en los bosques manifiestan la importancia de este uso de suelo a escala local y regional para su conservación. Asimismo, en las áreas de regeneración natural el tiempo de rehabilitación (más de 20 años), la alta riqueza de especies, y la presencia de hormigas especialistas y bioindicadoras (Leptogenys, Gnamptogenys, Prionopelta, Basiceros, Octostruma, Strumigenys), permiten suponer un estado avanzado de sucesión vegetal y un consecuente aumento de la complejidad estructural, lo que ha favorecido la riqueza y diversidad de hormigas en este uso de suelo. Resultados acordes con las experiencias de restauración en Colombia (Calle et al., 2013; Domínguez-Haydar & Armbrecht, 2011).
Los paisajes cafeteros son elementos dominantes en el ámbito rural nacional, por ello se ha propuesto la implementación de sistemas agroforestales cafeteros con diferentes especies de árboles nativos, maderables o frutales los cuales constituyen una matriz favorable para la diversidad de hormigas propias de áreas boscosas (Arenas-Clavijo & Armbrecht, 2018; García-Cárdenas et al., 2018; Rivera & Armbrecht, 2005; Urrutia-Escobar & Armbrecht, 2013; Zabala et al., 2013). Esto se evidenció en los agroforestales estudiados, la mayor riqueza y diversidad de hormigas se encontró en los cafetales dos y cuatro de V1, los cuales presentaron alta cobertura vegetal y diferentes estratos arbóreos. La mayoría de estos SAFC tienen labores de cultivo adecuadas, lo que permite la coexistencia de una gran variedad de gremios (Martínez-Gamba, 2018; Perfecto et al., 1996). Las especies compartidas entre los SAFC con los parches de bosque (47.8 %) y las áreas de regeneración natural (46.1 %) manifiestan la importancia de este uso de suelo a escala local como un elemento fundamental de conectividad entre usos de suelo, y el mejor hábitat para las especies forestales que se mueven entre fragmentos de bosque (Armbrecht et al., 2005; Perfecto & Vandermeer, 2002).
En los pastizales el número de especies de hormigas se redujo en un 57.2 % frente a los usos de suelo que conservan mayor cobertura vegetal natural. En el Cesar la ganadería es una actividad económica importante, con un área de pastoreo correspondiente al 47 % de su territorio (Arias et al., 2021). Este sistema de producción transforma la cobertura vegetal nativa de los bosques en pastizales, en los cuales la actividad pecuaria altera las propiedades del suelo (Estrada et al., 2019) y afecta de forma negativa a las comunidades de hormigas, lo que se vio reflejado en los valores más bajos de riqueza registrados en los pastizales de ambos paisajes. La acelerada transformación de bosques en pastizales amenaza la supervivencia de muchas especies de hormigas, sin embargo, el impacto de este cambio podría ser menor si se implementan sistemas que combinen plantaciones forestales nativas, o arbustivas en los pastizales, tal y como se evidenció en V1 donde los pastos con mayor cobertura vegetal (punto uno y tres) presentaron la mayor riqueza y diversidad de hormigas. Los árboles y arbustos en los pastizales proporcionan cobertura al suelo, mejoran la conectividad del paisaje y proporcionan ambientes favorables para la macrofauna edáfica y el ganado, incrementando el potencial de las fincas ganaderas (Arias et al., 2021; Calle et al., 2017; Gamboa et al., 2010).
Asociación entre variables ambientales y biológicas: El análisis de co-inercia comprobó que los usos de suelo con menor cobertura dosel y menor aporte de hojarasca fueron los menos ricos y diversos en mirmecofauna, es decir, los pastizales.
En el primer eje se asociaron usos de suelo con alta cobertura de dosel y hojarasca, como los bosques (V2, V3, V4), en donde las condiciones microclimaticas favorecen el establecimiento y la abundancia de hormigas propias de este uso de suelo (Gnamptogenys sp. 1, Basiceros sp.1, Leptogenys sp. 1, Pachycondyla impressa) y algunas especies crípticas de hojarasca (Strumigenys sp. 4, Cyphomyrmex sp. 1, Myrmicocrypta sp. 1), las cuales suelen nidificar en madera descompuesta, hojarasca o cavidades en el suelo (Fernández et al., 2019). De forma inversa en este mismo eje se agruparon los pastizales (V1, V2, V3, V4), donde la baja cobertura de dosel (14.4 %), el pisoteo frecuente del ganado y la subsecuente compactación del suelo se reflejan en altas temperaturas (27-32 °C), mayor resistencia a la penetración (3.4 kg/cm2) y mayor densidad aparente (0.83 g/cm3). En este uso de suelo fueron abundantes especies con hábitos generalistas (Acromyrmex aspersus, Tapinoma melanocephalum, Solenopsis sp. 5, Linepithema sp. 1, Ectatomma ruidum, Dorymyrmex biconis, y varias especies de Camponotus), que son frecuentes en áreas abiertas y con poca vegetación.
En el segundo eje los usos de suelo se separan por localidades de acuerdo con diferencias geográficas. Los bosques en V1 fueron el uso de suelo con mayor riqueza de especies de hormigas y los SAFC de V2 fueron el uso de suelo con menor riqueza asociada, además del total de especies registradas en V2 sólo cuatro fueron exclusivas de esta localidad (Anochetus sp. 3, Camponotus sp. 10, Nesomyrmex sp. 2, Tranopelta sp. 1). En este sentido y acorde con el alto valor de anidamiento obtenido entre estas localidades, las especies de los bosques y SAFC en V2 son un subconjunto de las especies presentes en los bosques y SAFC de V1. En el paisaje de no compensación (V3-V4), las especies exclusivas entre los SAFC (41.02 %) y las áreas de regeneración natural (51.2 %) contribuyeron al alto recambio obtenido en este paisaje. Estos valores de recambio no fueron acordes con el supuesto de distancia entre sitios, mecanismo que plantea que entre sitios muy cercanos se obtienen valores de recambio bajos a moderados y entre sitios muy alejados se obtienen valores de recambio altos (Koleff et al., 2003); ya que, aunque V3 y V4 se encuentran próximas geográficamente, los valores obtenidos de beta diversidad y de recambio fueron altos, lo que sugirió la presencia de otro mecanismo que explicara estos resultados.
El reemplazo de especies (95.7%) que dio lugar a combinaciones diferentes en la composición, fue el mecanismo que contribuyó directamente al valor del recambio de especies obtenido entre los usos de suelo estudiados. Únicamente cinco especies (4.27 %) fueron recolectadas en los cuatro usos de suelo de los dos paisajes: Nylanderia sp. 1, Pheidole sp. 2, Pheidole sp. 5, Solenopsis sp. 1, Solenopsis sp. 5. Las especies de estos géneros son de hábitos generalistas y tienen la capacidad de establecerse en diferentes ambientes y condiciones (Fernández & Ortiz-Sepúlveda, 2019; Serna et al., 2019; Wilson, 2003).
Se evidenció que la densidad y humedad del suelo, las variables ambientales que más contribuyen en este eje, están relacionadas con el aporte continuo de biomasa procedente del sombrío (CD = 74.8 %, AH = 3.7 cm), estas condiciones contribuyen a mejorar las propiedades físicas del suelo (Salamanca & Sadeghian, 2005) y, por ende, favorecen la abundancia y diversidad de hormigas propias de áreas forestales y crípticas de hojarasca (Hylomyrma, Odontomachus, Apterostigma, Gnamptogenys, Dolichoderus, Rogeria, Strumigenys, Octostruma, Mycocepurus).
Nuestros hallazgos muestran que las hormigas responden a los cambios de uso de suelo y en particular a la cobertura vegetal, esto se evidenció en las áreas de pastos y cafetales con alta riqueza de hormigas y mayor presencia de vegetación. Por ello, además de las medidas de conservación de los bosques se deben establecer prácticas adecuadas de manejo agropecuario en los SAFC de café y los pastizales, que promuevan el mantenimiento de la diversidad, tales como aumentar la cobertura arbórea y minimizar o sustituir el uso de insumos agroquímicos (fertilizantes, herbicidas, insecticidas). La alta variabilidad en la diversidad de hormigas entre las áreas de una misma cobertura no permitió observar diferencias entre el paisaje de compensación y no compensación. Por ello, se recomienda incluir la heterogeneidad ambiental de estos paisajes relacionada con distintos procesos de fragmentación, historias de uso y transformación, para relacionarlas con la diversidad y composición de hormigas.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


