Introducción
La minería es una actividad vinculada al desarrollo económico de muchas regiones alrededor del mundo. Sin embargo, esta actividad también es responsable de drásticos impactos sobre la estructura, funcionamiento y dinámica natural de ecosistemas forestales estratégicos para la conservación y el uso sostenible de la biodiversidad (Sonter et al., 2018). Los ecosistemas forestales tropicales impactados por la minería, debido al deterioro que se observa y a la importancia que representan para la conservación, y uso sostenible de la vida silvestre, requieren de la aplicación de estrategias urgentes de rehabilitación y/o restauración ecológica (Ramírez-Moreno et al., 2019), y aunque existen algunos lineamientos metodológicos para enfrentar el problema (Cooke & Johnson, 2002; Ramírez-Moreno et al., 2016), existe la controversia sobre el uso de especies vegetales exóticas para la recuperación de suelos degradados (Maglianesi, 2010).
La controversia sobre el uso de plantas exóticas en programas de rehabilitación o restauración ecológica de suelos degradados tiene dos enfoques distintos; por un lado, se argumenta que las especies exóticas introducidas pueden convertirse en invasoras que provocan perturbaciones a la dinámica natural de ecosistemas autóctonos (Byrne et al., 2011; Millar et al., 2012), al respecto, las plantas invasoras pueden causar desplazamiento de poblaciones autóctonas, cambios en los niveles tróficos de la comunidad, disminución de la biodiversidad, alteración de los regímenes de perturbación y desviaciones en la trayectoria de la sucesión natural en áreas perturbadas (Vilà et al., 2006); por otro lado, existe un enfoque ecológico del uso de plantas exóticas, cuando se trata de suelos extremadamente degradados como los suelos mineros, argumentado en el hecho que algunas plantas introducidas son exitosas en programas de recuperación de cobertura boscosa sobre suelos degradados en el mundo, pues estas especies, por lo general, son de rápido crecimiento y fácil establecimiento, sin necesidad de largos periodos de mantenimiento (Maglianesi, 2010), por ejemplo, en varias regiones neotropicales se han sembrado coníferas para repoblar y recuperar exitosamente la cobertura vegetal de suelos degradados con baja fertilidad (Chaves, 2005).
Las siembras forestales con especies exóticas se aplican en regiones tropicales como estrategia para la rehabilitación de suelos degradados (Maglianesi, 2010). La rehabilitación de suelos impactados por la minería generalmente comprende acciones que involucran la introducción de plantas con alta capacidad de adaptación a ambientes estresantes o con déficit de nutrientes en el suelo que intervienen en el crecimiento de las plantas, donde especies vegetales nativas no adaptan y crecen fácilmente (Pérez et al., 2012); en este sentido, una especie exótica común en planes de rehabilitación forestal de áreas mineras en el mundo es Acacia mangium Willd., una leguminosa arbórea de alta capacidad adaptativa a suelos drásticamente degradados (Pérez et al., 2012; Wasis et al., 2019). A. mangium es un árbol con rápida tasa de crecimiento (Valois-Cuesta, 2016); se ha demostrado que mejora las condiciones de disponibilidad de nitrógeno (N) en suelos degradados (Pérez et al., 2012; Valois-Cuesta, 2016; Voigtlaender et al., 2012) y que facilita el establecimiento de especies autóctonas o introducidas naturalizadas en bosques tropicales lluviosos impactados por la minería (Valois-Cuesta, 2016).
La región del Chocó biogeográfico en Colombia posee uno de los bosques tropicales lluviosos con mayor biodiversidad del planeta (Poveda et al., 2004; Rangel-Ch, 2004), donde la minería de oro a cielo abierto en el seno del bosque ha alcanzado gran auge, dejando en consecuencia ecosistemas selváticos con una diversidad biológica rica en especies y endemismos vulnerada (Lara-Rodríguez et al., 2020; Valois-Cuesta & Martínez-Ruiz, 2016; Fig. 1). Grandes extensiones de esas áreas son objeto de planes de reforestación con plantaciones de A. mangium, desconociendo el impacto de la introducción de esta especie sobre la trayectoria de la sucesión natural de esas áreas críticas; por lo tanto, desde el enfoque de la restauración ecológica, surge la pregunta ¿Cuál es el efecto de las siembras de A. mangium en la rehabilitación de áreas degradadas por minería de oro en la selva pluvial tropical del Chocó? Se parte de la premisa que, si las plantaciones de A. mangium facilitan la recuperación del suelo y el reclutamiento de especies autóctonas y/o naturalizadas, entonces, se debe esperar que la comunidad vegetal subyacente en las áreas mineras reforestadas con A. mangium presenten mayor complejidad en términos de su estructura biológica y composición de especies, que aquellas áreas mineras no reforestadas y en sucesión pasiva.
Por lo anterior, el objetivo del presente trabajo fue analizar el efecto de la introducción de la especie exótica A. mangium sobre la fertilidad del suelo, la estructura biológica y la composición de especies (autóctonas y/o naturalizadas) en comunidades vegetales que subyacen espontáneamente en minas abandonadas con plantaciones de A. mangium y en minas bajo condiciones de regeneración natural en la selva pluvial tropical del Chocó en Colombia.

Fig. 1 Minería a cielo abierto en la selva pluvial tropical del Chocó, Colombia. A.-B. Minas abandonadas con extensas áreas de arena y grava, C. que experimentan procesos de sucesión natural, D. o son reforestadas con Acacia mangium. / Fig. 1. Open pit mining in the tropical rain forest of Chocó, Colombia. A.-B. Abandoned mines with extensive areas of sand and gravel, C. undergoing natural succession processes, D. or are reforested with Acacia mangium.
Materiales y métodos
Área de estudio: El estudio se realizó en dos localidades, Raspadura (5°13'17'' N & 76°38'37'' W), municipio de Unión Panamericana y Condoto (5°5'32'' N & 76°38'55'' W), municipio de Condoto, Chocó, Colombia. Ambas localidades pertenecen a la Subregión Central Norte del Chocó biogeográfico colombiano, que se caracteriza por su elevada pluviosidad (8 000 - 11 000 mm anuales), una temperatura promedio de 26 °C y la humedad relativa mayor al 80 %; esta subregión presenta una vegetación nativa propia del bosque pluvial tropical (Poveda et al., 2004). El Chocó es uno de los territorios de Colombia con mayor producción aurífera, donde cerca del 90 % de la minería se realiza sin formalización legal (Lara-Rodríguez et al., 2020; Valois-Cuesta & Martínez-Ruiz, 2016). Muchos pobladores del territorio practican la minería de manera tradicional, con herramientas de bajo impacto ambiental. Sin embargo, cada vez más, la minería de oro a cielo abierto se realiza con maquinaria pesada (retroexcavadoras y motobombas) que lavan grandes volúmenes de tierra, dejando como resultado los bosques fragmentados y extensas zonas con montículos de arena y grava expuestos a la intemperie, y que, en algunos casos, son reforestados con la especie exótica A. mangium(Valois-Cuesta, 2016; Fig. 1). A. mangium es un árbol nativo de Australia, Papua Nueva Guinea e Indonesia; presenta rápido crecimiento como planta heliófila pionera en su hábitat natural. Esta especie tolera suelos pobres y ácidos altamente degradados, con elevadas concentraciones de óxidos de hierro y aluminio; puede desarrollarse en regiones hasta los 480 m.s.n.m., bajo regímenes de precipitación entre 1 000 y 4 200 mm anuales, y temperaturas entre 12 y 34 °C (Hegde et al., 2013; Krisnawati et al., 2011).
Escenarios de estudio y diseño de muestreo: Se seleccionaron 16 áreas mineras abandonadas, las cuales eran similares en cuanto al impacto en tamaño del área perturbada (≈ 1 ha) y el tipo de minería que recibieron (minería a cielo abierto con uso de retroexcavadoras y motobombas), pero diferían respecto al tipo de revegetación temprana experimentada. Así, se contó con ocho áreas mineras que tras el cese de la minería fueron reforestadas con A. mangium y sin mantenimiento posterior (cuatro en Raspadura y cuatro en Condoto), y otras ocho áreas que tras el cese de la minería fueron abandonadas e iniciaron la regeneración pasiva sin siembra de acacias (cuatro en Raspadura y cuatro en Condoto). Estas áreas mineras seleccionadas tenían entre 10 y 12 años de abandono tras el cese de la minería y haber sido revegetadas con A. mangium o dejadas revegetar naturalmente, información que fue suministrada por los representantes legales de los consejos comunitarios de Raspadura y Condoto, y propietarios de los predios escogidos para el estudio.
Muestreos de vegetación: En cada una de las áreas mineras, con y sin plantaciones de acacia, se estableció una parcela de 2 × 50 m, entre agosto y octubre de 2018; por lo tanto, en cada escenario de muestreo y localidad se contó con cuatro parcelas (400 m2) como unidad de muestreo para los censos de vegetación. En cada parcela se registró el número total de individuos de cada especie de plantas vasculares, excluyendo los individuos de acacia usados para reforestar las áreas mineras.
El material vegetal recolectado en las parcelas fue identificado hasta el nivel de especie, haciendo uso de literatura especializada (Gentry, 1996), por confrontación con ejemplares de los herbarios CHOCÓ (Universidad Tecnológica del Chocó) y COL (Universidad Nacional del Colombia), y con la colaboración de especialistas. La validez de los nombres científicos se comprobó usando la base de datos The Plant List (2013). Las muestras recolectadas fueron depositadas en el Herbario CHOCO y su clasificación se basa en los trabajos del grupo de filogenética de angiospermas (The Angiosperm Phylogeny Group, 2009).
Análisis de fertilidad del suelo: En cada una de las parcelas donde se realizaron los censos florísticos, se obtuvo una muestra de suelo compuesta por la mezcla de 10 sub-muestras recolectadas aleatoriamente en diez puntos dentro la parcela. En total se recolectaron 16 muestras de suelo, es decir cuatro réplicas para cada escenario y localidad. Las muestras de suelo fueron selladas en bolsas y enviadas al laboratorio donde se analizaron los siguientes parámetros: textura (método Bouyoucos), capacidad de intercambio catiónico efectiva (CIC ef a saturación con acetato de amonio; método cuantificación: volumétrico), pH (método extracción: suelo/agua (1:1); método cuantificación: potenciométrico), Al, Mg, K, Ca (método de extracción con Acetato de Amonio 1N y pH 7; método cuantificación: Absorción Atómica), P (método extracción: B-Bray II; método cuantificación: empleando como reductor ácido ascórbico), MO (método extracción: B-Walkley Black por oxidación húmeda; método cuantificación: volumétrico), N total (método Kjeldhal).
Tratamiento y análisis de los datos: Los datos de vegetación fueron analizados a nivel de comunidad, entendiendo por comunidad vegetal cada unidad conformada por la combinación de cada tipo de revegetación (plantación de acacia o regeneración pasiva) × localidad (Raspadura o Condoto); así, se dispone de datos de cuatro parcelas de 2 × 50 m (400 m2) por comunidad, i.e. cuatro réplicas.
En cada comunidad vegetal se estimó la riqueza de especies con los estimadores Chao1 y ACE, y la diversidad mediante el índice de Shannon (Colwell, 2013). Además, se realizaron curvas de rango-abundancia, usando los valores de importancia ecológica de las especies, con el fin de analizar el patrón de representatividad de las especies dentro de cada comunidad (Villareal et al., 2006).
El peso ecológico de las especies por comunidad fue calculado mediante el Índice de Valor de Importancia Ecológica Simplificado (IVIs). Este índice se estimó sumando la abundancia relativa (abundancia absoluta de la especie dividida por la suma de las abundancias absolutas de todas las especies) y la frecuencia relativa (frecuencia absoluta de la especie dividida entre el sumatorio de todas las frecuencias absolutas de las especies) de cada especie: (IVIs = (densidad relativa + frecuencia relativa)). La abundancia absoluta para cada especie se calculó como la suma de todos los individuos de una especie encontrados y la frecuencia absoluta se calculó como la suma del número de parcelas de cada comunidad donde se halló la especie (Villareal et al., 2006). Las diferencias estadísticas entre comunidades en los valores promedio de importancia ecológica de las especies se evaluaron con una ANOVA de dos vías. El modelo incluyó las interacciones entre los niveles de los factores (tipo de revegetación × localidad).
Para determinar diferencias estadísticas en el número de individuos, especies, géneros y familias entre comunidades vegetales se empleó la prueba z para proporciones. Por otro lado, similitudes en la composición florística entre comunidades se determinaron con el índice de Jaccard y su estimador probabilístico, donde valores cercanos a 1 indican composiciones florísticas idénticas mientras que valores cercanos a 0 indican falta de similitud (Chao et al., 2005; Colwell, 2013). Además, para determinar diferencias estadísticas en la composición de especies entre comunidades se usó la prueba Binomial, en la cual se asumió como hipótesis alternativa que dos comunidades son similares, si la probabilidad de recambio de especies es mayor que 0.5 a intervalos de confianza del 95 %.
Para evaluar diferencias en las propiedades físicas y químicas del suelo entre escenarios de revegetación se realizó una prueba de Mann-Whitney. Además, se realizó un análisis de componentes principales (ACP) para explorar las relaciones entre las comunidades vegetales y las variables de la vegetación y suelo encontradas en ellas.
La riqueza y diversidad de especies se calculó con el programa Estimates versión 9 (Colwell, 2013). Los análisis de componentes principales (ACP) se realizaron con el programa CANOCO versión 4.5 (Ter Braak & Šmilauer, 2002). Todas las pruebas estadísticas se realizaron en el entorno de programación R (R Core Team, 2012).
Resultados
Efectos sobre la estructura biológica de la vegetación: En general, a partir de los censos de vegetación realizados en parcelas con regeneración natural y aquellas con plantaciones de A. mangium, se registró un total de 73 especies de plantas vasculares pertenecientes a 69 géneros y 45 familias. Las minas reforestadas con A. mangium presentaron más especies (59 especies; 80.8 % del total), géneros (45 géneros; 65.2 %) y familias (32 familias; 71.1 %) que aquellas bajo sucesión natural y sin plantaciones de acacia (40 especies, 54.8 %; 36 géneros, 52.1 % y 24 familias, 53.3 %), pero estas diferencias no fueron independientes de la localidad, ya que las comunidades vegetales censadas en áreas mineras de Condoto presentaron más taxones que aquellas registradas en Raspadura (Tabla 1). Al analizar la riqueza de especies observada respecto a lo estimado por los parámetros Chao 1 y ACE, se pudo determinar que el esfuerzo de muestreo aplicado fue representativo en todas las comunidades evaluadas, ya que los censos de vegetación permitieron registrar entre 90.5 y 100 % de las especies estimadas en ellas (Tabla 1).
Tabla 1 Estructura de la vegetación de minas revegetadas con Acacia mangium y minas en sucesión natural en dos localidades del Chocó, Colombia. / Table 1. Vegetation structure of mines revegetated with Acacia mangium and mines in natural succession in two localities of Chocó, Colombia.
| Tipo de Revegetación (TR) | Localidad | Área (m2) | Densidad | Riqueza | Diversidad | |||||||
| N° individuos | Familias | Géneros | Especies | ACE | Chao 1 | Shannon | ||||||
| Plantación A. mangium | ||||||||||||
| Raspadura | 400 | 1 075 | 21 | 27 | 33 | 37 | 36 | 2.45 | ||||
| Condoto | 400 | 1 377 | 28 | 37 | 41 | 56 | 45 | 2.81 | ||||
| c2 | 74.1*** | 3.1 ns | 4.3* | 1.7 ns | 12.2*** | 2.1 ns | ||||||
| Global | 800 | 2 443 | 32 | 45 | 59 | 65 | 65 | 3.06 | ||||
| Sucesión natural | ||||||||||||
| Raspadura | 400 | 1 221 | 11 | 17 | 18 | 18 | 18 | 2.01 | ||||
| Condoto | 400 | 1 568 | 23 | 28 | 30 | 30 | 30 | 2.49 | ||||
| c2 | 85.8*** | 12.2* | 5.9* | 6.3* | 6.3* | 6.3* | ||||||
| Global | 800 | 2 789 | 24 | 36 | 40 | 40 | 40 | 2.59 | ||||
| Efecto del TR | c2 | 45.4*** | 2.3ns | 1.9ns | 10.1** | 19.5*** | 19.5*** | |||||
Nota: Diferencias estadísticas (prueba z para proporciones) entre ambientes de revegetación y entre localidades para cada ambiente se indican así: * P < 0.05, **P < 0,01, *** P < 0.0001, ns = No significativo (P > 0.05). / Note: Statistical differences (z test for proportions) between revegetation environments and between localities for each environment are indicated as follows: * P < 0.05, ** P < 0.01, *** P < 0.0001, ns = Not significant (P > 0.05).
La densidad de individuos (n° de individuos en 400 m2) fue mayor en las minas bajo sucesión natural que en aquellas revegetadas con A. mangium, pero ello no fue independiente de la localidad, ya que en las minas de Condoto hubo mayor densidad que en las minas de Raspadura. Por el contrario, al igual que la riqueza de especies, la diversidad de especies fue mayor en las minas reforestadas con A. mangium que en aquellas bajo sucesión natural, con máximos valores en las minas de Condoto y mínimos en Raspadura (Tabla 1).
El valor promedio de importancia ecológica (IVIs) de las especies no varió con la localidad (ANOVA de dos vías: Raspadura = 7.8 ± 1.23; Condoto = 5.6 ± 0.69; F 1,118 = 2.88; P = 0.09), pero si con el tipo de revegetación (F 1,118 = 4.96; P = 0.002), con valores más altos en las minas con revegetación natural (8.3 ± 1.29) que en aquellas reforestadas con A. mangium (5.4 ± 0.67). En este caso la interacción tipo de revegetación × localidad no fue significativa (F 1,118 = 1.51; P = 0.22). Lo anterior se vislumbra claramente en las curvas de rango-abundancia (usando los IVIs de las especies), las cuales muestran que independientemente de la localidad, las comunidades vegetales de las áreas mineras reforestadas con A. mangium son más ricas en especies que muestran un patrón de distribución de abundancia más equitativo si se compara con aquellas comunidades vegetales que subyacen bajo condiciones de regeneración pasiva, donde pocas especies son altamente dominantes (comunidades poco equitativas) (Fig. 2).
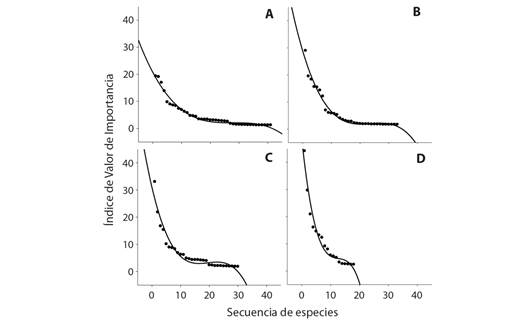
Fig. 2 Curvas de rango-abundancia de las comunidades vegetales, A.-B. en minas reforestadas con Acacia mangium y C.-D. minas en sucesión natural, A., C. en las localidades de Condoto y B., D. Raspadura, Chocó, Colombia. / Fig. 2. Rank-abundance curves of plant communities, A.-B. in mines reforested with Acacia mangium and C.-D. mines in natural succession, A., C. in the localities of Condoto and B., D. Raspadura, Chocó, Colombia.
Efecto sobre la composición florística: Al observar el recambio de especies (número de especies comunes) a nivel global entre escenarios sucesionales (áreas mineras con plantaciones de acacias y sin ellas), se aprecia baja similitud en la composición de especies entre la vegetación subyacente en las áreas mineras reforestadas con A. mangium y aquella que surge bajo sucesión natural (35.6 %). Esta tendencia se mantiene al observar el recambio de especies a nivel de comunidades vegetales, ya que el número de especies compartidas fue inferior a 37 % en todas las comparaciones posibles (15.7 - 36.5 %), indicando diferencias estadísticamente significativas en la composición florística entre comunidades, especialmente entre aquellas que experimentan distintos regímenes de revegetación (con plantaciones de acacias o sin ellas) y/o se encuentran en localidades diferentes. El índice de Jaccard y su estimador probabilístico corroboran lo anterior, muestran que la similitud florística es baja entre las comunidades de las minas reforestadas con A. mangium y las minas en regeneración natural, especialmente entre aquellas ubicadas en distinta localidad (Tabla 2).
Tabla 2 Similitud en la composición de especies entre minas revegetadas con Acacia mangium y minas en sucesión natural en dos localidades del Chocó, Colombia. / Table 2. Similarity in species composition between mines revegetated with Acacia mangium and mines in natural succession in two localities of Chocó, Colombia.
| Comunidad florística 1 | Comunidad florística 2 | Número de especies | Índice de similitud | Probabilidad de recambio (> 0.5) | |||||||||
| Tipo de revegetación | Localidad | Tipo de revegetación | Localidad | Global | Compartidas | Chao-Jaccard | Estimador | Prueba binomial | |||||
| A. mangium | Condoto | Sucesión natural | Condoto | 52 | 19 | 0.54 | 0.55 | 0.36 | ns | ||||
| A. mangium | Condoto | A. mangium | Raspadura | 59 | 15 | 0.31 | 0.32 | 0.25 | ns | ||||
| Sucesión natural | Condoto | Sucesión natural | Raspadura | 51 | 8 | 0.25 | 0.25 | 0.15 | ns | ||||
| Sucesión natural | Condoto | A. mangium | Raspadura | 54 | 9 | 0.33 | 0.33 | 0.16 | ns | ||||
| Sucesión natural | Condoto | Sucesión natural | Raspadura | 40 | 8 | 0.45 | 0.45 | 0.20 | ns | ||||
| A. mangium | Raspadura | Sucesión natural | Raspadura | 42 | 9 | 0.66 | 0.66 | 0.21 | ns | ||||
| A. mangium (Global) | Sucesión natural (Global) | 73 | 26 | 0.62 | 0.62 | 0.35 | ns | ||||||
Nota: Los valores de similitud no fueron significativos entre las comunidades (ns = no significativo, P > 0.05). / Note: Similarity values were not significant between communities (ns = not significant, P > 0.05).
La vegetación subyacente en los escenarios estudiados estuvo representada principalmente por especies herbáceas y arbustivas como Lycopodiella cernua (L.) Pic. Serm., Andropogon bicornis L., Dicranopteris flexuosa (Schrad.) Underw., Clidemia sericea D. Don, Pityrogramma calomelanos (L.) Link, Cespedesia spathulata (Ruiz & Pav.) Planch., Mimosa pudica L., Miconia reducens Triana y Miconia capitellata Cogn. No obstante, las especies variaron en su representatividad dentro de cada comunidad vegetal dependiendo del tipo de revegetación y localidad (Tabla 3). Por ejemplo, la comunidad florística subyacente en minas de Condoto revegetadas con A. mangium, se caracteriza por la dominancia de Spermacoce alata Aubl. (IVIs = 9.7 %), A. bicornis (9.6 %), P. calomelanos (8.5 %) y Paspalum conjugatum P. J. Bergius (6.9 %), mientras que aquellas en sucesión natural (sin acacias) en esa misma localidad, mostraron asociaciones vegetales dominadas por A. bicornis (16.5 %), L. cernua (10.9 %), P. calomelanos (8.4 %), M. pudica (7.7 %) y Erechtites hieracifolia (L.) Raf. (5.1 %). Por su parte, en Raspadura, la comunidad florística de las minas revegetadas con A. mangium estuvieron representadas por L. cernua (14.5 %), A. bicornis (9.8 %), C. sericea (9.2 %), Becquerelia cymosa Brongn. (7.8 %), D. flexuosa (7.7 %), C. spathulata (7.2 %) y M. reducens (6.1 %); y la comunidad florística en minas en sucesión natural estuvieron dominadas por L. cernua (22.1 %), A. bicornis (14.8 %), D. flexuosa (10.4 %), Xyris jupicai Rich. (8 %), Cyperus laxus Lam. (7.3 %), C. spathulata (6.6 %) y M. capitellata (6.1 %) (Tabla 3).
Tabla 3 Table 3. Importancia ecológica de las especies de las especies de plantas en minas revegetadas con Acacia mangium y minas en sucesión natural en dos localidades del Chocó, Colombia. / Ecological importance of plant species in mines revegetated with Acacia mangium and mines in natural succession in two localities of Chocó, Colombia.
| Familia | Especie | Condoto | Raspadura | ||||||||||||||
| Minas con A. mangium | Minas en sucesión natural | Minas con A. mangium | Minas en sucesión natural | ||||||||||||||
| DR | F | FR | IVIs | DR | F | FR | IVIs | DR | F | FR | IVIs | DR | F | FR | IVIs | ||
| Malvaceae | Abelmoschus moschatus Medik. | 0.38 | 0.25 | 1.75 | 2.14 | ||||||||||||
| Fabaceae | Aeschynomene rudis Benth. | 1.28 | 1.0 | 7.02 | 8.29 | ||||||||||||
| Ephorbiaceae | Alchornea costaricensis Pax & K.Hoffm. | 0.29 | 0.25 | 1.19 | 1.48 | 0.84 | 0.75 | 4.84 | 5.68 | ||||||||
| Poaceae | Andropogon bicornis L. | 15.5 | 0.75 | 3.57 | 19.1 | 26.0 | 1.0 | 7.02 | 33.04 | 14.7 | 0.75 | 4.84 | 19.5 | 20.9 | 1.0 | 8.7 | 29.6 |
| Araceae | Anthurium sp. | 0.07 | 0.25 | 1.19 | 1.26 | ||||||||||||
| Araceae | Anthurium brownii Mast. | 0.06 | 0.25 | 1.75 | 1.82 | 0.19 | 0.25 | 1.61 | 1.8 | ||||||||
| Cyperaceae | Becquerelia cymosa Brongn. | 10.7 | 0.75 | 4.84 | 15.6 | ||||||||||||
| Moraceae | Brosimum utile (Kunth) Oken | 0.28 | 0.25 | 1.61 | 1.89 | ||||||||||||
| Urticaceae | Cecropia hispidissima Cuatrec. | 0.51 | 0.5 | 2.38 | 2.89 | 0.09 | 0.25 | 1.61 | 1.71 | ||||||||
| Urticaceae | Cecropia peltata L. | 4.21 | 1.0 | 4.76 | 8.97 | 0.83 | 0.5 | 3.51 | 4.34 | 0.37 | 0.25 | 1.61 | 1.98 | ||||
| Ochnaceae | Cespedesia spathulata (Ruiz & Pav.) Planch. | 1.02 | 0.5 | 2.38 | 3.4 | 7.91 | 1.0 | 6.45 | 14.3 | 4.5 | 1.0 | 8.7 | 13.2 | ||||
| Gentianaceae | Chelonanthus alatus (Aubl.) Pulle | 0.07 | 0.25 | 1.19 | 1.26 | 0.19 | 0.25 | 1.75 | 1.95 | 0.28 | 0.5 | 3.23 | 3.5 | ||||
| Vitaceae | Cissus erosa Rich. | 3.63 | 1.00 | 4.76 | 8.39 | 2.68 | 0.5 | 3.51 | 6.19 | ||||||||
| Melastomataceae | Clidemia sericea D. Don | 2.69 | 0.75 | 3.57 | 6.26 | 0.57 | 0.5 | 3.51 | 4.08 | 11.91 | 1.0 | 6.45 | 18.3 | 2.62 | 0.75 | 6.52 | 9.14 |
| Rubiaceae | Coccocypselum hirsutum Bartl. ex DC. | 2.03 | 0.5 | 2.38 | 4.41 | 1.91 | 1.0 | 7.02 | 8.93 | 0.28 | 0.25 | 1.61 | 1.89 | ||||
| Lamiaceae | Cornutia microcalycina Pav. ex Moldenke | 0.09 | 0.25 | 1.61 | 1.71 | ||||||||||||
| Costaceae | Costus lasius Loes. | 1.09 | 0.75 | 3.57 | 4.66 | 0.57 | 0.25 | 1.75 | 2.33 | ||||||||
| Cyatheaceae | Cyathea alsophila (Link) Domin | 0.09 | 0.25 | 1.61 | 1.71 | ||||||||||||
| Cyperaceae | Cyperus laxus Lam. | 0.45 | 0.5 | 3.51 | 3.96 | 5.9 | 1.0 | 8.7 | 14.5 | ||||||||
| Cyperaceae | Cyperus ligularis L. | 0.47 | 0.25 | 1.61 | 2.08 | 1.47 | 0.5 | 4.35 | 5.82 | ||||||||
| Cyperaceae | Cyperus luzulae (L.) Retz. | 2.42 | 0.25 | 1.75 | 4.18 | ||||||||||||
| Gleicheniaceae | Dicranopteris flexuosa (Schrad.) Underw. | 1.09 | 0.5 | 2.38 | 3.47 | 10.6 | 0.75 | 4.84 | 15.4 | 12.2 | 1.0 | 8.7 | 20.9 | ||||
| Poaceae | Digitaria bicornis (Lam.) Roem. & Schult. | 7.41 | 0.25 | 1.19 | 8.6 | ||||||||||||
| Gesneriaceae | Drymonia serrulata (Jacq.) Mart. | 1.02 | 0.5 | 2.38 | 3.4 | 0.38 | 0.25 | 1.75 | 2.14 | ||||||||
| Cyperaceae | Eleocharis filiculmis Kunth | 0.49 | 0.25 | 2.17 | 2.67 | ||||||||||||
| Cyperaceae | Eleocharis interstincta (Vahl) Roem. & Schult. | 0.33 | 0.25 | 2.17 | 2.5 | ||||||||||||
| Orchidaceae | Epidendrum sp. | 0.73 | 0.5 | 2.38 | 3.11 | 5.23 | 0.5 | 3.51 | 8.74 | 0.25 | 0.25 | 2.17 | 2.42 | ||||
| Asteraceae | Erechtites hieracifolia (L.) Raf. | 0.44 | 0.25 | 1.19 | 1.63 | 6.63 | 0.50 | 3.51 | 10.1 | ||||||||
| Orchidaceae | Eulophia alta (L.) Fawc. & Rendle | 0.22 | 0.25 | 1.19 | 1.41 | ||||||||||||
| Moraceae | Ficus insipida Willd. | 0.07 | 0.25 | 1.19 | 1.26 | 0.26 | 0.25 | 1.75 | 2.01 | ||||||||
| Annonaceae | Guatteria cargadero Triana & Planch. | 0.36 | 0.50 | 2.38 | 2.74 | ||||||||||||
| Annonaceae | Guatteria hirsuta Ruiz & Pav. | 0.09 | 0.25 | 1.61 | 1.71 | ||||||||||||
| Campanulaceae | Hippobroma longiflora (L.) G.Don | 0.29 | 0.25 | 1.19 | 1.48 | ||||||||||||
| Poaceae | Homolepis aturensis (Kunth) Chase | 2.60 | 0.5 | 3.23 | 5.83 | ||||||||||||
| Poaceae | Ischaemum latifolium (Spreng.) Kunth | 3.41 | 0.5 | 2.38 | 5.79 | 4.53 | 0.25 | 1.75 | 6.28 | ||||||||
| Rubiaceae | Isertia pittieri (Standl.) Standl. | 0.84 | 0.50 | 3.23 | 4.06 | 1.06 | 0.25 | 2.17 | 3.24 | ||||||||
| Verbenaceae | Lantana camara L. | 2.18 | 1.00 | 4.76 | 6.94 | ||||||||||||
| Ochnaceae | Ludwigia decurrens Walter | 3.38 | 0.5 | 3.51 | 6.89 | ||||||||||||
| Lycopodiaceae | Lycopodiella cernua (L.) Pic. Serm | 3.78 | 0.75 | 3.57 | 7.35 | 16.5 | 0.75 | 5.26 | 21.8 | 22.5 | 1.0 | 6.45 | 28.9 | 35.46 | 1.0 | 8.70 | 44.16 |
| Anacardiaceae | Mangifera indica L. | 0.09 | 0.25 | 1.61 | 1.71 | ||||||||||||
| Melastomataceae | Miconia brachycalyx Triana | 2.14 | 0.75 | 4.84 | 6.98 | ||||||||||||
| Melastomataceae | Miconia calvescens DC. | 1.16 | 0.75 | 3.57 | 4.73 | 0.26 | 0.25 | 1.75 | 2.01 | 0.19 | 0.25 | 1.61 | 1.8 | ||||
| Melastomataceae | Miconia capitellata Cogn. | 1.15 | 0.5 | 3.51 | 4.66 | 1.49 | 0.25 | 1.61 | 3.10 | 3.6 | 1.0 | 8.7 | 12.3 | ||||
| Melastomataceae | Miconia reducens Triana | 0.65 | 0.5 | 2.38 | 3.03 | 5.67 | 1.0 | 6.45 | 12.1 | 1.06 | 0.50 | 4.35 | 5.41 | ||||
| Asteraceae | Mikania psilostachya DC. | 0.65 | 0.25 | 1.19 | 1.84 | 1.21 | 0.25 | 1.61 | 2.82 | ||||||||
| Fabaceae | Mimosa pudica L. | 5.01 | 1.0 | 4.76 | 9.77 | 8.35 | 1.0 | 7.02 | 15.3 | ||||||||
| Nephrolepidaceae | Nephrolepis occidentalis Kunze | 0.38 | 0.25 | 1.75 | 2.14 | ||||||||||||
| Melastomataceae | Nepsera aquatica (Aubl.) Naudin | 0.44 | 0.5 | 2.38 | 2.82 | ||||||||||||
| Poaceae | Paspalum conjugatum P.J.Bergius | 10.3 | 0.75 | 3.57 | 13.8 | ||||||||||||
| Piperaceae | Piper aduncum L. | 1.02 | 0.5 | 2.38 | 3.4 | 0.19 | 0.25 | 1.75 | 1.95 | ||||||||
| Piperaceae | Piper auritum Kunth | 0.22 | 0.25 | 1.19 | 1.41 | ||||||||||||
| Piperaceae | Piper peltatum L. | 0.15 | 0.25 | 1.19 | 1.34 | ||||||||||||
| Pteridaceae | Pityrogramma calomelanos (L.) Link | 12.2 | 1.0 | 4.76 | 16.96 | 11.4 | 0.75 | 5.26 | 16.74 | ||||||||
| Myrtaceae | Psidium guajava L. | 0.22 | 0.5 | 2.38 | 2.6 | ||||||||||||
| Rubiaceae | Psychotria cooperi Standl. | 0.19 | 0.25 | 1.61 | 1.80 | ||||||||||||
| Rubiaceae | Psychotria longicuspis Müll.Arg. | 0.28 | 0.25 | 1.61 | 1.89 | ||||||||||||
| Rubiaceae | Psychotria poeppigiana Müll. Arg. | 0.19 | 0.25 | 1.61 | 1.80 | ||||||||||||
| Cyperaceae | Rhynchospora tenerrima Nees ex Spreng. | 0.25 | 0.25 | 2.17 | 2.42 | ||||||||||||
| Rubiaceae | Sabicea panamensis Wernham | 0.41 | 0.25 | 2.17 | 2.58 | ||||||||||||
| Ochnaceae | Sauvagesia erecta L. | 1.40 | 0.5 | 3.51 | 4.91 | ||||||||||||
| Cyperaceae | Scleria robusta Camelb. & Goetgh. | 0.57 | 0.5 | 4.35 | 4.92 | ||||||||||||
| Plantaginaceae | Scoparia dulcis L. | 0.73 | 0.5 | 2.38 | 3.11 | 0.83 | 0.5 | 3.51 | 4.34 | 1.47 | 0.75 | 6.52 | 8.0 | ||||
| Selaginellaceae | Selaginella articulata (Kunze) Spring | 1.21 | 0.25 | 1.61 | 2.82 | ||||||||||||
| Orchidaceae | Sobralia decora Bateman | 0.07 | 0.25 | 1.19 | 1.26 | ||||||||||||
| Arecaceae | Socratea exorrhiza (Mart.) H.Wendl. | 0.09 | 0.25 | 1.61 | 1.71 | ||||||||||||
| Solanaceae | Solanum nudum Dunal | 0.15 | 0.25 | 1.19 | 1.34 | 0.13 | 0.25 | 1.75 | 1.88 | ||||||||
| Rubiaceae | Spermacoce alata Aubl. | 14.60 | 1.00 | 4.76 | 19.3 | ||||||||||||
| Rubiaceae | Spermacoce ocymifolia Willd. ex Roem. & Schult. | 0.83 | 0.50 | 3.51 | 4.34 | ||||||||||||
| Anacardiaceae | Spondias mombin L. | 0.07 | 0.25 | 1.19 | 1.26 | ||||||||||||
| Pteridaceae | Thelypteris andreana (Sodiro) C.V. Morton | 0.15 | 0.25 | 1.19 | 1.34 | 0.65 | 0.25 | 1.61 | 2.26 | ||||||||
| Hypericaceae | Vismia macrophylla Kunth | 0.07 | 0.25 | 1.19 | 1.26 | 1.21 | 0.75 | 4.84 | 6.05 | ||||||||
| Annonaceae | Xylopia macrantha Triana & Planch. | 0.47 | 0.75 | 4.84 | 5.3 | ||||||||||||
| Xyridaceae | Xyris jupicai Rich. | 0.64 | 0.25 | 1.75 | 2.39 | 7.37 | 1.0 | 8.7 | 16.0 | ||||||||
| Total | 100 | 21 | 100 | 200 | 100 | 14.25 | 100 | 200 | 100 | 15.5 | 100 | 200 | 100 | 11.5 | 100 | 200 | |
Nota: DR = densidad relativa, F = frecuencia, FR = frecuencia relativa, IVIs = Índice de Valor de Importancia Simplificado. / Note: DR = relative density, F = frequency, FR = relative frequency, IVIs = Simplified Importance Value Index.
Efecto sobre las propiedades físicas y químicas del suelo: El análisis aplicado al conjunto de variables físicas y químicas del suelo que fue recolectado en parcelas de minas revegetadas con A. mangium y en minas en sucesión natural, reveló que la textura del suelo no varía significativamente entre localidades, pero si entre ambientes de regeneración. Al respecto, el porcentaje de arena y limos fue mayor en suelos de minas revegetadas con A. mangium que en las minas en regeneración natural (Tabla 4). Al aplicar el análisis de componentes principales (ACP) en el conjunto de parcelas se constata que además de lo anterior, el suelo de las minas revegetadas con A. mangium tiende a presentar mejores condiciones nutricionales (mayor cantidad de N-NHO3, Mg y CIC ef.) que el suelo de las minas en regeneración natural. Sin embargo, estas diferencias no fueron independientes de la localidad, ya que las parcelas de Condoto se agruparon en el extremo derecho del ACP, donde se asocian a mayores valores de nutrientes, que aquellas muestreadas en Raspadura, indistintamente del tipo de revegetación (Fig. 3).
Tabla 4 Parámetros del suelo en minas revegetadas con Acacia mangium y minas en sucesión natural en dos localidades del Chocó, Colombia. / Table 4. Soil parameters in mines revegetated with Acacia mangium and mines in natural succession in two localities of Chocó, Colombia.
| Variables | Unidades | Tipo de ambiente | Mann-Whitney | ||||||
| Minas con A. mangium | Minas en sucesión natural | ||||||||
| Condoto | Raspadura | Global | Condoto | Raspadura | Global | ||||
| Arena | % | 81.0 ± 3.70 | 80.0 ± 2.8 | 80.5 ± 2.16a | 77.5 ± 3.20a | 50.5 ± 3.59b | 64.0 ± 5.57b | 11 | * |
| Limo | % | 14.5 ± 2.50 | 15.0 ± 2.08 | 14.8 ± 1.51a | 18.0 ± 1.41a | 26.5 ± 1.50b | 22.3 ± 1.87b | 8 | ** |
| Arcillas | % | 4.50 ± 1.50 | 5.00 ± 1.29 | 4.8 ± 0.92 | 4.50 ± 1.89 | 23.0 ± 2.38 | 13.8 ± 3.77 | 17.5 | ns |
| pH | dSm-1 | 4.80 ± 0.04 | 4.78 ± 0.18 | 4.79 ± 0.09 | 4.80 ± 0.18 | 4.35 ± 0.14 | 4.58 ± 0.14 | 18.5 | ns |
| MO | cmolc kg-1 | 0.65 ± 0.05 | 1.11 ± 0.17 | 0.88 ± 0.12 | 0.64 ± 0.19 | 1.11 ± 0.48 | 0.87 ± 0.25 | 25 | ns |
| Al | cmolc kg-1 | 1.03 ± 0.10 | 1.20 ± 0.15 | 1.11 ± 0.09 | 0.95 ± 0.26 | 2.05 ± 0.23 | 1.50 ± 0.26 | 20 | ns |
| Ca | cmolc kg-1 | 0.95 ± 0.31 | 0.17 ± 0.07 | 0.56 ± 0.21 | 1.24 ± 0.35 | 0.09 ± 0.01 | 0.67 ± 0.27 | 31 | ns |
| Mg | cmolc kg-1 | 0.98 ± 0.24 | 0.20 ± 0.05 | 0.59 ± 0.18 | 0.70 ± 0.27 | 0.47 ± 0.13 | 0.58 ± 0.14 | 28 | ns |
| K | cmolc kg-1 | 0.04 ± 0.00 | 0.08 ± 0.03 | 0.06 ± 0.02 | 0.09 ± 0.02 | 0.05 ± 0.00 | 0.07 ± 0.01 | 23.5 | ns |
| CICef | meq/100g | 3.00 ± 0.51 | 1.68 ± 0.22 | 2.34 ± 0.36 | 3.00 ± 0.28 | 2.65 ± 0.29 | 2.83 ± 0.20 | 18.5 | ns |
| P | mg kg-1 | 14.3 ± 0.85 | 8.00 ± 1.08 | 11.1 ± 1.34 | 24.8 ± 3.50 | 9.00 ± 0.58 | 16.9 ± 3.40 | 21 | ns |
| N-NO3 | mg kg-1 | 1.85 ± 0.68 | 0.68 ± 0.19 | 1.26 ± 0.39a | 0.35 ± 0.03 | 0.30 ± 0.00 | 0.33 ± 0.02b | 7 | ** |
| N-NH4 | mg kg-1 | 8.00 ± 0.00 | 19.8 ± 4.85 | 13.9 ± 3.16 | 10.3 ± 1.31 | 12.8 ± 0.85 | 11.5 ± 0.87 | 28 | ns |
Nota: Diferencias estadísticas (prueba de Mann-Whitney) entre ambientes de revegetación (global) se indican así: * P < 0.05, ** P < 0.01, ns = No significativo (P > 0.05). / Note: Statistical differences (Mann-Whitney test) among revegetation environments (global) are indicated as follows: * P < 0.05, ** P < 0.01, ns = Not significant (P > 0.05).
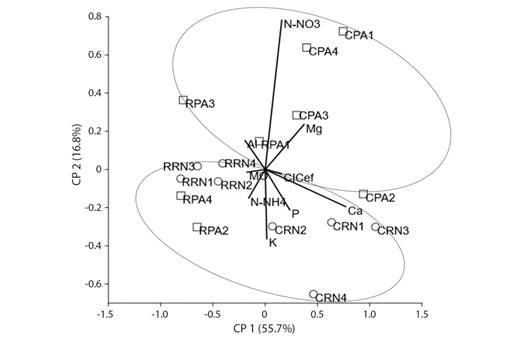
Fig. 3 Análisis de componentes principales que asocia a parcelas revegetadas con Acacia mangium (PA) y parcelas en regeneración natural (RN) con propiedades químicas del suelo en Condoto (C) y Raspadura (R), Chocó, Colombia. / Fig. 3. Principal component analysis associating plots revegetated with Acacia mangium plantations (PA) and plots in natural regeneration (RN) with soil chemical properties in Condoto (C) and Raspadura (R), Chocó, Colombia.
Discusión
Las estrategias de restauración ecológica activa (recuperación dirigida) y pasiva (recuperación natural o espontanea) son dos técnicas usadas convencionalmente para revegetar suelos degradados por minería, pero en el caso de la restauración activa, surge el debate sobre la conveniencia de sembrar especies vegetales exóticas para tales fines (Lozano-Báez et al., 2022; Maglianesi, 2010). Uno de los aspectos más controversiales que envuelve al uso de plantas exóticas en restauración ecológica, es el hecho de ser elementos no autóctonos que pueden alterar la trayectoria sucesional natural de los sistemas perturbados hacia la condición original (Chazdon, 2003; Young, 2000). Tal visión puede limitar la recuperación de suelos drásticamente erosionados, como aquellos impactados por la minería a cielo abierto (Fig. 1), donde los nutrientes y la materia orgánica del suelo desaparecen casi en su totalidad, configurando un nuevo sistema dominado por botaderos de sustratos estériles con condiciones limitadas para la recolonización de plantas autóctonas, adaptadas a condiciones distintas en el sistema original (Chazdon, 2003; Ramírez-Moreno et al., 2019; Valois-Cuesta, 2016; Young, 2000). Por ello, un amplio número de países acepta la introducción de especies exóticas de rápido crecimiento y reconocida adaptabilidad a suelos de baja fertilidad (como A. mangium) para la recuperación de suelos degradados (Koutika & Richardson, 2019).
El análisis de suelo realizado en este trabajo mostró que los sustratos mineros sembrados con A. mangium, tuvieron más NO3 que aquellos no revegetados con esta especie (Tabla 4). De manera similar, Valois-Cuesta (2016), al estudiar el efecto de la siembra de A. mangium en minas de oro en un bosque pluvial tropical del Chocó, Colombia, encontró que el suelo bajo la copa de las plantas de acacia presentó mayor porcentaje de materia orgánica y nitrógeno total, en comparación con el suelo sin cobertura de estas plantas. En consecuencia, hubo mayor cobertura vegetal (plantas nativas y naturalizadas) bajo la copa de las plantas de acacia que afuera de ellas (Valois-Cuesta, 2016). El mayor contenido de N observado en los suelos mineros revegetados con A. mangium puede deberse a la capacidad que tiene esta especie, al igual que otras leguminosas, de asociarse simbióticamente con microrganismo edáficos (bacterias nitrificantes) que fijan nitrógeno atmosférico (N2) y lo convierten en amonio (NH4), nitratos (NO3) y nitratos (NO2) (Wibisono et al., 2015). Además de la fijación de N2, las siembras de A. mangium generan y acumulan cantidades considerables de hojarasca sobre el suelo (entre 6.94 y 8.94 t de hojarasca ha-1 año-1 con una acumulación de 6.64 t ha-1; Hero & Watanabe, 2000; Tsai, 1998), la cual, al descomponerse, contribuye a aumentar la retención de agua y la biomasa microbiana del suelo; así como la disponibilidad de materia orgánica, fósforo (P) y N por mineralización de los compuestos de origen vegetal (Bachega et al., 2016; Couic et al., 2022; Voigtlaender et al., 2012; Xiong et al., 2008).
Los altos valores de producción de hojarasca y de retorno potencial de nutrientes que ocurren en las siembras de A. mangium, muestran que esta especie tiene un potencial para la recuperación de suelos degradados, a partir del restablecimiento temprano de los ciclos biogeoquímicos (Castellanos & León, 2010). Por ejemplo, plantaciones de A. mangium sembradas a una densidad de 2.5 × 2.5 m en botaderos de roca estéril, aumentan el contenido de carbono (C) orgánico (100 %), potasio (K) (124 %) y magnesio (Mg) (55 %) intercambiable, y cobre (Cu) extraíble (en 5 veces), y disminuye el contenido de Aluminio (Al) intercambiable, en comparación con botaderos de roca estéril sin plantas de acacia (Lewis & Hossain, 2022).
La disponibilidad de nutrientes en el suelo es uno de los factores más limitantes para la revegetación de suelos impactados por la minería (Ramírez-Moreno et al., 2019; Valois-Cuesta, 2016). Por lo tanto, si A. mangium contribuye a mejorar las condiciones de fertilidad en suelos degradados (Bachega et al., 2016; Ren & Yu, 2008; Valois-Cuesta, 2016; Voigtlaender et al., 2012; Xiong et al., 2008), es razonable pensar que la vegetación que subyace naturalmente en las minas sea más compleja, en términos de la estructura y composición de especies vegetales, en aquellas áreas reforestadas con acacia, al compararse con áreas sin siembra de ellas, tal cómo se observó en este trabajo (Tabla 1). Al respecto, se ha demostrado que parte del N fijado por las acacias a través de las bacterias nitrificantes puede ser transferido a otras especies vegetales no fijadoras por medio de la rizósfera edáfica en siembras mixtas (Paula et al., 2015).
Aunque la capacidad de fijar y transferir N a otras plantas no fijadoras (Paula et al., 2015) es un atributo que pueden facilitar el establecimiento de vegetación bajo la cobertura de siembra de A. mangium en suelos con déficit de nutrientes (Valois-Cuesta, 2016), la mayoría de trabajos sobre facilitación planta-planta, reconocen como plantas nodriza (facilitadoras) a especies arbustivas que generan micro-climas favorables para el establecimiento de otras plantas bajo sus copas en ambientes xerofítico (Alday et al., 2015; Castro et al., 2002; James et al., 2015; López-Pintor et al., 2003; Torroba-Balmori et al., 2015). El efecto nodriza en especies arbóreas como A. mangium se ha investigado menos que en especies arbustivas (pero ver Norisada et al., 2005; Osorio, 2017; Yang et al., 2009), especialmente en bosques neotropicales lluviosos impactados por minería (pero ver Valois-Cuesta, 2016). Sin embargo, al tomar como referencia estudios realizados en otras latitudes, se observa que la siembra de A. mangium, además de aumentar la fertilidad y la mineralización de material vegetal en suelos degradados (Garay et al., 2004; Tsai, 1998; Xiong et al., 2008), también puede mejorar las condiciones micro-climáticas bajo su dosel, al compararse con sitios sin siembra de esta acacia (Yang et al., 2009). Al respecto, Norisada et al. (2005), al evaluar parcelas sembradas con A. mangium y dipterocarpáceas (mixtas), y parcelas solamente con dipterocarpáceas (control) en suelos arenosos dragados, encontraron que, en las parcelas mixta, el dosel de A. mangium se hallaba completamente cerrado a los 25 meses después de la siembra, mientras que las parcelas control permanecían con el dosel abierto tras 45 meses después de la siembra. En consecuencia, el régimen de luz incidente (densidad de flujo fotónico diario - µmol m2 s) al interior de las parcelas con acacia disminuyó hasta 5.4 µmol m2 s, comparado con 46.9 µmol m2 s en la parcela de control. Así mismo, los valores promedio máximos de temperatura diaria del aire (con acacias = 33.2 °C vs. sin acacias = 33.7 °C) y de déficits de presión de vapor (con acacias = 2.2 °C vs. sin acacias = 2.4 °C) fueron significativamente más bajos en las parcelas con A. mangium que en las parcelas sin estas plantas (Norisada et al., 2005). Estos autores además registraron que, tras los 45 meses de muestreo, las especies de dipterocarpáceas (Dipterocarpus alatus Roxb. ex G. Don, Hopea odorata Roxb. y Shorea roxburghii G. Don) sobrevivieron significadamente más en las parcelas con A. mangium (mixtas) que en aquellas parcelas control, y plantean que la supervivencia de las plantas de dipterocarpáceas puede mejorar si se siembran cuando las plantas de A. mangium hayan crecido lo suficiente como para proporcionar sombra (Norisada et al., 2005). En este mismo sentido, Yang et al. (2009), al evaluar las características micro-climáticas y algunos aspectos eco-fisiológicos de tres especies nativas (Castanopsis hystrix, Michelia macclurei y Manglietia glauca) bajo el dosel de Acacia auriculiformis y A. mangium, y en suelo desnudo (control), encontraron que ambas especies de acacia facilitan el crecimiento de las especies nativas. Sin embargo, A. mangium tiene un mayor efecto facilitador por una mayor amortiguación de la temperatura, la reducción de la radiación y el aporte de minerales esenciales para las plantas al suelo (Yang et al., 2009).
A. mangium es una especie con potencial para la revegetación temprana de suelos degradados (Ren & Yu, 2008), pues sus atributos biológicos y ecológicos facilitan el establecimiento de otras plantas bajo su cobertura (Norisada et al., 2005; Osorio, 2017; Yang et al., 2009). No obstante, la discusión sobre el uso de esta especie exótica en proyectos de restauración ecológica de áreas impactadas por minería, especialmente en bosques pluviales tropicales ricos en especies vegetales endémicas como los del Chocó (Gentry, 1986; Rangel-Ch, 2004), también debe enfocarse en el posible potencial de la especie vegetal para invadir las formaciones forestales naturales que circundan la minas. Al respecto, aunque en este trabajo no se evaluó directamente la estructura demográfica o el patrón de expansión de A. mangium desde las siembras en las minas hacia los bosques naturales adyacentes, por medio de recorridos realizados en la zona boscosa adyacente a las minas no se observó evidencia de su invasión; de hecho, al revisar los inventarios florísticos realizados en los bosques adyacentes a minas del área de estudio, después del establecimiento de la siembra de A. mangium, no se registran individuos de esta especie exótica en ningún estado de crecimiento (Ramírez-Moreno & Rangel-Ch, 2019; Valois-Cuesta et al, 2022), lo cual sugiere que A. mangium no tiene un patrón de expansión invasor en los bosques naturales del sistema estudiado. Es probable que A. mangium no invada los bosques adyacentes a las minas debido a su condición de planta leguminosa heliófila adaptada a sitios perturbados con suelos degradados y/o zonas abiertas con alta incidencia lumínica, lo que puede limitar su establecimiento bajo condición de sombra imperante al interior del bosque cerrado (Hegde et al., 2013; Krisnawati et al., 2011; Osunkoya et al., 2005). Evidencia de ello fue encontrada por Osunkoya et al. (2005), quienes al estudiar el crecimiento de A. mangium bajo dos condiciones de luz, encontraron que individuos sometidos a alta luz mostraron significativamente mayor área foliar, biomasa, tasa de crecimiento y alturas, al compararse con aquellos individuos sembrados a intensidades lumínicas bajas.
En conclusión, los resultados sugieren que las siembras de A. mangium tienen un efecto positivo sobre la rehabilitación del suelo y la vegetación subyacente de las áreas impactadas por minería de oro en la selva pluvial tropical del Chocó, Colombia, ya que después de 10-12 años tras el cierre de las minas, las áreas mineras que fueron reforestadas inicialmente con A. mangium desarrollan comunidades vegetales más complejas en términos de la estructura biológica y composición de especies (más ricas, diversas y equitativas), que aquellas áreas mineras dejadas en abandono bajo sucesión pasiva y/o sin la siembra de esta leguminosa. El rol de A. mangiun como planta nodriza de otras especies nativas y/o naturalizadas en las áreas impactadas por minería, se debe a su capacidad para establecerse en áreas perturbadas y mejorar las condiciones micro-ambientales bajo la cobertura, a través de la fijación de nitrógeno molecular y aporte de materia orgánica al suelo, así como de su capacidad para regular las condiciones micro-climáticas bajo el dosel de las plantaciones, tal como se ha registrado en otros trabajos (Norisada et al., 2005; Osorio, 2017; Valois-Cuesta, 2016; Yang et al., 2009). No hay evidencia de invasión de A. mangium en los bosques adyacentes a las minas estudiadas, por lo tanto, se destaca su importancia para la revegetación temprana de áreas degradadas por la minería de oro a cielo abierto en los bosques pluviales del Chocó, Colombia y otras regiones tropicales con regímenes climáticos y de disturbio similares al estudiado.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


