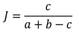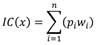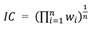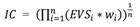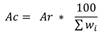Introducción
La gestión ambiental de proyectos de infraestructura y producción, supone un abordaje integral, enfocado en entender y minimizar los impactos que dañen tanto el entorno natural y su biodiversidad como sus funciones ecológicas y los servicios ecosistémicos que brindan a las comunidades humanas (Massolo, 2015; O’riordan, 2014). Cuando los impactos son inevitables e irreversibles, se deben resarcir las pérdidas y alteraciones ambientales generadas. Esta compensación constituye un instrumento técnico-administrativo en la gestión ambiental (Cowell, 1997;Díaz-Reyes, 2014) que procura generar una ganancia neta en biodiversidad (u otros atributos del ambiente) o, cuando menos, la no pérdida neta debido a los impactos generados (Cuperus, 2005; Hodgson et al., 2011).
En su dimensión ecológica, la compensación ambiental parte del principio de equivalencia ecológica, un precepto que se refiere a la similitud o proporcionalidad en atributos de los ecosistemas naturales, comunidades bióticas y procesos ecológicos (Parkes et al., 2003; Quétier & Lavorel, 2011). Bajo este criterio, la indemnización es concebida como una manera de regresar al menos a la condición inicial (p.e., a partir de la restauración de ambientes) o, de sustituir aquellos componentes del medio que han sido impactados (Calle et al., 2014). Los aspectos más frecuentemente empleados para evaluar la equivalencia ecológica son: la composición de especies, la similitud entre comunidades y las medidas de diversidad (Kati et al., 2004; Urbina-Cardona et al., 2006). Estas métricas proporcionan medidas cuantitativas claras e información sobre el papel de la biodiversidad en el funcionamiento y la salud de los ecosistemas (Laurila-Pant et al., 2015), por lo que juegan un papel protagónico sobre el cual basar decisiones de manejo (Kerr, 1997; McKenney & Kiesecker, 2009; Rodrigues et al., 2004; Ten Kate et al., 2004).
En el abordaje empírico de la evaluación ambiental, el preferido es el enfoque sobre grupos taxonómicos sustitutos o bioindicadores (Failing & Gregory, 2003; Quetier & Lavorel, 2011). Los grupos sustitutos pretenden representar a otros taxones que constituyen las comunidades presentes en el ecosistema a evaluar. En general, son relativamente fáciles de identificar y muestrear en el campo, al tiempo que representan atributos ecológicos de interés, por ejemplo, representar diversos niveles de la red trófica, jugar papeles claves en el ecosistema, o servir como especies paragua o emblemáticas (Barua, 2011; Simberloff, 1998). Un bioindicador efectivo debe adaptarse bien a características específicas del paisaje o reaccionar a los impactos y cambios que se pretenden evaluar (Büchs, 2003; Paoletti, 1999). De hecho, Majer propone que los grupos sustitutos deben tener una serie de atributos, entre los que destacan: el poder relacionarse con los objetivos de la evaluación que se pretende realizar, cumplir un papel importante para la estructura y función del ecosistema, representar una respuesta al estrés ambiental y poder ser cuantificados fácilmente.
Entre los grupos sustitutos empleados más comúnmente en estudios ambientales se incluyen: plantas vasculares (Anand et al., 2005; Kati et al., 2004; Norden et al., 2007; Urbina-Cardona et al., 2006), vertebrados (Fausch et al., 1990; Lund & Rahbek, 2002), mariposas (Lovell et al., 2007; Nally & Fleishman, 2004) y escarabajos (Azeria et al., 2009; Baldi, 2003; Lovell et al., 2007); aunque otros invertebrados, como hormigas (Andersen, 1997) y macroinvertebrados en sistemas acuáticos (Pérez, 1999; Heino, 2010), también son extensamente utilizados.
La valoración de la equivalencia ecológica para compensación basada en atributos de biodiversidad, involucra comparaciones estadísticas entre estimados de riqueza o similitud de comunidades (McKenney & Kiesecker, 2009). También pueden emplearse procedimientos estandarizados de puntuación (Butler, 2009), que consisten en mecanismos que asignan valores a diferentes indicadores e identifican un procedimiento apropiado para el cálculo de su pérdida o ganancia (Quetier & Lavorel, 2011). En un artículo previo en este mismo suplemento (Bonilla et al., 2022) ilustramos el empleo de uno de esos procedimientos, el método Hectárea de Hábitat (Parkes et al., 2003), aplicándolo a un estudio de caso en la Reserva Biológica Lomas de Barbudal (RBLB), ubicada en el noroeste de Costa Rica. Este método, está diseñado para evaluar el ambiente natural de un sitio, a partir de la asignación de valores a una serie de indicadores de estructura de hábitat que cuantifican su condición (“calidad ambiental”) con relación a la de un sitio de referencia. Esa condición es combinada con el área, para determinar la cantidad de hectáreas de ese ambiente requeridas para resarcir las pérdidas en la referencia. En el estudio de caso mencionado, unas 113 ha en el extremo este de la RBLB, bajo la cota de 50 m de elevación, serían anegadas para establecer el Proyecto Embalse Río Piedras (Fig. 1 en Bonilla et al., 2022), un plan de desarrollo que busca trasladar agua para irrigación y consumo hacia la margen izquierda del Río Tempisque en el Pacífico norte del país (Cajiao, 2019). Empleando el método de Hectárea de Hábitat, evaluamos la condición de estructura del hábitat de una propiedad privada (el sitio potencial de compensación), en referencia al ambiente a inundar dentro de la RBLB (Bonilla et al., 2022).
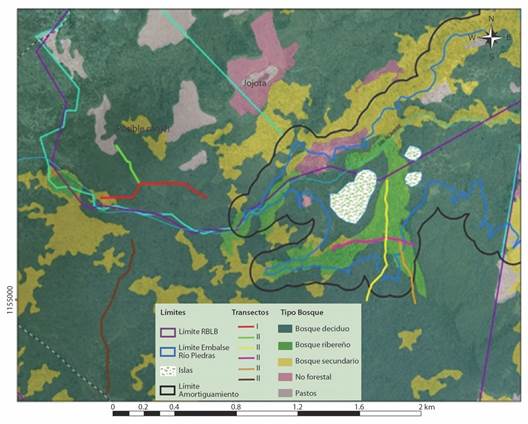
Fig. 1 Transectos para el muestreo de fauna vertebrada terrestre en los sitios de estudio. / Fig. 1. Transepts for sampling terrestrial vertebrate fauna in the study sites.
En el presente trabajo, analizamos el potencial que tienen los grupos sustitutos en evaluaciones de compensación ambiental, empleando como estudio de caso el embalse Río Piedras. Tres preguntas fundamentales enmarcan este estudio: 1) ¿Cuál es la biodiversidad del sitio potencial de impacto dentro de la RBLB?, 2) ¿Qué tan equivalentes en composición de especies y diversidad, son el área potencial de impacto y el área potencial de compensación? y 3) ¿Qué tan sensibles son los grupos sustitutos empleados para detectar diferencias entre los dos sitios? Con el fin de contestar estas interrogantes, cuantificamos la composición de especies y la diversidad de grupos sustitutos, tanto en la RBLB como en el sitio potencial de compensación, y los comparamos empleando un procedimiento de ponderación. De esta manera, evaluamos si el sitio seleccionado como compensación posee una biodiversidad equivalente a la que podría perderse en el sitio potencial de inundación.
Materiales y métodos
Sitios de estudio y periodo de muestreos
La Reserva Biológica Lomas de Barbudal (RBLB) se extiende por 2645 ha y está ubicada en el cantón de Bagaces, entre las coordenadas 10°30’8.59” Norte / 85°22›1.8» Oeste y 10°25’56.05” Norte / 85°17’39.51” Oeste. La zona potencial a ser inundada dentro de la RBLB se ubica en el sector sureste, entre las coordenadas 10°26’0.99” Norte / 85°18’54.72” Oeste y 10°30’54.80” Norte / 85°15’5.78” Oeste y tiene una superficie estimada en 113 ha (Cajiao, 2019). Esta zona está cubierta por bosque deciduo temprano (73 % del área superficial), bosque secundario (8 %) y bosque ribereño (9 %) a lo largo de la quebrada Vizcoyol y quebrada Sin Nombre. La propiedad privada a emplear en compensación, se ubica en la misma región, adyacente al límite sureste de la RBLB (Bonilla et al., 2022). Las coberturas vegetales en este sitio incluyen (porcentaje de área superficial): bosque deciduo (74 %), bosque secundario (9 %) y extensiones de pastos (15 %). Además, el bosque ribereño cubre menos de 2 ha en este sitio y se encuentra disperso (Bonilla et al., 2022).
La caracterización de la diversidad en los sitios de estudio inició a mediados de enero 2016 y, concluyó la última semana de enero del 2017, muestreándose durante la época seca (diciembre-mayo) y la lluviosa (mayo-noviembre). Los permisos correspondientes de la investigación se incluyen en la resolución 005-2016-INV-ACAT.
Grupos indicadores empleados para la valoración de diversidad
A continuación, se explican los grupos indicadores utilizados.
1)Comunidad de plantas. Las plantas vasculares constituyen el grupo más diverso de productores primarios en sistemas terrestres y, en gran medida, son responsables de la estructura del hábitat. Para cada cobertura vegetal presente en los sitios de estudio se caracterizó la vegetación de plantas vasculares (Tabla 1), se identificaron las especies y su prioridad de conservación (para aquellas con información disponible). Las especies fueron identificadas en el campo o en el Herbario Ulises Chavarría, de la Estación Biológica Palo Verde, Organización para Estudios Tropicales, donde además se depositaron los especímenes testigo. Los análisis de diversidad y composición de especies fueron realizados de forma independiente en especies leñosas y en especies herbáceas, procurando así corregir los posibles efectos que deriven de sus diferentes ciclos de vida.
Dentro de la puntuación global (Tabla 1), el componente comunidad de plantas recibió un mayor peso (60 %) debido a su rol como productores primarios y por constituir la estructura física del hábitat. La composición de especies herbáceas tuvo una menor ponderación debido a que muchas poseen ciclos de vida anuales y, solamente se observan durante la época lluviosa. Además, pocas de las especies herbáceas cuentan con información disponible sobre su estado de conservación.
2)Comunidades faunísticas de vertebrados. Los vertebrados son un grupo de relevancia ecológica relativamente fácil de muestrear e identificar en el campo (Silva-Chaves et al., 2019). La diversidad de gremios en mamíferos y aves se asocian con la complejidad de ambientes y su capacidad de mantenimiento al actuar como dispersores de semillas, polinizadores, depredadores y presas (Kasso & Balakrishnan, 2013; Lacher, 2019; Neuschulz et al., 2016). Para cada clase de vertebrado (aves, mamíferos, reptiles, anfibios, peces) se determinó la riqueza de especies y diversidad, así como la composición de especies en los sitios de estudio. El análisis de las comunidades de vertebrados combinadas representó el 20 % de la ponderación final de la puntuación global de comunidades (Tabla 1).
3)Comunidad de artrópodos del sotobosque. El estudio de comunidades de insectos y otros artrópodos en evaluaciones ambientales es recomendado debido a su diversidad, facilidad de muestreo, especificidad en distintos microhábitats y al hecho que representan gremios con distintas funciones en el ecosistema (Godfray et al., 1999; Rosenberg et al., 1986; Stork, 1988). Los polinizadores, parasitoides y depredadores, especialmente himenópteros, han sido señalados como indicadores de la complejidad de redes tróficas y del estado de salud del ecosistema (Gaston et al., 1996; Hanson, 2011). Además, su presencia se relaciona con la calidad del hábitat (Andersen & Müeller, 2000; Balestra et al., 1992; Majer et al., 1997) y el grado de alteración de la cobertura vegetal (Restello & Penteado-Dias, 2006).
La diversidad y composición de artrópodos de sotobosque fue analizada empleando un muestreo pasivo (Janzen & Hallwachs, 2021) a partir de trampas Malaise (Tabla 1). Los artrópodos capturados fueron separados en el Laboratorio de Entomología de la Estación Biológica La Selva en Sarapiquí, Heredia, e identificados a nivel de familia. Además, se cuantificó su abundancia relativa de cada trampa. Adicionalmente, las muestras de himenópteros fueron enviados al Laboratorio de Entomología de la Escuela de Biología de la Universidad de Costa Rica, donde fueron identificados a nivel de género y clasificados por gremio ecológico. Ambos componentes (familias de artrópodos y géneros de himenópteros) representaron el 10% de la ponderación global (Tabla 1).
Tabla 1 Indicadores de diversidad y estado de conservación de los grupos taxonómicos sustitutos empleados para evaluar la compensación en este estudio. / Table 1. Indicators of diversity and conservation status of surrogate taxonomic groups employed to assess compensation in this study.
| Componente Indicador / puntaje(ptos.) | Método de muestreo | Puntaje máximo (ptos.) |
| Riqueza de especies | Muestreo aleatorio estratificado empleando parcelas de vegetación de 20 X 20 m para identificar las plantas con DAP> 5 cm. Además, un cuadrante de 5 X 5 m dentro de esa parcela, se identificaron los individuos con diámetros menores. | 20 |
| Leñosas / 15 | ||
| Herbáceas / 5 | ||
| Dominancia | 5 | |
| Leñosas/3 | ||
| Herbáceas / 2 | ||
| Diversidad de especies | 10 | |
| Leñosas / 6 | ||
| Herbáceas / 4 | ||
| Prioridad de conservación | 25 | |
| Leñosas / 20 | ||
| Herbáceas / 5 | ||
| Comunidad de aves Riqueza / 5 Prioridad conservación / 5 | Transectos de 1 km de longitud (Fig. 1), redes de niebla y grabadoras programables durante madrugada y noche. Los valores asignados a riqueza y prioridad fueron promediados. | 5 |
| Comunidad de mamíferos Riqueza / 5 Prioridad conservación /5 | Trampas Sherman y Tomahawk cebadas, redes de niebla y grabador acústico para detectar murciélagos. Los valores asignados a riqueza y prioridad fueron promediados. | 5 |
| Comunidad de herpetofauna Riqueza / 5 Prioridad conservación / 5 | Encuentros visuales en los transectos de 1 km. Los valores asignados a riqueza y prioridad fueron promediados. | 5 |
| Comunidad de peces Riqueza / 5 | Muestreos en las quebradas Viscoyol y Sin nombre, redes de pesca (chinchorro), atarraya de nylon con poros de 0.8 x 0.8 cm, y nasas con cebo (Fig. 2). | 5 |
| Comunidad de artrópodos (no himenópteros) Riqueza familias Diversidad familias | Cinco trampas Malaise (Townes Style, BioQuip®): dos en cada sitio de estudio y una en el sitio no inundable dentro de la RBLB. Los insectos fueron capturados en ETOH (90 %), y removidos en 14 recolectas. | 10 |
| Géneros de himenópteros Riqueza | 10 | |
| Total | 100 |
Estimación de medidas de diversidad
Las siguientes medidas fueron empleadas para estimar la diversidad de cada sitio:
1)S = riqueza esperada de especies en un sitio determinado.
2)D = Dominancia de especies basada en el índice de Simpson, que calcula la fracción de la muestra representada por las especies más comunes.
3)NE = Número efectivo de especies. El número hipotético de especies de esa comunidad que resultaría si todas las especies presentes tuvieran la misma frecuencia. Es determinado como exp(H), el índice de diversidad de Shannon, que toma en consideración tanto el número de especies como la igualdad de las frecuencias de especies (García-Morales et al., 2011). Previo a la estimación del índice, se determinó la abundancia relativa de cada especie, en cada cobertura y sitio. En el caso de los artrópodos, la riqueza y diversidad fue estimada a nivel de familia.
4)Similitud de sitios. Se utilizó el coeficiente de Jaccard, determinando el porcentaje de especies compartidas entre los sitios.
Donde a y b son el número total de especies en cada sitio respectivamente, c es el número de especies compartidas en ambos sitios.
Debido a la asignación de afijación proporcional en el muestreo, se empleó rarefacción (Chiarucci et al., 2008; Gart et al., 1982), para establecer los valores esperados en cada uno de los índices y realizar comparaciones equivalentes entre coberturas (en plantas) o sitios (todos los grupos) (Shimadzu, 2018). Tanto la estimación de índices, como el procedimiento de rarefacción fueron calculados en el programa EcoSim® (http://www.garyentsminger.com/ecosim/index.htm).
Prioridad de conservación
Para determinar la prioridad de conservación de cada grupo indicador, se emplearon distintos procedimientos.
Plantas vasculares. Se determinó el nivel de amenaza de especies arbóreas (w i ) mediante información combinada de: 1) la lista de especies forestales vedadas de Costa Rica (Quesada-Monge, 2004; Quesada-Monge, 2008), 2) la lista de especies de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres [CITES] (https://cites.org/), y 3) la lista roja de especies florísticas de la Unión Internacional para la Conservación de la Naturaleza [UICN] (http://www.iucnredlist.org/search) (Tabla 2).
Tabla 2 Valores del nivel de amenaza por categoría de conservación. / Table 2. Threat level values by conservation category.
| Atributos | Descripción de condición | Nivel de amenaza (w) |
| No uso | 0 | |
| 1. Uso de especie | Ornamental o comestible | 1 |
| Maderable | 2 | |
| No enlistada | 0 | |
| 2. Categoría en CITES | Apéndice III | 1 |
| Apéndice II | 2 | |
| Apéndice I | 3 | |
| Datos insuficientes o no información | 1 | |
| Menor preocupación | 2 | |
| 3. Categoría UICN | Casi amenazado | 3 |
| Vulnerable | 4 | |
| En peligro | 5 | |
| Peligro crítico | 6 |
Para cada cobertura en cada sitio de estudio, se estableció un índice de prioridad de conservación IC(x) a partir de la composición de especies encontradas. Este índice requiere dos parámetros: el nivel de amenaza de las especies (w i ) y la abundancia relativa de esa especie en el estrato (pi). Para cada sitio x:
El índice de prioridad de conservación, incluye sólo aquellas especies cuya situación ha sido verificada previamente en las citas mencionadas (Tabla 2). Esto considera especies que tienen presión sobre su uso (principalmente maderables), se trafican internacionalmente (se incluyen en algún Apéndice CITES), o existe información sobre su estatus de conservación según la UICN o en el Decreto No. 25700-MINAE. Este índice alcanza valores más altos en los sitios donde las especies más utilizadas y con categorías de amenaza mayor son más frecuentes.
Aves y mamíferos: Para ambos grupos, el nivel de amenaza de las especies observadas se basó en la clasificación de la UICN (Tabla 2). El índice de prioridad en conservación fue cuantificado a partir de la media geométrica de los valores asignados al nivel de amenaza (w) para cada una de las especies (n) presentes en un sitio, siguiendo la fórmula:
La media geométrica es la raíz enésima del producto de todos los valores de nivel de amenaza de las especies que constituyen la comunidad. Este estadístico es menos sensible a valores extremos, que en este caso corresponden a aquellas especies con altos niveles de amenaza.
Anfibios y reptiles: Para medir el nivel de amenaza empleamos el Índice de Vulnerabilidad Ambiental (EVS por sus siglas en inglés, Wilson & Mc Cranie, 1992; Wilson & Mc Cranie, 2004) y la categorización de la UICN (Tabla 2). El EVS se basa en tres componentes: 1) la amplitud de la distribución geográfica de una especie (especies con distribuciones reducidas y restringidas a un sitio son más vulnerables), 2) la amplitud de la distribución ecológica o nicho (especies restringidas a un tipo de hábitat, o especialistas en una dieta particular son más vulnerables) y 3) el grado de especialización en modo reproductivo (en anfibios) o el grado de persecución (en reptiles). El índice se computa para cada especie como una sumatoria de los valores asignados a cada uno de esos componentes, de modo que valores altos de EVS representan especies muy vulnerables, con distribuciones geográficas reducidas, restringidas a un tipo de hábitat y muy perseguidas (reptiles) o, con modos reproductivos muy especializados (anfibios). Los valores del índice EVS están disponibles para las especies de anfibios y reptiles costarricenses (Sasa et al., 2010).
Para determinar el índice de prioridad en conservación, empleamos el nivel de amenaza UICN y el índice de vulnerabilidad ambiental de las especies en cada comunidad. Dado que estos índices siguen distintos criterios para establecer el grado de fragilidad de las especies, optamos por multiplicar sus valores para incorporar sus aportes en una sola medida, siguiendo la fórmula:
Donde w i es el nivel de amenaza según los criterios de la UICN (Tabla 2). Los valores altos de media geométrica, representan comunidades con especies con alto grado de vulnerabilidad o amenaza.
Peces y artrópodos de sotobosque. A diferencia de los otros grupos sustitutos, la mayoría de peces de aguas continentales no cuentan con análisis sistemáticos sobre su ecología básica y sobre la situación de sus poblaciones (Bussing & López, 1996), por lo que el nivel de amenaza de las especies es desconocido. De hecho, muy pocas especies están incluidas en las listas de la UICN y casi todas en categoría de preocupación menor. La misma situación ocurre con artrópodos. Por ello, nuestro análisis no incluyó una evaluación del nivel de prioridad de conservación de los sitios basado en la comunidad de peces o artrópodos.
Procedimiento de ponderación y cálculo de área a compensar
Para contrastar la composición y diversidad de comunidades entre el sito potencial de impacto en la RBLB y el sitio potencial de compensación, se siguió un procedimiento de puntuación (Bonilla et al., 2022). Los indicadores de diversidad y prioridad de conservación de cada grupo sustituto en el sitio de compensación, recibieron un puntaje siguiendo criterios tasados previamente (Tablas A1-A14, Apéndice 1). Estos criterios se establecieron en relación al valor del indicador correspondiente en el sitio de impacto en la RBLB (la referencia). De esta manera, el máximo puntaje para un indicador, se asignó cuando su valor no difiere con el del sitio de referencia.
Plantas vasculares. Se calificó la riqueza especies, dominancia, diversidad y el valor del índice de prioridad de conservación para especies leñosas y herbáceas, siguiendo los criterios indicados en las Tablas A1 a A8 del Apéndice 1.
Vertebrados. Se calificaron los indicadores riqueza de especies y prioridad de conservación de aves, mamíferos y herpetofauna siguiendo los criterios presentados en las Tablas A9 y A10 (Apéndice I). Los valores asignados a cada indicador fueron promediados para obtener el puntaje final de cada uno de estos grupos sustitutos. Para peces solo se calificó la riqueza de especies (Tabla A11, Apéndice I).
Artrópodos. Se calificaron los indicadores riqueza y diversidad de familias de artrópodos del sotobosque siguiendo los criterios señalados en las Tablas A12 y A13 (Apéndice 1). Para himenópteros, los géneros identificados fueron clasificados por gremio ecológico y se asignó un puntaje según los criterios indicados en la Tabla A14 (Apéndice 1).
La ponderación final, resulta de la sumatoria de los valores asignados a todos los indicadores (∑w i ) y, es interpretada como la condición ambiental del sitio de compensación, en términos de composición de especies y biodiversidad, con relación al de referencia. Esa ponderación final puede servir además como criterio sobre el cual basar acciones compensatorias. Así, en el procedimiento propuesto la ponderación final permite un coeficiente sobre el cual tasar la estimación del área necesaria de compensación. El área necesaria para compensar es estimada siguiendo la relación:
donde es el área impactada en la referencia, en este caso el sitio potencial a inundar en la RBLB.
Esta relación coteja el área necesaria para mantener una diversidad como la encontrada en el sitio de referencia, por un área equivalente en la compensación. La suposición subyacente es que las comunidades en ambos sitios son similares y comparables en términos de riqueza y composición de especies, de esta manera es cuestión de incrementar o reducir el área de la compensación para poder observar una diversidad similar a la de referencia.
Resultados
Diversidad y composición de plantas vasculares
En las parcelas de vegetación, se identificaron y midieron 5 740 individuos de 246 especies de plantas vasculares clasificadas en 67 familias (Tabla A1, Apéndice II). El 43 % de las especies son árboles, 10 % son arbustos, 17 % bejucos y 28 % corresponden a hierbas. Completan la lista dos especies de palmas Acrocomia aculeata (Jacq.) Lodd. ex. Mart. y Bactris guineensis (L.) H.E. Moore.
Para especies leñosas, la curva de acumulación en la RBLB mostró una riqueza de especies ligeramente mayor que la encontrada en el sitio de compensación (Fig. 3A), mientras que se observa lo opuesto con las especies herbáceas (Fig. 3B). En este último grupo, se observó un aumento en el número de especies acumuladas hacia el muestreo #40, que coincide con la aparición de nuevas hierbas durante el periodo máximo de precipitación. Tan solo un 43 % de las especies de hierbas fueron compartidas entre sitios, mientras que un 58 % de especies de bejucos y un 55 % de arbustos ocurren en ambos sitios. En cambio, ambos sitios comparten más del 60 % de especies arbóreas. La composición de especies en las distintas coberturas vegetales también difiere entre sitios (Tabla 3).
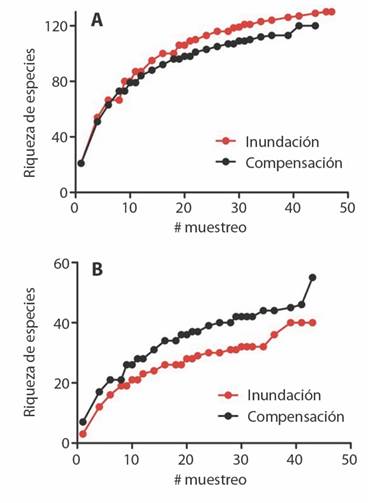
Fig. 3 Curvas de acumulación de especies leñosas (A) y herbáceas (B) en el sitio potencial de inundación en RBLB y el sitio potencial de compensación. / Fig. 3. Accumulation curves of woody (A) and herbaceous (B) plant species in the potential flood site in RBLB and the potential compensation site.
Tabla 3 Índice de similitud (Jaccard) entre pares de coberturas forestales dentro y entre sitios de estudio. Comparación entre comunidades de especies leñosas (arriba de la diagonal) y herbáceas (debajo de la diagonal). / Table 3. Similarity index (Jaccard) between pairs of forest covers within and between study sites. Comparisons between communities of woody (above the diagonal) and herbaceous species (below the diagonal).
| Compensación | Inundación | |||||
| Deciduo | Secundario | Deciduo | Secundario | Ribereño | ||
| Compensación | Deciduo | - | 0.530 | 0.557 | 0.468 | 0.493 |
| Secundario | 0.185 | - | 0.468 | 0.495 | 0.501 | |
| Inundación | Deciduo | 0.403 | 0.310 | - | 0.604 | 0.554 |
| Secundario | 0.345 | 0.280 | 0.454 | - | 0.590 | |
| Ribereño | 0.216 | 0.347 | 0.342 | 0.242 | - |
De las 176 especies leñosas observadas, 84 % se encontraron en ambientes dentro del sitio potencial de inundación en RBLB, mientras que el sitio de compensación registró 74 % (Tabla A1, Apéndice II). En contraste, de las 70 especies herbáceas registradas, 44 % ocurren en el sitio de inundación y 56 % en el sitio de compensación. Los estimados de riqueza de especies, dominancia y el número efectivo de especies para ambos grupos se muestran en la Tabla 4.
Tabla 4 Estimados de riqueza de especies (S), índice de dominancia (D), diversidad (cuantificado como número efectivo de especies, NE) y prioridad de conservación (IC) de plantas leñosas y herbáceas en cada cobertura vegetal en los sitios de estudio. Se indica la calificación asignada (PA) a cada uno de los indicadores en el sitio de compensación en referencia al estimado en RBLB, siguiendo los criterios establecidos en las Tablas A1-A8 (Apéndice I). / Table 4. Estimates of species richness (S), dominance index (D), diversity (quantified as the effective number of species, NE), and conservation priority (CI) of woody and herbaceous plants in each vegetation cover in the study sites. The score assigned (PA) to each indicator in the compensation site is indicated concerning the estimate in RBLB, following the criteria established in Tables A1-A8 (Appendix I).
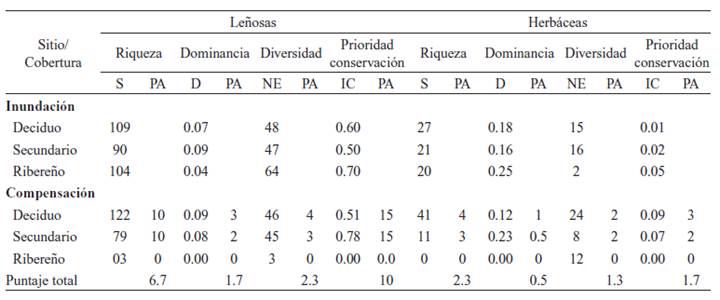
Cincuenta y cinco especies leñosas disponen de información sobre usos o estado de sus poblaciones, lo que permite establecer un diagnóstico de su nivel de amenaza (Tabla 5). Las especies más amenazadas fueron: Platymiscium parviflorum Benth. (Cristóbal) cuyo uso está vedado en Costa Rica (Decreto Nº 25700-MINAE; Quesada-Monge, 2004), así como Dalbergia retusa Hemsl. (Cocobolo, CITES Apéndice II), Swietenia humilis Zuccarini y S. macrophylla King (Caoba, CITES II y en categoría de vulnerable según la UICN). Otras especies de importancia para conservación fueron: Bombacopsis quinata (Jacq.) Dugand (Pochote), Lonchocarpus phaseolifolius Benth. (Chaperno) y Garcia nutans Vahl ex Rohr (Abellán), Handroanthus ochraceus (Cham.) Mattos (Corteza amarilla), Ocotea veraguensis (Meisn.) Mez (Laurel) y Brosimum alicastrum Sw. (Ojoche) (Tabla 5). Para este grupo, los estimados más altos de prioridad de conservación se encontraron en la cobertura bosque ribereño en la RBLB (Tabla 4), principalmente por la presencia de S. macrophylla, C. odorata, O. veraguensis y B. alicastrum, así como en el bosque secundario del sitio de compensación (este último con una frecuencia mayor de L. phaseolifolius y Handroanthus ochraceus).
Tabla 5 Nivel de amenaza de las especies con información sobre estatus de poblaciones y usos. / Table 5. Threat level for species with information on population status and uses.
| Especie | Nombre común | Usos | CITES | UICN | Nivel de amenaza wi |
| Leñosas | |||||
| Acrocomia aculeata | Coyol | 1 | 1 | ||
| Agonandra macrocarpa | 3 | 3 | |||
| Albizia adinocephala | Gavilancillo | 1 | 1 | ||
| Albizia niopoides | Guanacaste blanco | 2 | 2 | ||
| Anacardium excelsum | Espavel | 2 | 2 | ||
| Andira inermis | Arenillo | 2 | 2 | ||
| Annona purpurea | Toreta | 1 | 1 | ||
| Astronium graveolens | Ron-Ron | 2 | 2 | ||
| Bactris guineensis | Viscoyol | 1 | 1 | ||
| Bombacopsis quinata | Pochote | 2 | 3 | 5 | |
| Brosimum alicastrum | Ojoche | 2 | 2 | ||
| Byrsonima crassifolia | Nance | 1 | 1 | ||
| Caesalpinia eriostachys | Sahinillo | 2 | 2 | ||
| Calycophyllum candidissimum | Madroño | 1 | 1 | ||
| Casearia aculeata | Peipute | 1 | 1 | ||
| Cedrela odorata | Cedro dulce | 2 | 3 | 5 | |
| Cordia alliodora | Laurel | 2 | 1 | 3 | |
| Cordia gerascanthus | Laurel negro | 2 | 2 | ||
| Cordia panamensis | Muñeco | 2 | 2 | ||
| Dalbergia retusa | Cocobolo | 2 | 2 | 3 | 7 |
| Enterolobium cyclocarpum | Guanacaste | 2 | 2 | ||
| Eugenia salamensis | Fruta de pava | 4 | 4 | ||
| Garcia nutans | Abellán | 4 | 4 | ||
| Gliricidia sepium | Madero negro | 2 | 2 | ||
| Gmelina arborea | Gmelina | 2 | 2 | ||
| Gonolobus sp. | 4 | 4 | |||
| Handroanthus ochraceus | Corteza amarillo | 2 | 2 | ||
| Hymenaea courbaril | Guapinol | 2 | 1 | 3 | |
| Leucaena leucocephala | Ipil- Ipil | 2 | 2 | ||
| Licania arborea | Alcornoque | 2 | 2 | ||
| Lonchocarpus minimiflorus | Chaperno | 1 | 1 | ||
| Lonchocarpus phaseolifolius | 5 | 5 | |||
| Lonchocarpus phlebophyllus | 4 | 4 | |||
| Lonchocarpus salvadorensis | Chaperno | 2 | 2 | ||
| Lysiloma divaricatum | Quebracho | 1 | 1 | ||
| Maclura tinctoria | Mora | 2 | 2 | ||
| Manilkara zapota | Nispero Chicle | 2 | 2 | ||
| Marsdenia sp. | 4 | 4 | |||
| Ocotea veraguensis | Canelo | 2 | 2 | ||
| Platymiscium parviflorum | Cristobal | 2 | 3 | 2 | 7 |
| Pterocarpus michelianus | Cachimbo blanco | 2 | 2 | ||
| Rehdera trinervis | Yayo | 2 | 2 | ||
| Samanea saman | Genízaro | 2 | 2 | ||
| Sapranthus palanga | Palanco | 2 | 2 | ||
| Sideroxylon capiri | Tempisque | 2 | 2 | ||
| Simarouba glauca | Aceituno | 2 | 2 | ||
| Spondias mombin | Jobo | 1 | 1 | ||
| Spondias purpurea | Jocote | 1 | 1 | ||
| Sterculia apetala | Panamá | 2 | 2 | ||
| Swietenia humilis | Caoba | 2 | 2 | 3 | 7 |
| Swietenia macrophylla | Caoba | 2 | 2 | 3 | 7 |
| Tabebuia impetiginosa | Cortez negro | 2 | 1 | 3 | |
| Tabebuia rosea | Roble de sabana | 2 | 2 | ||
| Triplaris melanodendron | Hormigo | 2 | 2 | ||
| Stenocereus aragonii | Cactus | 1 | 1 | 2 | |
| Herbáceas | |||||
| Agave angustifolia | Agave | 1 | 1 | ||
| Chamaecrista nictitans | 1 | 1 | |||
| Commelina erecta | 1 | 1 | |||
| Iresine diffusa | 1 | 1 | |||
| Mimosa xanthocentra | 1 | 1 | |||
| Orquidea, morfoespecie 1 | Orquídea | 1 | 2 | 3 | |
| Orquidea, morfoespecie 2 | Orquídea | 1 | 2 | 3 | |
| Urochloa reptans | 1 | 1 |
En contraste, tan sólo ocho especies herbáceas poseen información sobre usos o estatus de conservación que permiten estimar prioridades de conservación en cada estrato (Tabla 4). La mayoría de esas especies son empleadas como ornamentales o, han sido señaladas como de preocupación menor, por lo que la información disponible para este grupo es particularmente fragmentada. Dos especies de orquídeas, no identificadas aún, sobresalen entre las herbáceas de mayor interés en conservación. Ambas fueron encontradas en el bosque secundario del sitio de compensación. La calificación final de los indicadores de diversidad y prioridad de conservación para especies leñosas y herbáceas se muestra en Tabla 6.
Tabla 6 Puntajes asignados a indicadores de diversidad y prioridad de conservación de los grupos sustitutos empleados en la evaluación de la compensación ambiental. Table 6. Scores assigned to indicators of diversity and conservation priority of surrogate groups used in the evaluation of environmental compensation.
| Grupo sustituto | Sitio | inundación | Sitio | compensación | Puntaje final componente | ||
| Número de especies | Prioridad de conservación | Número de especies | Puntaje diversidad | Prioridad de conservación | Puntaje conservación | ||
| Plantas leñosas | 148 | 0.60 | 130 | 10.7 | 0.43 | 10 | 20.7 |
| Plantas herbáceas | 30 | 0.03 | 39 | 3.1 | 0.05 | 1.7 | 4.8 |
| Aves | 59 | 1.10 | 55 | 4 | 1.07 | 4 | 4 |
| Mamíferos | 48 | 1.04 | 30 | 1 | 1.07 | 4 | 2.5 |
| Anfibios y Reptiles | 26 | 9.53 | 21 | 3 | 9.14 | 4 | 3.5 |
| Peces | 13 | - | 4 | 2 | - | - | 2 |
| Artrópodos de sotobosque1 | 154 | - | 173 | 8 | - | - | 8 |
| Himenópteros2 | 30 | - | 43 | 8 | - | - | 8 |
| Puntaje final diversidad | 53.5 |
1. Estimación basada en familias. 2. Estimación basada en géneros.
Diversidad y composición de avifauna
Se registraron un total de 70 especies de aves, representando 29 familias (Tabla A2, Apéndice II). Del total de especies, 84 % se registraron en RBLB, mientras que 78 % fueron observadas en el potencial sitio de compensación, y cerca del 62 % se registraron en ambos sitios.
La mayoría de especies encontradas, habitan zonas abiertas y, son comunes en bosques deciduos de ambientes estacionales en la región mesoamericana y noroeste de Sudamérica (Prieto-Torres et al., 2019; Fig. 4). Varias de estas especies son consideradas en estado de preocupación menor, aunque algunas poblaciones muestran tendencias decrecientes, como sucede con las Loras Amazona albifrons (Sparrman, 1788) y A. auropalliata (Lesson, 1842), el Verdillo Pachysylvia decurtatus (Bonaparte, 1838), el Culleo Nyctidromus albicollis (Gmelin, 1789), la Perlita Polioptila albiloris (Sclater & Salvin, 1860) y el Pájaro Chancho Tityra semifasciata (Spix, 1825). De la lista de especies, únicamente la Lora Amazona auropalliata y el Pavón Crax rubra (Linnaeus, 1758) son consideradas en estado vulnerable, por la destrucción de sus hábitats, la persecución para el mercado de mascotas y como piezas de cacería, respectivamente. La baja fracción de especies consideradas con niveles de amenaza altos conduce a promedios geométricos con valores bajos, lo que a su vez resulta en una ponderación relativamente alta para este componente (Tabla 6).

Fig. 4 Algunas especies de aves encontradas en el estudio. (A) Trogon caligatus; (B) Eumomota superciliosa; (C) Melanerpes hoffmannii; (D) Crax rubra; (E) Pulsatrix perspicillata; (F) Columbina inca. / Fig. 4. Some species of birds found in the study. (A) Trogon caligatus; (B) Eumomota superciliosa; (C) Melanerpes hoffmannii; (D) Crax rubra; (E) Pulsatrix perspicillata; (F) Columbina inca.
Diversidad y composición de mamíferos
Para ambos sitios de estudio se registraron un total de 53 especies de mamíferos, representantes de 19 familias (Tabla A3, Apéndice II). Cuarenta de las especies registradas corresponden a murciélagos (Fig. 5), mayormente capturados en el sitio potencial de inundación (168 vs. 51 capturas, respectivamente). Esta diferencia, posiblemente se deba a la permanencia de cuerpos de agua en la reserva biológica durante los primeros muestreos, efectuados en la época seca. A pesar de esta variación en las capturas, el estimado de riqueza de murciélagos no varió significativamente entre sitios: 35 en el sitio de inundación (estimado en 43 ± 5.8 especies, Lukacs, 2009; White, 1982), contra 31 (estimado en de 40 ± 7.6 especies) (Tabla A3, Apéndice II). Las especies de murciélagos registradas, se agrupan en seis gremios tróficos en el sitio de inundación y cinco en el de compensación (Tabla 7), no siendo esa diferencia significativa (c2 = 3.14, gl =5, P=0.53). El gremio mejor representado fue el de los insectívoros aéreos, detectados principalmente con grabaciones ultrasónicas. El potencial sitio de compensación, registró un mayor número de especies pertenecientes a este grupo, probablemente al contar con una cobertura vegetal más abierta que facilita su detección.

Fig. 5 Algunas especies de murciélagos encontradas en el estudio. / Fig. 5. Some species of bats found in the study.
Tabla 7 Número de especies de murciélagos registradas, agrupadas por gremio tróficos. / Table 7. The number of registered bat species grouped by the trophic guild.
| Gremio trófico | Inundación | Compensación |
| Insectívoro aéreo | 14 | 18 |
| Frugívoro | 11 | 7 |
| Insectívoro de follaje | 4 | 1 |
| Nectarívoro | 2 | 2 |
| Piscívoro | 1 | 1 |
| Hematófago | 1 | 1 |
| Omnívoro | 1 | 0 |
También se observaron trece especies de mamíferos no voladores (Tabla A3, Apéndice II), todas en el sitio potencial de inundación en RBLB, aunque el mono carablanca (Cebus imitator (Thomas, 1903)), el mono aullador (Alouatta palliata (Gray, 1849)) y el zorro pelón (Didelphis marsupialis (Linnaeus, 1758)), también fueron observados en el sitio de compensación. El sitio potencial de compensación muestra una menor riqueza de mamíferos que la observada en RBLB (c2 = 9.7, gl=1, P<0.001). Ambos sitios de estudio comparten el 47 % de las especies registradas, un 54 % si solo se toman en cuenta las especies de murciélagos, por lo que la observación para el componente de diversidad de mamíferos es baja (Tabla 6).
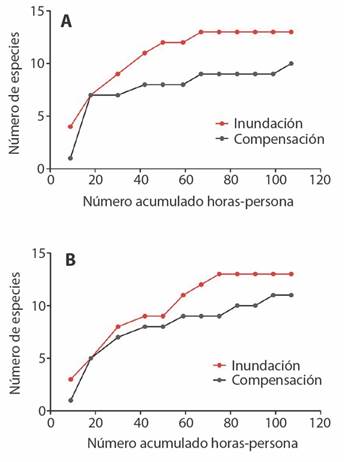
Fig. 6 Curvas de acumulación de especies de anfibios (A) y reptiles (B) en sitio potencial de inundación y en sitio potencial de compensación. / Fig. 6. Accumulation curves of amphibians (A) and reptiles (B) in the potential flood site and in the potential compensation site.
La mayoría de las especies registradas en los muestreos se consideran comunes, aunque el Reglamento de Vida Silvestre de Costa Rica, considera como especies amenazadas al mono carablanca (Cebus imitator) y al mono congo (Alouatta palliata) (Decreto Nº 40548-MINAE). Dentro del grupo de los murciélagos cuatro especies de insectívoros de follaje, son más comunes en bosques conservados: Glyphonycteris sylvestris (Thomas, 1896), Lampronycteris brachyotis (Dobson, 1879), Micronycteris microtis (Miller, 1898), Micronycteris minuta (Geravais, 1856). El murciélago Enchistenes hartii (Thomas, 1892), perteneciente a un género monotípico, es de especial interés debido a que tiene pocos registros en el país, principalmente en tierras medias. Es una especie poco conocida en general, registrada en la zona potencial de inundación. Pese a ello, ninguno de los mamíferos registrados se encuentra bajo categoría de amenazas de acuerdo con la UICN (2001). En consecuencia, la estimación de la prioridad de conservación resultó en valores bajos para ambos sitios (Tabla 6).
Diversidad y composición de Herpetofauna
En los muestreos se observaron un total de 14 especies de anfibios y 18 de reptiles (Tabla A4, Apéndice II), ambos sitios registraron una riqueza de especies comparable (Tabla 6). Las curvas de acumulación de especies permiten comparaciones de la diversidad de anfibios y reptiles entre los sitios de estudio (Fig. 6). El crecimiento en la riqueza estimada de anfibios se estabiliza cerca del séptimo muestreo, con unas 67 horas-persona de búsqueda acumuladas; mientras que se registran 13 especies de anuros en el sitio potencial de inundación y 9 en el sitio de compensación (Fig. 6 A). Después de ese punto, la curva del sitio de compensación se incrementa paulatinamente. Para reptiles, las curvas de acumulación de especies también difieren entre sitios: la del sitio de inundación se estabiliza hacia el octavo muestreo, unas 83 horas-persona, y resulta en 13 especies. En contraste, con ese mismo esfuerzo se registraron 9 especies en el sitio de compensación (Fig. 6 B). Basados en estas curvas, la interpretación es que hay diferencias sutiles en la abundancia de especies, donde la RBLB muestra una ligera mayor diversidad.
El sitio de inundación en RBLB comparte un 79 % de las especies de anuros y un 39 % de los reptiles con el sitio de compensación. Si se contemplan ambas clases de vertebrados, tan solo un 52 % de las especies son compartidas. Estas marcadas diferencias reflejan el contraste entre la eficacia del muestreo de las comunidades de anfibios (en sus sitios reproductivos) y la deficiencia en muestreos de reptiles, algunos de ellos -como las serpientes- difíciles de observar en estudios a corto plazo. Con los resultados obtenidos, es claro que las comunidades de anfibios en ambos sitios de estudio son relativamente similares, pero no es claro si la composición de reptiles es similar. El bajo puntaje asignado al componente de diversidad de herpetofauna refleja esa disparidad (Tabla 6).
Algunas de las especies observadas son generalistas con amplia distribución en Mesoamérica y, habitan varios tipos de zonas de vida, entre ellas: el sapo común Rhinella horribilis (Wiegmann, 1833), la iguana Iguana iguana (Linnaeus, 1758), la bequer Boa imperator (Daudin, 1803), y la coral Micrurus nigrocinctus (Girard, 1854). Otras especies habitan exclusivamente el bosque seco tropical y por lo tanto son consideradas endémicas regionales: el sapo borracho Rhinophrynus dorsalis (Duméril & Bibron, 1841), el sapo de bosque seco Incilius luetkenii (Boulenger, 1891), el garrobo Ctenosaura similis (Gray, 1831), la serpiente cascabel Crotalus simus (Latreille, 1801), la toboba gata Trimorphodon quadruplex (Smith, 1941) y la toboba chinga Porthidium ophryomegas (Bocourt, 1868) son ejemplo de ellas (Figs. 7 y 8). La mayoría de estas especies se consideran en estado de preocupación menor por la UICN, por lo que su valor del nivel de amenaza es bajo. Sin embargo, dos especies: el gecko Phyllodactylus tuberculosus (Wiegmann, 1834) y la falsa coral Lampropertis abnorma (Bocourt, 1886) son considerados vulnerables por esta organización, mientras que la serpiente llamada La Béquer de la especie Boa imperator está incluida en el Apéndice II de CITES.

Fig. 7 Algunas de las especies de anuros encontradas en los sitios de estudio. (A) Rhinella marina, (B) Incilius luetkenii, (C) Hypopachus variolosus, (D) Rhinophrynus dorsalis, (E) Leptodactylus poecilochilus, (F) Trachycephalus typhonius, (G) Leptodactylus savagei, (H) Lithobates forreri. / Fig. 7. Some of the anuran species found at the study sites. (A) Rhinella marina, (B) Incilius luetkenii, (C) Hypopachus variolosus, (D) Rhinophrynus dorsalis, (E) Leptodactylus poecilochilus, (F) Trachycephalus typhonius, (G) Leptodactylus savagei, (H) Lithobates forreri.

Fig. 8 Algunas especies de reptiles registradas en los sitios de estudio. (A) Ctenosaura similis, (B) Marisora unimarginata, (C) Coniophanes piceivittis, (D) Phyllodctylus tuberculosus, (E) Rhinoclemmys pulcherrima, (F) Lampropeltis abnorma. / Fig. 8. Some species of reptiles recorded in the study sites. (A) Ctenosaura similis, (B) Marisora unimarginata, (C) Coniophanes piceivittis, (D) Phyllodctylus tuberculosus, (E) Rhinoclemmys pulcherrima, (F) Lampropeltis abnorma.
Por otro lado, otras especies como las serpientes venenosas Crotalus simus, Porthidium ophryomegas y Micrurus nigocinctus, la caracolera Sibon anthracops y la toboba gata Trimorphodon quadruplex, así como otras especies como La Béquer B. imperator, la iguana verde Iguana iguana y el garrobo Ctenosaura similis, presentan valores altos del índice de vulnerabilidad ambiental, por lo que se consideran especies en riesgo (Sasa et al., 2010). La media geométrica del nivel de amenaza estimada para cada sitio de estudio fue similar (Tabla 6), en el sitio potencial de inundación en RBLB fue estimada en 9.53 mientras que en el sitio de compensación la media resultó en 9.14. Por lo tanto, no parece haber notables diferencias entre las prioridades de conservación en ambas comunidades (Tabla 6).
Diversidad y composición de ictiofauna
Un total de 210 peces fueron capturados en los muestreos, 170 en el sitio potencial de inundación en RBLB y 40 en el sitio potencial de compensación. Este número de individuos representa 13 especies incluidas en cinco familias (Tabla A5, Apéndice II). Las especies observadas (Fig. 9) son comunes en otros sistemas de la cuenca, quizás con la única excepción de Astatheros alfari (Meek, 1907) y Neoheterandria umbratilis (Meek, 1912). Sin embargo, se observaron diferencias en el número de individuos capturados durante los muestreos, así como en el número de especies registradas en cada sitio de estudio (Tabla 6). En el potencial sitio de inundación en RBLB se encontraron todas las especies, mientras que en el sitio potencial de compensación tan solo se observaron cuatro de ellas: la sardinita Astyanax aeneus (Günther, 1860), el barbudo Rhamdia guatemalensis (Günther, 1864), y las olominas Brachyrhaphis olomina (Meek, 1914) y Poecilia gillii (Kner, 1863).

Fig. 9 Algunas de las especies de peces encontradas en los sitios de estudio. / Fig. 9. Some of the fish species found at the study sites.
La notable diferencia en composición encontrada en las comunidades de peces posiblemente se deba a diferencias en elevación y, en las cualidades de los microambientes acuáticos entre los sitios comparados: el de RBLB presenta un mayor número y más profundidad de pozas y remansos, mientras que en el sistema de quebradas en el sitio de compensación, el agua fluye más somera. Aunque estas diferencias no fueron cuantificadas, es claro que el agua en superficie prevalece un mayor tiempo en RBLB, efecto especialmente notable durante los meses de estación seca. Las diferencias en la retención de agua superficial en parte serían responsables de las diferencias observadas en la composición de otros grupos de vertebrados entre los sitios de estudio.
Las diferencias en riqueza de especies y composición encontradas son responsables del bajo puntaje asignado al componente diversidad de peces (Tabla 6).
Diversidad y composición de artrópodos de sotobosque
Un total de 143,929 artrópodos, que representan 195 familias, fueron recolectados durante el trampeo pasivo (Tabla A6, Apéndice II). Las familias con mayor representación (en número de individuos) fueron Chrysomelidae (Coleoptera), Ceratopogonidae y Chironomidae (Díptera), Formicidae (Hymenoptera) y las polillas de la superfamilia Gelechioidea (Fig. 10). Es interesante que, a pesar de que las trampas de Malaise fueron colocadas cerca de las quebradas, la representación de grupos con ciclos de vida acuáticos (Trichoptera, Ephemenoptera, etc.) fueron más bien pobres.

Fig. 10 Representantes de algunas familias de insectos del sotobosque. (A) Larva de Saturniidae, (B) Avispa Polistes, Vespidae, (C) Blaberus giganteus, Blaberidae, (D) Mantidae, (E) Orthemis ferruginea, Libellulidae y (F) Erotylidae. / Fig. 10. Representatives of some insect families in the forest understory. (A) Saturniidae larva, (B) Polistes wasp, Vespidae, (C) Blaberus giganteus, Blaberidae, (D) Mantidae, (E) Orthemis ferruginea, Libellulidae y (F) Erotylidae.
La riqueza de familias recolectadas aumenta al inicio de la temporada de lluvias, para descender durante el periodo de mayor precipitación en setiembre y octubre (Fig. 11). Este patrón posiblemente refleje el sesgo que el método de muestreo tiene hacia insectos voladores, cuya actividad disminuye notablemente durante lluvias torrenciales (observación personal). Además, los periodos de actividad de muchos de los insectos voladores están asociados con los ciclos de floración de la vegetación del lugar.
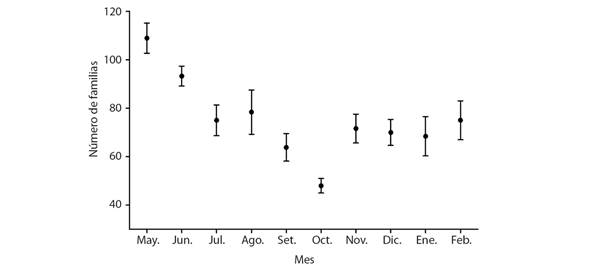
Fig. 11 Riqueza de familias de artrópodos recolectados en trampas de Malaise. La riqueza aumenta al principio de la época lluviosa. / Fig. 11. Family richness of arthropods collected in Malaise traps. Richness increases at the beginning of the rainy season.
El número total de familias observado en la RBLB fue relativamente menor que el número registrado en el sitio potencial de compensación (154 vs. 173, Tabla 6). De igual modo, el valor estimado para el índice de Shannon fue menor en el sitio potencial de inundación (H = 3.58), que en el de compensación (H = 5.48). En el sitio no inundado dentro de RBLB, el estimado de diversidad fue 2.73. Estas diferencias en diversidad biológica se mantienen incluso cuando el análisis se realiza empleando rarefacción para equiparar las estimaciones de riqueza a partir del mismo número de individuos recolectados.
El sitio de potencial inundación en RBLB, compartió un 78 % de los grupos taxonómicos con el sitio de la reserva que no sería afectado directamente por la inundación. Del mismo modo, un 75 % de las familias fueron compartidas entre el sitio de inundación y el sitio de compensación en la propiedad privada. Por ello, el puntaje asignado al componente riqueza y diversidad de artrópodos fue relativamente alto (Tabla 6).
Diversidad y composición de Hymenoptera
Un total de 60 morfotipos (géneros o especies) de himenópteros fueron identificadas en submuestras aleatorias recolectadas de las muestras originales (Tabla A7, Apéndice II). Las muestras provenientes del sitio de potencial inundación en RBLB mostraron una menor riqueza (S= 30), especialmente de abejas polinizadoras, mientras que el número en el sitio de compensación y en el sitio de no inundación en RBLB fueron similares (43 morfotipos).
De los himenópteros identificados a la fecha, el 6 % corresponden a especies parasitoideas (la mayoría no fueron incluidos, pues el estudio se enfocó en abejas y hormigas), 14 % son carroñeros, 21 % cultivadores de hongos o áfidos, 26 % polinizadores y 31 % son especies depredadoras. La proporción de gremios representados, así como el número de especies, difiere entre los sitios de estudio, siendo menor en el sitio potencial de inundación (Fig. 12).
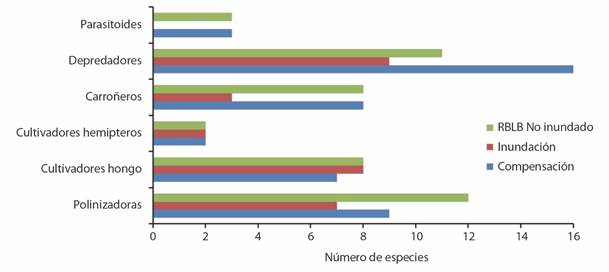
Fig. 12 Gremios de Himenóptera encontrados en sitios de estudio. / Fig. 12. Hymenoptera guilds found at study sites.
La zona de inundación potencial en RBLB y el sitio de compensación comparten un 40% de las especies de himenópteros identificados, mientras que el sitio de compensación y el sitio seleccionado dentro de la RBLB que no sería afectado directamente por el embalse comparten cerca del 52 % de las especies. El puntaje asignado al componente diversidad de himenópteros refleja esos resultados (Tabla 6).
Calificación final de la diversidad del sitio de compensación
La calificación final de la diversidad del sitio de compensación fue de 53.5 puntos, la sumatoria de puntajes asignados a los indicadores de diversidad y prioridad de conservación de cada uno de los grupos sustitutos empleados (Tabla 6). Siguiendo el procedimiento propuesto, el factor de compensación para el cálculo del área requerida para resarcir la pérdida de diversidad en el sitio de inundación sería 100/53.5 o 1.87. Por lo tanto, para resarcir la pérdida de 113 ha en la RBLB, se requeriría al menos 211.3 ha de ambiente con diversidad como la del sitio potencial de compensación evaluado.
Discusión
Tanto el sitio de inundación dentro de la RBLB como el sitio de compensación mostraron gran diversidad general. No obstante, la mayoría de grupos sustitutos analizados muestran mayor diversidad y prioridad de conservación en el sitio potencial de inundación en la RBLB, resultado no sorprendente debido a la protección que se le brinda a ese entorno desde hace más de tres décadas. Esta situación debe ser tomada en cuenta a la hora de plantear medidas de resarcimiento, especialmente si es la alternativa de sustitución por un área con un ambiente cuya diversidad debe ser equivalente. En el procedimiento seguido en este análisis, la equivalencia entre los dos sitios se consigue al incrementar el área a anexar en sustitución del área que sería impactada en la reserva.
Necesidad de sustitución de área impactada
La sustitución de un ambiente terrestre por un sitio acuático tiene enormes repercusiones a nivel de la composición de diversidad, pero también a nivel de la geomorfología y geoquímica del sitio, así como de los flujos de energía (Zhang et al., 2022). La inundación de hábitats cubiertos por vegetación provoca la liberación de metano y dióxido de carbono con distintos efectos a nivel local y regional (Alho, 2011). Algunas aves, como Tigrisoma mexicanus y Dendrocygna autumnalis, así como especies de anuros y peces están asociadas a ambientes acuáticos, por lo que podría suponerse que serán favorecidas por las nuevas condiciones del lugar si el embalse llegara a desarrollarse. Sin embargo, aún en especies estrictamente acuáticas los impactos de la inundación pueden ser severos. La inundación altera el ciclo hidrológico de cauces, limitando el movimiento estacional de especies acuáticas en busca de recursos ecológicos (Alho, 2011). La mayoría de los anuros del bosque seco tienen reproducción explosiva y requieren cuerpos de agua poco profundos y estacionales para poner sus huevos y evitar depredadores (Savage, 2002), por lo que un cambio en esas condiciones no necesariamente facilitaría su reproducción. De igual manera, peces que habitan quebradas intermitentes están adaptados a condiciones de alta estacionalidad, tanto en la presencia de agua como en la disponibilidad de recursos (Bussing & López, 1996). Como estrategia, varias especies de peces estivan durante los meses secos, por lo que es difícil predecir cómo serán afectados por las nuevas condiciones hídricas del entorno. El contacto con nuevos depredadores una vez se establezca el Embalse Piedras es otra preocupación que requiere ser abordada a partir del monitoreo a mediano y largo plazo.
La composición y abundancia de fauna terrestre también se vería afectada por la inundación. Más del 90 % de las especies de vertebrados encontrados perderán sus hábitats y se verán obligados a desplazarse hacia otros sectores, dentro o fuera de la reserva biológica. El impacto de dichos desplazamientos no es del todo claro, pero supone poseer la capacidad de orientarse y movilizarse hacia nuevos entornos, encontrar nuevos refugios, enfrentar incrementos en la competencia intra e interespecífica (sitios adecuados para anidar, alimentos, pareja) y ser capaz de sobrevivir a depredadores e impactos humanos en sus nuevos ambientes (Nussear et al., 2012).
A nivel de plantas, varias de las especies leñosas observadas en el potencial sitio de afectación son maderables y se encuentran amenazadas (Quesada-Monge, 2008). Eliminar individuos de poblaciones ya de por sí reducidas y fragmentadas (Powers et al., 2009) supone una pérdida sensible y contribuye con su erosión genética. De hecho, procesos de inundación han sido señalados como modificadores de la estructura poblacional y genética de organismos tan diversos como artrópodos (Lambeets et al., 2008), aves (Turley & Holthuijzen, 2005), y peces e invertebrados acuáticos (Arthington & McKenzie, 1997).
El rescate y traslado de individuos o poblaciones de especies silvestres ha sido empleado como estrategia de conservación para mitigar impactos de proyectos (Menkhorst et al., 2016), especialmente en el caso de especies raras o amenazadas que se desean conservar (Greene et al. 2005). El éxito de programas de reintroducción o “rescate” de fauna silvestre ha llevado a diferentes resultados (Germano & Bishop, 2009), aunque en general se considera que sólo una pequeña proporción de esos programas han permitido el establecimiento exitoso de poblaciones viables (Menkhorst et al., 2016) y se han observado altos índices de mortalidad en individuos de diversas especies trasladadas (Dickens et al., 2009).
En el caso de aves, Beck et al., (1994) consideran que solo el 11% de las reintroducciones de especies en este grupo han sido exitosas, aunque más recientemente otros investigadores sugieren que este porcentaje es un tanto más alto (Sisson et al., 2012). En Costa Rica, diversas iniciativas de reintroducción han sido realizadas con especies focales (especialmente guacamayas del género Ara) o mediante los programas de rescate durante la construcción de embalses hidroeléctricos (Forbes, 2006). Sin embargo, al no contarse con seguimiento en estas iniciativas a lo largo del tiempo, es difícil evaluar el alcance de estos esfuerzos. Por ello, y dado que el embalse impactaría directamente la composición de flora y fauna del sitio de inundación dentro de la Reserva Biológica Lomas de Barbudal, el traslado de elementos de la diversidad afectados no parece ser una opción satisfactoria de compensación. La alternativa es la incorporación de un área cuyas comunidades de plantas y animales sea razonablemente similar a la encontrada en el sitio de afectación.
Procedimiento para la cuantificación de equivalencia a partir de grupos sustitutos
En el procedimiento seguido para evaluar el potencial sitio de compensación, se asignaron valores a cada indicador de diversidad de los grupos sustitutos. La asignación de esos valores se basó en criterios previamente establecidos que cuantificaron aspectos de la diversidad o, el estado de conservación de cada grupo en el sitio de compensación, en relación a la condición en el sitio de inundación. La calificación final, se logra al sumar todos los puntajes asignados a cada indicador.
Si bien la ponderación alcanzada es proporcional a las diferencias entre sitios, no debe entenderse como el porcentaje de similitud en biodiversidad entre ellos. En cambio, la calificación representa un valor sobre el cual tasar acciones compensatorias. En nuestro análisis, el valor resultante de 53.5 es interpretado como la ponderación necesaria a la hora de calcular el área requerida para resarcir por la pérdida en diversidad que supondría la inundación en RBLB. Así, 211.3 ha de un ambiente con la diversidad como la registrada en la propiedad privada, deberían ser anexadas a la reserva para indemnizar las pérdidas que derivarían de la inundación. La suposición tácita en este caso sería que ambos sitios, referencia y compensación, poseen una diversidad equiparable. Consideramos que hay elementos que apoyan esa presunción. Por un lado, las especies observadas forman parte de los mismos ensamblajes ecológicos y biogeográficos (Janzen, 1988). De hecho, muchas de ellas se distribuyen exclusivamente en el bosque seco tropical y poseen adaptaciones a la marcada estacionalidad que impera en la región (plantas: Hilje et al., 2015; Powers & Tiffin, 2010; aves: Hilje et al., 2020; Gillespie & Walter, 2001; herpetofauna: Sasa & Bolaños, 2004; Savage, 2002; mamíferos: Stoner & Timm, 2004; peces: Bussing, 1998; Sandlund et al., 2010). Además, una importante fracción de las especies de todos los grupos indicadores es común entre ambos sitios. Por otro lado, es posible que el grado de alteración en sitio de compensación explique algunas de las diferencias observadas en diversidad. No hay que olvidar que ese sitio corresponde a una propiedad privada que no ha recibido la protección del sitio potencial de inundación en la reserva. De incorporarse al régimen de protección de la RBLB sería posible la recuperación de hábitats y parte de la diversidad, lo que supondría una mayor correspondencia con la condición del sitio de referencia.
Reconocemos que la medida resarcitoria propuesta aquí (i.e. sustitución por un área estimada directamente a partir del valor de condición de diversidad del sitio potencial de compensación) puede ser debatible. Sin embargo, es posible plantear otras posibles medidas de compensación basadas en esta cuantificación de la diversidad del sitio de compensación, relativo al de referencia. Por ejemplo, puntajes altos podrían resultar en acciones resarcitorias menores o enfocadas a componentes específicos de la diversidad dentro del sitio de compensación, mientras que calificaciones bajas podrían desencadenar medidas que permitan acelerar la ganancia en términos de diversidad (i.e. rehabilitación o restauración de hábitats, Benayas et al., 2009). Otra ventaja del procedimiento de puntuación seguido es que los indicadores, su peso en el análisis, los criterios de puntaje para la comparación y las acciones resarcitorias que resulten pueden ser consensuados a priori por un panel de expertos (p.ej. Método Delphi: García & Suárez, 2013; Hernández & Barrera, 2018). Esto permitiría adaptar el procedimiento a las particularidades de cada caso y a la validación técnica y administrativa de la metodología.
Grupos indicadores en el análisis de compensación
Aunque nuestro estudio no fue diseñado para evaluar correlación entre grupos taxonómicos, es claro que hay congruencia en la información derivada de varios de ellos, lo que ilustra su ventaja en evaluaciones de compensación. Por un lado, las especies de plantas leñosas, aves, mamíferos y peces dan cuenta de una mayor riqueza en el sitio potencial de inundación en RBLB, mientras que los anfibios parecen mantener una diversidad y composición comparable y los reptiles registraron diferencias en la composición entre sitios. La congruencia entre grupos, apoya la noción que el sitio en la reserva biológica efectivamente mantiene una mayor diversidad biológica que el examinado como potencial compensación. En contraste, las plantas herbáceas, los artrópodos de sotobosque y los himenópteros revelan una situación diferente, donde la mayor diversidad se registra en el sitio de compensación. Semejante aumento en la riqueza de especies como respuesta a alteraciones ambientales intermedias ha sido reportado en otros grupos y ambientes (Giehl et al., 2020), donde ha sido atribuido a aumentos en la productividad primaria, disponibilidad de presas y/o heterogeneidad ambiental (Connell, 1978; Tonkin et al., 2013).
El uso de indicadores de biodiversidad como herramienta para el análisis del impacto ambiental y conservación de entornos naturales es frecuente (Perevochtchikova, 2013) y se ha empleado para dilucidar acciones rápidas contra la pérdida de biodiversidad (Gerhardt, 2003; Kati et al., 2004; Lindenmayer et al., 2000; Soberón et al., 2000). La idea de utilizar estos indicadores se basa principalmente en la suposición de que diferentes taxones tienen patrones congruentes de riqueza de especies, de modo que pueden reflejar los patrones de distribución de otros taxones no censados o de la biodiversidad general (Kati et al., 2004; McGeoch, 1998).
A pesar de lo atractivo de esa idea, el empleo de grupos indicadores ha sido objeto de intenso debate en la literatura científica (Hodkinson & Jackson, 2005). Heino (2010) encontró que los grupos indicadores tienen poca utilidad para predecir la biodiversidad de otros taxones en ecosistemas acuáticos, señalando que, incluso cuando se han detectado correlaciones estadísticamente significativas entre grupos taxonómicos, estas correlaciones tienden a ser demasiado débiles para proporcionar predicciones fiables de la biodiversidad general. También en sistemas terrestres las relaciones encontradas entre diferentes taxones son, cuando mucho, débiles (p. ej., Saetersdal et al., 1993; van Jaarsveld et al., 2005). Esto hace que algunos autores (Ricketts et al., 1999) sugieran que ningún grupo individual puede usarse de manera efectiva para predecir la variación en diversidad de otros grupos taxonómicos.
Pese a esas objeciones, es posible que la correlación entre estimaciones de riqueza dependa de la escala geográfica (Wolters et al., 2006; Blair et al., 1999; Hess et al., 2006; Ovadia, 2003). En escalas espaciales amplias, las examinaciones de múltiples grupos taxonómicos han mostrado congruencias en la variación en plantas vasculares, escarabajos o mariposas como indicadores de biodiversidad (Crisp et al., 1998; Faro et al., 1999; Pearson & Carroll, 1998; Pearson & Cassola, 1992). Correlaciones positivas entre aves, plantas vasculares, anfibios y reptiles y mamíferos a escalas geográficas más estrechas también han sido registradas (Vera et al., 2011), reafirmando el uso de grupos bioindicadores para ayudar a dilucidar patrones generales de biodiversidad a nivel local.
Además de las diferencias en riqueza, el sitio de compensación muestra también heterogeneidad en la composición de especies, compartiendo solo la mitad de las especies de plantas leñosas y mamíferos y menos de una tercera parte de los reptiles, peces y plantas herbáceas con el de inundación. La heterogeneidad espacial entre sitios cercanos parece ser la norma en comunidades que, como las analizadas en este estudio, están integradas por un alto número de especies poco abundantes (Reid, 1998). Por ejemplo, en el Caribe costarricense Guariguata et al. (1997) encontraron que sitios cercanos con coberturas de bosque secundario comparten entre el 47 y 62 % de sus especies florísticas; mientras que sitios con coberturas de bosque primario comparten entre el 38 % y 48 %. En esa misma región, Heinen (1992) encontró que las comunidades de anfibios y reptiles que habitan el bosque húmedo y cacaotales adyacentes, estructuralmente similares, comparten alrededor del 57 % de sus especies; mientras que, en Panamá, Van Bael et al. (2007) observaron que sitios cercanos (<1 km distancia) compartían tan solo un 44 % de sus aves (102 de un total de 234 especies).
El origen y mantenimiento de la variación de diversidad a escala de paisaje ha sido debatido intensamente en la literatura científica (Calderón-Patrón et al., 2012; Hubbell & Foster, 1983; Lieberman et al., 1985; Legendre et al., 2005), y dos hipótesis suelen esgrimirse para explicarla. Primero, la diversificación en composición puede resultar de la heterogeneidad física del ambiente (Hubbell y Foster, 1983; Lieberman et al., 1985; Terborgh et al., 1996). En segundo lugar, la composición fluctúa aleatoriamente como resultado del aislamiento espacial generado por limitaciones de la dispersión (Hubbell et al., 1999; Hurtt & Pacala, 1995; Tilman & Pacala, 1993). Aunque antagónicas, ambas explicaciones pueden actuar para elucidar patrones de variación observados en distintas escalas. Por ejemplo, Potts et al., (2002) indican que a escala regional, la variación florística se correlaciona más fuertemente con el hábitat que con la distancia geográfica, mientras que, a nivel local, existe un umbral de recursos por encima del cual la similitud florística entre los sitios puede ser explicada por los efectos de la distancia geográfica. En nuestro caso, el sitio de compensación es adyacente al del posible impacto (inundación) y ambos poseen cierta semejanza estructural (Bonilla et al., 2022). Sin embargo, las diferencias observadas en la diversidad y composición de grupos indicadores parecen resultar de las sutiles diferencias a nivel ambiental observadas entre los sitios, más que del efecto de distancia. En apoyo de este punto, la cobertura de bosque ribereño en el sitio de compensación está restringida a unos minúsculos fragmentos dispersos, lo que directamente afecta la cuantificación de especies leñosas en ese lugar. Además, las secciones de las quebradas del sitio de inundación parecen retener el agua por más tiempo durante el periodo seco, lo que -en consecuencia- explica la mayor riqueza de peces y de murciélagos registrados.
La decisión de cuales grupos sustitutos deben emplearse en estudios de compensación e impacto ambiental debe ser tomada cuidadosamente, toda vez que algunos de ellos pueden resultar redundantes o, no proveer información que lleve a interpretaciones concluyentes (Moreno et al., 2007). Otro importante reto es lograr muestreos igualmente representativos para los grupos indicadores empleados, situación que no siempre se logra en estudios ambientales a corto plazo. En nuestro estudio, las plantas herbáceas, mamíferos no voladores y reptiles representan una fracción menor de las especies esperadas en los sitios de estudio, como lo evidencian sus curvas de acumulación de especies o los registros previos en la región (Rodríguez-Herrera et al., 2014, Sasa et al., 2010). En ambientes estacionales, las hierbas tienden a ciclos de vida cortos, mientras que reptiles y mamíferos no voladores suelen tener hábitos esquivos y abundancias relativas bajas, lo que dificulta su representatividad en estudios a corto plazo. Muy posiblemente, también sea así para los artrópodos de sotobosque presentes en los sitios de estudio, aunque no disponemos de estimados previos para este grupo. En contraste, las especies leñosas registradas representan el 86 % de las especies conocidas localmente (Gillespie, 2000). Lo mismo sucede con los anuros (88 %, Sasa y Bolaños, 2004), murciélagos (60 %, LaVal & Rodríguez, 2002) y peces (87 %, Bussing & López, 1977) registrados, lo que sugiere ventajas en su empleo en este tipo de estudios.
Conclusiones y recomendaciones
Ante la alteración o destrucción de un ecosistema natural protegido como lo es la RBLB, la compensación ambiental no es una opción deseada, sino una mejor opción que debe procurarse a raíz del remplazo planificado del ecosistema por parte del desarrollo de una obra. El fundamento que sustente la magnitud de la compensación debe ser lo más robusto posible, aunque estamos conscientes de que cualquier métrica para evaluar y determinar la equivalencia ecológica para resarcir el área impactada estará limitada en tiempo y recursos.
Este estudio utiliza elementos de la biodiversidad ya conocidos, como son los grupos taxonómicos representativos del ecosistema en cuestión, permitiendo una evaluación práctica y replicable para otros eventuales escenarios futuros. A partir de los grupos examinados, establecimos la línea base sobre la biodiversidad que se perdería en la zona de posible impacto y sustentamos una propuesta metódica y sistemática tendiente a la mejor compensación ecológica posible, basada exclusivamente en biodiversidad. Los resultados obtenidos en este estudio son producto de evaluaciones relativamente rápidas, y focalizadas en parte de los taxones presentes en el área de estudio. No obstante, la información generada permite evidenciar, de forma cuantitativa, las condiciones de los potenciales sitios de impacto y compensación. Los dos sitios evaluados parten de una diversidad razonablemente equiparable, aunque no idéntica, constituida por comunidades de flora y fauna típicas de la zona de vida Bosque Seco Tropical. Esta información a su vez, ofrece elementos concretos para fundamentar la propuesta de compensación ambiental. Así, el resarcimiento involucra incorporar a la Reserva Biológica un mayor número de hectáreas del sitio de compensación como indemnización por las pérdidas en diversidad que supondría la afectación directa del embalse.
El análisis realizado muestra que es factible emplear grupos sustitutos en estudios ambientales de corta duración, pero que su selección y número dependerá de los objetivos del proyecto, por lo que deben ser evaluados caso por caso. Realizar un buen registro de la diversidad y situación de esos grupos y cómo varían en el tiempo, es una medida de seguimiento necesaria en estudios aplicados a la compensación ambiental. Solo con datos empíricos es posible evaluar efectivamente los alcances de las medidas resarcitorias propuestas.
Las experiencias de compensación ambiental no han sido la norma en Costa Rica, por lo que las conceptualizaciones y procedimiento utilizados aquí deben ser considerados incipientes, pero pioneros en el país. Los ecosistemas tropicales son altamente complejos, lo cual hace casi imposible una evaluación integral de todos los aspectos que están involucrados en cambios drásticos en el ambiente. Dada la fragilidad y complejidad de estos ecosistemas, recomendamos evitar realizar obras de desarrollo en sitios ya ocupados por ecosistemas naturales. Destruir y reponer, o compensar ambientalmente la destrucción de la naturaleza, no debe ser de ninguna manera un principio orientador. Por lo tanto, cualquier caso de compensación ambiental como única opción debe regirse por una metodología validada, sujeta a escrutinio profesional y debe de publicarse de la manera más transparente posible. Para los casos en los cuales se lleve a cabo la obra y se ejecute la compensación correspondiente, recomendamos implementar un monitoreo de los grupos sustitutos evaluados durante el proceso de la determinación de la compensación. Esto permitiría una mejor validación de las respuestas de los grupos indicadores, permitiendo realizar ajustes en las metodologías utilizadas en la evaluación de los parámetros para la determinación de la magnitud de la compensación requerida. Finalmente, consideramos necesario iniciar un foro de discusión sobre compensación ambiental en el país con el fin de consolidar líneas de acción ante los cambios futuros en el ambiente.
Declaración de ética: Los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio