Introducción
Las plantaciones forestales comerciales representan aproximadamente el 7 % de la superficie forestal del mundo y constituyen un factor importante de cambio de uso del suelo a nivel global (Brockerhoff et al., 2013; Rivera et al., 2013). Pese a esto, pueden brindar servicios ambientales y tener efectos positivos en la conservación de la biodiversidad (Brockerhoff et al., 2013; Secco & Pirard, 2015). Por ejemplo, pueden proporcionar hábitats estructuralmente funcionales y mantener flujos biológicos entre fragmentos de coberturas naturales para distintos organismos (Barbosa et al., 2017).
Las consecuencias del establecimiento de plantaciones forestales comerciales sobre la biodiversidad dependen de varios factores que incluyen la vegetación colindante y el uso anterior del suelo (Brockerhoff et al., 2013; Livingston et al., 2013). Para este último, dependiendo de la vegetación precedente al establecimiento de las plantaciones forestales, pueden proporcionar un hábitat sustituto para las especies de la antigua cobertura natural (Brockerhoff et al., 2008). Por ejemplo, cuando bosques naturales previamente deforestados son reemplazados por plantaciones, estas pueden simular parcialmente la estructura y algunas condiciones microambientales del bosque reemplazado y pueden proveer algunos servicios ambientales similares que los de la cobertura anterior (Barbosa et al., 2017). Esto permitiría que algunas de las especies del bosque no resulten afectadas por el establecimiento de las plantaciones (Brockerhoff et al., 2008; Brockerhoff et al., 2013; Felton et al., 2016; Livingston et al., 2013; Rivera et al., 2013). Sin embargo, cuando las plantaciones se establecen en coberturas no forestales, como las llanuras o sabanas, el efecto de esta forestación no necesariamente es análogo al reemplazo de los bosques naturales (Brockerhoff et al., 2008; Brockerhoff et al., 2013). En este sentido, la forestación produce cambios en la estructura y composición de la vegetación, pero no es claro su efecto sobre las especies de bosques naturales remanentes y cercanos a las plantaciones.
En relación con la forestación, se conoce que algunos grupos de vertebrados tienden a mostrar mayor diversidad en las plantaciones, especialmente si estas se encuentran en zonas cercanas de bosque natural (Brockerhoff et al., 2013; Felton et al., 2016). Dentro de los invertebrados, los escarabajos coprófagos (Tavares et al., 2019), las hormigas cortadoras de hojas (Rivera et al., 2013) y las termitas (Junqueira et al., 2008; Pinzón et al., 2012) muestran respuestas similares que los vertebrados. En contraste, la diversidad de carábidos epiedáficos (García-Suabita et al., 2019) y macroinvertebrados en plantaciones forestales (Cordero-Rivera et al., 2017) muestra una reducción considerable en comparación a las coberturas naturales. Probablemente las diferentes respuestas se deban a cambios en las condiciones microclimáticas del sotobosque y la complejidad estructural de la vegetación (Brockerhoff et al., 2008). Teniendo en cuenta que los organismos responden de manera diferente ante los disturbios es importante profundizar tanto en la diversidad asociada como en los factores que determinan dichos cambios, esto para contar con herramientas que permitan apoyar la toma de decisiones a favor de la conservación de la biodiversidad de las regiones en donde se realiza desarrollo socio-económico basado en plantaciones forestales.
Las mariposas frugívoras son ecológicamente diversas y altamente sensibles a cambios ambientales por perturbaciones (Lourenço et al., 2019; Uehara-Prado et al., 2006) y han sido usadas como bioindicadores (Barlow et al., 2007a; Barlow et al., 2008; Lucci Freitas et al., 2014). Asimismo, están estrechamente relacionadas con el estado de conservación del bosque, la estructura de la vegetación, patrones de disponibilidad de recursos y algunos factores microclimáticos (Barlow et al., 2007a; Bobo et al., 2006; Fermon et al., 2005; Lourenço et al., 2019). Sin embargo, el papel de las plantaciones forestales como hábitats para especies de mariposas frugívoras de bosques naturales remanentes, en el caso de la forestación de sabanas, no ha sido estudiado. Los estudios en este grupo se han enfocado en el efecto de la reforestación con especies de eucalipto (Eucalyptus L’Hér.) y árboles de caucho (Hevea brasiliensis (Willd. ex A.Juss.) Müll. Arg.) en la Mata Atlántica en Brasil y sugieren que las plantaciones mantienen comunidades de mariposas menos diversas que los bosques naturales reemplazados (Barlow et al., 2007a; Barlow et al., 2008; Barlow et al., 2012; Nogueira et al., 2019), otros refieren efectos positivos sobre la diversidad de mariposas (Ramos, 2000).
Estudios previos que han comparado la diversidad de mariposas frugívoras entre bosques naturales y plantaciones de eucalipto resaltan la homogeneidad estructural de las plantaciones (Barbosa et al., 2017; Bobo et al., 2006; Ramos, 2000) y la simplificación de las especies del sotobosque como factores limitantes para los diferentes estadios de desarrollo de las mariposas frugívoras (Barbosa et al., 2017; Barlow et al., 2008; Bobo et al., 2006; Nogueira et al., 2019; Ramos, 2000). Se hipotetiza que la diversidad de mariposas frugívoras será diferente entre las coberturas estudiadas. Específicamente planteamos las siguientes predicciones: 1) las comunidades de mariposas frugívoras en las plantaciones pueden ser menos diversas que las encontradas en bosques naturales circundantes y, 2) la diversidad estará relacionada con los patrones locales de diversidad del sotobosque y estructura del bosque. El presente estudio estimó y comparó la diversidad de mariposas frugívoras (Lepidoptera: Nymphalidae) en plantaciones forestales de eucalipto y relictos de bosques naturales y exploró algunas variables ambientales para explicar la composición de las comunidades de mariposas frugívoras observados en el área de estudio.
Materiales y métodos
Área de estudio: La investigación se llevó a cabo en el municipio de San Martín (Meta, Colombia) en un núcleo forestal comercial de 88 km2 de Eucalyptus pellita F. Muell., Eucalyptus grandis W. Hill ex Maiden y Pinus patula Schltdl. & Cham. Las plantaciones fueron establecidas en áreas ocupadas por sabanas previamente utilizadas para ganadería extensiva en donde se realiza un manejo de conservación de bosques de galería remanentes. El predio se encuentra ubicado en la zona Sabanas del Provenir (3°4’28’’ N & 72°32’12’’ W) entre las veredas de Cumaralito y La Cristalina (Apéndice 1). La temperatura media de la región es 25.5 °C y la precipitación promedio es 2 520 mm distribuidos en un régimen monomodal con una temporada de lluvias de abril a noviembre y una temporada seca de diciembre a marzo (Borralho & Nieto, 2012).
Muestreo de mariposas frugívoras: Con el objeto de estimar la diversidad y comparar las comunidades de mariposas frugívoras entre diferentes usos del suelo, se muestrearon simultáneamente especímenes de mariposas frugívoras desde diciembre 2020 hasta julio de 2021 en plantaciones de E. pellita de seis y cuatro años; así como en dos tipos de bosques de galería, uno con predominancia de suelos secos (tipo 1) y otro con suelos anegados (tipo 2) (Apéndice 2).
Empleando un diseño similar al reportado por Barbosa et al. (2017) y Nogueira et al. (2019), en cada tipo de hábitat y edad de la plantación estudiados se establecieron dos repeticiones cada una compuesta de cuatro trampas Van Someren-Rydon (TVSR). Las 32 trampas en las ocho repeticiones permanecieron durante 203 días en las unidades y representaron 6 496 días/trampa de muestreo durante el estudio. Todas las TVSR fueron revisadas cada cinco días en orden aleatorio para recolectar material y renovar la provisión de cebo, que consistió en 125 ml de cebo estándar de banano fermentado, el cual es el más empleado en estudios ecológicos sobre mariposas frugívoras (Lucci Freitas et al., 2014; DeVries et al., 2016). Las TVSR fueron dispuestas en un transecto lineal de 75m, a 50 m del borde y ubicadas a una distancia de 25 m entre sí a una altura entre 1.5 y 3 m del suelo. En las plantaciones forestales los transectos se establecieron siguiendo la línea de siembra, pero en los bosques de galería se centraron lo máximo posible en el sitio. Las ocho repeticiones estuvieron separadas en promedio 1.5 km entre sí. Los especímenes recolectados fueron procesados, examinados, fotografiados y para futuras referencias fueron depositados en la Colección Entomológica Forestal de la Universidad Distrital Francisco José de Caldas, Bogotá, Colombia (RNC 045).
Con el objeto de explicar la diversidad encontrada, se registraron variables relacionadas con la biodiversidad de mariposas frugívoras. Así, se registraron las variables abióticas (temperatura, humedad y velocidad del viento) (Agudelo-Martínez et al., 2018; Fermon et al., 2005; Nogueira et al., 2019), bióticas estructurales del bosque (DAP, cobertura de dosel, número de árboles por transecto) (Bobo et al., 2006; Ramos, 2000), bióticas de recursos alimenticios (densidad de hierbas, densidad de arbustos y abundancia de lianas) (Barlow et al., 2008; Bobo et al., 2006; Ramos, 2000) y hábitat (usos del suelo). Para su registro, en cada réplica se establecieron tres transectos paralelos de 125 m de longitud y distantes 25 m. El transecto medio contenía la línea de TVSR y los otros dos paralelos a cada lado de la línea. A lo largo de los tres transectos se tomaron datos en diferentes momentos del día de las variables mencionadas en 30 puntos aleatorios y espaciados en intervalos regulares de 10 m.
Se registró la temperatura y humedad relativa empleando un termohigrómetro digital de uso comercial (HCO ®, modelo HTC-2), la velocidad del viento con un anemómetro digital (Beneteh ®, modelo GM816), el diámetro a la altura del pecho (DAP) utilizando una cinta diamétrica y el porcentaje de cobertura de dosel usando un densímetro esférico convexo (Forestry Suppliers ®, Inc., Jackson, MS, EE.UU.). Asimismo, la densidad se estimó como el número de árboles por cada transecto, se cuantificó la abundancia de plantas herbáceas y arbustivas en cuadrantes de 1.5 × 1.5 m y el número de árboles del transecto con carga de lianas. Previo al análisis de Beta diversidad el conjunto de datos de abundancia absoluta de las especies de mariposas fue transformado a datos de presencia/ausencia y para los datos ambientales se calculó el valor promedio de cada réplica.
Análisis estadístico: Para evaluar la representatividad del muestreo se realizó una curva de rarefacción con base en cobertura, la cual representa la fracción de las abundancias totales de la comunidad que están representadas, dividido entre el número de individuos observados en la muestra (Hsieh et al., 2016). Se evaluó la diversidad Alfa utilizando datos de abundancia absoluta y empleando el análisis de diversidad verdadera (Hsieh et al., 2016) con base en los números efectivos de especies o número de especies equivalentes (Hill, 1973). La estimación de la diversidad incluyó la riqueza de especies (q0), antilogaritmo del índice de diversidad de Shannon (q1), e inverso del índice de diversidad de Simpson (q2) (Hsieh et al., 2016). Las diferencias entre los usos del suelo se evidenciaron cuando no se traslaparon los intervalos de confianza del 95 % (Hsieh et al., 2016).
Se estimó la diversidad Beta utilizando datos de presencia/ausencia, a partir del cálculo del grado de disimilitud segregado en los componentes de recambio y diferencias en la riqueza o anidamiento con ajuste a Jaccard (bjac = bjtu + bjne) (Baselga & Orme, 2012) entre los usos del suelo estudiados. De igual manera, se empleó una prueba de comparación múltiple ajustada a Bonferroni con el fin de observar las diferencias significativas entre las edades de plantaciones forestales y los tipos de bosques de galería. Asimismo, se compararon las comunidades de mariposas empleando un escalonamiento no métrico multidimensional (NDMS) y con el fin de encontrar afinidades entre especies y las coberturas se identificaron especies indicadoras utilizando el método de valor indicador (Dufrêne & Legendre, 1997).
Para determinar las variables que tienen un efecto significativo sobre la composición de mariposas frugívoras, previo análisis de varianza se utilizó un PERMANOVA donde se incluyeron todas las variables registradas. Todas las estimaciones se implementaron en el software estadístico R (R Core Team, 2018) versión 4.0.2. y sus paquetes anexos vegan (Oksanen et al., 2016), iNEXT (Hsieh et al., 2016), vegetarian (Charney & Record, 2015), labdsv (Roberts, 2007), indicspecies (De Cáceres & Legendre, 2009; De Cáceres et al., 2010; Martín-Regalado, 2019) y betapart (Baselga & Orme, 2012).
Resultados
Diversidad de mariposas frugívoras: Se recolectaron 227 especímenes de mariposas frugívoras pertenecientes a 30 especies, 23 géneros y 5 subfamilias dentro de la familia Nymphalidae (Tabla 1). La mayor cantidad de especies y la mayor abundancia correspondieron a la subfamilia Satyrinae (40.0 y 47.1 %, respectivamente), seguida de Charaxinae (23.4 y 22.9 %, respectivamente). El 35.2 % de individuos se registró en las plantaciones de seis años, mientras que en plantaciones de cuatro años y los dos tipos de bosques de galería la abundancia fue menor (Tabla 1). Taygetis laches (Fabricius, 1793), fue la especie más abundante con 19.4 % de los individuos recolectados, seguida de Zaretis ellops (Ménétriés, 1855) y Catonephele acontius (Linnaeus, 1771) con 11.9 y 11.5 % respectivamente (Apéndice 3).
Tabla 1 Diversidad Alfa de subfamilias de mariposas frugívoras (Nymphalidae) en bosques de galería tipo 1, tipo 2 y plantaciones de Eucalyptus pellita de cuatro y seis años en el municipio de San Martín, Meta (Orinoquía colombiana). Table 1. Alpha diversity of fruit-feeding butterflies subfamilies (Nymphalidae) in gallery forests type 1, type 2 and plantations of Eucalyptus pellita of four- and six-years-old in the municipality of San Martín, Meta (Colombian Orinoco).
| Subfamilia | Plantación 4 años | Plantación 6 años | Bosque galería tipo 1 | Bosque galería tipo 2 | Total Subfamilia |
| Biblidinae | |||||
| Número de individuos | 8 (0.104) | 11 (0.138) | 8 (0.200) | 9 (0.300) | 36 (0.159) |
| Riqueza de especies | 5 (0.227) | 2 (0.087) | 1 (0.083) | 2 (0.167) | 6 (0.200) |
| Charaxinae | |||||
| Número de individuos | 15 (0.195) | 27 (0.338) | 3 (0.075) | 7 (0.223) | 52 (0.229) |
| Riqueza de especies | 6 (0.273) | 6 (0.261) | 3 (0.250) | 4 (0.333) | 7 (0.233) |
| Limenitidinae | |||||
| Número de individuos | 6 (0.078) | 3 (0.038) | - | 2 (0.067) | 11 (0.048) |
| Riqueza de especies | 1 (0.045) | 2 (0.087) | - | 1 (0.083) | 2 (0.067) |
| Nymphalinae | |||||
| Número de individuos | 5 (0.065) | 7 (0.088) | 3 (0.075) | 6 (0.200) | 21 (0.093) |
| Riqueza de especies | 2 (0.091) | 2 (0.087) | 2 (0.167) | 2 (0.167) | 3 (0.100) |
| Satyrinae | |||||
| Número de individuos | 43 (0.558) | 32 (0.400) | 26 (0.650) | 6 (0.200) | 107 (0.471) |
| Riqueza de especies | 8 (0.364) | 11 (0.478) | 6 (0.500) | 3 (0.250) | 12 (0.400) |
| Número total de individuos (N) | 77 (0.339) | 80 (0.352) | 40 (0.176) | 30 (0.132) | 227 |
| Riqueza total de especies (S) | 22 | 23 | 12 | 12 | 30 |
Los valores corresponden a la abundancia absoluta y la riqueza registradas en cada ambiente estudiado. El valor entre paréntesis corresponde a la abundancia y la riqueza en relación con el total para el respectivo tipo de uso del suelo. / The values correspond to the absolute abundance and richness recorded in each environment studied. The value in parentheses corresponds to the abundance and richness in relation to the total of the respective type of land use.
Los muestreos realizados fueron representativos de la diversidad esperada de mariposas en el área de estudio (Apéndice 4). El análisis de completitud evidenció un valor general de 96.4 %. La cobertura del muestreo para las plantaciones de eucalipto de seis años fue de 87.6 %, 84.5 % en plantaciones de cuatro años, 82.7 % para bosques de galería tipo 1 y 87.7 % para bosques de galería tipo 2.
La diversidad de mariposas, expresada en número efectivo de especies (q0, q1 y q2) fue diferente entre los usos del suelo estudiados (Fig. 1). Particularmente, la riqueza de especies (q0) de las plantaciones fue mayor en comparación con la observada en los bosques de galería tipo 2 donde se registró un 60.5 % menos de especies efectivas (Fig. 1A). Igualmente, se observaron diferencias en el número efectivo de especies comunes (q1 antilogaritmo del índice de diversidad de Shannon) entre las plantaciones y los bosques de galería. q1 fue mayor para las plantaciones y en el caso de las de seis años fue 48 % más alta que en bosques de galería tipo 1 (Fig. 1B). El número efectivo de especies ponderado por su abundancia (q2, inverso del índice de Simpson) entre sitios mostro diferencias, q2 fue mayor en plantaciones de eucalipto de seis años y un 53.4 % más baja en los bosques de galería tipo 1 (Fig. 1C).
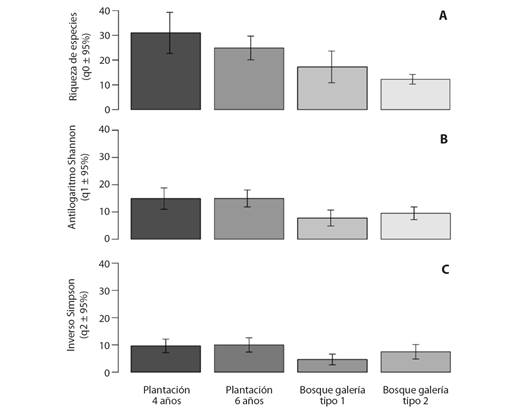
Fig. 1 Número efectivo de especies de mariposas frugívoras (Nymphalidae) en bosques de galería tipo 1, tipo 2 y plantaciones de Eucalyptus pellita de cuatro y seis años en el municipio de San Martín, departamento del Meta, Orinoquía colombiana. (Intervalos de confianza al 95 % no sobrepuestos indican diferencias entre coberturas). A. Riqueza (orden de diversidad q0). B. Antilogaritmo del índice de diversidad de Shannon (orden de diversidad q1). C. Inverso del índice de Simpson (orden de diversidad q2) (Jost, 2006; Jost, 2007; Hsieh et al., 2016). / Fig. 1. Effective number of species of fruit-feeding butterflies (Nymphalidae) in type 1, type 2 gallery forests and four- and six-year-old Eucalyptus pellita plantations in the municipality of San Martín, department of Meta, Colombian Orinoco. (Non-overlapping 95 % confidence intervals indicate differences between coverages). A. Richness (diversity order q0). B. Antilogarithm of Shannon diversity index (diversity order q1). C. Inverse of Simpson’s index (diversity order q2) (Jost, 2006; Jost, 2007; Hsieh et al., 2016).
El análisis de disimilitud segregado en componentes (Baselga & Orme, 2012) mostró una disimilitud total del 67.5 % (bjac = 0.675) entre los cuatro sitios evaluados. La contribución del recambio a esta disimilitud total fue 49.4 % (bjtu = 0.494) y de las diferencias en la riqueza o andamiento de 18.1 % (bjne = 0.181). Se registró una disimilitud total mayor al 60 % entre las plantaciones de seis años y los bosques de galería tipo 1 y 2 y del 58.3 % cuando se compararon los dos tipos de bosques con las plantaciones de cuatro años. Se evidenció una diferencia de 39.3 % entre las dos edades de plantación y de 58.8 % entre los dos tipos de bosques de galería estudiados (Apéndice 5). El mayor valor de recambio se encontró cuando se compararon los dos tipos de bosques de galería (bjtu = 0.588) y de anidamiento cuando se contrastaron las plantaciones de 6 años y el bosque de galería tipo 1 (bjtu = 0.314).
El gráfico de ordenación NDMS evidencia que las plantaciones de eucalipto de seis años y los bosques de galería tipo 2 son las coberturas que muestran la mayor diferencia en la composición de mariposas frugívoras (Fig. 2). Asimismo, se evidencia que Z. ellops, Zaretis itys (Cramer, 1777) y Prepona laertes (Hübner, [1811]) se asocian con las plantaciones de seis años. Hermeuptychia hermes (Fabricius, 1775) y Manataria maculata (Hopffer, 1874) con las plantaciones de cuatro años, C. acontius con los bosques de galería tipo 2 y T. laches con los bosques de galería tipo 1 (Fig. 2).
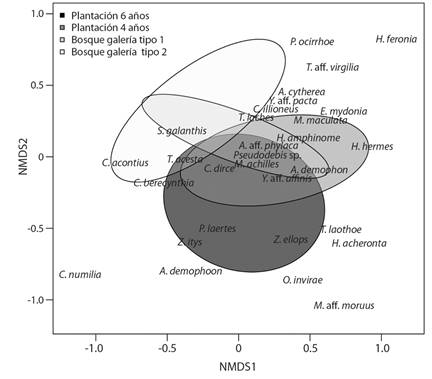
Fig. 2 Escalonamiento métrico no multidimensional (NMDS) de la composición de mariposas frugívoras (Nymphalidae) en bosques de galería y plantaciones de Eucalyptus pellita en el municipio de San Martín, Meta en la Orinoquía colombiana. Las elipses muestran intervalos de confianza del 95 %. / Fig. 2. Non-multidimensional metric scaling (NMDS) of the composition of fruit-feeding butterflies (Nymphalidae) in gallery forests and Eucalyptus pellita plantations in the municipality of San Martín, Meta in the Colombian Orinoco. Ellipses show 95 % confidence intervals.
Las comunidades de mariposas frugívoras fueron diferentes entre los sitios comparados (ANOSIM, R = 0.098, P = 0.036). El análisis de comparación múltiple (Apéndice 6) evidenció diferencias en la diversidad de mariposas frugívoras entre las combinaciones de pares de usos del suelo (plantaciones vs bosques de galería), pero no entre estratos del mismo uso. De las 30 especies observadas 3 mostraron afinidad por los ambientes de las plantaciones y 3 por los bosques naturales (Apéndice 7). En este sentido, los mayores valores de indicación se encontraron para H. hermes en las plantaciones de cuatro años y Z. ellops para las plantaciones de seis años. T. laches para bosques de galería tipo 1 y C. acontius fue indicadora para bosques de galería tipo 2 (Apéndice 7). Es importante señalar que los valores de indicación no superaron el 44.2 %.
Factores ambientales relacionados con la diversidad de mariposas frugívoras: De las diez variables ambientales consideradas, el uso del suelo, el DAP, la cobertura de dosel y densidad de hierbas se relacionaron significativamente con la diversidad y composición de las especies de mariposas frugívoras (Apéndice 8). El uso del suelo explicó un 13.2 % de la variación, seguido de la cobertura de dosel con un 5.4 %, la densidad de hierbas con 5.2 % y el DAP con el 5.0 % (Apéndice 8). Las variables no reflejadas en la tabla presentaron un R-cuadrado marginal (Apéndice 8).
Discusión
Los métodos de muestreo de mariposas frugívoras empleados detectaron mayor número de especies efectivas en las plantaciones forestales que en los relictos de bosque natural circundantes. Lo anterior es contrario a nuestra hipótesis y a los reportes de menor riqueza de especies en plantaciones forestales en escenarios de reforestación (Barbosa et al., 2017; Barlow et al., 2007a; Barlow et al., 2007b, Barlow et al., 2008, Barlow et al., 2012; Nogueira et al., 2019; Norfolk et al., 2017). Así, las plantaciones de eucalipto de cuatro y seis años presentaron aproximadamente un 50 % más de especies efectivas, especies comunes y especies abundantes, y compartieron aproximadamente el 30 % de las especies de mariposas frugívoras presentes en coberturas naturales cercanas. Las diferencias en la composición de las comunidades fueron explicadas por el recambio de especies y la mayor diversidad de las subfamilias Satyrinae y Charaxinae en paisajes de plantación.
Un factor determinante de la diversidad observada en las plantaciones, se atribuye a la mayor diversidad y dominancia de la subfamilia Satyrinae, principalmente en las plantaciones, similar a lo encontrado por Ramos (2000), Barlow et al. (2007b), Barlow et al. (2008), Nogueira et al. (2019) en plantaciones de eucalipto y por Barbosa et al. (2017) en plantaciones de caucho. Este grupo se caracteriza por especies generalistas (sensuBeccaloni et al., 2008) y oportunistas que en etapas larvarias se alimentan de plantas herbáceas principalmente de la familia Poaceae (Beccaloni et al., 2008; Fermon et al., 2005), hierbas altamente dominantes en el sotobosque de las plantaciones, lo cual fue consistente con la densidad de hierbas como variable explicativa de las diferencias observadas entre la diversidad y la composición las comunidades de frugívoras. En este mismo sentido, en otros estudios se ha encontrado que este grupo de mariposas muestra respuestas positivas a las perturbaciones forestales, ya que algunas especies prefieren un sotobosque simplificado como sería el caso de las plantaciones forestales (Norfolk et al., 2017).
Asimismo, la mayor diversidad observada de mariposas frugívoras puede obedecer a que las plantaciones representan un escenario de disturbio intermedio entre las sabanas y los bosques de galería (Connell, 1978). En este sentido, las plantaciones lograron mantener algunos grupos umbrófilos asociados al bosque (e.g. Charaxinae) con algunos heliófilos de zonas abiertas (e.g. Nymphalinae). Esto es un caso diferente a la diversidad observada en áreas que han sufrido deforestación y posterior repoblamiento con monocultivos forestales, en los que se reportan mayores niveles de riqueza de especies en los tratamientos de bosque natural (Barbosa et al., 2017; Barlow et al., 2007a; Barlow et al., 2007b; Barlow et al., 2008; Barlow et al., 2012; Nogueira et al., 2019; Norfolk et al., 2017). En este último escenario, tanto el uso del suelo anterior como el posterior presentaban cobertura de dosel arbóreo y una porción de especies de mariposas frugívoras especialistas de bosques naturales logra tolerar esta perturbación.
Otro argumento para explicar la mayor diversidad de mariposas frugívoras que se observó en las plantaciones de eucalipto y que brinda elementos para apoyar la hipótesis de disturbio intermedio, es la capacidad de las plantaciones para acoger mariposas en tránsito de la matriz de sabana circundante. Aunque en este estudio no se tienen registros de mariposas frugívoras de sabanas colindantes con las plantaciones, en uno de los pocos estudios disponibles se encontró que en sabanas inundables de la Orinoquia se compartieron alrededor del 30 % de las especies (Agudelo-Martínez et al., 2018). Entre las especies típicas de hábitats abiertos y fragmentados registradas se encuentran H. hermes, Hamadryas spp. Hübner, [1806], Historis acheronta (Fabricius, 1775) y Colobura dirce (Linnaeus, 1758), así como los charaxinos Z. ellops y Siderone galanthis (Cramer, 1775) (Agudelo-Martínez et al., 2018). Charaxinae, se compone de mariposas de vuelo potente (Barbosa et al., 2017; Nogueira et al., 2019), por lo que es posible pensar que además de los recursos alimenticios, la morfología de vuelo y la distancia a coberturas naturales puede estar relacionada con ocurrencia de algunas mariposas en las plantaciones forestales (Barlow et al., 2008).
Con relación a lo anterior, H. hermes y Z. ellops fueron especies indicadoras de las plantaciones estudiadas, mientras que la especie H. hermes se reconoce como común en plantaciones forestales (Barbosa et al ., 2017; Nogueira et al., 2019; Ramos, 2000), Z. ellops es representativa en hábitats abiertos como las sabanas (Agudelo-Martínez et al., 2018). Estas observaciones apoyan el argumento del disturbio intermedio mencionada anteriormente y reflejan la plasticidad de algunas especies ante las perturbaciones en el escenario de forestación.
Otra hipótesis que podría explicar la mayor diversidad taxonómica registrada en las plantaciones tiene en cuenta la distribución vertical de las mariposas frugívoras. Se ha encontrado que las comunidades de dosel son más diversas que las comunidades de sotobosque (DeVries et al., 2012; Ribeiro & Freitas, 2012) y que las perturbaciones forestales que simplifican la estructura de la vegetación, alteran la estratificación vertical de estos conjuntos de mariposas (Fermon et al., 2005; Schulze et al., 2001). Este sentido, se ha reportado mayor diversidad en ambientes perturbados, debido a una superposición entre la fauna de sotobosque y dosel (Fermon et al., 2005; Schulze et al., 2004). Para nuestro estudio, en las unidades de plantaciones de eucalipto es posible que se presente este solapamiento, lo que explica que las plantaciones muestren la mayor diversidad de mariposas encontrada y la menor se evidencie en las unidades de bosques de galería donde el tipo de muestreo no alcanzó la comunidad de dosel. Sin embargo, en casos de reforestación en Brasil donde las comunidades de dosel no fueron tenidas en cuenta se evidencia una mayor diversidad en las unidades de bosque natural que en las plantaciones (Barbosa et al., 2017; Nogueira et al., 2019; Ramos, 2000). Esto podría indicar que no en todos los casos de perturbación se presente este solapamiento.
Además de las diferencias en la composición de las comunidades, los resultados también apoyan la hipótesis de que la diversidad de mariposas frugívoras está vinculada con los patrones locales de densidad del sotobosque y estructura del bosque (Barbosa et al., 2017; Barlow et al., 2007b; Barlow et al., 2008; Nogueira et al., 2019; Ramos, 2000). Se encontró que la edad de la plantación (representada en el DAP), la cobertura de dosel, la densidad de hierbas y el tipo de uso del suelo se relacionaron con la riqueza y composición de las especies de mariposas frugívoras en los usos del suelo estudiados. Se puede considerar que factores estructurales del bosque como el DAP y la cobertura de dosel y de recursos alimenticios como la densidad de hierbas son buenos predictores de la diversidad de mariposas frugívoras y pueden actuar como una herramienta para predecir el efecto del cambio de uso del suelo sobre la diversidad. Las comunidades de mariposas también estuvieron fuertemente relacionadas con la vegetación del sotobosque y la estructura del bosque, en estudios realizados en la región amazónica de Brasil, que compararon bosques naturales con plantaciones de eucaliptos (Barlow et al., 2007b; Barlow et al., 2008; Nogueira et al., 2019; Ramos, 2000) y en plantaciones de caucho (Barbosa et al., 2017), con un predominio también de los satirinos.
En este sentido, se podría esperar que una mayor densidad de plantas en el sotobosque y un mayor desarrollo de la estructura forestal debería aumentar el número de especies de mariposas frugívoras en los escenarios de plantaciones. De este modo, las plantaciones con tiempos de residencia más largos y un manejo a favor de mantener las condiciones complejas del sotobosque (manejo de la densidad de hierbas, arbustos y árboles) puede aumentar el valor de conservación de este tipo de proyectos. De esta forma, podrían mejorar el flujo de fauna entre fragmentos de coberturas naturales y servir de hábitat sustituto para algunas especies (Barlow et al., 2008).
Nuestros resultados sugieren que las forestaciones de eucalipto del sitio de estudio pueden proporcionar hábitats funcionales para algunas especies de mariposas frugívoras de remanentes de bosques adyacentes y pueden ser una alternativa con mayor permeabilidad y amortiguación que otros usos del suelo, como el agrícola. Sin embargo, para aumentar la representatividad y la utilidad en bioindicación en la región se requieren estudios a mayor escala. Si bien las plantaciones forestales pueden ser una alternativa de desarrollo socio-económico regional, preferible a otros sistemas de monocultivos, evidentemente no sugerimos que las plantaciones forestales sustituyan las coberturas naturales de sabanas o de bosques naturales, ya que estos no son los hábitats óptimos para muchas especies de fauna incluyendo las mariposas frugívoras.
Esta investigación exploró la diversidad de mariposas frugívoras en el contexto de la forestación de sabanas en la altillanura colombiana, que requiere la comparación con la diversidad propia del uso anterior del suelo, que no fue posible incluir en este estudio. Estudios similares, pero en áreas forestadas en la mata atlántica brasileña reportan niveles de diversidad más altos que los encontrados en este estudio (Barbosa et al., 2017; Barlow et al., 2007b; Barlow et al., 2008; Nogueira et al., 2019; Ramos, 2000). Sin embargo, en sabanas de la Orinoquia colombiana, con el uso de cebo estándar de banano fermentado, un mayor tiempo de muestreo y replicas en época seca y lluviosa, obtuvieron menor riqueza y abundancia similar a las encontradas en este estudio (Agudelo-Martínez et al., 2018).
Es importante resaltar que en futuros estudios un muestreo con mayor número de unidades y tipos de muestreo incluyendo la comunidad de mariposas de dosel en bosques de galería y muestreos en época seca y lluviosa podría aumentar el alcance de los hallazgos de esta investigación. Asimismo, en futuros estudios es recomendable explorar la diversidad taxonómica, y funcional de las mariposas frugívoras en ambientes abiertos de sabanas colindantes con plantaciones forestales y evaluar el impacto una vez realizado la cosecha de las plantaciones. De igual forma, y teniendo en cuenta que los bosques de galería son ambientes con alta presión antrópica es importante evaluar su estado de conservación y la relación con la diversidad asociada. Igualmente, se recomienda ampliar el alcance de este trabajo en mariposas diurnas (Papilionoidea).
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


