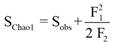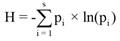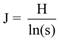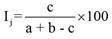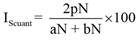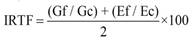Introducción
El desarrollo de programas de restauración ecológica es una prioridad como medida para recuperar los bienes y servicios ambientales de ecosistemas alterados (Young, 2000). Una de las actividades que genera mayor impacto en los ecosistemas naturales es la minería a cielo abierto, pues ocasiona fuertes cambios en la estructura y funcionamiento de dichos sistemas (Alday et al., 2010; Martínez-Ruiz & Fernández-Santos, 2001).
La minería ha alcanzado gran auge en regiones con alta biodiversidad y endemismos, como es el caso del Chocó en Colombia (Rangel-Ch, 2004), donde la minería de oro y platino ha incrementado en los últimos años, haciendo uso de maquinaria pesada y técnicas rudimentarias que dejan a su paso sistemas selváticos fragmentados y una mega-diversidad en riesgo (Lara-Rodríguez et al., 2020). Estos sistemas ecológicos impactados requieren de la aplicación de medidas de restauración ecológica y conservación urgentes (Ramírez-Moreno et al., 2016; Valois-Cuesta & Martínez-Ruiz, 2016). Sin embargo, aplicar estrategias de restauración desconociendo los factores y procesos ecológicos que condicionan la regeneración natural de los sistemas degradados, puede generar impactos negativos tales como el establecimiento de especies invasoras, cambios genéticos en las poblaciones nativas y/o extinciones en poblaciones autóctonas, así como también, la transformación y cambios funcionales en sistemas ecológicos originales (Byrne et al., 2011; Millar et al., 2012).
Los estudios sobre sucesión natural en áreas impactadas por la minería son escasos en regiones tropicales (Díaz & Elcoro 2009), donde la producción de conocimiento se ha enfocado hacia la comprensión de la sucesión en bosques secundarios y campos de cultivo abandonados (Aide et al., 1996; Aide et al., 2000; Chazdon, 2003; DeWalt et al., 2003). La mayoría del conocimiento sobre los factores que condicionan la sucesión natural de áreas alteradas por minería proviene de regiones subtropicales. Muchos de estos trabajos sugieren que el tiempo de abandono (o tiempo transcurrido en sucesión natural), el tamaño del área afectada y su distancia a la comunidad de referencia (fuente de propágulos) son factores clave que ayudan a explicar la revegetación temprana en zonas donde la sucesión primaria es el punto de partida (Mori et al., 2008). Por ejemplo, en ambientes submediterráneos, se ha comprobado que la intensidad con la que especies leñosas colonizan las minas disminuye con la distancia al bosque circundante (Milder et al., 2008), pero algunas especies ven incrementada su densidad en los espacios abiertos (Milder et al., 2013) y también en función de la forma del ecotono (Martínez-Ruiz et al., 2021). La estructura de la comunidad vegetal que se establece en el área minera varía en el tiempo y en el espacio (Matlack, 1994; Newmak, 2001; Saunders et al., 1999), pero este proceso está determinado por interacciones entre el borde del bosque y la nueva mancha de vegetación en las minas (López-Barrera, 2004; López-Barrera et al., 2005), y por el gradiente ambiental generado por la actividad minera desde el bosque hacia los espacios mineros más abiertos (Kapos et al., 1997; Oosterhoorn & Kapelle, 2000; Williams-Linera, 1990). La matriz de bosque adyacente, como fuente de propágulos, determina en parte la composición de especies leñosas colonizadoras (Hardt & Forman, 1989; Milder et al., 2008), pues a menudo no hay un gran banco de semillas abundante en los suelos mineros (González-Alday et al., 2009; Valois-Cuesta et al., 2017); en este contexto, los animales de la matriz forestal juegan un importante papel como dispersores y/o consumidores de semillas (Gómez et al., 2003; López-Barrera et al., 2005; Parmenter et al., 1985).
Considerando lo anterior, surge la siguiente pregunta de investigación ¿Cómo cambia la estructura biológica y composición de la vegetación a través del tiempo y el espacio en áreas impactadas por minería en selvas pluviales tropicales? Al respecto, se hipotetiza que el tiempo de abandono tiene un efecto positivo sobre la intensidad de colonización y condiciona la estructura biológica y composición florística de la comunidad vegetal en las minas, pero dicho efecto no es independiente de la distancia al bosque adyacente, siendo los puntos más alejados del bosque en el seno de las minas menos ricos y diversos. Por lo anterior, el objetivo del presente trabajo fue evaluar el efecto de la edad sucesional y distancia al bosque adyacente (comunidad de referencia sin minería) sobre la estructura biológica y composición de la comunidad vegetal que subyace en minas de oro abandonadas en una selva pluvial tropical de la región del Chocó en Colombia.
Materiales y métodos
Área de estudio: El estudio se realizó en la localidad de Raspadura (5°13’17” N & 76°38’37” W), municipio de Unión Panamericana, Chocó, Colombia. Raspadura pertenece a la Subregión Central Norte del Chocó biogeográfico, la cual se caracteriza por presentar la mayor precipitación de la región (8 000-11 000 mm anuales), una temperatura promedio de 26 °C, humedad relativa mayor al 80 % y su vegetación nativa es propia del bosque pluvial tropical (Poveda-M et al., 2004). El Chocó ocupa el primer lugar en la producción de oro y platino de la República de Colombia (Valois-Cuesta & Martínez-Ruiz, 2016), pero más del 90 % de la minería aurífera en el territorio es ilegal (Lara-Rodríguez et al., 2020). Aunque muchos pobladores del territorio aun practican la minería de manera tradicional, con herramientas de bajo impacto ambiental (minería con batea y almocafre), en la actualidad, la minería de oro a cielo abierto se caracteriza por el uso de retroexcavadoras y motobombas que lavan grandes volúmenes de material que extraen del subsuelo, lo cual deja como resultado la selva nativa fragmentada por paisajes con socavones y extensas áreas cubiertas con montículos de rocas, arena y grava expuestos a la intemperie (Valois-Cuesta & Martínez-Ruiz, 2016) (Fig. 1).

Fig. 1 A. Minería de oro a cielo abierto con maquinaria pesada. B. Paisajes con socavones y montículos de piedra, arena y grava. C. Donde se inicia el proceso de revegetación natural. Imágenes son de un paisaje minero común en Raspadura, Chocó, Colombia. / Fig. 1. A. Open pit gold mining with heavy machinery. B. Landscapes with sinkholes and mounds of stone, sand and gravel. C. where the natural revegetation process begins. Images are of a typical mining landscape in Raspadura, Chocó, Colombia.
Escenarios de estudio y diseño de muestreos: Los muestreos de vegetación se llevaron a cabo en tres minas con distinto tiempo de abandono (o edad de sucesión natural) y en el bosque adyacente que circunda a las minas (comunidad de referencia), de la siguiente manera: entre junio y diciembre de 2012 se realizaron muestreos de vegetación en las tres minas que tenían 6, 10 y 15 años de abandono; luego, entre junio y octubre de 2021 (nueve años después), las minas que en 2012 tenían 10 y 15 años (con 19 y 24 años en 2021) fueron re-muestreadas. Así, se pudo configurar una cronocecuencia de estudio con 6, 10, 15, 19 y 24 años de revegetación natural en las minas y el bosque adyacente como comunidad de referencia.
Las minas escogidas fueron homogéneas en cuanto al tipo de minería e intensidad del disturbio que caracteriza la actividad en la región (Fig. 1). El tiempo de abandono de las minas se determinó a partir de información suministrada por los propietarios de los predios en la comunidad, quienes facilitaron información sobre la historia de uso de la tierra. La matriz de vegetación adyacente (en adelante bosque de referencia) es un bosque natural sin actividad minera (Fig. 1). Los suelos de las minas estudiadas son ácidos y presentan bajo contenido de materia orgánica y alta concentración de aluminio, al compararse con el suelo en bosques de referencia (Quinto & Moreno, 2014; Ramírez-Moreno et al., 2019; Valois-Cuesta & Martínez-Ruiz, 2016).
En cada mina y tiempo de abandono, así como en el bosque de referencia, se establecieron cuatro parcelas de 2 × 50 m (400 m2 en cada escenario de muestreo). Dentro de cada mina y tiempo de abandono, las parcelas fueron distribuidas de manera perpendicular al borde del bosque de referencia, a 50 m y 100 m de distancia (dos parcelas por distancia y tiempo de abandono), tomando como punto de partida el borde bosque-mina (ecotono). Esta misma distribución y punto de partida (borde bosque-mina) fue usada para posicionar cuatro parcelas hacia el interior del bosque de referencia (Fig. 2). Con este diseño, se pretende: 1) homogeneizar el esfuerzo de muestreo entre cada mina y el bosque de referencia tomando dos parcelas a cada distancia en cada ambiente, y 2) evitar posibles errores de estimación en variables de interés debido al efecto de borde, el cual, en ambientes tropicales, se extiende hacia el interior de los parches de bosque un poco menos de 50 m de distancia desde su borde (Harper et al., 2005).
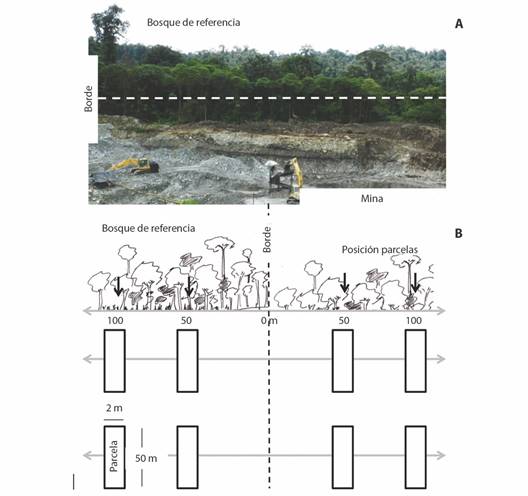
Fig. 2 Diseño de muestreo en las minas con distinta edad de revegetación natural y en el bosque de referencia en Raspadura, Unión Panamericana, Chocó, Colombia. / Fig. 2. Sampling design in mines of different ages of natural revegetation and reference forest in Raspadura, Unión Panamericana, Chocó, Colombia.
En todas las parcelas se registró el número total de individuos de cada especie de planta vascular, tomando nota de su hábito de crecimiento (hierba, arbusto, árbol) y modo de vida (terrestre o epífito). El material vegetal recolectado en las parcelas fue identificado hasta el nivel de especie, haciendo uso de literatura especializada (Gentry, 1996), por confrontación con ejemplares de los herbarios CHOCO (Universidad Tecnológica del Chocó), COL (Universidad Nacional del Colombia) y la colaboración de especialistas. La validez de los nombres científicos se comprobó en la base de datos The plant list (http://www.theplantlist.org). Las muestras recolectadas se herborizaron y depositaron en el Herbario CHOCO y su clasificación se basa en los trabajos del grupo de filogenética de angiospermas (The Angiosperm Phylogeny Group, 2009).
Tratamiento y análisis de los datos: Los datos fueron analizados a nivel de comunidad vegetal, entendiendo por comunidad vegetal cada combinación de los niveles de los factores distancia (50 y 100 m) × tiempo de abandono (6, 10, 15, 19 y 24 años de revegetación) en las minas y de distancia (50 y 100 m) en el bosque de referencia; por tanto, se dispone de datos de dos parcelas de 2 × 50 m (200 m2) por comunidad, i.e. dos réplicas.
En cada comunidad vegetal se estimó la riqueza de especies con el estimador Chao1 (ecuación 1), y la diversidad y equitatividad mediante los índices de Shannon (ecuación 2) y Pielou (ecuación 3), respectivamente (Colwell & Elsensohn, 2013).
(1)
Donde Sobs es el número de especies observadas en la muestra, F1 es el número especies con una sola ocurrencia en la muestra (singletons) y F2 es el número de especies con exactamente dos ocurrencias en la muestra (doubletons). El estimador se basa en que si se está muestreando una comunidad y todavía se están descubriendo especies raras (singletons), es probable que todavía se encuentren más especies; pero si todas las especies de la comunidad se hallan al menos dos veces (dobles), es probable que no se encuentren más especies.
(2)
Donde H es el índice de Shannon-Weaver, s es el número de especies (riqueza de especies), pi proporción de individuos de la especie i respecto al total de individuos.
(3)
Donde J es el índice de Pielou, H es el valor del índice de Shannon-Weaver y s es la riqueza de especies.
El peso ecológico de las especies dentro de cada comunidad fue calculado mediante el Índice de Valor de Importancia Ecológica Simplificado (IVIs). Este índice se calcula sumando la abundancia y frecuencia relativas de una especie de una comunidad, dividido por el sumatorio de las proporciones de todas las especies de esa comunidad y llevado a porcentaje (ecuación 4).
(4)
Donde Asp y Fsp son la abundancia (número total de individuos) y la frecuencia (número total de parcelas) respectivamente de una especie en una comunidad, Aspp y Fspp son las sumatorias de las abundancias y frecuencias respectivamente de todas las especies de esa comunidad (Mueller-Dombois & Ellenberg, 1974).
Para determinar el grado de semejanza florística entre las comunidades vegetales, se calcularon los índices de diversidad beta de Jaccard (ecuación 5) y Sorensen (ecuación 6) (Colwell & Elsensohn, 2013; Magurran, 2004; Magurran & McGill, 2011).
(5)
Donde Ij es el índice de Jaccard, a y b indican el número de especies en las comunidades A y B, y c indica el número de especies compartidas entre A y B.
(6)
Donde IScuant es el índice de Sorensen cuantitativo para datos de abundancia, aN es el número total de individuos en el sitio A, bN es el número total de individuos en la comunidad B y pN es la sumatoria de la abundancia más baja de cada una de las especies compartidas entre A y B.
Para este trabajo ambos índices (Jaccard y Sorensen) son expresados en porcentaje, por lo tanto, valores cercanos a 100 indican composiciones florísticas semejantes mientras que valores cercanos a 0 indican falta de semejanza. De manera complementaria a los índices, para determinar diferencias estadísticamente significativas entre comunidades en la composición de especies se usó una prueba Binomial sobre la base del número de especies comunes. Para esta prueba se estableció como límite de rechazo de la hipótesis alternativa el 0.5, con un intervalo de confianza del 95 %, es decir, que composiciones florísticas con una probabilidad de similitud por debajo del 50 % resultan, desde el punto de vista estadístico, significativamente disímiles (P < 0.05).
Finalmente, para explorar diferencias entre comunidades vegetales en la representatividad taxonómica a nivel de familias, se propone el Índice de Representatividad Taxonómica para Familias (IRTF), para las diez familias más comunes de cada comunidad vegetal. Este índice se calculó sumando los valores relativos del número de géneros y especies de una determinada familia en relación con el número total de géneros y especies de la comunidad a la cual pertenece, dividido por la sumatoria de las proporciones calculadas para todas las familias de esa comunidad y llevado a porcentaje (ecuación 7).
(7)
Donde Gf es el número de géneros de una determinada familia, Gc es número de géneros de la comunidad, Ef es el número de especies de esa familia y Ec es el número de especies en esa misma comunidad.
La estimación de la riqueza de especies y los índices de diversidad se calculó con el programa Estimates versión 9 (Colwell & Elsensohn, 2013) y las pruebas estadísticas se realizaron en el entorno de programación R (R Core Team, 2012).
Resultados
Cambios en la estructura biológica de la comunidad vegetal: A partir de los inventarios de vegetación realizados en las minas con distintos tiempos de revegetación natural y el bosque de referencia, se identificaron 300 especies (90 en las minas y 231 en el bosque de referencia; de las cuales, 21 fueron comunes en ambos sistemas) pertenecientes a 193 géneros y 75 familias. La mayoría de las especies en las minas fueron herbáceas (65.5 %) mientras que en el bosque de referencia estuvo representado por especies arbóreas (48 %) (Apéndice 1).
Al comparar la riqueza de especies observada con la riqueza estimada (Chao 1) en cada mina (6, 10, 15, 19 y 24 años) y el bosque de referencia, se pudo apreciar que el esfuerzo de muestreo fue representativo, pues se pudo registrar entre el 88.1 y 95.7 % de las especies de las minas y el 87.5 % de las especies del bosque de referencia (Tabla 1).
Tabla 1 Estructura biológica de las comunidades vegetales ubicadas a 50 y 100 m de distancia desde el ecotono, en minas con 6, 10, 15, 19 y 24 años de revegetación natural y bosque de referencia en Raspadura, Unión Panamericana, Chocó, Colombia. / Table 1. Biological structure of plant communities located 50 and 100 m away from the ecotone, in mines with 6, 10, 15, 19 and 24 years of natural revegetation and reference forest in Raspadura, Unión Panamericana, Chocó, Colombia.
| Ambiente | Distancia (m) | Área (m2) | Densidad | Riqueza | Diversidad Shannon | Equitatividad Pielou | ||||||||
| Individuos | (%) | Familias | (%) | Géneros | (%) | Especies | (%) | Chao1 | (%) | |||||
| Mina 6 años | 50 | 200 | 2 084 | 53.5 | 14 | 60.9 | 30 | 69.8 | 40 | 75.5 | 42 | 95.2 | 2.6 | 0.72 |
| 100 | 200 | 1 813 | 46.5 | 20 | 87.0 | 36 | 83.7 | 39 | 73.6 | 44 | 88.6 | 2.6 | 0.72 | |
| Total | 400 | 3 897 | 11.9 | 23 | 30.7 | 43 | 22.3 | 53 | 17.7 | 60 | 88.3 | 2.4 | 0.72 | |
| Mina 10 años | 50 | 200 | 2 812 | 48.9 | 21 | 91.3 | 39 | 86.7 | 48 | 81.4 | 57 | 84.2 | 2.6 | 0.66 |
| 100 | 200 | 2 935 | 51.1 | 16 | 69.6 | 29 | 64.4 | 38 | 64.4 | 45 | 84.4 | 2.6 | 0.72 | |
| Total | 400 | 5 747 | 17.6 | 23 | 30.7 | 45 | 23.3 | 59 | 19.7 | 67 | 88.1 | 2.7 | 0.66 | |
| Mina 15 años | 50 | 200 | 3 715 | 68.8 | 21 | 100 | 45 | 90.0 | 57 | 85.1 | 66 | 86.4 | 2.8 | 0.71 |
| 100 | 200 | 1 682 | 31.2 | 15 | 71.4 | 36 | 72.0 | 44 | 65.7 | 53 | 83.0 | 2.1 | 0.57 | |
| Total | 400 | 5 397 | 16.5 | 21 | 28.0 | 50 | 25.9 | 67 | 22.3 | 79 | 84.8 | 2.8 | 0.67 | |
| Mina 19 años | 50 | 200 | 3 923 | 52.4 | 25 | 92.6 | 47 | 88.7 | 65 | 85.5 | 69 | 94.2 | 2.7 | 0.68 |
| 100 | 200 | 3 564 | 47.6 | 19 | 70.4 | 42 | 79.2 | 63 | 82.9 | 75 | 84.0 | 2.6 | 0.74 | |
| Total | 400 | 7 487 | 22.9 | 27 | 36.0 | 53 | 27.5 | 76 | 25.3 | 82 | 92.7 | 2.8 | 0.73 | |
| Mina 24 años | 50 | 200 | 3 958 | 50.8 | 28 | 96.6 | 49 | 89.1 | 76 | 86.4 | 81 | 93.8 | 2.9 | 0.75 |
| 100 | 200 | 3 832 | 49.2 | 23 | 79.3 | 47 | 85.5 | 71 | 80.7 | 78 | 91.0 | 2.8 | 0.73 | |
| Total | 400 | 7 790 | 23.8 | 29 | 38.7 | 55 | 28.5 | 88 | 29.3 | 92 | 95.7 | 2.9 | 0.74 | |
| Bosque de referencia | 50 | 200 | 1 359 | 57.0 | 48 | 72.7 | 98 | 64.1 | 138 | 59.7 | 140 | 98.6 | 4.1 | 0.84 |
| 100 | 200 | 1 027 | 43.0 | 59 | 89.4 | 129 | 84.3 | 193 | 83.5 | 278 | 69.4 | 4.6 | 0.87 | |
| Total | 400 | 2 386 | 7.30 | 66 | 88.0 | 153 | 79.3 | 231 | 77.0 | 264 | 87.5 | 4.5 | 0.83 | |
| Ambientes | Global | 2 400 | 32 704 | 75 | 193 | 300 | ||||||||
Los porcentajes entre distancias se calcularon a partir del total y los porcentajes totales a partir del valor global. / Percentages between distances were calculated from the total and total percentages from the global value.
El número de individuos varió con el tiempo de abandono de las minas y respecto al bosque de referencia (Tabla 1); la densidad de individuos fue máxima en las comunidades de las minas con mayor tiempo de regeneración (19 y 24 años) y mínima en el bosque de referencia. El número de familias, géneros y especies, así como la diversidad y equitatividad parecen incrementar lentamente con el tiempo de revegetación de las minas, pero presentan sus valores máximos en el bosque de referencia (Tabla 1).
La distancia desde el borde bosque-mina afecta la densidad de individuos, ya que comunidades ubicadas, tanto en la mina como en el bosque de referencia, a 50 m de distancia respecto del borde bosque-mina, presentaron mayor número de individuos que aquellas ubicadas a 100 m. Por el contrario, el número de familias, géneros y especies en las minas no varió con la distancia al borde bosque-mina, mientras que en el bosque de referencia estas variables fueron significativamente mayores en la comunidad a 100 m del borde. La diversidad y equitatividad variaron poco entre comunidades ubicadas a 50 y 100 m en las minas con menor tiempo de revegetación (6 y 10 años), pero estas diferencias se hicieron más amplias en las minas de revegetación más tardía (15, 19 y 24 años) y en el bosque de referencia, mostrando tendencias opuestas: mayor diversidad y equitatividad a 50 m en la mina de 15, 19 y 24 años y a 100 m en el bosque de referencia (Tabla 1).
Cambios en la composición florística: Los índices de diversidad beta de Jaccard y Sorensen indicaron alta semejanza florística entre las comunidades de las minas y entre el conjunto de comunidades del bosque de referencia, pero baja semejanza entre las comunidades de estos dos ambientes (minas de distinto tiempo de revegetación vs bosque de referencia) (Tabla 2). Al respecto, el recambio de especies (número de especies comunes) entre las comunidades en las minas fue de 26.6-65.9 % y entre las comunidades en el bosque de referencia fue de 43.3 %. Sin embargo, al comparar los inventarios de las minas con el bosque de referencia, los porcentajes de especies comunes son muy inferiores en todas las posibles combinaciones (1.72-8.63 %), indicando diferencias estadísticamente significativas en composición florísticas entre estos dos ambientes, independiente del tiempo de revegetación de las minas (Tabla 2).
Tabla 2 Semejanza florística entre comunidades ubicadas a 50 y 100 m de distancia desde el borde mina-bosque, en minas de 6, 10, 15, 19 y 24 años de revegetación natural y bosque de referencia en Raspadura, Unión Panamericana, Chocó, Colombia. / Table 2. Floristic similarity between communities located 50 and 100 m of distance to the mine-forest edge, in mines with 6, 10, 15, 19 and 24 years of natural revegetation and reference forest in Raspadura, Unión Panamericana, Chocó, Colombia
| Comunidad vegetal 1 | Comunidad vegetal 2 | Riqueza de especies | Diversidad beta | Prueba Binomial | P | ||||||
| Tiempo de abandono (años) | Distancia desde el borde (m) | Tiempo de abandono (años) | Distancia desde el borde (m) | Total | Compartida | Jaccard | Sorensen | ||||
| Mina 6 años | 50 | Mina 6 años | 100 | 53 | 26 | 49.1 | 65.8 | 0.49 | 0.50 | ||
| Mina 10 años | 50 | 64 | 24 | 37.5 | 54.5 | 0.37 | 0.02 | ||||
| 100 | 54 | 24 | 44.4 | 61.5 | 0.44 | 0.24 | |||||
| Mina 15 años | 50 | 66 | 31 | 47.0 | 63.9 | 0.46 | 0.35 | ||||
| 100 | 56 | 28 | 50.0 | 66.7 | 0.50 | 0.55 | |||||
| Mina 19 años | 50 | 73 | 32 | 43.8 | 61.0 | 0.43 | 0.17 | ||||
| 100 | 68 | 35 | 51.5 | 68.0 | 0.51 | 0.60 | |||||
| Mina 24 años | 50 | 79 | 37 | 46.8 | 63.8 | 0.46 | 0.32 | ||||
| 100 | 75 | 36 | 48.0 | 64.9 | 0.48 | 0.40 | |||||
| Bosque | 50 | 172 | 6 | 3.49 | 6.74 | 0.03 | < 0.0001 | ||||
| 100 | 229 | 4 | 1.75 | 3.43 | 0.01 | < 0.0001 | |||||
| 100 | Mina 10 años | 50 | 62 | 25 | 40.3 | 57.5 | 0.40 | 0.08 | |||
| 100 | 54 | 23 | 42.6 | 59.7 | 0.42 | 0.17 | |||||
| Mina 15 años | 50 | 64 | 32 | 50.0 | 66.7 | 0.50 | 0.54 | ||||
| 100 | 59 | 24 | 40.7 | 57.8 | 0.40 | 0.09 | |||||
| Mina 19 años | 50 | 74 | 30 | 40.5 | 57.7 | 0.40 | 0.06 | ||||
| 100 | 68 | 34 | 50.0 | 66.7 | 0.50 | 0.54 | |||||
| Mina 24 años | 50 | 82 | 33 | 40.2 | 57.4 | 0.40 | 0.04 | ||||
| 100 | 78 | 32 | 41.0 | 58.2 | 0.41 | 0.07 | |||||
| Bosque | 50 | 168 | 9 | 5.36 | 10.2 | 0.05 | < 0.0001 | ||||
| 100 | 228 | 4 | 1.75 | 3.45 | 0.01 | < 0.0001 | |||||
| Mina 10 años | 50 | Mina 10 años | 100 | 59 | 27 | 45.8 | 62.8 | 0.45 | 0.30 | ||
| Mina 15 años | 50 | 75 | 30 | 40.0 | 57.1 | 0.40 | 0.05 | ||||
| 100 | 66 | 26 | 39.4 | 56.5 | 0.39 | 0.05 | |||||
| Mina 19 años | 50 | 74 | 39 | 52.7 | 69.0 | 0.52 | 0.71 | ||||
| 100 | 87 | 24 | 27.6 | 43.2 | 0.27 | < 0.0001 | |||||
| Mina 24 años | 50 | 89 | 35 | 39.3 | 56.5 | 0.39 | 0.02 | ||||
| 100 | 85 | 34 | 40.0 | 57.1 | 0.40 | 0.04 | |||||
| Bosque | 50 | 171 | 15 | 8.77 | 16.1 | 0.08 | < 0.0001 | ||||
| 100 | 230 | 11 | 4.78 | 9.13 | 0.04 | < 0.0001 | |||||
| 100 | Mina 15 años | 50 | 67 | 28 | 41.8 | 58.9 | 0.41 | 0.11 | |||
| 100 | 58 | 24 | 41.4 | 58.5 | 0.41 | 0.11 | |||||
| Mina 19 años | 50 | 72 | 31 | 43.1 | 60.2 | 0.43 | 0.14 | ||||
| 100 | 73 | 28 | 38.4 | 55.4 | 0.38 | 0.03 | |||||
| Mina 24 años | 50 | 85 | 29 | 34.1 | 50.9 | 0.34 | 0.002 | ||||
| 100 | 83 | 26 | 31.3 | 47.7 | 0.31 | 0.0004 | |||||
| Bosque | 50 | 167 | 9 | 5.39 | 10.2 | 0.05 | < 0.0001 | ||||
| 100 | 225 | 6 | 2.67 | 5.19 | 0.02 | < 0.0001 | |||||
| Mina 15 años | 50 | Mina 15 años | 100 | 67 | 34 | 50.7 | 67.3 | 0.50 | 0.59 | ||
| Mina 19 años | 50 | 84 | 38 | 45.2 | 62.3 | 0.45 | 0.22 | ||||
| 100 | 79 | 41 | 51.9 | 68.3 | 0.51 | 0.67 | |||||
| Mina 24 años | 50 | 85 | 48 | 56.5 | 72.2 | 0.56 | 0.90 | ||||
| 100 | 88 | 40 | 45.5 | 62.5 | 0.45 | 0.22 | |||||
| Bosque | 50 | 181 | 14 | 7.73 | 14.4 | 0.07 | < 0.0001 | ||||
| 100 | 240 | 10 | 4.17 | 8.00 | 0.04 | < 0.0001 | |||||
| 100 | Mina 19 años | 50 | 76 | 33 | 43.4 | 60.6 | 0.43 | 0.15 | |||
| 100 | 82 | 25 | 30.5 | 46.7 | 0.30 | 0.0002 | |||||
| Mina 24 años | 50 | 84 | 36 | 42.9 | 60.0 | 0.42 | 0.11 | ||||
| 100 | 87 | 28 | 32.2 | 48.7 | 0.32 | 0.0005 | |||||
| Bosque | 50 | 174 | 8 | 4.60 | 8.79 | 0.04 | < 0.0001 | ||||
| 100 | 233 | 4 | 1.72 | 3.38 | 0.01 | < 0.0001 | |||||
| Mina 19 años | 50 | Mina 19 años | 100 | 86 | 42 | 48.8 | 65.6 | 0.48 | 0.45 | ||
| Mina 24 años | 50 | 89 | 52 | 58.4 | 73.8 | 0.58 | 0.95 | ||||
| 100 | 82 | 54 | 65.9 | 79.4 | 0.65 | 0.99 | |||||
| Bosque | 50 | 196 | 7 | 3.57 | 6.90 | 0.03 | < 0.0001 | ||||
| 100 | 243 | 15 | 6.17 | 11.6 | 0.06 | < 0.0001 | |||||
| Mina 19 años | 100 | Mina 24 años | 50 | 89 | 50 | 56.2 | 71.9 | 0.56 | 0.89 | ||
| 100 | 87 | 47 | 54.0 | 70.1 | 0.54 | 0.80 | |||||
| Bosque | 50 | 187 | 14 | 7.49 | 13.9 | 0.07 | < 0.0001 | ||||
| 100 | 245 | 11 | 4.49 | 8.59 | 0.04 | < 0.0001 | |||||
| Mina 24 años | 50 | Mina 24 años | 100 | 90 | 57 | 63.3 | 77.6 | 0.63 | 0.99 | ||
| Bosque | 50 | 197 | 17 | 8.63 | 15.9 | 0.08 | < 0.0001 | ||||
| 100 | 253 | 16 | 6.32 | 11.9 | 0.06 | < 0.0001 | |||||
| Mina 24 años | 100 | Bosque | 50 | 195 | 14 | 7.18 | 13.4 | 0.07 | < 0.0001 | ||
| 100 | 252 | 12 | 4.76 | 9.09 | 0.04 | < 0.0001 | |||||
| Bosque de referencia | 50 | Bosque | 100 | 231 | 100 | 43.3 | 60.4 | 0.43 | 0.024 | ||
La composición florística (considerando las diez especies con mayor índice de valor de importancia en cada ambiente) en el bosque de referencia se caracterizó por la presencia de especies arbóreas, arbustivas y epífitas como Ossaea bracteata Triana, Ossaea spicata Gleason, Psychotria longicuspis Müll. Arg., Tococa guianensis Aubl., Dieffenbachia plowmanii Croat, Dicranopygium cuatrecasanum Harling., Palicourea seemannii Standl., Anthurium lancea Sodiro, Psychotria poeppigiana Mull. Arg., Qualea lineata Stafleu. Por su parte, la composición florística en el conjunto de minas estuvo representada principalmente por especies herbáceas como Lycopodiella cernua (L.) Pic., Serm., Sticherus bifidus (Willd.) Ching, Rhynchospora tenerrima Nees ex Spreng, Cyperus luzulae (L.) Retz., Clidemia sericea D. Don, Hypolepis repens (L.) C. Presl, Eleocharis interstincta (Vahl) Roem. & Schult., Andropogon bicornis L., Sauvagesia erecta L., Xyris jupicai Rich. Las especies arbóreas Cespedesia spathulata (Ruiz & Pavon) Planch y Miconia reducens Triana están bien representadas tanto en el bosque de referencia como en las minas, especialmente en la zona de borde bosque-mina (Apéndice 1).
Al analizar las diez familias de plantas más comunes tanto en las minas como en el bosque de referencia, se observaron diferencias en la identidad y representatividad taxonómica (número de géneros y especies) entre las comunidades de las minas y las del bosque de referencia, más que dentro de las comunidades de las minas. Las familias con mayor representatividad taxonómica en las minas fueron: Cyperaceae, Melastomataceae, Poaceae y Rubiaceae, mientras que en el bosque de referencia fueron también Melastomataceae y Rubiaceae, junto con Araceae, Fabaceae y Burseracea (Fig. 3).
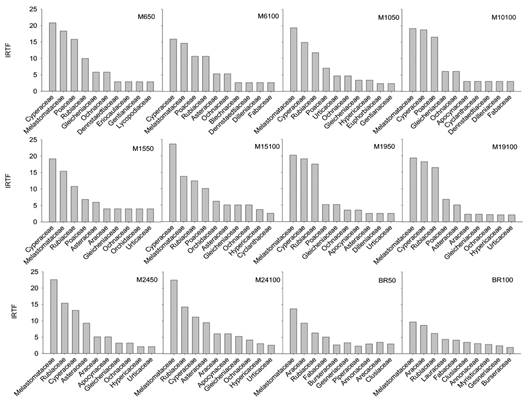
Fig. 3 Representatividad (IRTF %) de las diez familias más comunes encontradas a 50 y 100 m de distancia desde el borde bosque-mina, en minas (M) de distinto tiempo de revegetación natural (6, 10, 15, 19, 24 años) y bosque de referencia (BR) en Raspadura, Unión Panamericana, Chocó, Colombia. / Fig. 3. Representativeness (IRTF %) of the ten most common families found at 50 and 100 m of distance to the mine-forest edge, in mines (M) of different time of natural revegetation (6, 10, 15, 19, 24 years) and reference forest (BR) in Raspadura, Unión Panamericana, Chocó, Colombia.
Discusión
Cambios en la estructura biológica de la comunidad vegetal: La densidad de individuos es mayor en las minas que en el bosque de referencia, al contrario, la riqueza taxonómica (n° familias, géneros y especies), la diversidad y la equitatividad tienden a aumentar lentamente tras 24 años de abandono de las minas, pero son mayores en el bosque de referencia. Los cambios observados en la densidad de individuos pueden deberse a que los sitios alterados, durante la sucesión temprana, son colonizados inicialmente por especies de rápido crecimiento y de amplia dispersión (estrategia reproductiva r), pero con el tiempo de abandono, esta comunidad se va remplazando por especies más competitivas (estrategia reproductiva k), lo que genera un aumento de la diversidad y otros atributos estructurales de la comunidad vegetal con el tiempo (Sabattini & Sabattini, 2018). Esta tendencia se ha observado en otras regiones tropicales y subtropicales donde se han estudiado procesos de sucesión natural, aunque no siempre tras minería o condiciones de alta pluviosidad. Al respecto, DeWalt et al. (2003), al estudiar varios bosques secundarios en Barro Colorado (Panamá), encontraron que la densidad de árboles decayó con el tiempo de abandono, mientras que en Bolivia se observaron incrementos en la diversidad al aumentar la edad de los rodales (Peña-Claros, 2003). También, en ambientes muy distintos al estudiado, se encuentran tendencias similares en la diversidad durante la sucesión. Así, Titlyanova y Mironycheva-Tokareva (1990) encuentran, en una mina de carbón en Siberia, que la riqueza y diversidad de especies no variaron significativamente en los primeros estadios sucesionales (entre 2 y 25 años de abandono), pero sí entre éstos y la comunidad de referencia, tendiendo a aumentar con el tiempo, es decir, hacia las etapas más avanzadas de la sucesión. De manera similar, la riqueza y la diversidad aumentan con el tiempo de abandono en áreas agrícolas del bosque seco tropical, pero tras 50 años de abandono, esas áreas no alcanzan los valores superiores registrados en el bosque de referencia (Guerra-Martínez et al., 2021). Por el contrario, en minas de uranio (Martínez-Ruiz et al., 2001; Martínez-Ruiz & Fernández-Santos, 2005) y de carbón (Alday et al., 2011) en España, bajo clima Mediterráneo, la diversidad aumenta rápidamente durante la sucesión temprana (5-12 años) hasta valores máximos, similares a los de las comunidades de referencia (Martínez-Ruiz et al., 2001) o incluso más altos, y luego disminuye (Alday et al., 2011).
Asimismo, en bosques tropicales secundarios de Australia afectados por deforestación intensiva, se evidenció una fuerte influencia del tiempo de abandono sobre la diversidad de especies (Goosem et al., 2016). Está claro que al comparar tendencias de diversidad durante la sucesión no sólo debe considerarse el tipo de ambiente sino también la naturaleza de la actividad minera realizada, ya que pueden conllevar diferente grado de deterioro del suelo y por ello diferente trayectoria sucesional (Prach & Walker, 2019). Además de la riqueza y la diversidad de especies, otros atributos de la vegetación también parecen ser favorecidos por el tiempo de abandono de las áreas alteradas, encontrándose por ejemplo incrementos significativos de la cobertura vegetal conforme aumenta el tiempo de abandono (Goosem et al., 2016).
De manera general, se acepta que la colonización de especies, su crecimiento y la dinámica sucesional son procesos que están condicionados por el clima y la calidad del sustrato (Prach & Walker, 2019; Walker et al., 2003). Varios trabajos han demostrado que propiedades del suelo, tales como la biomasa microbiana, la actividad biológica, el contenido de materia orgánica y nutrientes, incrementan sus cantidades o mejoran su disponibilidad conforme aumenta el tiempo tras el cese de la alteración (Bardgett et al., 2005; De Kovel et al., 2000; Ramírez-Moreno et al., 2019; Wang et al., 2011). Dado que las comunidades vegetales estudiadas aquí (minas de distintos tiempos de abandono y bosque de referencia) están sometidas a las mismas condiciones climáticas (Poveda-M et al., 2004), es posible pensar que los pequeños cambios observados en la diversidad y en sus componentes se deban en gran medida al poco desarrollo del suelo en las minas tras la alteración, debido a la fuerte alteración biogeoquímica que el proceso extractivo genera sobre el suelo (Ramírez-Moreno et al., 2019), si se compara la calidad del suelo en las minas con el del bosque de referencia circundante donde la calidad del sustrato es mejor (Quinto & Moreno, 2014).
La calidad del sustrato tiene un efecto positivo sobre el restablecimiento de la vegetación en zonas alteradas (Prach & Walker 2019; Walker & del Moral, 2003). Sin embargo, es claro que otros factores, como los mecanismos de dispersión de las especies (Alday et al., 2011), la disponibilidad de un banco de semillas (Valois-Cuesta et al., 2017), la depredación post-dispersiva (Pérez-Ramos et al., 2012) o las interacciones planta-planta del tipo inhibición, competencia y/o facilitación (Alday et al., 2016), entre otros, también cumplen un papel regulador durante la revegetación natural temprana de zonas mineras abandonadas. Al respecto, algunas aproximaciones experimentales han demostrado que la introducción o eliminación de algunas especies de plantas (por ejemplo: especies nodriza, fijadoras de nitrógeno o promotoras de la actividad biológica del suelo) pueden limitar, favorecer o cambiar la trayectoria de la revegetación natural de áreas degradadas hacia la comunidad de referencia (John et al., 2012; Stinca et al., 2015; Walker et al., 2003).
Independiente del tipo de sistema estudiado (minas de diferentes tiempos de abandono o bosque de referencia), las áreas más cercanas a la zona de borde bosque-mina mostraron mayor densidad de individuos (mayor dominancia). Por su parte, la riqueza y diversidad de especies apenas variaron con la distancia en las minas de distintos tiempos de abandono, pero tomaron valores más altos en el bosque de referencia. Desde el punto de vista de la revegetación natural de las minas abandonadas, este resultado sugiere que la zona de transición bosque-mina (borde) cumple un papel regulador en la expansión de algunos (no todos) elementos florísticos del bosque de referencia hacia las minas. En esta zona de transición se generan condiciones ambientales y ecológicas particulares (p.e. hay más iluminación en el borde que en el interior del bosque) (Harper et al., 2005) que facilitan el establecimiento y propagación de algunas especies pioneras heliófitas que logran sobrevivir en el área próxima al borde del bosque de referencia (Forero & Finegan, 2002). Esto puede explicar el hecho de haber encontrado menor riqueza y diversidad de especies en el bosque de referencia a 50 m de distancia del borde bosque-mina (Tabla 1), y alta importancia ecológica (IVIs) de pocas especies leñosas como C. spathulata y M. reducens a esa misma distancia (50 m), tanto en el interior del bosque de referencia como de las minas (Apéndice 1).
El establecimiento natural de la vegetación en zonas donde la sucesión primaria es el punto de partida (minas, taludes de carretera, etc.) es lento, pero puede acelerarse si existe una fuente de propágulos cercana en parches de vegetación remanentes (Martín-Sanz et al., 2015). Aunque en este estudio la distancia al bosque de referencia no parece tener un efecto evidente sobre la riqueza y diversidad vegetal de las minas tras 24 años de abandono, otros trabajos desarrollados en áreas alteradas por causas antropológicas han mostrado tendencias diferentes. Por ejemplo, Goosem et al. (2016), evidenciaron que la riqueza de especies tiende a ser mayor en las áreas cercanas al bosque. Asimismo, Helsen et al. (2013), concluyeron que los cambios en diversidad vegetal en las áreas alteradas con respecto a la distancia al bosque adyacente están determinados por el tipo de especie de planta, puesto que las especies especialistas propias del bosque maduro disminuyen su representatividad con la distancia a éste; mientras que, las especies generalistas la aumentan en ese sentido (Helsen et al., 2013). Al respecto, Turner et al. (1998) encontraron que el tamaño del disturbio es un factor condicionante de la sucesión vegetal; pues si el área alterada es grande, puede cambiar drásticamente las condiciones microclimáticas del sitio y generar ambientes extremos que limitan la colonización y sobrevivencia de especies dentro del área alterada y, por lo tanto, se reduzca o se elimine la diversidad de especies con potencial para la revegetación temprana (Turner et al., 1998).
Tras 24 años de sucesión natural, las áreas afectadas por minería son colonizadas principalmente por especies herbáceas pioneras tolerantes a alta iluminación, altas temperaturas superficiales y sustratos pobres en nutrientes (Valois-Cuesta & Martínez-Ruiz, 2017), las cuales desarrollan altas abundancias en el seno de las minas (por ejemplo: A. bicornis, A. berteroniana, C. spathulata, C. alatus, C. hirta, C. luzulae, C. sphacelatus, D. flexuosa, D. capitatum, E. interstincta, E. acutangula, E. filiculmis, F. umbellata, H. repens, L. granatensis, L. cernua, M. calvescens, M. reducens, P. calomelanos, R. tenerrima, S. erecta, S. bifidus y X. jupicai). Como resultado, en las minas se configuran comunidades vegetales menos estructuradas en términos de riqueza, diversidad y equitatividad, si se comparan con el bosque de referencia (Tabla 1). Por ejemplo, en la mina de 6 años de revegetación, 62.3 % de los individuos registrados a 50 m desde el borde bosque-mina pertenecían a cinco (12.5 %) de las 40 especies registradas en esa mina y distancia (C. luzulae, H. repens, L. cernua, P. calomelanos y X. jupicai), todas reportadas como especies colonizadoras o pioneras (Valois-Cuesta & Martínez-Ruiz, 2017). Esta condición puede variar durante la sucesión natural, ya que las especies más dominantes cambian paulatinamente su representatividad ecológica, dando cabida a otras especies que se ven favorecidas por dichos cambios pudiendo establecerse dentro del sistema (Martín-Sanz et al., 2015).
Cambios en la composición florística: La semejanza florística fue alta entre las comunidades de las minas, pero fue mínima al comparar las minas con el bosque de referencia en todas las posibles combinaciones (Tabla 2). Esta tendencia se ha observado en otros bosques neotropicales, donde la semejanza florística aumenta con el tiempo de abandono, siendo mucho mayor en el bosque de referencia que en las áreas en recuperación (DeWalt et al., 2003). El hecho de que las comunidades de las minas y las del bosque de referencia difieran ampliamente en composición florística (solo un 7 % de la vegetación registrada en el bosque de referencia se encontró en las minas) sugiere que la vegetación que se establece en las minas durante los primeros 24 años de revegetación natural no proviene en gran medida de la matriz de bosque adyacente. Entonces ¿Cuál es la fuente principal de propágulos de las minas durante las etapas tempranas de revegetación natural? Esta pregunta puede responderse al analizar las comunidades estudiadas desde el punto de vista del IRTF para las familias más comunes (Fig. 3). Por ejemplo, al comparar las composiciones de las familias Melastomataceae y Rubiaceae, dos grupos indicadores de diversidad (Valois-Cuesta et al., 2016), en minas y bosque, se aprecia que las especies que crecen en las minas son diferentes, en alto porcentaje, a las halladas en el bosque de referencia, pues sólo 11.1 % (cuatro especies) de las melastomatáceas registradas (36) fueron comunes a los dos sistemas, un patrón similar fue observado en rubiáceas, con cuatro especies comunes (18.0 %) de 22 registradas (Apéndice 1), lo cual demuestra la existencia de amplias diferencias florísticas incluso a nivel de grupos taxonómicos comunes. Adicionalmente, una revisión de las colecciones de Melastomataceae y Rubiaceae en la base de datos Trópico del Missouri Botanical Garden (http://www.tropicos.org), reveló que la mayoría de las especies de Melastomataceae encontradas en las minas también se han recolectado en bordes y taludes de carreteras, en zonas de deslizamientos de tierra, y en zonas de cultivo o pastoreo abandonadas, mientras que las especies de esta misma familia registradas en el bosque de referencia son reportadas en bosques primarios o secundarios. Lo anterior sugiere que las diferencias en composición florística entre las minas y el bosque de referencia es el resultado de una colonización más eficiente de especies pioneras nativas o naturalizadas que provienen de otras áreas alteradas circundantes a las minas, que de especies menos adaptadas a las condiciones ambientales de las minas que posiblemente ingresan desde el bosque de referencia. Estas especies ruderales que colonizan las minas rápidamente tras su abandono ya están adaptadas a condiciones ambientales estresantes en otras zonas degradadas (p. e. alta disponibilidad de luz, altas temperaturas superficiales y pocos nutrientes en el suelo, alta presión de herbivoría, etc.) y pueden competir eficientemente con las especies que eventualmente llegan desde el bosque de referencia a esas zonas críticas.
Por otra parte, el hecho de que familias como Cyperaceae sean dominantes en las minas, pero no en el bosque de referencia, indica que ciertos taxones conforman grupos funcionales de especies que encuentran en el seno de las minas un hábitat propicio para prosperar y, eventualmente, favorecer las condiciones para el reclutamiento paulatino de otras especies menos tolerantes. El establecimiento temprano de especies de Cyperaceae en las minas pude deberse entre otras razones a las relaciones simbióticas que establecen con micorrizas arbusculares en sistemas con suelos degradados (Lovera & Cuenca, 1996). Helsen et al. (2013) sugieren que las diferencias en composición florística entre zonas alteradas y su bosque de referencia pueden ser explicadas por la historia de vida de las especies de plantas, ya que especies adaptadas al bosque maduro disminuyen su representatividad con la distancia a éste; mientras que aquellas generalistas la aumentan a medida que se alejan del mismo (Helsen et al., 2013).
La distancia al borde (bosque-mina) parece aumentar las diferencias en composición florística entre las comunidades del bosque de referencia. Al respecto, es posible que el efecto de borde penetre hasta los 50 m, pero no hasta los 100 m de distancia en el bosque estudiado, y como resultado de la variación en las condiciones microclimáticas que se generan entre la zona de borde y el interior del bosque (p.e. menor incidencia de flujo fotónico y demanda evapotranspirativa, pero mayor humedad y fertilidad del suelo en el interior que en el borde), se configuren composiciones vegetales diferentes, con una mezcla de especie heliófitas pioneras y esciófitas en el borde, y una comunidad dominada por especies esciófitas en el interior (Harper et al., 2005) (Apéndice 1).
En conclusión, los resultados sugieren que si se considera el bosque adyacente como la comunidad de referencia hacia donde tendría que direccionarse la trayectoria sucesional de las minas; entonces, 24 años de abandono tras el cierre de las minas es poco tiempo para apreciar una recuperación sustancial de la estructura biológica y composición de la vegetación, pues tras ese tiempo de revegetación natural, las comunidades de minas tienen alta semejanza florística, pero su riqueza, diversidad, equitatividad y composición de especies dista sustancialmente de los valores superiores registrados en el bosque de referencia (solamente 7 % de las especies del bosque de referencia prospera en las minas). Estas variaciones parecen ser independientes de la distancia a la cual las minas se encuentran del bosque de referencia; sin embargo, es claro que otros factores como la calidad del sustrato y las estrategias reproductivas de especies herbáceas de Cyperaceae y Melastomataceae, así como algunas arbóreas como C. spathulata y M. reducens, juegan un papel importante en la revegetación natural temprana de minas de oro abandonadas en los bosques pluviales del Chocó biogeográfico colombiano.
A manera de recomendación, se sugiere que, para futuras explotaciones mineras, previo a los impactos, se diseñen corredores biológicos que permitan un flujo de componentes bióticos desde la matriz de bosque adyacente a las áreas impactadas por la actividad, de manera que se promueva la dispersión de semillas entre estos dos sistemas, facilitando así, la revegetación natural temprana de las áreas impactadas por la minería.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio