Introducción
La zona hiporreica (ZH) comprende los sedimentos del subsuelo debajo de la corriente de un río, donde se intercambia agua superficial con el acuífero subyacente (Boulton et al., 1998). Desde el punto de vista ecológico, se le considera un ecotono entre los ambientes de superficie y el subsuelo de los ecosistemas lóticos, que no está delimitado con precisión, ya que sus fronteras no se pueden reducir exclusivamente a límites físicos (Gilbert, 1991). La ZH ofrece importantes servicios ecosistémicos (Boulton et al., 2008), entre los que se destaca la filtración y depuración del agua, lo cual permite mantener a largo plazo un recurso hídrico de alta calidad. Otras funciones de este ecotono son la regulación del flujo de agua y el almacenamiento y transformación de la materia orgánica (Mugnai et al., 2015a). Además, muchos invertebrados de la zona bentónica migran en estados juveniles hacia la ZH, donde se resguardan de algunas condiciones ambientales desfavorables (Dole-Olivier, 2011; Jacobi & Cary, 1996; Vander-Vorste et al., 2016). A pesar de su importancia (Mugnai et al., 2015b), la zona hiporreica es uno de los ambientes acuáticos más amenazados, ya que se ve muy afectado por las actividades humanas, a la vez que es el menos protegido por la legislación a nivel mundial.
La mayoría de los procesos que ocurren en la ZH se dan en el sedimento, por lo que su forma y tamaño determinan las propiedades asociadas a su funcionamiento, tales como la porosidad y la permeabilidad. Esta última regula del flujo hiporreico (Brunke & Gonser, 1997; Sawyer & Cardenas, 2009) y modifica las condiciones fisicoquímicas, al influir sobre el tiempo de retención hidráulica (Olsen & Townsend, 2003; Sobczak & Findlay, 2002; Vaux, 1968). El estudio de la ZH incluye el análisis de la dimensión vertical y de los vínculos entre las aguas superficiales y subterráneas (Boulton et al., 2010). Este intercambio vertical ocasiona discontinuidades fisicoquímicas en la ZH e incide en las concentraciones de oxígeno disuelto (Olsen & Townsend, 2003), las condiciones térmicas (Evans & Petts, 1997), los niveles de nutrientes (Franken et al., 2001), los flujos metabólicos y los procesos asociados a la descomposición de la materia orgánica en los ecosistemas acuáticos (Krause et al., 2011). Se generan así diversos microhábitats para la fauna hiporreica asociada (Pacioglu & Parvulescu, 2017), dado que las variaciones en los factores fisicoquímicos interactúan con la biota e inciden sobre su composición (Boulton et al., 1998; Brunke & Gonser, 1999; Dole-Olivier & Marmonier, 1992). De esta manera, los organismos de la ZH (también llamados hiporreos) (Mugnai et al., 2015b), tienen un alto potencial bioindicador (Brunke & Gonser, 1999; Dole-Olivier et al., 1997; Marmonier & Creuzé des Chatelliers, 1991).
La ecología, la distribución espacial y la dinámica temporal de la fauna hiporreica se ha estudiado en distintos sistemas fluviales (Danielpol, 1967; Dole-Olivier et al., 1994), en sedimentos arenosos o piedra caliza (Pacioglu & Parvulescu, 2017; Palmer, 1990; Stubbington et al., 2009). Sin embargo, aún existen regiones donde la fauna hiporreica no se ha caracterizado adecuadamente (Pacioglu, 2009). Mugnai et al. (2015a) revisaron algunas de las investigaciones realizadas en México, Honduras, Venezuela, Chile y Argentina y concluyeron que en la región Neotropical el conocimiento de la zona hiporreica y de su fauna aun es incipiente. Existen algunos trabajos recientes en Brasil (Mugnai et al., 2019; Veras et al. 2018), mientras que, en los ríos colombianos, este componente es prácticamente desconocido; solamente hay un estudio sobre la estigofauna de aljibes de aguas subterráneas de la región del Urabá antioqueño (Pineda, 2017), pero no hay ningún trabajo en ríos del país. En el presente estudio se investigó la composición y estructura de la fauna hiporreica de un río de montaña en Colombia y su distribución asociada a las variables fisicoquímicas del agua y del sedimento hiporreicos. La hipótesis planteada fue que los factores inherentes a la estación de monitoreo relacionados con la fisicoquímica del agua, la granulometría y el contenido de materia orgánica del sedimento pueden influenciar la composición y la distribución de la fauna a lo largo de las estaciones de muestreo.
Materiales y métodos
Región de estudio: El río Dagua nace aproximadamente a 2 200 msnm en una zona de bosque montano húmedo del Departamento del Valle del Cauca, Colombia, Sudamérica. Tiene una longitud de 101 km, una cuenca de drenaje de 142 500 ha y una pendiente promedio del terreno del 26 %. Con base en su topografía, Aguirre et al. (2017) mencionan que esta hoya hidrográfica presenta solamente una cuenca alta y otra baja. En su cuenca superior, la longitud es de aproximadamente 74 km y en ella el río atraviesa un cañón para luego atenuarse y descender suavemente por el flanco occidental de la Cordillera Occidental hacia la llanura costera del Pacífico. Esta cuenca se define como un sistema hidrológico que responde rápidamente a la precipitación y que tiene características torrenciales, con capacidad de generar elevados potenciales de erosión. Por ello, presenta altos niveles de sedimentación y de pérdida de suelos, a lo que contribuye la fuerte pendiente y las prácticas agronómicas poco adecuadas (Aguirre et al., 2017).
A lo largo de la cuenca del río Dagua se seleccionaron cinco estaciones de monitoreo, cuatro en la cuenca alta y una en la cuenca baja (Fig. 1). Los dos primeros sitios de la cuenca alta correspondieron a la cabecera: El Carmen (EC) y Centella Baja (CB). Las localidades ubicadas más abajo de la cabecera se denominaron estaciones de la cuenca alta-media y correspondieron a La Harinera (LH) y Bitaco Dagua (BD). El último lugar se ubicó en la cuenca baja y se designó como estación Córdoba (CO). Para la selección de estas estaciones se consideró la facilidad de acceso a la zona y las condiciones de seguridad de los sitios. En estos puntos de monitoreo la vegetación de ribera no tiene condiciones naturales debido a la presencia de vías de acceso y a la alteración significativa ocasionada por los asentamientos humanos y las actividades agropecuarias, por lo cual el paisaje es una mezcla de vegetación natural que alterna con cultivos y potreros. La descripción general de las estaciones de muestreo, las abreviaturas que identifican cada sitio, las coordenadas geográficas, las características fisiográficas y las actividades antrópicas locales se presentan en la Tabla 1.
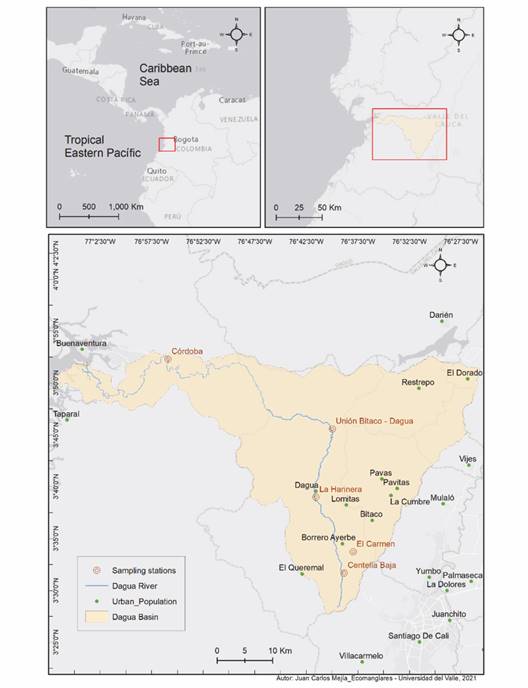
Fig. 1 Ubicación geográfica de la cuenca del río Dagua y distribución de las cinco estaciones de muestreo. El Carmen, Centella Baja, La Harinera, Bitaco Dagua y Córdoba. / Fig. 1. Geographic location of the Dagua river basin and distribution of the five sampling stations. El Carmen, Centella Baja, La Harinera, Bitaco Dagua and Córdoba.
Tabla 1 Características de las estaciones establecidas en el río Dagua para el muestreo de fauna hiporreica. / Table 1. Characteristics of the stations established in the Dagua River for the sampling of hyporheic fauna.
| Cuenca | Estación de muestreo | Convención | Latitud (N) | Longitud (W) | Altura m.s.n.m | Ancho del canal (m.) | Orden/ corriente | Temperatura promedio anual (°C) | Intervención humana |
| Alta | El Carmen | EC | 03º33’44.7” | 76º37’56.6” | 1 502 | 7 | 2 | 26 | Centro turístico y recreacional, efecto antrópico (actividad doméstica, agropecuaria), población dispersa. |
| Centella Baja | CB | 03º31’41.7” | 76º38’49.1” | 1 408 | 5 | 2 | 26 | Uso de suelo para agricultura, degradación de suelos, captaciones de agua, contaminación por agroquímicos, población dispersa. | |
| La Harinera | LH | 03º39’00.3” | 76º41’33.5” | 878 | 17 | 3 | 28 | Extracción de grava y arena, uso de detergentes en lavado y modificaciones del cauce para vías de acceso, población dispersa. | |
| Unión Bitaco-Dagua | BD | 03º45’34.9” | 76º39’57.8” | 649 | 12 | 3 | 28 | Contaminación orgánica y sedimentación, incremento de asentamientos humanos. | |
| Baja | Córdoba | CO | 03º52’19.2” | 76º55’54.0” | 52 | 25 | 3 | 29 | Explotación minera de oro y materiales de construcción, incremento de asentamientos humanos. |
Muestreo: Entre octubre de 2017 y diciembre de 2018 se llevaron a cabo tres (3) jornadas de muestreo en cinco estaciones del río Dagua. En cada una de las estaciones de muestreo se seleccionaron tres (3) zonas, dos de ellas correspondieron a las riberas del río (izquierda y derecha) y la tercera a islotes o islas fluviales. Estas tres zonas se denominaron “margen”. En cada uno de los márgenes se perforaron tres (3) pozos (réplicas), aplicando el método de Karaman-Chappuis (Chappuis, 1942; Karaman, 1935); se mantuvo una distancia de 10 m entre los pozos con el fin de garantizar su independencia. Las dimensiones de los pozos fueron de 50 cm de diámetro y 60 cm de profundidad con respecto al nivel del río. De cada pozo se extrajeron y filtraron cinco litros de agua intersticial del sedimento hiporreico través de un tamiz con ojo de poro de 63 µ; en el agua filtrada se midieron in situ el oxígeno disuelto (mg/L y % de saturación), los sólidos disueltos totales (SDT, ppt), la temperatura (°C), la conductividad (µS/cm), el pH (unidades) y la turbidez (unidades nefelométricas de turbidez NTU) mediante un equipo multiparamétrico Hanna HI 9829. El agua colectada se conservó refrigerada. Las muestras de sedimentos hiporreicos se homogenizaron in situ (aproximadamente 500 g) y se guardaron en bolsas resellables. Los organismos retenidos se fijaron con alcohol al 80 %. Todas las muestras de campo se transportaron al laboratorio de la sección de Biología Marina de la Universidad del Valle.
Identificación de ejemplares y análisis de laboratorio: En el laboratorio las muestras de organismos se tamizaron de nuevo cuidadosamente y se preservaron en alcohol al 80 %. Los invertebrados se extrajeron, se identificaron hasta el mínimo nivel taxonómico posible y se contabilizaron utilizando estereoscopios y microscopios. Para el filo Arthropoda, la clase Entognatha se identificó hasta orden, la clase Insecta en su mayoría hasta género, los ácaros se agruparon como Hydrachnidiae, los crustáceos hasta orden y los Pauropoda y Symphyla hasta clase. Los filos Annelida y Platyhelminthes se identificaron en su mayoría al nivel de familia, el filo Mollusca en su mayoría hasta género y el filo Nematoda se dejó a este nivel. Las claves taxonómicas empleadas fueron: Baltanás y Mesquita-Joanes (2015), Baquero y Jordana (2015), Domínguez y Fernández (2009), Galassi et al. (2009), Linares et al. (2018), Poinar-Jr (2015), Rodríguez-Domínguez (2015), Sendra-Mocholi (2015), Silva-Passos et al. (2007), y Thorp y Covich (2010). También se contó con el apoyo de especialistas en algunos grupos taxonómicos: Oligochaeta: Pilar Rodríguez, Universidad del País Vasco, España; Copepoda: Harpacticoida, Marcela Peralta, Fundación Miguel Lillo, Tucumán, Argentina; Gasteropoda: Gabriela Cuezzo, CONICET, Argentina; Clase Insecta: María del Carmen Zúñiga, Ranulfo González y Marcela Gonzáles, Universidad del Valle, Colombia.
En las muestras de agua hiporreica se determinaron las concentraciones de nitratos (mg/L NH3 -) y de amonio (mg/L NH4 +); también se tomaron alícuotas de agua (1 ml) a las cuales se les añadió una solución de ácido nítrico al 1 % con el fin de determinar las concentraciones de mercurio (Hg), cadmio (Cd) y plomo (Pb) mediante un equipo Metalyser HM 1 000 Trace2O. Para determinar la granulometría del sedimento hiporreico se utilizaron tamices de 8, 4, 2, 1 mm y 710, 335, 180, 125, 90, 63 y < 63 µ. Se consideraron las categorías de sedimento fino (partículas menores a 1 mm) (Olsen & Townsend, 2005), arena (partículas entre 1 y 2 mm) y grava (partículas mayores a 2 mm) (Winterkorn & Fang, 1991). El contenido de materia orgánica (MO) se midió por ignición, para lo cual se pesó una porción de la muestra secada previamente en estufa, se incineró en una mufla a 360 ºC durante 2 horas, se dejó enfriar y se pesó nuevamente, de acuerdo con la metodología de Schulte y Hopkins (1996).
Análisis de datos: Los estimadores de biodiversidad, tales como abundancia, riqueza, y diversidad de especies (H’ de Shannon con base en los logaritmos naturales), se calcularon mediante el programa Diversity 3.0 acorde con las indicaciones de Seaby y Henderson (2007). La equitabilidad de Pielou se calculó mediante el programa PAST (Hammer et al., 2001). Después de comprobar los supuestos de homogeneidad de la varianza mediante el test de Levene y de normalidad mediante la prueba de Anderson-Darling, se verificaron las diferencias en las variaciones espacio-temporal de las variables fisicoquímicas del agua y del sedimento hiporreicos mediante análisis de varianza (ANOVA) de tres vías factorial, ajustando un modelo lineal con diferente estructura de varianzas, y pruebas de comparación múltiple de Tukey. Este análisis estadístico se llevó a cabo con el programa de uso libre R 3.5.1 (R Development Core Team, 2019), utilizando un nivel de significancia del 5 %. El mismo procedimiento se realizó para valorar las diferencias entre sitios y muestreos en la abundancia, la riqueza y la diversidad de la fauna hiporreica. Para explorar las relaciones entre la abundancia y composición de la fauna hiporreica con las variables estaciones, muestreos, fisicoquímica del agua, granulometría y contenido de materia orgánica, se aplicó un análisis de redundancia (RDA); la significancia se estableció con un nivel del 5 % en 999 permutaciones. Estos análisis multivariados se realizaron igualmente con el programa R.
Resultados
Distribución espacio-temporal de la diversidad de la fauna hiporreica: Se recolectaron 7 164 organismos hiporreicos correspondientes a cinco Filos: Arthropoda (63.10 %), Annelida (18.37 %), Nematoda (13.81 %), Mollusca (4.33 %) y Platyhelminthes (0.39 %). Dentro de cada taxa puede haber 1 o varias especies que debido al tamaño tan pequeño y al estado inmaduro en que se encontraron los organismos hiporreicos, fue imposible su identificación más allá del nivel taxonómico registrado. Para realizar y facilitar el análisis estadístico de una especie o un grupo de especies pertenecientes a cada taxa, se asignó la identificación “Número de especie” (Tabla 2). La clase Insecta y la subclase Copepoda (Cyclopoida y Harpacticoida) fueron abundantes en la zona de cabecera (estaciones EC y CB) y decrecieron hacia la desembocadura. Por su parte, las clases Arachnida (Hydrachnidiae) y Clitellata y el filo Nematoda incrementaron su abundancia hacia las estaciones de las cuencas alta-media y la estación de la cuenca baja (LH, BD y CO). Algunos taxones estuvieron pobremente representados, como ocurrió con las clases Entognatha, Pauropoda, Ostracoda y Symphyla (Fig. 2). Dentro de la clase Insecta, los órdenes Coleoptera y Ephemeroptera y la familia Dolichopodidae del orden Diptera, fueron abundantes en las estaciones de cabecera, mientras que otras familias de Diptera (Ceratopogonidae, Chironomidae) estuvieron mejor representadas hacia la cuenca baja. El orden Trichoptera (en su mayoría Hydropsychidae), reportó abundancias similares en las diferentes estaciones de muestreo (Fig. 3). La diversidad varió entre 2.25 en la estación más baja (CO) y 2.69 en la cuenca alta (CB); la equitabilidad, a su vez, fluctuó entre 0.71 en CO y 0.83 en LH (cuenca alta-media).
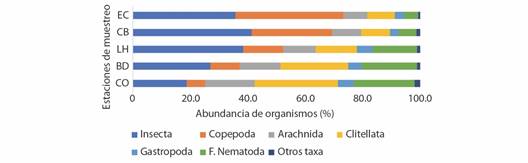
Fig. 2 Distribución de la abundancia de taxones recolectados en cada estación de muestreo de la cuenca del río Dagua. “Otros taxa “incluye las clases: Entognatha, Pauropoda, Ostracoda y Symphyla. Las abreviaturas de los sitios se indican en la Tabla 1. / Fig. 2. Distribution of the abundance of taxa collected at each sampling station in the Dagua river basin. “Other taxa” includes the classes: Entognatha, Pauropoda, Ostracoda and Symphyla. Site abbreviations are listed in Table 1.
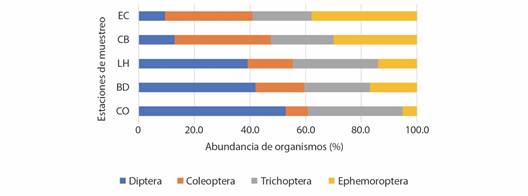
Fig. 3 Distribución de la abundancia de los órdenes de insectos más representativos recolectados en las estaciones de muestreo de la cuenca del río Dagua. Las abreviaturas de los sitios se indican en la Tabla 1. / Fig. 3. Distribution of the abundance of the most representative insect orders collected at the sampling stations of the Dagua river basin. Site abbreviations are listed in Table 1.
Tabla 2 Abundancia y distribución de los taxones recolectados en la zona hiporreica del río Dagua. / Table 2. Abundance and distribution of the taxa collected in the hyporheic zone of the Dagua River.
| Filo | Clase | Orden | Taxa | Número de especie | EC | CB | LH | BD | CO | Abundancia taxa |
| Filo | Clase | Orden | Taxa | Número de especie | EC | CB | LH | BD | CO | Abundancia taxa |
| Arthropoda | Entognatha | Collembola | Collembola spp. | Sp1. | 48 | 41 | 2 | 2 | 2 | 95 |
| Diplura | Japygidae spp. | Sp2. | 0 | 12 | 0 | 0 | 0 | 12 | ||
| Insecta | Megaloptera | Corydalus spp. | Sp.3 | 13 | 1 | 0 | 0 | 0 | 14 | |
| Diptera | Dolichopodidae spp. | Sp.4 | 47 | 39 | 5 | 12 | 15 | 118 | ||
| Bezzia spp. | Sp.5 | 16 | 19 | 93 | 79 | 77 | 284 | |||
| Syrphidae spp. | Sp.6 | 0 | 0 | 0 | 1 | 7 | 8 | |||
| Diptera spp. | Sp.7 | 2 | 4 | 2 | 2 | 3 | 13 | |||
| Chironomidae spp. | Sp.8 | 49 | 59 | 99 | 124 | 181 | 512 | |||
| Chaoboridae spp. | Sp.9 | 2 | 6 | 0 | 0 | 0 | 8 | |||
| Odonata | Libellulidae spp. | Sp.10 | 8 | 2 | 39 | 16 | 2 | 67 | ||
| Coenagrionidae spp. | Sp.11 | 11 | 1 | 0 | 2 | 0 | 14 | |||
| Coleoptera | Macrelmis spp. | Sp.12 | 17 | 5 | 1 | 1 | 0 | 24 | ||
| Heterelmis spp. | Sp.13 | 13 | 9 | 2 | 3 | 2 | 29 | |||
| Huleechius spp. | Sp.14 | 0 | 3 | 0 | 0 | 0 | 3 | |||
| Staphylinidae spp. | Sp.15 | 5 | 0 | 0 | 0 | 0 | 5 | |||
| Psephenus spp. | Sp.16 | 45 | 48 | 19 | 13 | 6 | 131 | |||
| Hidrophilidae spp. | Sp.17 | 55 | 54 | 7 | 15 | 7 | 138 | |||
| Plecoptera | Anacroneuria spp. | Sp.18 | 2 | 8 | 0 | 1 | 0 | 11 | ||
| Hemiptera | Cryphocricos spp. | Sp.19 | 5 | 5 | 0 | 0 | 0 | 10 | ||
| Hemiptera | Sp.20 | 5 | 2 | 14 | 3 | 0 | 24 | |||
| Trichoptera | Helicopsyche spp. | Sp.21 | 8 | 0 | 0 | 0 | 0 | 8 | ||
| Atopsyche spp. | Sp.22 | 2 | 1 | 2 | 2 | 0 | 7 | |||
| Hydropsychidae | Sp.23 | 91 | 86 | 59 | 46 | 71 | 353 | |||
| Ephemeroptera | Trycorythodes spp. | Sp.24 | 122 | 87 | 25 | 25 | 10 | 269 | ||
| Leptohyphes spp. | Sp.25 | 13 | 2 | 0 | 2 | 0 | 17 | |||
| Camelobaetidius spp. | Sp26. | 20 | 17 | 0 | 0 | 0 | 37 | |||
| Baetidae spp. | Sp27. | 4 | 5 | 0 | 3 | 0 | 12 | |||
| Arachnidae | Hydrachnidiae | Hydrachnidiae spp. | Sp.28 | 125 | 125 | 109 | 187 | 352 | 898 | |
| Pauropoda | Pauropoda spp. | Sp.29 | 0 | 0 | 2 | 0 | 0 | 2 | ||
| Ostracoda | Podocopida | Podocopida spp. | Sp.30 | 2 | 0 | 1 | 13 | 35 | 51 | |
| Hexanauplia | Cyclopoida | Cyclopoida spp. | Sp.31 | 246 | 176 | 73 | 75 | 70 | 640 | |
| Harpacticoida | Parastenocarididae spp. | Sp.32 | 323 | 170 | 62 | 59 | 76 | 690 | ||
| Symphyla | Symphyla spp. | Sp.33 | 0 | 1 | 0 | 0 | 0 | 1 | ||
| Platyhelminthes | N.A | Tricladida | Planariidae spp. | Sp.34 | 9 | 4 | 8 | 2 | 5 | 28 |
| Annelida | Clitellata | Tubificida | Naididae spp. | Sp.35 | 143 | 124 | 138 | 302 | 537 | 1 244 |
| Annelida spp. | Sp.36 | 2 | 0 | 2 | 7 | 56 | 67 | |||
| Mollusca | Gastropoda | Littorinimorpha | Cochliopidae spp. | Sp.37 | 6 | 0 | 0 | 0 | 0 | 6 |
| NA | Doryssa spp. | Sp.38 | 17 | 12 | 9 | 12 | 15 | 65 | ||
| N.A | Physidae spp. | Sp.39 | 7 | 7 | 6 | 15 | 11 | 46 | ||
| N.A | Gundlachia spp. | Sp.40 | 1 | 1 | 1 | 0 | 3 | 6 | ||
| N.A | Melanoides spp. | Sp.41 | 18 | 15 | 37 | 35 | 82 | 187 | ||
| Nematoda | Nematoda spp. | Sp.42 | 74 | 78 | 149 | 253 | 435 | 989 | ||
| Abundancia por estación y abundancia total | 1 587 | 1 236 | 967 | 1 314 | 2 060 | 7 164 |
El ANOVA mostró que la distribución espaciotemporal de la abundancia de los organismos estuvo más influenciada por el factor “estación de muestreo” que por el “período de muestreo” o por el “margen” del río (Tabla 3). El factor “estación de muestreo” fue determinante para los estimadores de riqueza y diversidad (Tabla 3). Las pruebas de Tukey de comparación múltiple confirmaron que las dos estaciones de cabecera (EC y CB) fueron similares entre sí y difirieron de las estaciones de la cuenca media-baja (LH, DB y CO).
Tabla 3 ANOVA de la diversidad de organismos hiporreicos del río Dagua, respecto a las estaciones, periodo de muestreo, y margen del río. Los valores corresponden a F (Fisher). / Table 3. ANOVA of the diversity of hyporheic organisms of the Dagua River, with respect to the seasons, sampling period, and river margin. Values correspond to F (Fisher).
| Factores | DF | Abundancia total | Riqueza (°D|) | Diversidad (H’) |
| Estación de muestreo | 4 | 34 8937*** | 12 1785*** | 26 757*** |
| Muestreo | 2 | 0.8837 | 0.628 | 2.729 |
| Margen | 2 | 0.4385 | 0.4222 | 2.267 |
| Estación: Muestreo | 8 | 2 2932* | 0.2895 | 1.025 |
***P-valor < 0.001; **P-valor < 0.01; *P-valor < 0.05. / ***P-value < 0.001; **P-value < 0.01; *P-value < 0.05.
Variables fisicoquímicas del agua intersticial y su relación con la fauna hiporreica: La Tabla 4 resume las características fisicoquímicas del agua hiporreica del río Dagua; la turbidez, la conductividad, los sólidos disueltos y los nitratos fueron las variables con mayor dispersión en los datos. La temperatura se incrementó desde la cabecera hacia la cuenca baja y el oxígeno disuelto tuvo el comportamiento contrario. Los metales pesados Hg, Cd y Pb no se detectaron. Los resultados de la partición de la varianza del RDA se muestran en la Tabla 5, en la que se puede ver que las variables estación y muestreo fueron las que tuvieron mayor explicación, la cual fue estadísticamente significativa. La representación gráfica del RDA (Fig. 4) muestra que las variables que presentaron mayor incidencia sobre la distribución de la abundancia de los organismos hiporreicos fueron los porcentajes de grava y sedimento fino.
Tabla 4 Promedios y desviaciones estándar de las variables fisicoquímicas del agua y del sedimento hiporreicos en las estaciones del río Dagua. / Table 4. Averages and standard deviations of the physicochemical variables of hyporheic water and sediment at the Dagua River stations.
| Variable (unidad de medición) | Estaciones de muestreo | ||||
| El Carmen | Centella Baja | La Harinera | Bitaco-Dagua | Córdoba | |
| Promedio y Desv. Est. | Promedio y Desv. Est. | Promedio y Desv. Est. | Promedio y Desv. Est. | Promedio y Desv. Est. | |
| OD (ppm) | 4.17±1.20 | 3.80±1.30 | 3.00±0.90 | 2.82±0.90 | 2.31±0.71 |
| pH (Unidades) | 7.05±0.31 | 6.98±0.28 | 6.85±0.47 | 6.90±0.32 | 6.57±0.42 |
| Temperatura (°C) | 21.4±2.3 | 21.4±1.4 | 21.9±1.5 | 23.4±1.8 | 24.0±1.1 |
| Conductividad (µS/cm) | 192.5±115.0 | 145.2±63.2 | 202.0±18.4 | 218.0±21.0 | 281.0±72.0 |
| SDT (ppt) | 182.3±112.7 | 145.2±63.2 | 202.7±224.9 | 212.8±208.8 | 281.1±272.2 |
| Turbidez (NTU) | 178.3±98.8 | 221.6±148.8 | 442.8±323.9 | 555.4±304.2 | 785.4±215.9 |
| NO3 - (ppm) | 2.9±1.3 | 3.0±1.2 | 3.0±1.1 | 2.7±0.8 | 3.2±1.3 |
| NH4 + (ppm) | 0.03±0.01 | 0.03±0.01 | 0.03±0.01 | 0.02±0.01 | 0.03±0.02 |
| Grava (%) | 66.3±9.0 | 68.4±7.3 | 37.1±11.0 | 26.0±7.6 | 15.8±8.9 |
| Arena (%) | 19.2±7.2 | 16.6±5.3 | 26.5±10.1 | 30.6±7.1 | 18.2±6.9 |
| Sedimento fino (%) | 14.5±5.2 | 15.1±4.2 | 36.4±11.9 | 43.4±9.7 | 66.0±11.6 |
| Materia orgánica (%) | 3.0±1.0 | 3.3±0.9 | 4.4±1.9 | 4.3±1.5 | 4.4±1.4 |
Las convenciones de las estaciones se indican en la Tabla 1. OD: oxígeno disuelto; SDT: sólidos disueltos totales; NTU: unidades nefelométricas de turbidez. / Station conventions are listed in Table 1. DO: dissolved oxygen; TDS: total dissolved solids; NTU: nephelometric turbidity units.
La granulometría y la materia orgánica del sedimento hiporreico y su relación con la distribución de la fauna hiporreica: La Tabla 4 incluye los resultados de las características fisicoquímicas del sedimento hiporreico, en los que se observa que el porcentaje de grava se redujo desde la cabecera hasta la cuenca baja, mientras que la arena y el sedimento fino tendieron a incrementarse con la reducción en el gradiente altitudinal; la materia orgánica mostró un patrón similar de incremento hacia la cuenca baja, pero con menor intensidad. El ANOVA (Tabla 6) mostró que los factores “estación de muestreo”, “período de muestreo” y la interacción entre estos dos, tuvieron influencia sobre la granulometría del sedimento. Las pruebas de Tukey indicaron que la granulometría fue similar entre las estaciones de cabecera (EC, CB, con un promedio del 67.3 % de gravas) pero distinta a la de los sitios de las cuencas alta-media (LH, BD) y baja (CO), en los cuales predominó el sedimento fino con un promedio del 48.6 %. En esta última estación se encontraron las menores proporciones de grava (15.8 %) y el mayor porcentaje de sedimento fino (66 %). El contenido de materia orgánica en el sedimento hiporreico estuvo influenciado tanto por el periodo de muestreo (que pasó del 3.5 % en octubre de 2017 al 4.4 % en diciembre de 2018) como por la ubicación de la estación de colecta en la cuenca (del 2.9 % en la cuenca alta subió hasta el 4.4 % en la cuenca baja); la interacción “periodo de muestreo-margen” también influyó en esta característica (Tabla 6). El RDA confirmó que la distribución de la fauna hiporreica estuvo muy influenciada por el sitio de muestreo (estación) y por el momento del muestreo (muestreo) (Tabla 5); con respecto a las variables del sedimento, la influenciada se debió principalmente a las proporciones de grava y de sedimento fino, como se ve en el RDA que relaciona estos datos (Fig. 4A). La granulometría gruesa (grava) ocurrió en las estaciones ubicadas en la zona alta de la cuenca (EC y CB), mientras que en los sitios de la cuenca baja (BD y CO) predominaron las partículas de pequeño tamaño (sedimento fino) y hubo un mayor porcentaje de MO (Tabla 4). Según el RDA (Fig. 4B), en el sedimento grueso de la cuenca alta fueron representativos los coleópteros (Hidrophilidae), los efemerópteros (Betidae), los ácaros (Hydrachnidiae) y los miriápodos (Pauropoda), mientras que en los sitios de sedimento fino de la cuenca baja se destacaron los gastrópodos (Gundlachia spp.), los tubifícidos (Naididae) y los nemátodos.
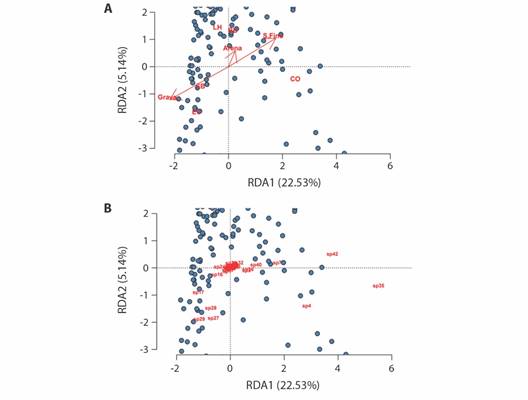
Fig. 4 Análisis de Redundancia (RDA) de la comunidad de invertebrados hiporreicos del río Dagua. A. Biplot de las abundancias de los taxones en los distintos muestreos; los puntos representan las observaciones y las especies se indican con un número, cuya identificación se incluye en la Tabla 2. B. Triplot de las variables explicativas (vectores), las estaciones de muestreo (EC: El Carmen, CB: Centella Baja, LH: La Harinera, BD: Bitaco-Dagua, CO: Córdoba) y las observaciones. Las variables con vectores de mayor longitud y más alejadas del centro son las más explicativas en el análisis. / Fig. 4. Redundancy Analysis (RDA) of the hyporheic invertebrate community of the Dagua River. A. Biplot of the abundances of the taxa in the different samplings; the points represent the observations and the species are indicated with a number, whose identification is included in Table 2. B. Triplot of the explanatory variables (vectors), the sampling stations (EC: El Carmen, CB: Centella Baja, LH: La Harinera, BD: Bitaco-Dagua, CO: Córdoba) and observations. The variables with vectors of greater length and further from the center are the most explanatory in the analysis.
Tabla 5 Partición de la varianza obtenida mediante el análisis RDA de las variables estación, muestreo, variables fisicoquímicas del agua, granulometría y contenido de materia orgánica. / Table 5. Partition of the variance obtained through the RDA analysis of the variables station, sampling, physicochemical variables of the water, granulometry and content of organic matter.
| Variable | GL | Varianza | F | P(>F) |
| Estación de muestreo | 4 | 135.84 | 11.40 | 0.001*** |
| Muestreo (período) | 2 | 10.62 | 1.78 | 0.045* |
| Oxígeno disuelto (ppm) | 1 | 1.42 | 0.47 | 0.792 |
| pH (Unidades) | 1 | 3.68 | 1.23 | 0.241 |
| Temperatura (°C) | 1 | 3.62 | 1.21 | 0.267 |
| Conductividad (µS/cm) | 1 | 6.93 | 2.32 | 0.055 |
| Sólidos disueltos totales (ppt) | 1 | 3.39 | 1.13 | 0.285 |
| (ppm) | 1 | 3.16 | 1.06 | 0.346 |
| Materia orgánica (%) | 1 | 3.19 | 1.07 | 0.317 |
| NO3 (ppm) | 1 | 2.70 | 0.90 | 0.414 |
| NH4 (ppm) | 1 | 2.49 | 0.83 | 0.524 |
| Grava (%) | 1 | 3.17 | 1.06 | 0.353 |
| Arena (%) | 1 | 3.37 | 1.13 | 0.306 |
| Sedimento fino (%) | 1 | 4.41 | 1.48 | 0.158 |
***P-valor < 0.001; **P-valor < 0.01; *P-valor < 0.05. GL: grados de libertad; P: probabilidad; F: Fisher. / ***P-value < 0.001; **P-value < 0.01; *P-value < 0.05. GL: degrees of freedom; P: probability; F: Fisher.
Tabla 6 ANOVA de las variables fisicoquímicas del sedimento hiporreico del río Dagua respecto a la estación de muestreo, margen y período muestreo. / Table 6. ANOVA of the physicochemical variables of the hyporheic sediment of the Dagua River with respect to the sampling station, margin and sampling period.
| Factores | Grados de libertad | Grava | Arena | Sedimento fino | Materia orgánica |
| Estación de muestreo | 4 | 195.11*** | 17.21*** | 156.93*** | 7.86*** |
| Periodo de muestreo | 2 | 5.52** | 22.23*** | 73.96*** | 20.79*** |
| Margen | 2 | 0.17 | 1.31 | 1.57 | 20.80*** |
| Estación:Muestreo | 8 | 10.69*** | 12.93*** | 5.24*** | 0.35 |
| Estación:Margen | 8 | 2.68* | 1.78 | 1.02 | 0.46 |
| Muestreo:Margen | 4 | 1.12 | 1.85 | 1.34 | 6.02*** |
| Estación:Muestreo:Margen | 16 | 1.14 | 0.97 | 0.71 | 1.44 |
***P-valor < 0.001; **P-valor < 0.01; *P-valor < 0.05. Los valores corresponden a F (Fisher). / ***P-value < 0.001; **P-value < 0.01; *P-value < 0.05. Values correspond to F (Fisher).
Discusión
En general, muchos de los organismos hiporreicos del río Dagua se han encontrado en diferentes lugares del mundo, como por ejemplo Cyclopoida, Harpacticoida y Nematoda en ríos de Norteamérica (Hunt & Stanley, 2003), Coleoptera y Ephemeroptera en corrientes de Nueva Zelanda (Olsen & Townsend, 2003), Chironomidae, Collembola, Cyclopoida y Annelida en sistemas fluviales de España (Barrera-González et al., 2014) y Diptera y Copepoda en el río Tijuca en Brasil (Mugnai et al., 2015a). Esto implica que a un nivel taxonómico grueso estos taxones son cosmopolitas, pero a nivel específico podría existir un gran número de endemismos para la región Neotropical, aún por estudiar.
La hipótesis planteada (la influencia de los factores abióticos particulares de cada estación de muestreo sobre la abundancia y diversidad de la fauna hiporreica) se pudo comprobar, ya que las características de composición y estructura de la comunidad cambiaron de acuerdo al sitio y momento del muestreo, lo cual se reflejó a su vez en la granulometría y la cantidad de materia orgánica de los distintos lugares de monitoreo. Estos resultados indican que las condiciones ambientales, particularmente las relacionadas con el sustrato de cada sitio, son muy importantes para definir la composición, abundancia y distribución de los organismos hiporreicos. La topografía de la cuenca, la altitud y la pendiente inciden sobre la velocidad de la corriente, sobre el contenido de oxígeno y sobre la granulometría del sedimento, con lo cual las estaciones de cabecera presentan lechos más heterogéneos, con abundantes rocas, piedras y guijarros, características que parecen favorecer una mayor biodiversidad. Se ha demostrado que la densidad y riqueza de invertebrados hiporreicos se correlacionan, entre otros factores, con la estabilidad y la complejidad del sustrato y con la profundidad y la velocidad de la corriente (Barmuta, 1989; Rabeni & Minshall, 1977). Además, la heterogeneidad del sustrato favorece la producción primaria, la retención de partículas que derivan, el establecimiento de las biopelículas (Cardinale et al., 2002; Wanner & Pusch, 2001) y la generación de zonas de protección o refugios (Townsend & Hildrew, 1994), todo lo cual incrementa la estabilidad de las comunidades acuáticas (Brown, 2003). Para la cuenca baja, el incremento de arena y sedimentos finos en el sustrato hiporreico podría deberse a un aumento en la turbidez y en la sedimentación, ya que en este sector el arrastre de partículas de toda la cuenca es mayor y la pendiente se reduce (Allan, 2004). La acumulación de partículas finas provoca la disminución de la permeabilidad y de la porosidad del sustrato hiporreico y hace más lento el intercambio hidrológico (Allan & Castillo, 2007; Buffington & Tonina, 2009), lo que puede reducir el suministro de oxígeno disuelto (Nogaro et al., 2010), y esto a su vez puede resultar en una reducción de la diversidad de organismos intersticiales.
Los resultados muestran que los cambios fisicoquímicos y granulométricos a lo largo del curso del río Dagua (mayor oxígeno, menor temperatura y tamaños mayores del sedimento en la cuenca alta, y menor oxígeno, mayor temperatura y sedimentos más finos en la cuenca baja) se relacionan con la composición y la distribución de la fauna hiporreica, algo que ya ha sido demostrado en otro tipo de ríos de latitudes altas (Malard et al., 2003). Así, en las estaciones de cabecera del río Dagua dominaron los insectos de los órdenes Ephemeroptera, Trichoptera, Coleoptera y Diptera (Dolichopodidae) y los copépodos de la clase Hexanauplia, organismos que requieren aguas oxigenadas y limpias (Allan & Castillo, 2007). Hacia las estaciones de la cuenca alta-media y de la cuenca baja se incrementaron los dípteros (Ceratopogonidae y Chironomidae), los oligoquetos (Clitellata) y los nemátodos. Las lombrices acuáticas son habitantes comunes del bentos y de la ZH y colonizan el agua subterránea (Malard, 2001). Se han encontrado masivamente en áreas con abundante lodo orgánico y con bajos niveles de oxígeno, asociadas a material muy fino (Mermillod-Blondin et al., 2004; Nogaro et al., 2006; Pacioglu et al., 2012). Además de los oligoquetos, los nemátodos y los quironómidos son frecuentes en zonas con abundante sedimento fino y con reducidas cantidades de oxígeno (Olsen & Townsend, 2003), tal como ocurrió en el río Dagua.
La investigación de la ZH del río Dagua confirma que el sustrato es un agente estructurador de la comunidad hiporreica (Hunt & Stanley, 2003), ya que las características del sedimento son determinantes en la distribución de los invertebrados de este ecotono (Maridet et al., 1996; Richards & Bacon, 1994). La penetración de organismos en las capas de sedimentos más profundas depende principalmente de la disponibilidad de hábitats intersticiales, lo que hace que la proporción de partículas finas en los intersticios sea un determinante clave para la colonización hiporreica (Maridet et al., 1996). En el presente estudio la mayoría de los insectos y la subclase Copepoda fueron más abundante en la cuenca alta, donde la granulometría fue más gruesa, mientras que los quironómidos, los oligoquetos y los nemátodos se incrementaron hacia la cuenca baja, donde predominó el sedimento fino. Resultados similares se encontraron en ríos de Oklahoma (Hunt & Stanley, 2003), en los que se encontró que la mayoría de los insectos predominaron en los sedimentos gruesos, mientras que los nematodos fueron más abundantes en las zonas arenosas y con los sedimentos más finos. Para el río Dagua, fue notorio el incremento de los ácaros acuáticos (Hydrachnidiae) y de los nemátodos hacia las regiones con mayor cantidad de arenas y sedimento fino, lo cual coincide con otros estudios en zonas templadas (Olsen & Townsend, 2003). La dominancia de Chironomidae y Oligochaeta en las estaciones de muestreo donde predominó el sedimento fino, y donde es posible que se presente disminución del intercambio de flujo hiporreico, puede ser crucial para generar procesos de bioturbación y bioirrigación, producto de la actividad de excavación de estos invertebrados para la construcción de sus refugios (Buffington & Tonina, 2009). Estos procesos de bioturbación y bioirrigación promueven la permeabilidad del sedimento e incrementan la respiración y la actividad bacteriana, lo cual influiría sobre la biogeoquímica del agua (Morad et al., 2010). De acuerdo con (Peralta-Maraver et al., 2018), la habilidad de los taxones hiporreicos para penetrar en la ZH depende de su tamaño, y cuando esta acción ocurre, dichos organismos tienen una alta influencia sobre la actividad biorreactora del sustrato hiporreico (Baranov et al., 2016; Bertics & Ziebis, 2009; Hölker et al., 2015; Krause et al., 2009).
En el río Dagua es evidente la afectación antrópica. Asociada a la intervención sobre el bosque de ribera con fines productivos, se suma la extracción de grava y arena del lecho y, hacia la cuenca baja, el impacto más drástico debido a la explotación aurífera. De esta manera, los procesos naturales de transporte y deposición de sedimentos se ven alterados por la extracción extensiva de grava y por la deforestación, lo que favorece la deposición e introducción de partículas finas en los intersticios hiporreicos, la colmatación del lecho del río y la disminución del intercambio hiporreico (Buffington & Tonina, 2009; Hancock, 2002). Aunque no se detectaron metales pesados en el agua intersticial con el método empleado, se sabe que en la cuenca baja del río Dagua ha existido una intensa explotación minera de oro (UPME, 2007), por lo que hay una alta probabilidad de que el mercurio y otros metales estén almacenado el sedimento hiporreico. Es probable que estos elementos no se encuentren en el agua intersticial evaluada, pero también puede ser que su concentración esté por debajo de los límites de detección del equipo utilizado (Hg: 5 ppb; Cd: 3 ppb, Pb: 5 ppb), o que estén inmovilizados en el sedimento. Para Gandy et al. (2007), los procesos físicos, químicos y biológicos que tienen lugar dentro de la ZH pueden reducir o atenuar las concentraciones de los metales, ya que este ecotono opera como un sumidero para estos contaminantes (Fuller & Harvey, 2000), con lo cual su carga en los sedimentos puede ser significativa a largo plazo. Por otra parte, en el área de estudio se ha evidenciado la bioacumulación de mercurio en anfibios (Hernández-Córdoba et al., 2013). Parece entonces necesario profundizar en este aspecto en el río Dagua, empleado métodos con límites de detección mucho menores y evaluando los metales también en el sedimento.
En síntesis, considerando los factores analizados (“estación de muestreo”, “margen” y “periodo de muestreo”), lo que mejor explicó los cambios en la abundancia, la riqueza y la diversidad de la fauna hiporreica del río Dagua fue la ubicación de las estaciones (cuenca alta y cuenca baja). Además de las variables ambientales asociadas a estos cambios a lo largo de la cuenca (granulometría, MO, oxígeno disuelto, mineralización, pH y nutrientes), que en su conjunto explicaron el 35.25 % de la varianza según el RDA, existe un 64.75 % no explicado que pueden deberse a otros factores hidrogeomorfológicos (conectividad hidráulica), biológicos (vegetación de ribera) y de variación temporal, no evaluados en esta investigación, los cuales podrían tener un papel determinante en la distribución de la fauna hiporreica. Se requieren estudios complementarios que permitan considerar holísticamente estos factores. Por el momento, los datos del presente estudio pueden ser de utilidad a la hora de proponer acciones de conservación que permitan mantener las características naturales del sustrato, a fin de asegurar un correcto funcionamiento del compartimiento hiporreico de río Dagua.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


