Introducción
Los ecosistemas riparios y las comunidades ictiológicas que albergan son altamente vulnerables a las actividades antropogénicas (Prat & Munné, 2014). La contaminación, la modificación del hábitat, la extracción de agua y la introducción de especies no nativas son algunas de las principales afectaciones en estos ecosistemas (Alcaraz et al., 2005; Karr & Rossano, 2001; Saunders et al., 2002; Stuart-Smith et al., 2013). Los peces, como grupo taxonómico, se consideran un bioindicador importante de la integridad biológica de los ecosistemas acuáticos (Kim & An, 2015; Rosso & Quirós, 2009; Rosso & Quirós, 2010; Viteri-Garcés et al., 2017).
El Río Amacuzac, ubicado en la parte alta de la cuenca del Río Balsas y con una longitud total de 104 km, es el río más importante en el estado de Morelos, en el centro sur de México. Abarca gran parte del territorio estatal y sus afluentes son aprovechados para distintas actividades de las comunidades aledañas (Contreras-MacBeath et al., 2006; Mejía-Mojica et al., 2015; Ocampo-Molina et al., 2019; Trujillo-Jiménez et al., 2010). El Amacuzac ha sido históricamente utilizado para la pesquería y la dotación de agua para zonas urbanas y procesos agrícolas (Eufracio-Torres et al., 2016). Los primeros estudios ictiológicos en la región datan del siglo XIX, con la descripción de Notropis boucardi (Günther, 1862; Günther, 1868). El Río Amacuzac cuenta con una ictiofauna nativa relativamente pobre (nueve especies) a la que se han sumado 16 especies no nativas (Mercado-Silva et al., 2020). La cuenca del Amacuzac sufre diversas afectaciones antropogénicas, entre las cuales destaca la expansión de especies no nativas producto de aumento en la actividad acuícola en el estado (Contreras-MacBeath et al., 2020; Mejía-Mojica et al., 2015; Mercado-Silva et al., 2020; Trujillo Jiménez et al., 2010). Las especies no nativas podrían convertirse en invasoras y causar el declive de las poblaciones de especies nativas y en algunos casos llevarlas a la extinción (Mills et al., 2004).
Los estudios más recientes sobre la ecología de las comunidades ícticas del Río Amacuzac datan del 2015 (Mejía-Mojica et al., 2015), sin embargo, a lo largo de los años se ha generado conocimiento sobre la composición de las comunidades de peces, su comportamiento, los hábitos de vida de las especies y uso como bioindicadores (Mejía-Mojica et al., 2012; Mejía-Mojica et al., 2013; Mejía-Mojica et al., 2015; Rosales-Quintero, 2016; Trujillo-Jiménez et al., 2010; Trujillo-Jiménez & Castro-Lara, 2008). También se han explorado factores ambientales que ayudan a estructurar las comunidades de peces (Trujillo-Jiménez et al., 2010). Pese a la existencia de numerosos estudios ictiológicos, aún se desconoce cómo contrastan los patrones de diversidad específica y taxonómica de su ictiofauna y los efectos particulares de la llegada de especies no nativas sobre las comunidades nativas.
La diversidad de una comunidad biológica es el resultado de procesos ecológicos e históricos (Bacaro et al., 2007). Analizar de manera conjunta ambos procesos, mejora el entendimiento de la diversidad de las comunidades biológicas (Moreno et al., 2007; Pontarp & Wiens, 2017). Una manera de abordar los patrones de diversidad de manera cuantitativa integrando una perspectiva histórica evolutiva a la diversidad alfa y beta, es a través del uso de índices de diversidad de especies y diversidad taxonómica. Los índices de diversidad de especies se enfocan en analizar una comunidad con base en su riqueza y la abundancia de especies, permitiendo entender su estructura y composición (Gómez-Ortiz & Moreno, 2017). La diversidad taxonómica incorpora la estructura taxonómica que poseen las especies de una comunidad tomando en cuenta la clasificación taxonómica linneana por encima del nivel de especie. Una comunidad tendrá mayor diversidad taxonómica en función de la “estructura taxonómica de sus especies” (categorías taxonómicas). En ciertas circunstancias ecológicas, evolutivas y biogeográficas los índices de diversidad tradicionales tienden a mostrar valores similares que no precisamente reflejan la variabilidad espacial y ambiental a un nivel local; es en estos escenarios donde estas medidas no son redundantes y su uso complementario en la descripción de los patrones de diversidad en las comunidades biológicas permite dilucidar de mejor forma los patrones de diversidad de especies (García de Jesús et al., 2016; Pielou, 1975).
El diseño de estrategias de conservación requiere del conocimiento de los atributos ecológicos de las comunidades biológicas (Moreno, 2001). Para ello no basta con la integración de listados de especies; es necesario tener información de la diversidad de cada comunidad y también de la tasa de cambio entre distintas comunidades; de esta forma se puede conocer la contribución de cada una de ellas a nivel regional (Moreno, 2001; Morrone, 2013). El conocimiento de esta contribución regional permite identificar patrones de diversidad y así generar un conocimiento más completo e integrativo de las comunidades biológicas.
Este trabajo analiza información de campo sobre las comunidades de peces del Río Amacuzac para generar información actualizada acerca de los patrones de diversidad de especies y taxonómica de estas comunidades biológicas con base en la estratificación de variables físicas y de hábitat de los sitios de muestreo a lo largo del cauce principal del Río.
Materiales y métodos
Sitio de estudio: Las aguas que dan origen al Río Amacuzac nacen en las faldas del Volcán Nevado de Toluca (en el Estado de México), donde se origina el Río Chontalcoatlán. Este confluye con los ríos Almoloya y Malinaltenango. Más adelante, con aporte de las aguas del Río San Gerónimo, transcurren de manera subterránea en la zona de calizas de la Sierra de Cacahuamilpa, para emerger en los límites entre los estados de Guerrero y Morelos, en el sitio llamado Dos Bocas. A partir de aquí se le conoce como Río Amacuzac, recorriendo 104 km hasta su unión con el Río Balsas (Contreras-MacBeath et al., 2006; Mejía-Mojica et al., 2015; Ocampo-Molina et al., 2019; Trujillo-Jiménez et al., 2010).
A lo largo de su recorrido, el Amacuzac recibe los aportes de diversos ríos, entre los que se cuentan el Chalma, Tembembe, Apatlaco, Tetlama, Yautepec y Cuautla; muchos de ellos atraviesan zonas urbanas y agrícolas en el norte del estado. La zona de estudio presenta importantes modificaciones a la cubierta vegetal. La cuenca tiene un uso de suelo dominado por el cultivo de caña de azúcar, arroz, hortalizas y flores, la ganadería y la piscicultura (Contreras-MacBeath et al., 2006; Eufracio-Torres et al., 2016; Vargas et al., 2006). El Río forma diversos cañones donde domina aún la vegetación riparia nativa. Numerosas comunidades humanas se han asentado a orillas del Amacuzac, donde estas y muchas zonas de cultivo vierten sus aguas de desecho sin tratamiento directamente al cauce (Contreras-MacBeath et al., 2006; Eufracio-Torres et al., 2016; Vargas et al., 2006).
La zona que atraviesa el Amacuzac tiene un régimen climático cálido subhúmedo, con épocas bien definidas de lluvias (junio a octubre) y sequias (noviembre a mayo). Presenta una precipitación media anual de 72.2 mm y una temperatura media anual de 21.5 °C (Eufracio-Torres et al., 2016; Trujillo-Jiménez et al., 2010). La vegetación natural en la cuenca comprende fragmentos de bosque seco tropical y bosque semicaducifolio (Aguilar, 1999; Eufracio-Torres et al., 2016; Trujillo-Jiménez et al., 2010).
En este trabajo se establecieron 10 sitios de muestreo a lo largo del cauce principal del Río Amacuzac, entre las coordenadas 18°39’16.69” N y 99°27’51.14” W a 18°28’51.80” N y 99°9’58.52” W, abarcando aproximadamente 75 km del río (Fig. 1). La altitud de los sitios fue de los 766 a los 962 m.s.n.m. Cada sitio fue visitado en mayo, julio, septiembre y noviembre de 2019 y en enero de 2020 (cinco eventos de muestreo). Durante el evento de muestreo de septiembre de 2019 el sitio uno no fue visitado debido a dificultades en el acceso. El muestreo se realizó sobre un segmento de entre 100 y 200 m lineales de río que fue muestreado hasta una profundidad máxima de 160 cm. Cuando las condiciones de profundidad lo permitieron, se trabajó en zig-zag a lo largo del segmento cubriendo ambas riberas del río y la zona central abarcando todos los hábitats posibles. Durante la temporada de lluvias, cuando las condiciones de flujo evitaron cubrir con seguridad todo el ancho del río, el muestreo se concentró sobre una de las riberas.
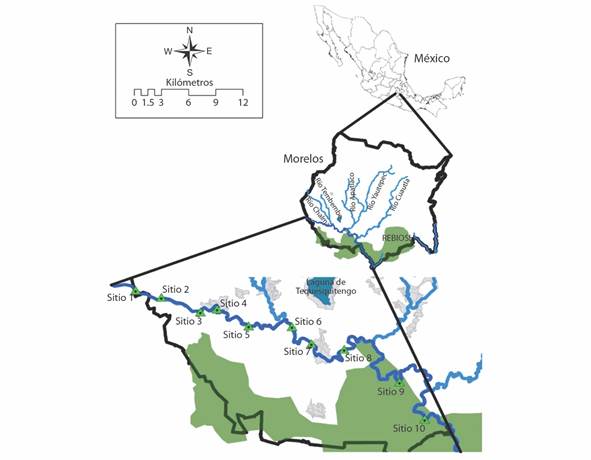
Fig. 1 Ubicación de los sitios de muestreo de las comunidades de peces a lo largo del Río Amacuzac (en azul profundo), Morelos, México. En verde aparece la Reserva de la Biósfera Sierra de Huautla (REBIOSH). Se presenta en gris las concentraciones urbanas en la zona. / Fig. 1. Location of fish community sampling sites along the Amacuzac River (in deep blue), Morelos, Mexico. The Sierra de Huautla Biosphere Reserve (REBIOSH) shown in green. Urban areas are presented in gray.
Toma de datos: En cada sitio de muestreo se obtuvieron variables físicas y del hábitat. La velocidad de la corriente (m/s) y profundidad (cm), se obtuvieron con un flujómetro FP111 (Global Water Instrument) a partir del promedio de tres medidas tomadas de manera aleatoria en cada uno de los sitios de muestreo. El ancho de canal (m) fue medido con una cinta métrica abarcando una línea perpendicular al flujo del río en un punto elegido al azar dentro del sitio de muestreo. Una vez definidas las coordenadas de los sitios de muestreo se obtuvo la altitud (m.s.n.m.) mediante el uso de sistemas de información geográfica (Google Earth Pro). Se estimó la ocurrencia de pozas, corridas y rápidos en cada sitio; dando un valor categórico a cada tipo de hábitat según su abundancia en el sitio (1 = nulo, 2 = recurrente, 3 = ocasional, 4 = común). En cada sitio se calculó el porcentaje de arcilla, limo, arena, grava, piedra y rocas que formó parte del sustrato y se llevó a cabo una caracterización de la zona ribereña alrededor del sitio de trabajo, evaluando la proporción cubierta por humedal, pasto, arbustos, bosque, con uso por ganado, uso agrícola, uso habitacional y/o urbano. Las definiciones de cada una de estas clasificaciones se obtuvieron siguiendo los criterios de valoración visual de calidad ambiental descritos por Hernández-Guerrero (2015).
Para la obtención de muestras de las comunidades de peces se utilizaron tres métodos de captura de peces. En cada evento de muestreo se llevaron a cabo seis arrastres con red tipo chinchorro de tres metros y tres arrastres con red de seis metros; ambos chinchorros tuvieron una luz de malla de 0.5 cm y una profundidad de 1.5 m. Además, se llevaron a cabo 10 lances con red tipo atarraya; la red tuvo una luz de malla de 1 cm y diámetro de apertura de 2.5 m. Finalmente, se llevaron a cabo muestreos de 30 minutos de pesca eléctrica efectiva (tiempo efectivo de descarga) con un equipo tipo mochila (ETS-electrofishing Co, Modelo ABP-3). Estas artes de pesca y su implementación se mantuvieron durante todos los eventos de muestreo y fueron utilizados para cubrir todos los tipos de hábitat disponibles en los sitios de trabajo. En los esfuerzos de muestreo las artes de pesca se utilizaron en porciones distintas del mismo para evitar doble esfuerzo de muestreo en un hábitat determinado.
Después de la utilización de cada uno de los métodos de muestreo, los organismos obtenidos se separaron e identificaron a nivel de especie siguiendo criterios de Álvarez (1970), Armbruster y Page (2006), Chávez et al. (2006), Meek (1904), Miller (2009), y Schmitter-Soto (2007). Ejemplares de Oreochromis sp. se identificaron solo a nivel de género debido a la dificultad en su identificación en etapas juveniles y la hibridación que se da entre las especies del género que han sido introducidas en el Amacuzac. Los organismos se contabilizaron en campo para obtener los datos de riqueza y abundancia por especie (Oreochromis sp. se consideró como una especie). Mientras eran procesados, los peces se mantuvieron con aireación constante, para evitar la muerte de ejemplares. Una vez concluida la toma de datos los peces muestreados se liberaron al río en el mismo sitio donde fueron capturados.
Análisis de datos: Se realizaron dos análisis independientes. El primero fue para llevar a cabo estratificación (conglomerados) de eventos de muestreo según los atributos del hábitat de los 10 sitios de muestreo. El segundo fue para evaluar la diversidad alfa y beta de peces, integrando la diversidad de especies y la diversidad taxonómica en los estratos definidos mediante el análisis de conglomerados.
Para proceder con el primer análisis, los valores de cada una de las variables ambientales y de hábitat obtenidas en campo fueron estandarizados a valores de Z. Se consideraron los valores de todas las variables tomadas en los meses de mayo y octubre de 2019. En seguida se llevó a cabo un análisis de correlación de Spearman para estimar la relación entre las variables físicas y de hábitat (Martínez-Ortega et al., 2009). Posterior al análisis de correlación de Spearman las variables que no presentaron dependencia entre sí y aquellas que se ha reportado presentan influencia sobre los peces se utilizaron para realizar un análisis de conglomerados (a través del análisis K-medias) (Amoros & Bornette, 2002; Feijoó et al., 2012; Growns et al., 2003; Kern & Langerhans, 2018; Pelicice et al., 2008; Petry et al., 2003). Este análisis permitió agrupar los sitios mediante su grado de similitud con base en las variables caracterizadas. Cada conglomerado estuvo representado por el promedio de los valores de Z de cada variable. Los análisis utilizados para agrupar los sitios de muestreo se realizaron en el programa Statistica 7 (StatSoft, 2004). Los conglomerados (grupos) obtenidos se utilizaron para conjuntar los datos de los peces obtenidos en cada uno de los eventos de muestreo.
Los análisis de diversidad alfa y beta se basaron en los datos de las comunidades de peces y se realizaron considerando los grupos formados mediante el análisis de conglomerados descrito y la fecha de los eventos de muestreo. Se llevaron a cabo análisis de diversidad de especies y diversidad taxonómica para cada uno de los grupos de sitios del Río Amacuzac definidos a partir del análisis de conglomerados. Para cada uno de estos grupos se calculó la completitud del inventario mediante el análisis de la cobertura de la muestra (Cm) (Chao & Jost, 2012). Los análisis de las comunidades de peces se llevaron a cabo en el programa iNEXT online (Chao et al., 2016).
Para los análisis de diversidad alfa nos enfocamos en dos facetas de la biodiversidad: diversidad de especies y diversidad taxonómica (Gómez-Ortiz & Moreno, 2017; Violle et al., 2007). La diversidad de especies se calculó obteniendo el número efectivo de especies de orden 1 (q1) con intervalos de confianza al 95 % (P < 0.05) y 100 permutaciones, en el programa iNEXT online (Chao et al., 2016; MacGregor-Fors & Payton, 2013). En este procedimiento, todas las especies son incluidas con un peso proporcional a su abundancia en la comunidad, donde los valores de q mayores a 1, dan mayor peso a las especies comunes (Moreno et al., 2011). Para el caso de la diversidad taxonómica se empleó el índice de distancia taxonómica promedio (∆+) (Warwick & Clarke, 1998), que se define como el grado de relación entre las especies dentro de la estructura taxonómica de una comunidad. Este análisis se realizó con el programa PRIMER v. 5 (Clarke & Gorley, 2001).
Para analizar la diversidad beta a nivel de especies y a nivel taxonómico se estimó la similitud entre las comunidades previamente definidas con el índice de Morisita-Horn (en PAST v. 4.06) (Hammer & Harper, 2006). Las matrices de similitud fueron utilizadas para llevar a cabo un análisis de ordenación mediante escalamiento multidimensional no-métrico (NMDS) (Chávez-López & Rocha-Ramírez, 2020). El NMDS permitió visualizar la similitud de especies entre los grupos de sitios.
Resultados
La selección de variables físicas y de hábitat resultó en la permanencia de las variables velocidad de la corriente, ancho de canal, dominancia de corridas y rápidos, porcentaje de grava, piedra y rocas y la proporción cubierta por pasto, bosque y uso urbano. A partir de estas variables, el análisis de conglomerados formó cuatro grupos (G); el grupo uno (G1) estuvo compuesto por un solo sitio (S10), los tres grupos restantes estuvieron compuestos por tres sitios cada uno (G2: S1, S3 y S5; G3: S2, S4 y S7; G4: S6, S8 y S9). El grupo uno se caracterizó por valores menores en las variables de velocidad de la corriente (0.23 m/s), ancho de canal (17.5 m), corridas (1), rápidos (2), grava (5), piedra (15), pastos (0.5), bosque (2) y área urbana (0.5). Los tres grupos restantes mostraron valores similares de velocidad de la corriente (min. = 0.4 m/s, máx. = 0.78 m/s), ancho del canal (min. = 40 m, máx. = 68 m), corridas (min. = 2, máx. = 3), rápidos (min. = 3.5, máx.= 4) y pastos (min. = 1.5, máx. = 2). El grupo dos se separó de los demás por una mayor presencia de bosque (3.5) y valores bajos de áreas urbanas (min. = 1, máx. = 1.5). El grupo tres tuvo mayor proporción de piedras (min. = 32.5, máx. = 55) y áreas urbanas (min. = 2, máx. = 3.5), y menor cantidad de rocas (min. = 5, máx. = 17.5) y bosque (min. = 2, máx. = 2.5). El grupo cuatro presentó una mayor proporción de grava (min. = 10, máx. = 30), roca (min. = 15, máx. = 67.5), pastos (2) y áreas urbanas (min. = 1.5, máx. = 3.5); la proporción de piedras (min. = 15, máx. = 20.5) y bosque (min. = 2, máx. = 2.5) fue relativamente baja en estos sitios.
La cobertura de la muestra reveló valores por arriba de 0.80, siendo G1-sep-19 el que presentó el menor valor (0.84). Los grupos G1-jul-19; G2-ene-20; G3-ene-20; G4-jul-19 y G4-sep-19, tuvieron un valor de 1.00.
A lo largo de todos los muestreos se capturaron un total de 7 638 individuos de 16 especies (nueve familias, 15 géneros) de las cuales siete son nativas (siete familias, siete géneros) y nueve son no nativas (cinco familias, nueve géneros). Las especies más abundantes fueron: Poeciliopsis gracilis (n = 2 246), Poecilia maylandi (n = 1 277) y Amatitlania nigrofasciata (n = 1 220). Las especies con menor cantidad de organismos capturados fueron Pterygoplichtys pardalis (n = 15), Ilyodon whitei (n = 14), Copadichromis borleyi (n = 2) e Ictalurus punctatus (n = 1). Las especies con la mayor prevalencia fueron A. nigrofasciata, Amphilophus istlanus, Andinoacara rivulatus, Notropis boucardi, Oreochormis sp., P. maylandi, P. gracilis y Thorichthys maculipinis presentes durante los cinco eventos de muestreo y en los 10 sitios; seguidas de Astyanax aeneus y Pseudoxiphophorus bimaculatus presentes en cinco eventos de colecta y nueve sitios. Las especies más restringidas fueron Atherinella balsana (4 eventos de muestreo/2 sitios), C. borleyi (2 eventos de muestreo/1 sitio), I. punctatus (1 evento de muestreo/1 sitio).
Considerando todos los eventos de muestreo, la abundancia de especies nativas (n = 3 036) fue menor que la abundancia de individuos de especies no nativas (n = 4 602). Dentro de las especies nativas P. maylandi e I. whitei tuvieron la mayor (n = 1 277) y menor (n = 14) abundancia total, respectivamente. Para las especies no nativas la mayor abundancia total se registró para P. gracilis (n = 2 246) seguida de A. nigrofasciata (n = 1 220). Las especies C. borleyi (n = 2) y P. pardalis (n = 15) fueron comparativamente poco abundantes en los muestreos realizados.
La riqueza de especies varió entre un mínimo de ocho especies (G1-jul-19) y un máximo de 13 especies (G1-ene-20; G4-jul-19; G4-nov-19) (Tabla 1). La mayor abundancia de individuos capturados la presentaron los eventos de muestreo G2-jul-19 (n = 1 021), G3-jul-19 (n = 819) y G4-may-19 (n = 800). La menor abundancia de especies en un evento de muestreo fue de 16 individuos (G1-sep-19) (Tabla 1).
Tabla 1 Registro temporal de especies en el Río Amacuzac. / Table 1. Temporal record of species in the Amacuzac River.
| Especie | 1898-1901 | 1945-1953 | 1971-1980 | 1994-1995 | 2008-2009 | 2010 | 2019-2020 |
| Astyanax aeneus* | X | X | X | X | X | X | X |
| Atherinella balsana* | 0 | X | 0 | 0 | X | X | X |
| Awaous banana* | X | 0 | 0 | 0 | 0 | 0 | 0 |
| Amphilophus istlanus* | X | X | X | X | X | X | X |
| Agonostomus monticola* | X | 0 | 0 | 0 | 0 | 0 | 0 |
| Amatitlania nigrofasciata | 0 | 0 | 0 | X | X | X | X |
| Andinoacara rivulatus | 0 | 0 | 0 | 0 | X | X | X |
| Copadichromis borleyi | 0 | 0 | 0 | 0 | 0 | 0 | X |
| Ictalurus balsanus* | X | X | X | X | X | X | X |
| Ictalurus punctatus | 0 | 0 | 0 | 0 | 0 | 0 | X |
| Ilyodon whitei* | 0 | 0 | X | X | X | 0 | X |
| Notropis boucardi* | X | X | 0 | 0 | X | X | X |
| Oreochromis sp. | 0 | 0 | X | X | X | X | X |
| Poecilia maylandi* | X | X | X | X | X | 0 | X |
| Poeciliopsis balsas* | X | X | X | 0 | 0 | 0 | 0 |
| Poeciliopsis gracilis | 0 | 0 | 0 | X | X | X | X |
| Poecilia reticulata | 0 | 0 | X | X | X | 0 | 0 |
| Poecilia sphenops* | 0 | 0 | 0 | 0 | 0 | X | 0 |
| Pterygoplichthys disjunctivus | 0 | 0 | 0 | 0 | X | X | 0 |
| Pterygoplichthys pardalis | 0 | 0 | 0 | 0 | X | 0 | X |
| Pseudoxiphophorus bimaculata | 0 | 0 | 0 | X | X | X | X |
| Thorichthys maculipinnis | 0 | 0 | 0 | 0 | X | 0 | X |
| Xiphophorus helleri | 0 | 0 | 0 | 0 | 0 | X | 0 |
| Especies | 8 | 7 | 8 | 10 | 16 | 13 | 16 |
| Especies nativas | 8 | 7 | 6 | 5 | 7 | 6 | 7 |
| Especies no nativas | 0 | 0 | 2 | 5 | 9 | 7 | 9 |
Una “X” representa la presencia y un “0” la ausencia de la especie en el periodo de tiempo (años). *especie nativa. Basado en Trujillo-Jiménez et al. (2010), Mejía-Mojica et al. (2015) y la presente investigación. / “X” indicates presence and “0” absence of the species in a given time period (years). * native species. Based on Trujillo-Jiménez et al. (2010), Mejía-Mojica et al. (2015) and this investigation.
Los valores obtenidos de los análisis de diversidad alfa mostraron poca variación entre los grupos dos, tres y cuatro, con excepción del G4-may19, que presentó un valor más bajo y distinto a los demás eventos de muestreo de este grupo (3.96). El grupo uno mostró la mayor variación en diversidad alfa entre las temporadas de muestreo. La mayor diversidad alfa se obtuvo en el G1-sep-19 (11.64) y el G1-ene-20 (10.00); la menor diversidad ocurrió en el G1-may-19 (2.35) y el G1-nov-19 (2.88) (Fig. 2).
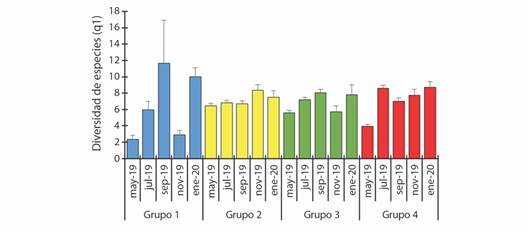
Fig. 2 Diversidad de orden 1 de las comunidades de peces del Río Amacuzac para cinco eventos de muestreo en mayo, julio, septiembre, noviembre y enero de 2019 y 2020. Las barras de error representan los intervalos de confianza al 95 % (< 0.05). Los sitios conforman grupos derivados del análisis de conglomerados. / Fig. 2. Diversity of order 1 of the fish communities of the Amacuzac River for five sampling events in May, July, September, November and January of 2019 and 2020. Error bars are 95 % confidence bars (< 0.05). Site groups derived from the cluster analysis.
El análisis NMDS sobre los valores de diversidad beta muestra al grupo uno como el más lejano en cuanto a la estructura de sus comunidades a través de los eventos de muestreo. El Grupo 2 también se alejó de los demás grupos; sin embargo, presentó similitud con el Grupo 3 durante el muestreo de may-19. Para los Grupos 3 y 4 se observó una alta similitud (Fig. 3).
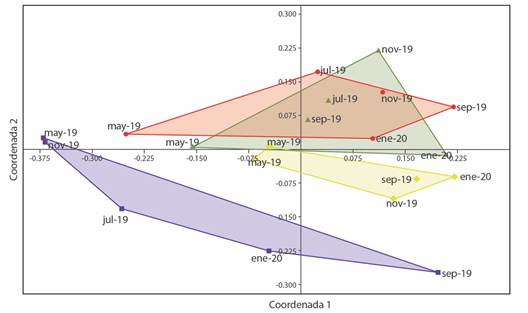
Fig. 3 Agrupamiento de la diversidad beta a nivel de especies de las comunidades de peces del Río Amacuzac (Morelos, México) obtenida del análisis NMDS. Las claves alfa-numérica de los puntos corresponden a los meses de muestreo (ene = enero, may = mayo, jul = julio, sep = septiembre, nov = noviembre) y los números al año de muestreo (19 = 2019, 20 = 2020). / Fig. 3. Grouping of beta diversity at the species level of the fish communities of the Amacuzac River (Morelos, Mexico) obtained from NMDS analysis. Alpha-numeric keys in each point are to sampling months (ene = January, may = May, jul = July, sep = September, nov = November) and year (19 = 2019, 20 = 2020).
La diversidad taxonómica alfa fue alta; tuvo un valor mínino de 81.94 (G1-may-19) y un máximo de 92.86 (G1-jul-19). La mayoría de los grupos de muestreo presentaron una distribución cercana a la diversidad taxonómica promedio esperada (90.7). La diversidad taxonómica alfa durante los distintos eventos de muestreo del Grupo 1 fue la que presentó la mayor variación (min. = 81.94 - máx. = 92.86) (Fig. 4).
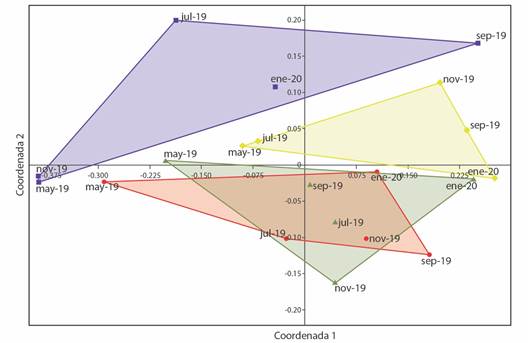
Fig. 4 Agrupamiento de la diversidad beta taxonómica de las comunidades de peces del Río Amacuzac (Morelos, México) obtenida del análisis NMDS. Las claves alfa-numérica de los puntos corresponden a los meses de muestreo (ene= enero, may= mayo, jul= julio, sep= septiembre, nov= noviembre) y los números al año de muestreo (19= 2019, 20= 2020). / Fig. 4. Grouping of taxonomic beta diversity of the fish communities of the Amacuzac River (Morelos, Mexico) from NMDS analysis. Alpha-numeric keys in each point are to sampling months (ene= January, may= May, jul= July, sep= September, nov= November) and year (19= 2019, 20= 2020).
En el nivel beta de diversidad taxonómica el Grupo 3 y el Grupo 4 fueron los únicos que presentaron similitud en cuanto a su estructura taxonómica (Fig. 5). El Grupo 2 tuvo una estructura taxonómica más cercana a las dos mencionadas anteriormente, sin embargo, no presentó un sobrelapamiento con estas comunidades. El Grupo 1 presentó una estructura taxonómica distinta a los demás grupos de muestreo (Fig. 5).
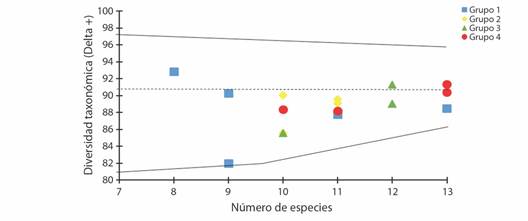
Fig. 5 Diversidad taxonómica de las comunidades de peces en el Río Amacuzac. Las líneas continuas representan los intervalos de confianza al 95 % (< 0.05); la línea punteada es la diversidad taxonómica promedio estimada (90.07). / Fig. 5. Taxonomic diversity of fish communities in the Amacuzac River. The continuous lines represent the 95 % confidence intervals (< 0.05); the dotted line is the estimated average taxonomic diversity (90.07).
Discusión
Históricamente en el Río Amacuzac se han registrado 22 especies de peces, de las cuales menos de la mitad corresponde a especies nativas (Contreras-Balderas et al., 2008; Contreras-MacBeath, 1991; Contreras-MacBeath et al., 1998; Contreras-MacBeath et al., 2020; Mejía-Mojica et al., 2012; Mercado-Silva et al., 2020; Trujillo-Jiménez et al., 2010). Factores como la sobreexplotación, la contaminación, introducción de especies no nativas y el deterioro de su hábitat ha modificado la estructura y composición de las comunidades a lo largo del tiempo, provocando la desaparición de parte de la ictiofauna y el establecimiento de nuevos componentes (Contreras-MacBeath et al., 2020; Meador et al., 2003; Mejía-Mojica et al., 2012; Mercado-Silva et al., 2020; Rahel, 2000; Torres-Orozco & Pérez-Hernández, 2011; Trujillo-Jiménez et al., 2010). Las presiones antropogénicas sobre las comunidades de peces del Amacuzac no han cesado y nuestros análisis corroboran una mayor riqueza de especies no nativas, lo que apunta a su capacidad de colonización y supervivencia (Alcaraz et al., 2008; Contreras-MacBeath et al., 2014; García-Berthou et al., 2015; McNeely, 2001; Mendoza & Koleff, 2014; Mercado-Silva et al., 2020; Noble et al., 2007; Williams & Meffle, 2005; Wilson, 2005). Aun así, cuatro especies nativas (A. istlanus, A. aeneus, N. boucardi y P. maylandi) que aún permanecen en el río parecen ser resilientes ante los impactos recibidos, al presentarse en abundancias relativamente altas a lo largo de los eventos de muestreo. Otras especies nativas (A. balsana e I. whitei) se presentan en baja abundancia relativa y con baja prevalencia, lo que sugiere posibles reducciones en sus poblaciones.
La evaluación de la diversidad alfa y beta de las comunidades de peces en el Río Amacuzac con dos aproximaciones (diversidad de especies y diversidad taxonómica) arrojó una relación directa entre la diversidad de especies observada y la diversidad taxonómica. Dicha relación puede deberse a la constante modificación de las comunidades de peces, principalmente a causa de la introducción de especies no nativas. La entrada de especies no nativas genera no solo el incremento de la riqueza de especies, sino la adición de elementos en distintos niveles taxonómicos, que representa una tendencia constante desde hace varias décadas en el Río Amacuzac (Contreras-MacBeath et al., 2020; Mejía-Mojica et al., 2012; Mercado-Silva et al., 2020; Trujillo-Jiménez et al., 2010).
La facilidad de establecimiento para las especies no nativas en el Río Amacuzac se puede deber a dos factores. En primera instancia puede deberse a la baja riqueza de especies nativas que presenta el río; comunidades con menor número de especies podrían presentar una menor resistencia a la introducción de nuevas especies, con base a la cantidad de espacios y recursos disponibles y el menor grado de competencia interespecífica (Byers & Noonburg, 2003). Por otra parte, las más de 150 granjas de cultivo de peces que se encuentran distribuidas a lo largo del Río Amacuzac y sus tributarios pueden propiciar la introducción y establecimiento de especies no nativas (Kanchi et al., 2021; Mercado-Silva et al., 2020). En estas granjas se cultivan numerosas especies para su uso pesquero y ornamental. El establecimiento de la actividad acuícola en la cuenca del Amacuzac tuvo un impulso importante durante los años 1980 (Kanchi et al., 2021; Martínez-Espinosa et al., 2013; Mendoza-Alfaro et al., 2017; Romero-Espín, 2015; Romero-Espín, 2018). Esto propició la expansión de la actividad para fines de consumo (principalmente con cíclidos del género Oreochromis) y de ornato (i.e., Pterigoplichthys sp.). Gracias a este impulso y a las condiciones climáticas ventajosas para el cultivo de peces, en el año 2000 el Estado de Morelos fue considerado líder en la producción y exportación de peces dulceacuícolas (Kanchi et al., 2021; Mejía-Mojica et al., 2012; Mejía-Mojica et al., 2015; Mercado-Silva et al., 2020; SAGARPA, 2012). A partir de la expansión de la actividad acuícola, algunas especies comenzaron a ser deliberadamente introducidas a los cuerpos de agua de la cuenca. Se han registrado en vida libre especies como A. nigrofasciata, A. rivulatus, Poecilia reticulata, P. gracilis, P. disjuntivus, P. pardalis, P. bimaculata, T. maculipinnis y Xiphophorus helleri, que se producen en la cuenca con fines de ornato e I. punctatus y varias especies del género Oreochromis que son producidas para consumo humano (Mercado-Silva et al., 2020). Hoy en día se producen en la región al menos 59 especies no nativas que tienen potencial de colonización a los distintos cuerpos de agua (Mercado-Silva et al., 2020), aunque no todas presentan el mismo potencial para establecerse en cuerpos de agua naturales en el estado (Mendoza-Alfaro et al., 2017; Romero-Espín, 2015; Romero-Espín, 2018). Además, existen algunas especies en cultivo que, aunque ya están presentes en los cuerpos de agua del estado, a partir de las actividades acuícolas tienen una elevada presión de propágulo que podría reforzar las poblaciones de especies no nativas que se encuentran ya establecidas (Mercado-Silva et al., 2020; Romero-Espín, 2015; Romero-Espín, 2018).
Entre las especies con alto potencial invasor se encuentra C. borleyi, que hoy ya consideramos establecida en el Amacuzac. En nuestros muestreos, la especie fue capturada durante dos eventos de muestreo distintos y pobladores de la región reportan que su presencia está en aumento. Esta especie es producida con fines de acuarismo y es un potencial competidor para otras especies de la cuenca, pudiendo modificar la dinámica de las comunidades que se han establecido hasta el momento (Bernardo et al., 2003; Canonico et al., 2005; Mejía-Mojica et al., 2015; Pino Del Carpio et al., 2010; Ricciardi & Kipp, 2008).
La constante adición de especies nuevas de peces al río, conlleva a un incremento en los valores de diversidad bajo distintas aproximaciones y nos brinda un panorama sobre los cambios a nivel funcional que pueden estarse presentando (alimentación, reproducción, uso de hábitat, etc.) (Mejía-Mojica et al., 2012; Rosales-Quintero, 2016; Trujillo-Jiménez et al., 2010). Aunque en este trabajo no se ahonda en los atributos funcionales de las especies del Amacuzac, recomendamos que se profundice en el estudio comparativo de la ecología funcional de las especies para que sea factible dilucidar algunos de los procesos ecológicos y evolutivos que influyen, a diferentes escalas espacio-temporales en la cuenca (García de Jesús et al., 2016; García-López et al., 2013).
Un patrón constante en las diversas investigaciones que se han llevado en la cuenca del Amacuzac es la mayor abundancia de las especies no nativas con relación a las especies nativas (Archundia et al., 2018; Contreras-MacBeath, 1991; Luna-Figueroa & Figueroa, 2003; Mejía-Mojica et al., 2015; Mercado-Silva et al., 2020; Rosales-Quintero, 2016; Trujillo-Jiménez et al., 2010). Las familias mejor representadas durante nuestra investigación fueron Poecilidae y Cichlidae. De modo similar a lo observado en estudios previos (Bonilla-Román, 2020; Contreras-MacBeath et al., 2020; Mejía-Mojica, 2007; Trujillo-Jiménez et al., 2010), nuestros resultados arrojan una mayor abundancia de la especie no nativa P. gracilis, en contraste con la especie nativa P. maylandi. Debido a la similitud en sus hábitos ambas especies pueden presentar competencia por alimento, refugio o sitios de reproducción, siendo observadas con una constante interacción (Bonilla-Román, 2020; Contreras-MacBeath et al., 2020; Mejía-Mojica, 2007).
Para el caso de los cíclidos, la especie no nativa A. nigrofasciata, había sido previamente capturada en alta abundancia en comparación con la nativa A. istlanus, reportada en abundancias bajas (Archundia et al., 2018; Mejía-Mojica et al., 2012; Trujillo-Jiménez, 1998; Trujillo-Jiménez et al., 2010). En nuestros resultados, aunque A. nigrofasciata presentó abundancias elevadas con relación a otras especies, esta no fue mayor a la observada para el cíclido nativo. Adicionalmente, en combates experimentales se ha demostrado que A. istlanus es dominante frente a A. nigrofasciata, lo cual podría sugerir que la competencia por interferencia no explica el número de individuos observados en el Río (Archundia & Arce, 2019; Franco & Arce, 2022; Molina et al., 2021). Otros estudios han reportado que estas especies no presentan competencia por alimento al ser la nativa carnívora y la no nativa entomófago-omnívora. Sin embargo, se ha evidenciado que existe competencia por espacios de reproducción y anidación (Archundia et al., 2018; McKaye, 1977; Trujillo-Jiménez, 1998; Wisenden, 1995). La alta abundancia de la especie no nativa podría generar una mayor presión, y con ello un efecto negativo sobre la especie nativa. Sin embargo, la especie nativa ha desarrollado conductas que le ayudan a lidiar con la presión que ejerce la especie no nativa (Archundia & Arce, 2019; Archundia et al., 2018; McKaye, 1977; Wisenden, 1995). Estas incluyen el incremento del tiempo que usa refugios, reducción del tiempo de nado y del alimento consumido (De la Torre Zavala et al., 2018). Con ello se puede explicar que sea común encontrar baja abundancia y tallas menores de A. istlanus donde A. nigrofasciata es abundante y presenta tallas mayores, y viceversa. Nuestra investigación sugiere, al igual que otros trabajos (Archundia & Arce, 2019; Franco & Arce, 2022; Molina et al., 2021) que las poblaciones de la especie nativa no necesariamente están siendo reducidas, al haber áreas donde la especie nativa es dominante. Sin embargo, es importante mantener atención sobre las interacciones entre estas especies y los posibles efectos de la presión de la especie no nativa.
Este estudio describe los patrones de diversidad de peces a lo largo del Río Amacuzac y actualiza el conocimiento sobre este grupo taxonómico. Del mismo modo, destaca la importancia de emplear métodos complementarios para el análisis de la diversidad. La información generada nos brinda mejores bases para el desarrollo de estrategias de conservación para la ictiofauna del Río Amacuzac. Para futuras investigaciones es importante analizar la diversidad funcional y analizar el efecto de las variables ambientales que podrían modificar los patrones de distribución y establecimiento de especies no nativas en el Río Amacuzac.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


