Introducción
La distribución geográfica es definida como el espacio en donde una especie puede encontrarse (Espinosa et al., 2001), la cual puede cambiar en el tiempo. La presencia de una especie en el espacio está determinada por la disponibilidad de recursos que satisfacen su requerimiento de nicho (Silva-López & Abarca, 2009), el cual es diferente para cada especie. Tal respuesta diferencial en el ambiente determina las variaciones espaciales en la composición local de las especies (Espinosa et al., 2002; Rumbo, 2010), aun cuando están estrechamente relacionadas (Hickman et al., 1993; Rumbo, 2010). Identificar los factores ambientales que se relacionan con la presencia de un conjunto de especies filogenéticamente cercanas permite explicar los patrones que originaron y modificaron su distribución geográfica (Llorente & Morrone, 2001).
Las áreas que presentan mayor variación en la composición de especies son aquellas que presentan una alta heterogeneidad ambiental (Wilson, 2000), ya sea por cambios en la elevación, clima o influencia de distintas regiones biogeográficas. México es un país con una alta diversidad de especies debido a que presenta variaciones en su elevación, cuenta con distintos sistemas montañosos, la influencia de los meteoros que se forman en el océano Atlántico y Pacífico y convergen las regiones biogeográficas del Neártico y Neotrópico (Arriaga-Flores et al., 2018). Sin embargo, es un país que presenta cuatro hotspots, que son áreas con un alto endemismos de plantas y en donde se perdió cerca del 70 % de su cobertura (Rzedowski, 2006).
Los estudios que abordan la biogeografía de los moluscos terrestres mexicanos utilizan a las regiones neártica, neotropical y variantes de estas para asignar las afinidades zoogeográficas de las especies (Correa-Sandoval, 1999; Correa-Sandoval et al., 2007; Correa-Sandoval et al., 2012), siendo Spiraxidae la familia con el mayor número de especies en México (Thompson, 2009) de distribución neotropical y parcialmente neártica (Correa-Sandoval et al., 2017). Esta afinidad principalmente neotropical se debe a que en esta región se encuentran ambientes más húmedos que favorece la actividad, distribución y la diversidad de los gasterópodos terrestres (Correa-Sandoval et al., 2009) y ambientes con amplias coberturas de vegetación que proveen de protección contra desecación y refugio (Correa-Sandoval et al., 2009).
Spiraxidae es una familia Neotropical que posee 260 especies en Centroamérica y México (Thompson, 2009), y específicamente en México se conocen 211 (Naranjo-García, 2014; Thompson, 2011), lo que representa alrededor del 18 % de las especies de gasterópodos terrestres en México. Esta familia se caracteriza por presentar un alto grado de endemismo, llegando a reportarse que cerca del 94 % de las especies son endémicas en ciertas zonas del país (Correa-Sandoval, 1999). Los caracoles de esta familia son carnívoros, a diferencia de la mayoría de los caracoles terrestres que son micrófagos o herbívoros (Speiser, 2001).
El presente estudio analizó la distribución de la familia Spiraxidae en México para establecer los componentes biogeográficos y la relación con los tipos de vegetación. Con ello también se buscó determinar la riqueza específica a nivel de estados y provincias biogeográficas, además de comparar su distribución con las distintas zonas de protección en México. Adicionalmente, se apoyó en un modelo de distribución potencial de las especies para identificar los centros de riqueza de la familia, segregación espacial de las especies y zonas con una composición de especies similar. Por último, se analizó la influencia de distintos factores ambientales en la ausencia-presencia de las especies.
Materiales y métodos
Registros de recolecta: Los registros de las especies de la familia Spiraxidae en México fueron obtenidos de la Colección Malacológica del Instituto Tecnológico de Ciudad Victoria (TAM-CEVS-CC-0001-15), de literatura especializada (Thompson, 2011) y del portal Global Biodiversity Information Facility (GBIF.org, 2019). Los registros que fueron utilizados incluyeron sólo aquellos que tuvieran las coordenadas geográficas, localidad y nombre del colector. Los registros fueron depurados para evitar incluir datos duplicados. Las coordenadas geográficas de las localidades fueron recuperadas del programa Google Earth descartando aquellos registros cuya descripción de la localidad resultó confusa. El listado de especies fue generado incluyendo el número de veces en que fue registrada cada especie y su distribución en el país, con el que se pudo establecer cuáles son los estados y las provincias biogeográficas que cuentan con la mayor riqueza de especies de Spiraxidae en México. Este listado también sirvió para determinar si las especies se encuentran dentro de las Áreas Naturales Protegidas (ANP).
Afinidad zoogeográfica: La afinidad se asignó a nivel de especie o subespecie según Correa-Sandoval (1999) y Correa-Sandoval (2003), utilizando el símbolo “NT” al indicar aquellas especies con localidades registradas exclusivamente en la región neotropical (al sur del Trópico de Cáncer), el símbolo “NA” indicando una distribución en la región neártica (exclusivamente al norte de la referencia latitudinal señalada), “PA” para referirse a las especies con una distribución panamericana, es decir, presentes tanto al norte y sur del Trópico de Cáncer. El mayor número de localidades conocidas para una especie en la región neotropical o neártica se señala con “p” (principalmente) enseguida de “NT” o “NA”, además de la segunda afinidad (NTp y NA o NAp y NT), refiriéndose a las especies con presencia en ambas regiones, pero con una proporción mayor al 50 % de sus localidades registradas en una de ellas.
Agrupación de los registros de colecta: Los registros fueron analizados para poder observar la similitud que existe entre los distintos tipos de vegetación donde las especies de Spiraxidae se encuentran y para establecer grupos de especies de acuerdo con el tipo de vegetación. La similitud taxonómica entre los distintos tipos de vegetación en México (Tabla 1) (Rzedowski, 1990) fue determinada con un análisis de agrupamiento aglomerativo utilizando los datos de ausencia-presencia de las especies de Spiraxidae. La agrupación se realizó con el programa STATISTICA (STATISTICA, 2008) usando el algoritmo de Ward, debido a su capacidad de crear grupos pequeños y uniformes (Szmrecsanyi, 2012), y la medida de distancia de Sorensen-Dice debido a que supone un muestreo imperfecto. El valor de corte se definió al observar el punto de estabilización de la curva de acumulación de unión que identifica la distancia en la que la composición entre grupos es diferente (Venegas-Barrera & Manjarrez, 2011). Un análisis de k-medias generalizado fue realizado para establecer grupos de especies similares en función a los tipos de vegetación donde fueron registrados. Este análisis busca el número óptimo de pequeños grupos donde un grupo se puede dividir. El análisis de k-medias generalizado permite el uso de variables categóricas, en este caso ausencia-presencia de las especies, partiendo de la hipótesis nula que la frecuencia de especies por grupo es similar con una probabilidad de 0.05.
Tabla 1 Claves y tipos de vegetación utilizados en los análisis de agrupamiento. / Table 1. Keys and vegetation types used in cluster analyses.
| Clave | Tipo |
| VAS | Vegetación acuática y subacuática |
| P | Pastizal |
| MX | Matorral xerófilo |
| BTS | Bosque tropical subcaducifolio |
| BTP | Bosque tropical perennifolio |
| BTC | Bosque tropical caducifolio |
| BMM | Bosque mesófilo de montaña |
| BE | Bosque espinoso |
| BCE | Bosque de coníferas y encino |
Modelos de distribución de especies: La distribución de las especies de Spiraxidae se estimó con el algoritmo de máxima entropía Maxent v. 3.3.0-beta (Dudik et al., 2009), el cual busca combinaciones de variables con máxima entropía y estima la importancia de estas en la distribución de las especies (Elith et al., 2010). Se solicitó el formato de salida cloglog, ya que resulta el más apropiado cuando solo se utilizan presencias (Phillips et al., 2017) y las características “Linear”, “Quadratic” y “Product”, la cual resulta la mejor combinación cuando se combinan variables “categóricas” y “continuas” (Phillips et al., 2017).
El modelo fue realizado solo con las especies que se registraron en al menos ocho localidades (Phillips et al., 2006), utilizando variables de vegetación, suelo y precipitación (Tabla 2) que resultan influyentes en la presencia de los gasterópodos terrestres (Naranjo-García, 2014). Las variables fueron homogeneizadas a una resolución espacial de 30″ (~1 km). Se realizó una regresión multiple para evitar incluir variables correlacionadas, incluyendo solo aquellas variables con un valor de VIF (1/1-R) > 5.
Tabla 2 Variables utilizadas en los modelos de distribución potencial y en el Análisis de Marginalidad Media (AMM). / Table 2. Variables used in the potential distribution models and in the Outlying Mean Index (OMI).
| Variables | Fuente | Tipo |
| Porcentaje de árboles deciduos | earthenv.org | continua |
| Porcentaje de árboles perennes | earthenv.org | continua |
| Porcentaje de árboles de hoja delgada | earthenv.org | continua |
| Porcentaje de arbustos | earthenv.org | continua |
| pH en el suelo | soilgrids.org | continua |
| Tipo de suelo | soilgrids.org | categórica |
| Textura de suelo | soilgrids.org | categórica |
| Elevación | worldclim.org | continua |
| Precipitación total anual | worldclim.org | continua |
| Porcentaje de precipitación en verano | worldclim.org | continua |
| Porcentaje de precipitación en otoño | worldclim.org | continua |
| Temperatura | worldclim.org | continua |
| Ecorregión | wwf.org | categórica |
El AMM solo incluyó variables de tipo continuo. / The (OMI) only included variables of the continuous type.
Los registros que se encontraron a menos de 10 km entre si fueron eliminados para evitar la autocorrelación espacial. En el caso de las especies que contaron con menos de 25 registros se realizó una prueba de Jacknife, para la validación de la predicción de los modelos (Pearson et al., 2007). El 75 % de los registros fueron utilizados para la generación del modelo y el restante para su validación, por lo cual se realizaron 20 réplicas por especie. La capacidad predictiva fue medida con la obtención de un valor de AUC (área bajo la curva) el cual tiene valores de 0 a 1, valores cercanos a 1.0 tuvieron el mejor poder predictivo, mientras que valores menores a 0.5 indican que el azar es mejor que el modelo generado.
Los modelos generados se utilizaron para obtener un mapa de consenso usando el método de Promedios Ponderados (Marmion et al., 2009), que es un mapa continuo, resultado de la suma de los 20 modelos individuales de cada una de las especies. El mapa de consenso se convirtió a uno binario que representó la presencia y ausencia de la especie, el cual fue definido utilizando el umbral de corte “Maximum training sensitivity plus specificity” que es el mejor método cuando solo se utilizan presencias (Liu et al., 2013). La prueba de Jacknife fue utilizada para identificar las variables que contribuyeron más a la generación del modelo y describen los factores ambientales asociados a la presencia de las especies (Plasencia-Vázquez et al., 2014). Un mapa de riqueza fue generado a partir de la suma de los mapas binarios de las especies.
Los mapas de distribución potencial de las especies se utilizaron para conocer el porcentaje de distribución que se encuentra en las distintas áreas de protección en México y, en áreas con distinto grado de perturbación por el hombre. Para ello se utilizaron los mapas binarios de las especies a los cuales se les extrajo la información de las capas de Áreas Naturales Protegidas federales (ANP), Áreas Naturales Protegidas estatales (ANPes), Áreas Voluntarias de Conservación (AVC), Regiones Terrestres Prioritarias (RTP) y Sitios Terrestres Prioritarios (STP), además de la capa de perturbación por el hombre (Human Footprint) (González-Abraham et al., 2015).
Los mapas binarios de las especies fueron utilizados para generar una matriz de la composición taxonómica de especies. Esta información fue obtenida al utilizar la herramienta de disolver del programa ArcGIS (ESRI, 2019) que genera nuevos mapas que contienen las zonas donde se encuentra o no una especie, para después unirlos con la herramienta intersecar obteniendo un único mapa que contiene todos los polígonos con distinta composición taxonómica de especies en México. Los polígonos fueron agrupados en un análisis de k-medias generalizado con el programa STATISTICA (STATISTICA, 2008) en función de la presencia-ausencia de las especies para establecer grupos de polígonos que cuentan con una composición de especies similar, solo se incluyó a los polígonos que potencialmente contuvieron al menos una especie.
La respuesta de las especies a las variables ambientales fue estimada para las especies incluidas en los modelos de distribución utilizando el análisis de marginalidad media (AMM), el cual se encuentra implementado en el programa ADE-4 (Thioulouse et al., 1997). El AMM permite estimar la separación de nichos de las especies con respecto a la condición promedio del área de estudio, estimar el grado de segregación de estas e identificar la relación que existe entre la presencia de la especie con respecto a las características ambientales (Dolédec et al., 2000). El análisis fue realizado a partir de 3 000 localidades generadas aleatoriamente con el programa ArcGis (v.10.8, ESRI) con el fin de representar las condiciones ambientales de todo el país. Este análisis se realizó a partir de dos matrices, una con la información de ausencia-presencia (extraída de los mapas binarios) y otra con la información de variables ambientales de tipo “continua” asociadas a la distribución de los moluscos terrestres (Tabla 2), ambas con la información de las 3 000 localidades generadas. Además, se incluyeron dos columnas que representan la ausencia de las especies al norte y sur del país para establecer un límite ambiental en la presencia de las especies en México.
Resultados
Composición taxonómica y distribución de la familia Spiraxidae: Ciento noventa y seis especies, así como 57 subespecies, de la familia Spiraxidae resultaron presentes en México, las cuales representaron a 3 subfamilias, 16 géneros y 16 subgéneros. La subfamilia Euglandininae fue la que presentó el mayor número de géneros (6) y especies y subespecies (106). Streptostyla fue el género con el mayor número de especies y subespecies (50), seguido de Guillarmodia (47) y Euglandina (43). Streptostyla es el género con la mayor cantidad de subgéneros (4), seguido de Euglandina (3) y Volutaxis (3). El subgénero con el mayor número de especies y subespecies fue Streptostyla (34), seguido de Proameria (31).
Ciento veintiocho especies y subespecies fueron reportadas en una sola localidad, lo cual representa el 55.8 % del total de especies y subespecies. El 18 % fueron reportadas en dos localidades, mientras que solo el 8.3 % de las especies fueron reportadas en 8 o más localidades (Fig. 1). Los géneros Streptostyla, Guillarmodia, Euglandina y Salasiella se reportaron en 8 o más localidades, mientras que los géneros Micromena, Mayaxis y Oryzosoma solo contaron con especies presentes en una sola localidad.
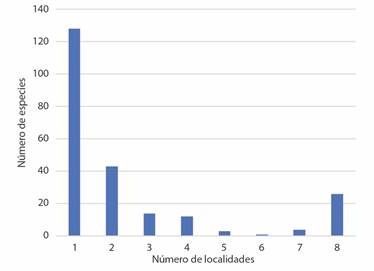
Fig. 1 Número de especies de Spiraxidae y número de localidades en donde fueron registradas. / Fig. 1. Number of Spiraxidae species and number of localities where they were recorded.
La familia Spiraxidae estuvo presente en 24 de los 32 estados de México, siendo Veracruz el estado que contó con el mayor número de géneros (13) (Fig. 2) y especies (96) (Fig. 3). Puebla contó con la segunda mayor riqueza específica (37), así como de géneros (10), mientras que los estados de Coahuila, Morelos, Hidalgo, Baja California Norte y Ciudad de México, contaron con una sola especie. Euglandina fue el género presente en la mayor cantidad de estados (21), seguido de Guillarmodia (13) y Streptostyla (12), mientras que Mayaxis, Strebelia, Oryzosoma y Streptostylella fueron reportados en un solo estado del país.
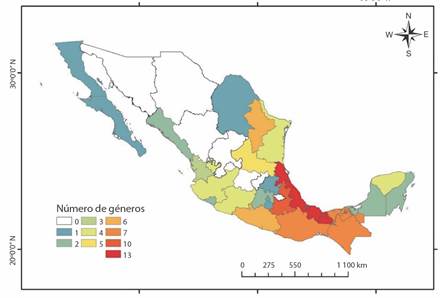
Fig. 2 Número de géneros de la familia Spiraxidae por estado en México. / Fig. 2. Number of genera of the Spiraxidae family by state in Mexico.
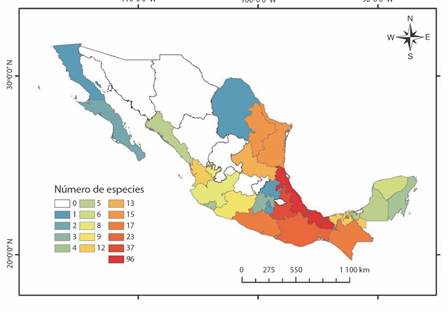
Fig. 3 Número de especies y subespecies de la familia Spiraxidae por estado en México. / Fig. 3. Number of species and subspecies of the family Spiraxidae by state in Mexico.
La familia Spiraxidae se encontró en 15 de las 19 provincias biogeográficas mencionadas para México (CONABIO, 1997). La provincia de Oaxaca conto con el mayor número de géneros de la familia Spiraxidae (13) (Fig. 4), seguido de la del Golfo de México (12) y la Sierra Madre Oriental (11). Esta última provincia contó con la mayor cantidad de especies y subespecies (74) (Fig. 5), seguido de la provincia del Golfo de México (66) y la de Oaxaca (57).
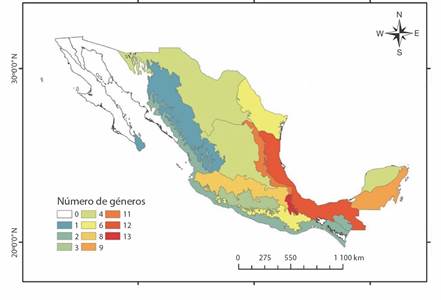
Fig. 4 Número de géneros de la familia Spiraxidae por provincia biogeográfica en México. / Fig. 4. Number of genera of the family Spiraxidae by biogeographical province in Mexico.
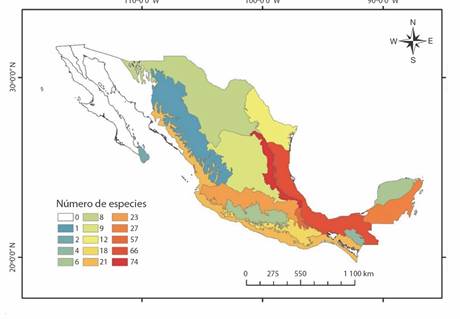
Fig. 5 Número de especies y subespecies de la familia Spiraxidae por provincia biogeográfica en México. / Fig. 5. Number of species and subspecies of the family Spiraxidae by biogeographical province in Mexico.
Los registros indican que solo 70 (30.3 %) de las especies se encontraron en territorio catalogado como Área Natural Protegida (ANP). La Zona Protectora Forestal Vedada Cuenca Hidrográfica del Rio Necaxa fue la ANP que contó con la mayor presencia de especies (31). Otras 13 ANP’s contaron con presencia de especies de Spiraxidae, sin embargo, esta no fue mayor a 8 especies (Fig. 6).
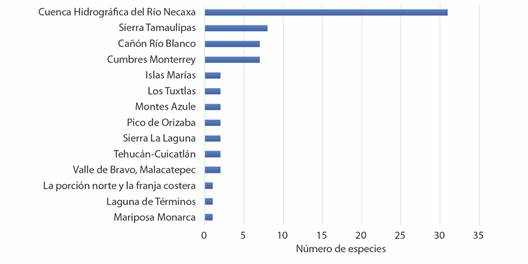
Fig. 6 Número de especies de Spiraxidae con distribución dentro las Áreas Naturales Protegidas en México. / Fig. 6. Number of species of Spiraxidae with distribution within Natural Protected Areas in Mexico.
Componentes biogeográficos: La principal afinidad zoogeográfica resultó ser la neotropical (Tabla 3). El género con el mayor número de especies neotropicales fue Streptostyla (48). Salasiella cuenta con el mayor número de especies de origen neotropical principalmente y neártica (4), y Pseudosubulina es el único género que cuenta con distribución panamericana y neártica (1 especie).
Tabla 3 Número de especies y subespecies de Spiraxidae por género proporción según afinidades zoogeográficas. / Table 3. Number of species and subspecies of Spiraxidae by genus proportion according to zoogeographical affinities.
| Género | Número de especies y subespecies | NA | NT | NTp y NA | PA |
| Volutaxis | 29 | 1 (3.4 %) | 28 (96.55 %) | 0.00 | 0.00 |
| Rectaxis | 7 | 0.00 | 7 (100 %) | 0.00 | 0.00 |
| Micromena | 2 | 0.00 | 2 (100 %) | 0.00 | 0.00 |
| Pseudosubulina | 21 | 3 (14.29 %) | 17 (80.95 %) | 0.00 | 1 (4.76 %) |
| Miraradula | 2 | 0.00 | 2 (100 %) | 0.00 | 0.00 |
| Mayaxis | 2 | 0.00 | 2 (100 %) | 0.00 | 0.00 |
| Streptostyla | 50 | 1 (2 %) | 48 (96 %) | 1 (2 %) | 0.00 |
| Strebelia | 1 | 0.00 | 1 (100 %) | 0.00 | 0.00 |
| Salasiella | 10 | 0.00 | 6 (60 %) | 4 (40 %) | 0.00 |
| Oryzosoma | 1 | 0.00 | 1 (100 %) | 0.00 | 0.00 |
| Pittieria | 6 | 0.00 | 6 (100 %) | 0.00 | 0.00 |
| Varicoturris | 5 | 0.00 | 5 (100 %) | 0.00 | 0.00 |
| Streptostylella | 1 | 0.00 | 1 (100 %) | 0.00 | 0.00 |
| Varicoglandina | 4 | 0.00 | 4 (100 %) | 0.00 | 0.00 |
| Euglandina | 43 | 2 (4.65 %) | 40 (93.02 %) | 1 (2.33 %) | 0.00 |
| Guillarmodia | 47 | 3 (6.38 %) | 42 (89.36 %) | 2 (4.26 %) | 0.00 |
| Total | 231 |
“NT” neotropical, “NTP y NA” neotropical principalmente y neártica, “PA” distribución panamericana o “NA” neártica, por género. / “NT” Neotropical, “NTP and NA” mainly Neotropical and Nearctic, “PA” Pan-American distribution or “NA” Nearctic, by genus.
Asociación con tipos de vegetación: El número de grupos de tipos de vegetación por especies fue de tres (Fig. 7). El pastizal y el matorral xerófilo formaron el primer grupo. El segundo grupo fue formado por el bosque espinoso, bosque de coníferas y encino y el bosque tropical caducifolio. El tercer grupo se formó por el bosque mesófilo de montaña, el bosque tropical perennifolio, el bosque tropical subcaducifolio y la vegetación acuática y subacuática.
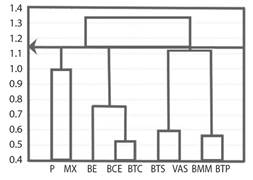
Fig. 7 Clúster aglomerativo de tipos de vegetación en función a la ausencia-presencia de especies de Spiraxidae. “P” pastizal, “MX” matorral xerófilo, “BE” bosque espinoso, “BCE” bosque de coníferas y encinos, “BTC” bosque tropical caducifolio, “BTS” bosque tropical subcaducifolio, “VAS” vegetación acuática y semiacuática, “BMM” bosque mesófilo de montaña, “BTP” bosque tropical perennifolio. / Fig. 7. Agglomerative cluster of vegetation types according to the absence-presence of Spiraxidae species. “P” grassland, “MX” xeric scrub, “BE” thorny forest, “BCE” coniferous and oak forest, “BTC” tropical deciduous forest, “BTS” tropical sub-deciduous forest, “VAS” aquatic and semi-aquatic vegetation, “BMM ” cloudy mountain forest, “BTP” tropical evergreen forest.
El análisis de k medias generalizado formó cuatro grupos de especies en función de la presencia-ausencia en los tipos de vegetación, siendo siete de los nueve tipos de vegetación utilizados en el análisis de aportación significativa a la formación de los grupos (P < 0.05, Tabla 4). El bosque tropical perennifolio fue la variable de mayor contribución a la formación de los grupos mientras que el bosque mesófilo de montaña es el que contó con el mayor número de especies. El primer grupo incluyó al mayor número de especies (91) contando con una distribución dispersa en todo el país (Fig. 8), el segundo grupo fue formado por 6 especies, de las cuales 5 se encontraron en el sureste de México, el tercer grupo estuvo formado por especies con una distribución principalmente en los estados de Veracruz, Oaxaca y Chiapas, mientras que las especies del cuarto grupo tuvieron una distribución dispersa encontrándose principalmente en el centro y norte de Veracruz. El primer grupo de especies contó con una mayor asociación al bosque tropical caducifolio, las especies del segundo grupo tienen una principal asociación con el bosque tropical subcaducifolio, el tercer grupo de especies se asoció principalmente al bosque tropical perennifolio, mientras que las especies del cuarto grupo contaron con una asociación principal al bosque mesófilo de montaña.
Tabla 4 Número de especies por grupo y prueba de independencia de las variables utilizadas en el análisis de k medias generalizado. / Table 4. Number of species per group and test of independence of the variables used in the generalized k-means analysis.
| CLAVE | GRUPO 1 | GRUPO 2 | GRUPO 3 | GRUPO 4 | TOTAL | X2 | P |
| BTP | 13 | 2 | 62 | 0 | 77 | 156.27 | 0 |
| VAS | 1 | 0 | 0 | 0 | 1 | 1.31 | 0.73 |
| BMM | 8 | 0 | 30 | 51 | 89 | 116.71 | 0 |
| BTS | 4 | 6 | 0 | 0 | 10 | 125.68 | 0 |
| BTC | 54 | 0 | 0 | 0 | 54 | 95.06 | 0 |
| MX | 29 | 0 | 4 | 3 | 36 | 24.68 | 0 |
| BCE | 40 | 0 | 9 | 2 | 51 | 35.79 | 0 |
| P | 1 | 0 | 0 | 0 | 1 | 1.31 | 0.73 |
| BE | 14 | 0 | 0 | 0 | 14 | 19.62 | 0 |
| TOTAL | 164 | 8 | 105 | 56 |
“P” pastizal, “MX” matorral xerófilo, “BE” bosque espinoso, “BCE” bosque de coníferas y encinos, “BTC” bosque tropical caducifolio, “BTS” bosque tropical subcaducifolio, “VAS” vegetación acuática y semiacuática, “BMM” bosque mesófilo de montaña, “BTP” bosque tropical perennifolio. / “P” grassland, “MX” xeric scrub, “BE” thorny forest, “BCE” coniferous and oak forest, “BTC” tropical deciduous forest, “BTS” tropical sub-deciduous forest, “VAS” aquatic and semi-aquatic vegetation, “BMM” cloudy mountain forest, “BTP” tropical evergreen forest.
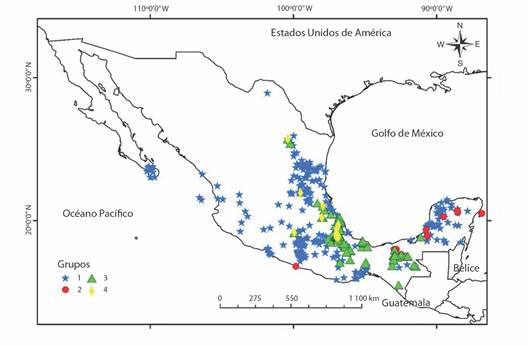
Fig. 8 Grupos de especies de la familia Spiraxidae formados por el análisis de k-medias generalizado en función a su ausencia-presencia en lis distintos tipos de vegetación en México. / Fig. 8. Groups of species of the Spiraxidae family formed by generalized k-means analysis based on their absence-presence in different types of vegetation in Mexico.
Modelo de distribución: La prueba de Jacknife encontró que los modelos de 19 especies que cuentan con entre 8 y 25 registros resultaron estadísticamente significativos (P > 0.05) (Tabla 5). En total, la distribución de 24 especies fue modelada, encontrando que la mayoría de las especies se distribuyeron en el noreste del país (Fig. 9), además se encontró que la región occidente de México no contó con ninguna de las especies de Spiraxidae incluidas en el análisis. La especie Euglandina texasiana texasiana fue la de mayor distribución en México (Tabla 6), mientras que la especie Streptostyla novoleonis fue la especie con menor área de distribución. El análisis además encontró que las variables ecorregión y el tipo de suelo fueron de mayor contribución para predecir la distribución de las especies de la familia Spiraxidae en México. La ecorregión con el mayor número de especies resultó ser Bosques húmedos de Veracruz, el tipo de suelo con el mayor número de especies fue leptosoles.
Tabla 5 Valores de probabilidad (P) obtenidos de la prueba de Jacknife para la validación de los modelos de especies con menos de 25 registros. / Table 5. Probability values (P) obtained from the Jacknife test for the validation of species models with less than 25 records.
| Especie | P |
| Euglandina corneola | 0.00 |
| E. cumingi | 0.00 |
| E. cylindracea | 0.00 |
| E. daudebarti dardebarti | 0.00 |
| E. sowerbyana sowerbyana | 0.00 |
| E. vanuxemensis | 0.00 |
| Guillarmodia comma | 0.01 |
| G. dalli | 0.00 |
| G. gracilior | 0.00 |
| G. kingi | 0.00 |
| G. pupa | 0.00 |
| G. stenotrema | 0.00 |
| G. Victoriana | 0.00 |
| Salasiella hinkleyi | 0.00 |
| Streptostyla bartschi | 0.00 |
| S. nigricans | 0.00 |
| S. novoleonis | 0.00 |
| S. streptostyla coniformis | 0.00 |
| S. ventricosula | 0.00 |
Tabla 6 Promedio de los valores de AUC y variables que contribuyen un 80 % en la predicción de la distribución de las especies incluidas en el análisis. / Table 6. Average of the AUC values and variables that contribute 80 % to the prediction of the distribution of the species included in the analysis.
| Especie | AUC | VARIABLES |
| Euglandina corneola | 0.97 | Ecorregión, tipo de suelo, textura de suelo |
| E. cumingi | 0.98 | Ecorregión, textura de suelo, temperatura promedio |
| E. cylindracea | 0.99 | Ecorregión, tipo de suelo, textura de suelo |
| E. daudebarti dardebarti | 0.96 | Ecorregión, tipo de suelo, textura de suelo |
| E. liebmanni | 0.99 | Ecorregión, Tipo de suelo |
| E. sowerbyana sowerbyana | 0.96 | Ecorregión, tipo de suelo, textura de suelo |
| E. texasiana texasiana | 0.99 | Ecorregión, tipo de suelo, textura de suelo |
| E. vanuxemensis | 0.99 | Ecorregión, tipo de suelo, elevación |
| Guillarmodia comma | 0.99 | Ecorregión, tipo de suelo, precipitación verano |
| G. dalli | 0.98 | Ecorregión, tipo de suelo, textura de suelo |
| G. gracilior | 0.99 | Ecorregión, tipo de suelo, temperatura promedio |
| G. kingi | 1.00 | Ecorregión, tipo de suelo, textura de suelo |
| G. potosiana tamaulipensis | 0.99 | Ecorregión, tipo de suelo, arbustos |
| G. pupa | 0.96 | Ecorregión, tipo de suelo, precipitación |
| G. stenotrema | 1.00 | Ecorregión, tipo de suelo, temperatura promedio |
| G. victoriana | 0.99 | Ecorregión, tipo de suelo, textura de suelo |
| Salasiella hinkleyi | 0.98 | Ecorregión, tipo de suelo, textura de suelo |
| Streptostyla bartschi | 1.00 | Ecorregión, tipo de suelo, arbustos |
| S. gracilis | 0.99 | Ecorregión, tipo de suelo, textura de suelo |
| S. meridana meridana | 0.99 | Ecorregión, temperatura promedio, tipo de suelo |
| S. nigricans | 0.93 | Ecorregión, tipo de suelo, precipitación total |
| S. novoleonis | 0.97 | Ecorregión, tipo de suelo, arbustos |
| S. streptostyla coniformis | 1.00 | Ecorregión, precipitación de otoño, tipo de suelo |
| S. ventricosula | 0.99 | Ecorregión, tipo de suelo, textura de suelo |
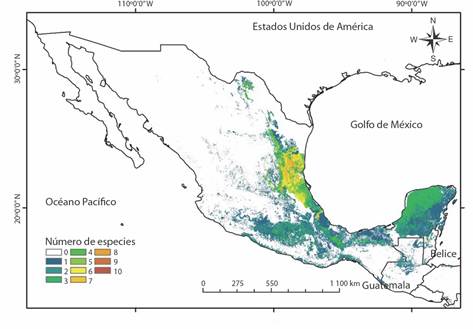
Fig. 9 Mapa de riqueza de la familia Spiraxidae en México elaborado a partir de los modelos de distribución. / Fig. 9. Map of richness of the family Spiraxidae in Mexico elaborated from the distribution models.
Los modelos de distribución muestran que la mayor parte de la distribución de las especies de Spiraxidae se encuentra fuera de las ANP’s federales. Las ANP’s federales protegen cerca del 50 % de la distribución S. novoleonis, sin embargo, menos del 20 % de la distribución del resto de las especies se encuentra dentro de estas áreas (Tabla 7). Las ANP’s estatales protegen menos del 10 % de todas las especies, mientras que las AVC menos del 2 %. Las RTP protegen arriba del 7 % de la distribución de todas las especies, llegando a proteger el 66 % de la distribución de S. novoleonis. Los STP son las zonas que cuentan con la mayor distribución de especies de Spiraxidae, protegiendo arriba del 13 % de la distribución de todas las especies, llegando hasta el 70 % en el caso de S. ventricosula y E. cylindracea. La especie S. novoleonis tiene cerca del 80 % de su distribución en sitios sin transformar, mientras que solo el 5 % de la distribución de G. pupa se encuentra en sitios con estas características. Las especies E. daudebarti y E. vanuxemensis tienen más del 30 % de su distribución en zonas con un nivel de perturbación muy alto, mientras que menos del 1 % de la distribución de S. novoleonis se encuentra en zonas con esta característica.
Tabla 7 Distribución de las especies de Spiraxidae en México y porcentaje de su distribución dentro de distintas áreas de protección en México y, en áreas con distinto grado de perturbación por el hombre. / Table 7. Distribution of Spiraxidae species in Mexico and percentage of their distribution within different protection areas in Mexico and, in areas with different degrees of disturbance by man.
| Especie | Superficie (km2) | ANP | ANP es | AVC | RTP | STP | Sintransformar | Bajo | Medio | Alto | Muy Alto |
| Euglandina corneola | 21 193.5 | 6.06 | 2.09 | 0.04 | 16.79 | 23.18 | 20.50 | 13.18 | 16.61 | 30.40 | 19.32 |
| E. cumingi | 25 011.6 | 13.23 | 1.73 | 0.04 | 24.03 | 15.58 | 17.42 | 9.27 | 12.12 | 46.56 | 14.64 |
| E. cylindracea | 63 981.7 | 4.74 | 8.62 | 0.03 | 15.65 | 71.20 | 50.31 | 14.58 | 15.60 | 15.66 | 3.85 |
| E. daudebarti d | 43 385.3 | 1.15 | 0.45 | 0.08 | 7.59 | 13.80 | 8.89 | 5.75 | 9.25 | 41.82 | 34.29 |
| E. liebmanni | 66 452.2 | 3.81 | 2.97 | 0.35 | 13.24 | 17.88 | 37.68 | 16.92 | 15.79 | 15.81 | 13.81 |
| E. sowerbyana s | 30 931.4 | 10.56 | 1.75 | 0.49 | 32.97 | 41.43 | 18.34 | 10.15 | 12.58 | 32.06 | 26.87 |
| E. texasiana t | 116 817.6 | 12.86 | 3.51 | 0.35 | 25.11 | 34.53 | 37.02 | 9.90 | 10.79 | 26.03 | 16.26 |
| E. vanuxemensis | 56 523.6 | 8.40 | 2.46 | 0.28 | 17.21 | 34.29 | 26.47 | 11.29 | 12.48 | 15.98 | 33.78 |
| Guillarmodia comma | 6 184.8 | 0.14 | 0.02 | 0.06 | 25.53 | 31.88 | 19.77 | 14.70 | 18.82 | 27.97 | 18.74 |
| G. dalli | 24 393.9 | 12.05 | 3.24 | 0.14 | 19.67 | 37.59 | 35.50 | 9.07 | 10.30 | 26.19 | 18.95 |
| G. gracilior | 4 430.2 | 10.04 | 2.29 | 0.41 | 18.86 | 19.63 | 51.34 | 17.37 | 16.56 | 11.46 | 3.27 |
| G. kingi | 13 211.2 | 2.66 | 0.03 | 0.46 | 25.94 | 30.83 | 22.52 | 10.99 | 14.68 | 25.71 | 26.10 |
| G. potosiana tamaulipensis | 57 516.1 | 16.55 | 4.92 | 0.45 | 27.60 | 39.12 | 46.61 | 10.81 | 9.95 | 19.26 | 13.38 |
| G. pupa | 6 718.0 | 2.55 | 2.50 | 0.11 | 11.85 | 28.77 | 5.22 | 6.12 | 9.35 | 55.81 | 23.50 |
| G. stenotrema | 21 238.0 | 3.56 | 4.62 | 0.72 | 19.81 | 25.12 | 46.53 | 17.83 | 15.73 | 13.14 | 6.78 |
| G. victoriana | 77 894.5 | 7.50 | 2.60 | 0.06 | 14.43 | 30.24 | 24.76 | 10.16 | 12.55 | 33.29 | 19.23 |
| Salasiella hinkleyi | 54 035.5 | 10.20 | 3.18 | 0.12 | 19.23 | 25.90 | 30.57 | 10.71 | 11.99 | 29.11 | 17.62 |
| Streptostyla bartschi | 65 870.6 | 8.61 | 2.60 | 0.06 | 16.36 | 26.64 | 21.71 | 9.29 | 12.16 | 36.06 | 20.77 |
| S. gracilis | 70 438.5 | 11.54 | 3.36 | 0.09 | 21.63 | 30.40 | 32.31 | 9.98 | 11.31 | 28.97 | 17.43 |
| S. meridana m | 135 422.8 | 8.20 | 7.18 | 0.07 | 34.99 | 61.02 | 54.61 | 11.93 | 12.30 | 17.07 | 4.09 |
| S. nigricans | 10 342.2 | 0.22 | 1.50 | 0.08 | 19.35 | 42.94 | 14.97 | 12.48 | 17.90 | 46.77 | 7.88 |
| S. novoleonis | 2 859.3 | 46.98 | 1.97 | 1.46 | 66.24 | 42.57 | 79.20 | 11.24 | 5.71 | 3.26 | 0.59 |
| S. streptostyla c | 17 339.6 | 1.08 | 1.58 | 1.55 | 17.07 | 40.59 | 15.23 | 9.00 | 10.42 | 43.82 | 21.53 |
| S. ventricosula | 62 294.4 | 4.64 | 9.29 | 0.02 | 20.53 | 72.55 | 52.41 | 15.00 | 15.28 | 14.30 | 3.00 |
ANP: Áreas Naturales Protegidas, ANPes: Áreas Naturales Protegidas estatales, AVC: Áreas Voluntarias de Conservación, RTP: Regiones Terrestres Prioritarias, STP: Sitios Terrestres Prioritarios. / ANP: Protected Natural Areas, ANPes: State Protected Natural Areas, AVC: Voluntary Conservation Areas, RTP: Priority Terrestrial Regions, STP: Priority Terrestrial Sites.
Sitios con composición de especies similar: Tres grupos de zonas con composición de especies similar fueron formados (Fig. 10), donde todas las especies presentaron diferencias significativas entre especies (P < 0.05) (Tabla 8), siendo Guillarmodia victoriana y Salasiella hinkleyi las que contribuyeron más con las diferencias. El primer grupo incluyó el sur de México y parte del centro y noreste, el cual se asoció con la presencia de la especie Euglandina texasiana texasiana. El segundo grupo fue formado por zonas del centro de Veracruz y zonas particulares del noreste de México, las cuales se asocian principalmente con la presencia de E. texasiana texasiana, G. dalli, G. victoriana y S. bartschi. El tercer grupo fue formado por zonas del centro y sur de Tamaulipas y Nuevo León, estando asociado principalmente a las especies E. texasiana texasiana, G. potosiana tamaulipensis, G. victoriana, Salasiella hinkleyi, Streptostyla bartschi y S. graclis.
Tabla 8 Prueba de independencia de las variables utilizadas en el análisis de k medias generalizado. Afinidad de distribución proporcional de las especies por grupo de zonas con composición similar. / Table 8. Test of independence of the variables used in the generalized k-means analysis. Proportional distribution affinity of the species by group of zones with similar composition.
| Especie | X2 | P | Grupo 1 | Grupo 2 | Grupo 3 |
| Euglandina corneola | 94.47 | 0.00 | 34.76 | 21.80 | 43.45 |
| E. cumingi | 50.06 | 0.00 | 100.00 | 0.00 | 0.00 |
| E. cylindracea | 36.42 | 0.00 | 100.00 | 0.00 | 0.00 |
| E. daudebarti dardebarti | 90.85 | 0.00 | 68.34 | 14.67 | 16.99 |
| E. liebmanni | 294.73 | 0.00 | 100.00 | 0.00 | 0.00 |
| E. sowerbyana sowerbyana | 58.35 | 0.00 | 40.06 | 22.26 | 37.68 |
| E. texasiana texasiana | 869.20 | 0.00 | 37.09 | 27.75 | 35.16 |
| E. vanuxemensis | 10.10 | 0.01 | 46.01 | 21.45 | 32.54 |
| Guillarmodia comma | 36.42 | 0.00 | 100.00 | 0.00 | 0.00 |
| G. dalli | 1 253.25 | 0.00 | 23.09 | 55.06 | 21.85 |
| G. gracilior | 91.33 | 0.00 | 100.00 | 0.00 | 0.00 |
| G. kingi | 140.71 | 0.00 | 100.00 | 0.00 | 0.00 |
| G. potosiana tamaulipensis | 1 221.67 | 0.00 | 27.46 | 21.11 | 51.42 |
| G. pupa | 93.46 | 0.00 | 100.00 | 0.00 | 0.00 |
| G. stenotrema | 136.38 | 0.00 | 100.00 | 0.00 | 0.00 |
| G. victoriana | 2 689.92 | 0.00 | 18.18 | 41.54 | 40.28 |
| Salasiella hinkleyi | 1 956.93 | 0.00 | 19.78 | 20.04 | 60.18 |
| Streptostyla bartschi | 1 669.49 | 0.00 | 15.74 | 39.93 | 44.33 |
| S. gracilis | 1 717.96 | 0.00 | 26.93 | 21.21 | 51.86 |
| S. meridana meridana | 234.02 | 0.00 | 100.00 | 0.00 | 0.00 |
| S. nigricans | 75.39 | 0.00 | 100.00 | 0.00 | 0.00 |
| S. novoleonis | 12.52 | 0.00 | 54.88 | 14.48 | 30.64 |
| S. streptostyla coniformis | 137.46 | 0.00 | 100.00 | 0.00 | 0.00 |
| S. ventricosula | 42.71 | 0 .00 | 100.00 | 0.00 | 0.00 |
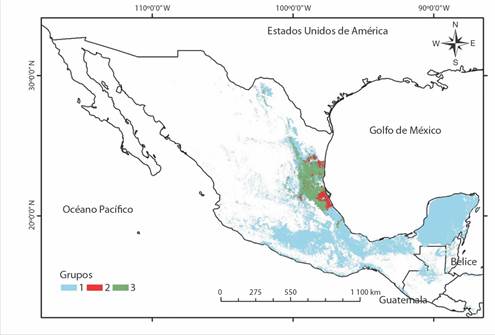
Fig. 10 Grupos de zonas con composición de especies similar. / Fig. 10. Zone groups with similar species composition.
Segregación ambiental de las especies: La relación de las variables ambientales con la presencia de las especies de la familia Spiraxidae fue estadísticamente significativa (P = 0.0) (Tabla 9). La marginalidad de 22 especies fue estadísticamente significativa, por lo tanto, estas se encuentran en condiciones diferentes al promedio de las localidades analizadas. Los primeros 2 ejes del AMM representan el 57.2 % de la variación total explicada por las variables. El primer eje, el cual contiene el 29.34 % de la variación, se relacionó con el porcentaje de árboles perennes de hoja anchas (0.61) y la precipitación anual total (0.64) (Fig. 11), mientras que el segundo eje representó el 27.76 % de la variación, la cual estuvo relacionada con la variable pH en el suelo (-0.45).
Tabla 9 Especies de la familia Spiraxidae incluidas en el estudio. / Table 9. Species of the Spiraxidae family included in the study.
| Especie | Inercia | Marg. | Tol. | Tol. Res. | P |
| Euglandina corneola | 8.35 | 4.34 | 0.36 | 3.65 | 0 |
| E. sowerbyana sowerbyana | 9.34 | 3.73 | 1.81 | 3.81 | 0 |
| E. liebmanni | 6.19 | 3.09 | 0.14 | 2.97 | 0 |
| E. daudebarti daudebarti | 10.05 | 7.23 | 0.57 | 2.25 | 0 |
| E. cylindracea | 15.07 | 11.05 | 1.03 | 3 | 0 |
| E. cumingi | 23.67 | 21.53 | 0.27 | 1.88 | 0 |
| E. texasiana texasiana | 7.15 | 1 | 0.56 | 5.59 | 0 |
| E. vanuxemensis | 5.52 | 2.37 | 0.33 | 2.82 | 0 |
| Salasiella hinkleyi | 6.36 | 1.93 | 0.37 | 4.06 | 0 |
| Streptostyla bartschi | 6.89 | 2.61 | 0.55 | 3.73 | 0 |
| S. ventricosula | 15.58 | 11.55 | 1.01 | 3.02 | 0.67 |
| S. streptostyla coniformis | 17.06 | 13.75 | 0.74 | 2.57 | 0 |
| S. novoleonis | 6.91 | 4.08 | 0.29 | 2.54 | 0 |
| S. nigricans | 36.98 | 34.07 | 0.54 | 2.36 | 0 |
| S. meridana meridana | 18.68 | 13.32 | 1.35 | 4.01 | 0 |
| S. gracilis | 6.38 | 1.95 | 0.31 | 4.12 | 0 |
| Guillarmodia comma | 10.57 | 7.63 | 0.26 | 2.68 | 0 |
| G. victoriana | 5.68 | 1.79 | 0.6 | 3.3 | 0 |
| G. stenotrema | 6.26 | 3.96 | 0.2 | 2.1 | 0 |
| G. pupa | 12.74 | 10.79 | 0.24 | 1.71 | 0 |
| G. potosiana tamaulipensis | 6.81 | 1.6 | 0.23 | 4.98 | 0.91 |
| G. kingi | 8.88 | 6.59 | 0.22 | 2.07 | 0 |
| G. gracilior | 4.92 | 3.74 | 0.05 | 1.13 | 0 |
| G. dalli | 5.37 | 2.48 | 0.33 | 2.56 | 0 |
| Ausencias (n) | 9.48 | 1.01 | 1.27 | 7.2 | 0 |
| Ausencias (s) | 10.01 | 1.84 | 1.08 | 7.09 | 0 |
Análisis de Marginalidad Media: Inercia, Marg, marginalidad; Tol, tolerancia; TolR, tolerancia residual; valores de significancia. / Outlying Mean Index: Inertia, Marg, marginality; Tol, tolerance; TolR, residual tolerance; significance values.
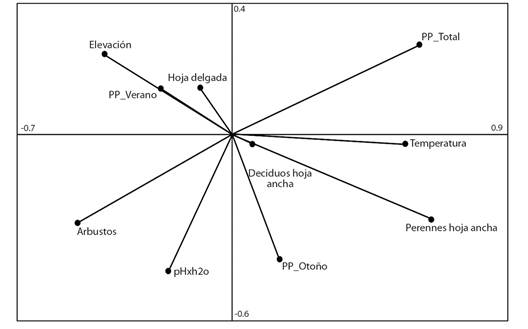
Fig. 11 Variables ambientales en los primeros dos ejes del AMM. / Fig. 11. Environmental variables in the first two axes of the OMI.
La especie Streptostyla nigricans se encontró en sitios con una cobertura de árboles perennes de hoja ancha mayor de 60 % (Fig. 12), donde la precipitación anual fue mayor de 2 500 mm (Fig. 13). Las especies de la familia Spiraxidae resultaron ausentes en el sur de México, en donde la precipitación anual fue menor de 1 000 mm, mientras que en el norte del país resultaron ausentes en localidades que cuentan con una precipitación anual menor a los 500 mm. En el norte y sur del país las especies resultaron ausentes en localidades donde la cobertura de árboles perennes de hoja ancha fue cercana al 0 %.
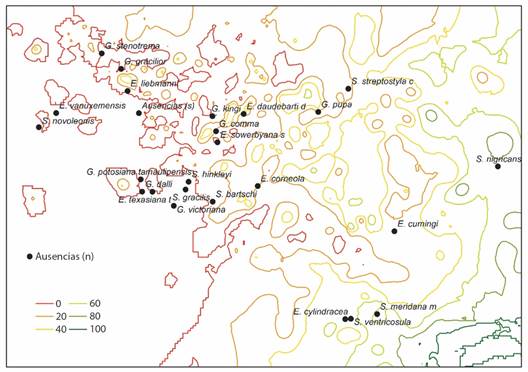
Fig. 12 Posición promedio de los sitios donde fue registrada cada especie de Spiraxidae utilizada en el AMM, con relación al promedio total de sitios evaluados (centro de gravedad), en un gradiente de porcentaje de árboles perennes de hoja ancha (porcentaje). / Fig. 12. Average position of the sites where each Spiraxidae species used in the OMI was recorded, in relation to the total average of sites evaluated (center of gravity), in a gradient of percentage of evergreen broadleaf trees (percentage).
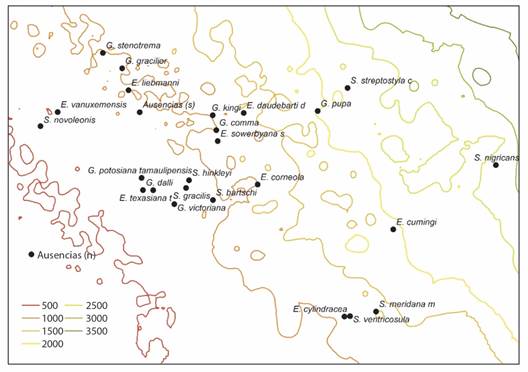
Fig. 13 Posición promedio de los sitios donde fue registrada cada especie de Spiraxidae utilizada en el AMM, con relación al promedio total de sitios evaluados (centro de gravedad), en un gradiente de precipitación total anual (milímetros). / Fig. 13. Average position of the sites where each species of Spiraxidae used in the OMI was recorded, in relation to the total average of sites evaluated (center of gravity), in a gradient of total annual precipitation (millimeters).
Discusión
Spiraxidae es la familia de gasterópodos terrestres que cuenta con la mayor diversidad de especies en México (Thompson, 2011). Sin embargo, la información que existe sobre la diversidad y distribución de esta familia en México es aún incompleta debido al bajo número de investigaciones e investigadores que estudien la malacofauna terrestre del país. Esto se ve reflejado en la baja cantidad de registros con las que cuentan, donde cerca del 55.8 % de las especies fueron registradas en una sola localidad. La falta de información se debe a que el 85 % del territorio mexicano está muy poco explorado en cuanto a especies de gasterópodos (Thompson, 2011), lo cual dificulta realizar inferencias sobre la distribución de las especies. Las investigaciones disponibles se concentran principalmente en la región neotropical del país, mientras las zonas templadas y desérticas son poco exploradas. De tal forma, es necesario incrementar el esfuerzo de colecta para mejorar el entendimiento de los patrones de riqueza de las especies, aún más considerando la relevancia de Spiraxidae en México.
Veracruz presentó la mayor cantidad de especies, ya que es el área geográfica con el mayor esfuerzo de colecta de gasterópodos terrestres en México y Centroamérica (Correa-Sandoval, 2000; Martens, 1890). Veracruz cuenta con bosque perennifolio y bosque mesófilo de montaña (Rzedowski, 2006), que son tipos de vegetación que favorecen la presencia de estas especies (Correa-Sandoval et al., 2009). Puebla y Oaxaca cuentan también con un alto número de especies de Spiraxidae (Thompson, 2011), y presentan también los tipos de vegetación mencionados anteriormente (Rzedowski, 2006). Tamaulipas, que también tiene estos tipos de vegetación, no tiene un gran número de especies de Spiraxidae, lo cual puede explicarse por una menor proporción en superficie de estos tipos de vegetación, además de encontrarse en el límite con la región neártica del país que se caracteriza por zonas menos húmedas que la tropical (Morrone, 2005).
México perdió el 30 % de cobertura de vegetación nativa en los últimos 10 años (SEMARNAT, 2018), debido a factores como la deforestación y otros tipos de actividades antropogénicas (Rzedowski, 2006). El bosque mesófilo de montaña ocupa menos de 1 % de superficie en México (Williams-Linera et al., 2002). La pérdida de estos tipos de vegetación y la asociación que existe con la presencia de la familia Spiraxidae en México sugiere la posibilidad de una pérdida de diversidad de especies de esta familia. La probable pérdida de diversidad toma más fuerza al revisar la antigüedad de los últimos registros de las especies, ya que la mayoría de los registros fueron obtenidos entes de la década de 1970, posterior a esos años la vegetación en México ha sido considerablemente modificada. La pérdida de cobertura vegetal tiene un impacto directo en los moluscos terrestres debido a su baja capacidad de desplazamiento (Kiss & Magnin, 2006), especialmente en especies cuya distribución y hábitats son reducidos.
La afinidad neotropical resultó ser la predominante en todas las especies de Spiraxidae. Sin embargo, es importante mencionar la presencia de varias especies en la región neártica. El género Pseudosubulina presenta el 14 % de sus especies en la región neártica, principalmente en la península de Baja California. Las especies presentes en esta región están expuestas a condiciones diferentes que las de la región neotropical. Sin embargo, la poca cantidad de registros con las que se cuenta dificulta estudios que analicen el efecto de las variaciones ambientales en su distribución.
Los modelos de distribución geográfica son una herramienta útil para llenar huecos en la información de la distribución de las especies cuya distribución no es del todo conocida (Mateo et al., 2011). Sin embargo, los resultados obtenidos de estos modelos se ven afectados por la información con la que son generados, variables ambientales y registros de la distribución conocida. En este caso, la elección de variables se debió al conocimiento de las características generales de los moluscos terrestres, los cuales se encuentran principalmente asociados a las condiciones de precipitación, vegetación y suelo, humedad y vegetación, que se conoce son influyentes en la presencia de los gasterópodos terrestres. Si bien, la mayoría de los modelos de distribución utilizan de manera general variables bioclimáticas, el uso de variables que se conoce tienen un efecto directo en la distribución de los moluscos terrestres resultó en una predicción satisfactoria. El modelo de distribución permitió identificar las variables que más contribuyeron en la distribución de la familia Spiraxidae, además de identificar zonas con potenciales nuevos registros de las especies.
El modelo de distribución de las especies sugiere a la región noreste del país, incluyendo una zona del centro de Veracruz, como la zona donde se concentra la mayor diversidad de especies de la familia Spiraxidae. Tal región cuenta con una mayor investigación taxonómica, mientras que zonas como el sur de Veracruz y los estados de Puebla y Oaxaca, que son los que cuentan con la mayor cantidad de especies de esta familia, aún deben de ser revisados (Thompson, 2009). Esta región se caracteriza por albergar un alto número de especies endémicas, siendo mencionada como una zona rica en plantas (Davis et al., 1997) y aves endémicas (Stattersfield et al., 1998), con lo que, de acuerdo en lo encontrado en este estudio es también una zona favorable al endemismo de las especies de la familia Spiraxidae. La región incluye una buena parte del noreste de México que alberga la mayor riqueza de especies encontrada, la cual influyó directamente en la formación de los grupos de polígonos con una composición de especies similar, diferenciándola de los otros dos grupos de zonas formados que incluyen zonas en la región sur y más tropical de México.
La especie Euglandina texasiana texasiana, resultó presente en los tres grupos de composición de especies similar en el país. Esta especie también resultó ser la especie con mayor distribución en México, ya que su distribución va desde Veracruz hasta el sur de Texas en Estados Unidos de América (Thompson, 2011). La presencia de esta especie tanto en la región neotropical como en la región neártica sugiere una mayor tolerancia a las variaciones ambientales que existen entre ambas regiones.
El Análisis de Marginalidad Media identificó el porcentaje de cobertura de árboles perennes de hoja ancha y la precipitación total anual como factores determinantes en la presencia de las especies de la familia Spiraxidae en México. Con esto se estableció un gradiente ambiental donde las especies de la familia Spiraxidae resultaron ausentes en el norte y sur del país en sitios donde la cobertura de árboles perennes de hoja ancha es de 0 %. Dicha relación se ve explicada ya que los gasterópodos terrestres requieren de sitios con amplia cobertura vegetal que le sirva como alimento y refugio ante posibles presas (Correa-Sandoval et al., 2009). Sin embargo, solamente las especies del sur como Streptostyla nigricans, S. ventricosula, S. meridana meridana, Euglandina cumingi y E. cylindracea se encontraron en sitios con más del 20 % de cobertura de árboles perennes de hoja ancha, por lo que se puede interpretar que el resto de las especies no requieren de este tipo de condiciones.
La precipitación total anual resultó ser otro factor determinante, encontrando que las especies resultan ausentes en sitios donde la precipitación anual es inferior a los 500 mm y en el sur del país en sitios donde la precipitación total anual es menor a los 1 000 mm. La ausencia de los gasterópodos terrestres en zonas con bajas precipitaciones se debe a que estos organismos requieren de lugares con alta humedad en el ambiente para evitar la muerte por desecación (Barker, 2001). Dentro de este gradiente de condiciones ambientales se encontró que las especies Streptostyla nigricans y S. streptostyla coniformis requieren de sitios con una mayor precipitación total anual que el resto de las especies, las cuales serían más propensas a la desecación, mientras que especies como Euglandina texasiana texasiana, E. vanuxemensis, Streptostyla novoleonis, Guillarmodia potosiana tamaulipensis y G. dalli tendrían una mayor tolerancia a condiciones con bajas precipitaciones.
De manera general existe una respuesta de las especies a las variables ingresadas en el análisis, teniendo que 66.6 % de las especies contaron con nichos restringidos siendo consideradas como especies especialistas. Sin embargo, la marginalidad de Euglandina sowerbyana sowerbyana, E. texasiana texasiana, E. vanuxemensis, Guillamordia potosiana tamaulipensis, G. victoriana, Salasiella hinkleyi, Streptostyla gracilis y Streptostyla bartschi fue menor del 50 % lo que significa que esta resultó no ser del todo explicada por las variables utilizadas en el análisis, lo que sugiere que existen otras variables que explican la presencia de estas especies.
Las especies de Spiraxidae, en general, mostraron una preferencia a sitios con amplias coberturas vegetales y elevadas precipitaciones, estando en su mayoría ausentes en sitios donde no se presentaron estas condiciones. Esta sensibilidad a las condiciones ambientales permite catalogar estas especies como especialistas, por lo que pueden considerarse como especies bioindicadoras, lo que resulta de utilidad ya que los gasterópodos son un grupo sensible a la fragmentación del hábitat (Kappes et al., 2009), además de ser útiles como bioindicadores de perturbación en el ambiente (González-Valdivia et al., 2010). Lo anterior resulta de gran interés al considerar que, si bien, el 30 % de las especies tienen presencia dentro de ANP’s, menos del 20 % de la distribución de las especies incluidas en los modelos de distribución, a excepción de S. novoleonis, se encuentra dentro de estas áreas de protección. Esto revela que a pesar de que la presencia de estas especies indique ambientes saludables y poco perturbados, estas no son consideradas para el establecimiento de zonas de conservación de especies.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


