Introducción
Los escarabajos coprófagos (Coleoptera: Scarabaeinae) son un grupo de insectos abundante y diverso en los bosques tropicales (Nichols & Gardner, 2011) e importante para el funcionamiento de los ecosistemas (Larsen et al., 2011; Milotić et al., 2017; Nichols et al., 2008). Las heces de los vertebrados son removidas de la superficie del suelo por estos escarabajos, y usadas para su alimentación y oviposición (Halffter & Edmonds, 1982; Nichols et al., 2008). El hábito alimenticio y comportamiento de nidificación de estos insectos facilita varios procesos ecológicos como el reciclaje de nutrientes, la bioturbación del suelo y la dinámica de semillas (Feer et al., 2013; Nichols et al., 2008; Santos-Heredia & Andresen, 2014). Estos procesos ecológicos también pueden constituir servicios ecosistémicos de gran valor económico (Lopez-Collado et al., 2017; Schowalter et al., 2018).
Los escarabajos coprófagos son un grupo muy usado como taxón focal en estudios que evalúan el efecto de las perturbaciones antropogénicas (Carvalho et al., 2020; Noriega et al., 2021). Sin embargo, los estudios enfocados a la importancia ecológica de los escarabajos coprófagos son relativamente menos frecuentes en ecosistemas con altas tasas de endemismo, como los bosques andinos (Davies et al., 2020; López-Aguirre et al., 2018; Pyrcz et al., 2016). En Colombia, estos bosques son uno de los ecosistemas más amenazados, porque han perdido gran parte de su cobertura original (> 60 %, Armenteras et al., 2011; World Wildlife Fund-Colombia, 2017), siendo sustituidos por coberturas agropecuarias (Aguilar-Isaza et al., 2010).
Los escarabajos coprófagos de bosques tropicales son sensibles a los cambios en la estructura de la vegetación (Halffter & Arellano, 2002), y está bien demostrado que el cambio en el uso del suelo modifica la estructura y composición de los ensambles de estos insectos (Escobar, 2004; Horgan, 2005; Otavo et al., 2013). Como consecuencia, los disturbios también pueden afectar las funciones ecológicas de los Scarabaeinae (Carvalho et al., 2020; Santos-Heredia et al., 2018). Sin embargo, en algunos casos se ha visto que, a pesar de los cambios que sufren los ensambles, no se detectan cambios en las funciones (Carvalho et al., 2020; Correa et al., 2019). Esto sugiere que los disturbios pueden tener efectos independientes sobre los ensambles de escarabajos coprófagos y sobre sus funciones ecológicas. Asimismo, existe gran variación entre los resultados de investigaciones particulares sobre las correlaciones entre los atributos de los ensambles de escarabajos y sus funciones (Carvalho et al., 2020). De manera similar, aunque se asume que la mayoría de las funciones ecológicas de los escarabajos son consecuencia directa de la remoción de heces, algunos estudios no han encontrado la correlación esperada (Carvalho et al., 2020), por lo que es un tema que debe explorarse más.
En la presente investigación, estudiamos los escarabajos coprófagos y sus funciones ecológicas en tres tipos de coberturas vegetales en un paisaje de bosque premontano fragmentado en los Andes colombianos, y evaluamos posibles mecanismos responsables de los patrones observados. Las preguntas que nos planteamos responder fueron: (1) ¿Cómo afecta el cambio de uso del suelo los atributos del ensamble de escarabajos coprófagos y sus funciones? (2) ¿Cómo se relacionan los atributos del ensamble con las funciones ecológicas? y (3) ¿Cómo se relacionan las diferentes funciones ecológicas entre sí? Los tres tipos de cobertura vegetal que estudiamos representan tres usos de suelo que difieren en su grado de perturbación: el bosque secundario, la cobertura mejor conservada; el bosque mixto, un bosque secundario invadido por guadua, con un grado intermedio de perturbación; los potreros para ganado, la cobertura más perturbada. Las hipótesis de trabajo fueron que: (a) debido a que los escarabajos coprófagos son sensibles a los cambios en la estructura de la vegetación, los atributos de los ensambles diferirán en los tres tipos de cobertura vegetal; además, (b) si los atributos de los ensamble se asocian con las funciones ecológicas, éstas también diferirán en los tres tipos de cobertura vegetal; finalmente, (c) si la excavación de suelo y la dispersión de semillas son consecuencia directa de la remoción de heces, el efecto de la cobertura vegetal será similar para las tres funciones. Alternativamente, si los atributos del ensamble y las funciones no se correlacionan estrechamente, el efecto de la alteración sobre los escarabajos y sobre las funciones podrían estar disociados. De manera similar, si las diferentes funciones ecológicas no están correlacionadas, sus respuestas al cambio de uso de suelo podrían diferir.
Materiales y métodos
Área de estudio: El estudio se llevó a cabo en la hacienda “El Ocaso” (4°34’08’’ N & 75°51’03’’ W), localizada en el valle interandino del Río Cauca, entre las Cordilleras Occidental y Central de los Andes, a una altitud entre 975 y 1 100 m.s.n.m., en el municipio de Quimbaya, departamento del Quindío, Colombia (Agudelo, 2001; Villa & Vila, 2003, Fig. 1). La temperatura media anual es de 24 °C y la precipitación anual varía entre 2 000 y 3 000 mm con un patrón de lluvias bimodal, con temporadas lluviosas entre marzo-mayo y septiembre-noviembre, y temporadas secas en diciembre-febrero y junio-agosto (Agudelo & Gómez, 2001).
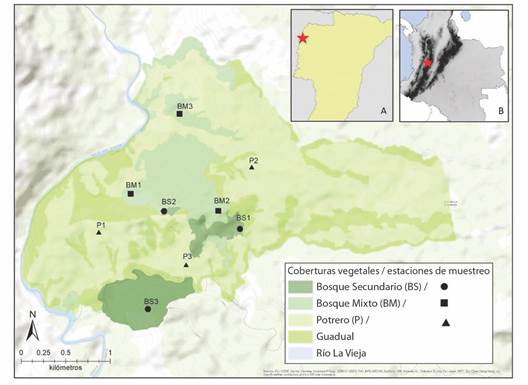
Fig. 1 Zona de estudio (hacienda “El Ocaso”, área coloreada en tonos de verde del mapa grande) y ubicación de los nueve sitios donde se muestrearon los escarabajos coprófagos y sus funciones en tres tipos de cobertura vegetal: bosque secundario (BS, círculos), bosque mixto (BM, cuadrados) y potreros (P, triángulos). A. Ubicación de la hacienda “El Ocaso” en el departamento del Quindío. B. Ubicación del departamento del Quindío en Colombia. / Fig. 1. Study area (farm “El Ocaso”, are colored in shades of green on the large map) and location of the nine sites where the dung beetles and their functions were sampled in three types of vegetation cover: secondary forest (BS, circles), mixed forest (BM, squares) and cattle pasture (P, triangles). A. Location of the farm “El Ocaso” in the Quindío Department. B. Location of the Quindío department in Colombia.
Actualmente, la hacienda “El Ocaso” cuenta con un área total de 790 ha, de las cuales 457.09 ha (57.86 %) están destinadas a la producción ganadera, 148.68 ha (18.82 %) a la conservación mediante la Reserva Natural “La Montaña del Ocaso” y 184.23 ha (23.32 %) a actividades agropecuarias e infraestructura (Aguilar-Isaza et al., 2010). “La Montaña del Ocaso” fue declarada Reserva Natural en 1998 (Villa & Vila, 2003) y el manejo técnico-científico lo realizaba la Universidad del Quindío bajo la figura de comodato hasta el 2018, año en que finalizó el contrato. El 52.67 % (78.31 ha) de la superficie de “La Montaña del Ocaso” está cubierta por bosque mixto, 24.13 % (35.88 ha) es guadual, 10.46 % (15.55 ha) es bosque secundario y 12.74 % (18.94 ha) es zona de recuperación (Gómez-Villadiego, 2017). “La Montaña del Ocaso” es considerada uno de los últimos relictos de bosque premontano del departamento del Quindío (Marín-Gómez, 2012; Soto-Agudelo et al., 2016). A continuación, se describen los tres tipos de cobertura vegetal en los que se trabajó.
i) Bosque secundario. Bosque sucesional maduro (20 años) de la vegetación nativa típica, que es una transición entre bosque húmedo premontano y bosque seco tropical de los Andes, según la metodología CORINE Land Cover adaptada para Colombia (Instituto de Hidrología, Meteorología y Estudios Ambientales, 2010). Hasta antes de ser declarada la Reserva Natural (1998), esta cobertura había perdido cerca del 42 % de su extensión en la región de estudio, principalmente por la entresaca de los árboles maderables. A partir de su protección ha ocurrido la sucesión secundaria, permitiendo la restauración pasiva de la vegetación (Aguilar-Isaza et al., 2010). Las familias (y géneros) más representativas en esta cobertura son: Moraceae (Pseudolmedia, Clarisia, Ficus, Trophis), Anacardiaceae (Anacardium), Sapindaceae (Cupania), Meliaceae (Guarea) y Lauraceae (Pérez-Torres & Cortés-Delgado, 2009). En el momento del estudio, el bosque secundario se encontraba delimitado y separado del potrero por cercas de alambre que impedían el paso del ganado al bosque.
ii) Bosque mixto. Es un bosque secundario que se caracteriza por la dominancia de guadua (Guadua angustifolia Kunth; Poaceae), especie nativa de estos bosques, la cual representa el 40 % del estrato arbóreo. La guadua, una especie de bambú, es de rápido crecimiento (hasta 21 cm por día) y en los primeros 6 meses alcanza su altura máxima (15-30 m, Londoño, 1998). Este bosque se caracteriza por tener menor altura de dosel y un sotobosque más cerrado, en comparación con el bosque secundario. La guadua se sembró como barrera (cerca viva natural) para evitar el paso del ganado hacia el bosque, pero posteriormente incrementó su dominancia en el paisaje e invadió áreas de bosque secundario (Soto-Agudelo et al., 2016).
iii) Potrero. Los potreros son manejados intensa y permanentemente con una carga animal no tecnificada de dos cabezas por hectárea, sobrepastoreo y utilización de agroquímicos para el control de plagas y parásitos. Los potreros son la matriz predominante en el paisaje y algunos presentan cercas vivas (Marín-Gómez, 2012).
Diseño de estudio: Para cada cobertura vegetal se seleccionaron tres sitios (N = 3) distanciados entre sí por un mínimo de 800 m, para un total de nueve sitios de muestreo (Fig. 1). En cada sitio se colocaron tres trampas de caída dispuestas en las esquinas de un triángulo de 50 m de lado (para minimizar la interferencia entre las trampas, Larsen & Forsyth, 2005). A 2 m de cada trampa, se dispuso una estación para medir las funciones ecológicas. Se realizaron tres muestreos (tanto de escarabajos como de funciones) en el 2018 (julio, septiembre y noviembre), manteniendo la misma ubicación de las trampas y estaciones. Las estaciones para medir las funciones fueron dispuestas diez días antes de la apertura de las trampas de caída.
Muestreo de escarabajos coprófagos
Las trampas de caída para el muestreo de escarabajos consistieron en recipientes plásticos (9 cm de diámetro y 13 cm de profundidad) con 100 ml de alcohol al 90 %. Las trampas se enterraron a ras de suelo y protegieron de la lluvia con un plato plástico de 27 cm (a manera de techo). Cada trampa de caída fue cebada con 30 g de heces frescas (mezcla 7:3 de heces de ganado porcino y humano, respectivamente, Marsh et al., 2013). Las trampas se abrieron al atardecer (16:00-18:00 h) y se mantuvieron activas por 48 h; posteriormente, se recolectaron los escarabajos.
Se midieron la longitud y masa corporal de 1-30 individuos, dependiendo de la cantidad de escarabajos recolectados. La longitud corporal se midió con un calibrador electrónico desde el clípeo hasta el pigidio. Para medir la masa los individuos se secaron en un horno a 60 °C hasta alcanzar un registro de masa constante con una balanza de precisión (0.001 g, Cultid et al., 2012).
Para estimar la longitud promedio ponderada de escarabajos en una trampa, se multiplicó la longitud promedio de cada especie por su abundancia en dicha trampa y se sumaron los valores para todas las especies; finalmente, la suma se dividió entre el número total de escarabajos capturados en la trampa. La longitud promedio ponderada es una medida que refleja el tamaño promedio de todos los escarabajos capturados en una muestra. Para determinar los valores de la biomasa total de los escarabajos capturados en cada trampa, se multiplicó la masa de cada especie por su abundancia en dicha trampa y posteriormente se realizó la sumatoria de los valores de cada especie.
El material biológico recolectado se determinó mediante claves taxonómicas (Medina & Lopera-Toro, 2000; Vaz-De-Mello et al., 2011) y la determinación fue corroborada por el Dr. Alejandro Lopera-Toro (Colección CALT-ECC, Bogotá, Colombia). Los especímenes de referencia se encuentran en la Colección de Insectos de la Universidad del Quindío (CIUQ). Todos los permisos necesarios para las recolectas fueron otorgados por la Corporación Autónoma Regional del Quindío (CRQ) de acuerdo con la resolución No 374 de marzo de 2014.
Muestreo de funciones ecológicas
Para cuantificar la remoción de heces, la cantidad de suelo excavado y la dispersión de semillas, se colocaron 50 g de heces frescas (7:3 cerdo-humano) en cada estación. En las áreas donde se colocó la porción de heces la hojarasca fue retirada (radio de ~ 70 cm). Cada porción de heces se protegió de la lluvia con un plato plástico a manera de techo. En cada porción se colocaron 80 cuentas esféricas de madera: 50 de 4 mm, 20 de 8 mm y 10 de 12 mm. Las cuentas se usan como semillas artificiales, ya que permiten estandarizar los métodos y evitar la remoción de semillas verdaderas por animales granívoros (Andresen, 2002). Después de 48 h, las heces se recogieron y se pesaron para calcular la cantidad de heces removidas. Además, se realizó la corrección de cambio de peso de las heces por desecación o hidratación; para esto se colocó, en cada sitio, una porción de heces protegida por una malla. Se extrajeron las cuentas no removidas de las heces para calcular la proporción de semillas dispersadas. El suelo excavado por los escarabajos coprófagos, visiblemente reconocible sobre la superficie del suelo, fue recogido, secado a una temperatura de 70 °C hasta obtener un peso constante, y posteriormente pesado en una balanza (precisión de 0.001 g).
A diferencia de otros estudios (e.g., Braga et al., 2013), no delimitamos el área de cada estación con una valla. Por lo tanto, a pesar de que otros estudios en los Andes colombianos han encontrado que los escarabajos mueven las semillas a distancias máximas de 36 cm (Santos-Heredia et al., 2010), es probable que algunos escarabajos movieran parte del estiércol y semillas a distancias más allá del área revisada por nosotros (70 cm de radio). En consecuencia, nuestras estimaciones para la cantidad de suelo excavado podrían ser conservadoras, pero esto no afectaría nuestra comparación entre tipos de cobertura vegetal.
Análisis de datos: Para analizar el efecto de la cobertura vegetal sobre los escarabajos y sus funciones, se usaron Modelos Lineales Generalizados (MLG) con el tipo de hábitat como factor fijo, usando los paquetes “multcomp” v. 1.4-17 (Hothorn et al., 2008) y “lme4” v. 1.1-27.1 (Bates et al., 2019). Para obtener los valores de las variables de respuesta, se promediaron los datos de las tres trampas/estaciones por sitio usadas en cada repetición temporal y posteriormente se promediaron los valores de las tres repeticiones temporales. De esta manera, se obtuvo un dato por sitio para cada variable de respuesta, y este dato fue un valor promedio por trampa/estación. Las variables de respuesta para los atributos del ensamble de escarabajos fueron abundancia, número de especies, biomasa (g) y longitud corporal ponderada (mm). Las variables de respuesta para las funciones ecológicas fueron heces removidas (%), suelo excavado (g), semillas dispersadas totales (%), semillas dispersadas grandes, medianas y pequeñas (%). Se utilizó una estructura de error Gaussiana para biomasa, longitud ponderada, abundancia, número de especies y suelo excavado y quasibinomial para heces removidas y semillas dispersadas, porque mostraron los mejores ajustes de los modelos. Finalmente, para analizar las correlaciones entre las funciones ecológicas, así como entre los atributos del ensamble y las funciones ecológicas, se calcularon los coeficientes de correlación de Spearman con el paquete “stats” de Rstudio. Todos los análisis fueron realizados en R Core Team (2020) Versión 1.2.1335.
Resultados
Atributos del ensamble de escarabajos coprófagos: En total, se recolectaron 1 492 individuos de 18 especies y 10 géneros. En el bosque secundario se registraron 15 especies (895 individuos), en bosque mixto 12 especies (482 individuos) y en potrero 5 especies (115 individuos; Apéndice 1). El género dominante en las tres coberturas fue Onthophagus. En bosque secundario y bosque mixto Onthophagus acuminatus representó el 40 y 35 % de los individuos recolectados, respectivamente; en potrero, Onthophagus bidentatus representó el 80 %. En bosque secundario se registraron cuatro especies exclusivas, aunque con bajas abundancias (< 6 individuos): Deltochilum sp., Dichotomius allyates, Onthophagus nasutus y Ontherus kirschii. El bosque mixto presentó una especie exclusiva (Onthophagus sp. con dos individuos) y el potrero dos (Coprophanaeus corythus con un individuo y O. bidentatus con 91 individuos) (Apéndice 1).
Los modelos lineales generalizados mostraron que la cobertura vegetal afectó la abundancia de escarabajos capturados por trampa (X 2 = 1 2003, g.l. = 2, P < 0.001), el número de especies (X 2 = 76.543, g.l. = 2, P < 0.001) y la biomasa total (X 2 = 8.1273, g.l. = 2, P < 0.001), pero no la longitud corporal ponderada (X 2 = 1.805, g.l. = 2, P = 0.6777). Las pruebas post hoc (Apéndice 2) mostraron diferencias en abundancia entre las tres coberturas: el bosque secundario tuvo el valor más alto, seguido por el bosque mixto, mientras que el potrero presentó los valores más bajos (Fig. 2A). El número de especies fue similar en bosque secundario y bosque mixto, pero menor en potrero (Fig. 2B), mientras que la biomasa fue similar en bosque mixto y potrero, pero mayor en bosque secundario (Fig. 2C).
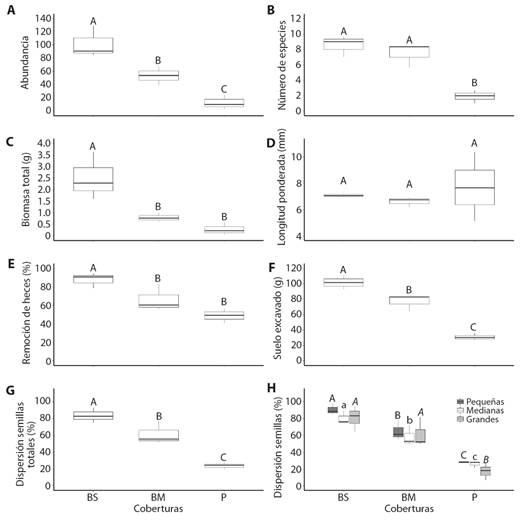
Fig. 2 Efecto de la cobertura vegetal (BS, bosque secundario; BM, bosque mixto; P, potrero) sobre los atributos del ensamble (valores promedio por trampa por sitio) de escarabajos coprófagos (A. abundancia; B. número de especies; C. biomasa total; D. longitud ponderada) y sus funciones ecológicas (valores promedio por estación por sitio; E. remoción de heces; F. suelo excavado; G. dispersión de semillas totales; H. dispersión de semillas por tamaño de semillas). Letras diferentes sobre las barras indican diferencias estadísticas significativas (P < 0.05) con la prueba post hoc de Tukey. / Fig. 2. Effect of vegetation cover (BS, secondary forest; BM, mixed forest; P, cattle pasture) on the attributes of the assemblage (mean values per trap per site) of dung beetles (A., abundance; B. number of species; C. total biomass; D. weighted mean length) and its ecological functions (average values per station per site; E. dung removal; F. soil excavation; G. total seed dispersal; H. seed dispersal by seed size). Different letters above bars indicate significant statistical differences (P < 0.05) with Tukey’s post hoc test.
Funciones ecológicas: Las funciones ecológicas también fueron afectadas por el tipo de cobertura vegetal (remoción de heces: F2,6 = 9.1347, P < 0.001; suelo excavado: X 2 = 7744.3, g.l. = 2, P < 0.001 y semillas totales dispersadas: F2,6 = 24.203, P < 0.001). La remoción de heces fue mayor en bosque secundario que en las otras dos coberturas, pero no difirió entre bosque mixto y potrero (Fig. 2E). Para la excavación de suelo y la dispersión de semillas totales, los valores fueron estadísticamente diferentes en cada cobertura (Fig. 2F, Fig. 2G). También hubo diferencias significativas en la dispersión de semillas para cada uno de los tamaños estudiados (pequeñas: F2,6 = 48.385, P < 0.001; medianas; F2,6 = 35.071, P < 0.001; grandes: F2,6 = 11.961, P < 0.001), pero la dispersión de semillas grandes fue estadísticamente similar en bosque secundario y bosque mixto (Fig. 2H, Apéndice 2).
Relación entre los atributos del ensamble y sus funciones ecológicas: Se encontraron correlaciones positivas (todos los valores de rho > 0.7) entre las tres funciones ecológicas y tres de los atributos del ensamble (número de especies, abundancia y biomasa; Fig. 3A, Fig. 3B, Fig. 3C, Apéndice 3). La longitud ponderada no se relacionó con las funciones.
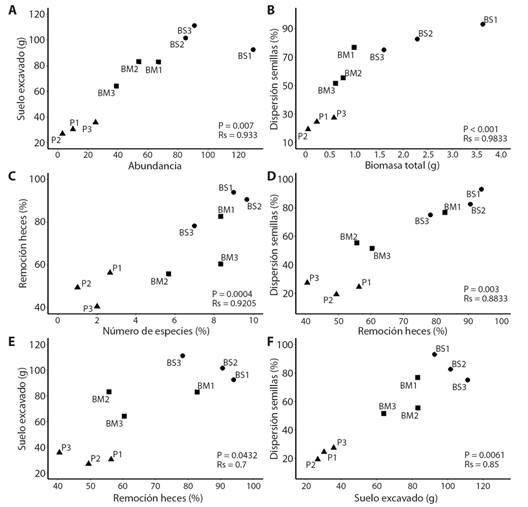
Fig. 3 Las tres correlaciones más fuertes entre cada una de las funciones y algún atributo del ensamble (A, B, C; los estadísticos de las demás correlaciones entre funciones y atributos se pueden encontrar en Apéndice 3) y correlaciones entre las tres funciones ecológicas (D, E, F). Cada punto representa un sitio de estudio en cada una de tres coberturas vegetales: BS, bosque secundario; BM, bosque mixto; P, potrero. / Fig. 3. The three strongest correlations between each of the functions and some attribute of the assemblage (A, B, C; the statistical values of the other correlations between functions and attributes can be found in Appendix 3) and correlations between the three ecological functions (D, E, F). Each point represents a study site in each of three vegetation covers: BS, secondary forest; BM, mixed forest; P, cattle pasture.
Relación entre la remoción de heces y las otras funciones: Se encontró una correlación positiva entre la remoción de heces y las otras dos funciones (Fig. 3D, Fig. 3E). Asimismo, la excavación de suelo y la dispersión de semillas presentaron una fuerte correlación positiva (Fig. 3F).
Discusión
Nuestro estudio tuvo como meta determinar de qué manera los ensambles de escarabajos coprófagos, y sus funciones ecológicas, son afectados por el cambio de uso del suelo en un ecosistema amenazado y muy poco estudiado, los bosques andinos premontanos. Asimismo, dado que existe una falta de consenso con respecto a las relaciones entre diferentes funciones de los escarabajos, y entre las funciones y los atributos de los ensambles, también exploramos estos aspectos. En general, nuestros resultados apoyan nuestras hipótesis de trabajo, ya que los atributos del ensamble de escarabajos coprófagos y sus funciones ecológicas se vieron afectados negativamente por la modificación de la vegetación. Además, debido a que los atributos del ensamble determinan la remoción de heces y que las demás funciones son consecuencia directa de la remoción de heces, todas las funciones son alteradas de manera similar y análoga a los cambios que ocurren en el ensamble. Considerando el uso extendido de los escarabajos coprófagos como grupo indicador y taxón focal para el monitoreo de la biodiversidad en sistemas alterados, la información que presentamos es un valioso recurso para futuros programas de conservación y restauración de bosques andinos en la región de estudio.
El cambio en la cobertura vegetal se asoció con una disminución en todas las variables de respuesta que medimos (con excepción de la longitud ponderada). Nuestros resultados coinciden con los de varios estudios en paisajes montañosos neotropicales (Escobar, 2004; Giraldo et al., 2011; Horgan, 2005; Medina et al., 2002; Noriega et al., 2021). Los cambios más evidentes se observaron en la cobertura vegetal más alterada, es decir en los potreros. En esta cobertura, la mayoría de las especies de escarabajos coprófagos presentes en los bosques secundarios y mixtos estuvieron ausentes, y una sola especie, O. bidentatus, dominó el ensamble (80 % del total de individuos). Asimismo, los potreros mostraron que están sufriendo una remoción ineficiente de heces (cerca del 50 % de las heces no fue removida) con posibles implicaciones negativas para el manejo de los pastizales y del ganado (Nichols et al., 2008). Estos resultados confirman que los escarabajos coprófagos están bien adaptados a ecosistemas boscosos pues les proveen las condiciones ambientales idóneas para su supervivencia. Por el contrario, las áreas de potrero evidencian la necesidad de implementar estrategias de manejo para aumentar el área de cobertura vegetal (e.g., cercas vivas, sistemas agroforestales) que brinden al ganado y la fauna nativa, y por tanto a los ensambles de escarabajos, ambientes más favorables.
Diferentes estudios han encontrado una relación positiva entre los atributos y las funciones ecológicas que desempeñan los escarabajos coprófagos (Bang et al., 2005; Braga et al., 2013; Dangles et al., 2012; Griffiths et al., 2015; Griffiths et al., 2016; Manning et al., 2016; Slade et al., 2007). En este estudio encontramos que todos los atributos (excepto longitud ponderada) se relacionaron con todas las funciones. Sin embargo, las relaciones más estrechas fueron aquellas entre la biomasa y la dispersión de semillas, entre la abundancia y el suelo excavado, y entre la riqueza y la remoción de heces. En general, entre más funciones son consideradas en los estudios, el efecto de la biodiversidad sobre el funcionamiento de los ecosistemas es más evidente y consistente en los diferentes hábitats (e.g., Lefcheck et al., 2015; Milotić et al., 2017). Si bien la mayoría de la evidencia muestra la relación entre la comunidad de escarabajos y sus funciones, es de esperar que esta relación sea muy variable en espacio y tiempo (e.g., Dangles et al., 2012).
Respecto a las relaciones entre la remoción de heces y las otras funciones ecológicas de los escarabajos coprófagos, estas fueron significativas. Esto sugiere que la excavación de suelo y la dispersión de semillas son resultado directo de la remoción de heces, como otros estudios han mostrado (Santos-Heredia et al., 2018; Slade et al., 2007). Sin embargo, los resultados de algunos estudios indican que esta suposición no debe ser generalizada, porque la relación entre la remoción de heces y otras funciones no siempre es tan clara (Braga et al., 2013; Carvalho et al., 2020; Nichols et al., 2013). Por ejemplo, un estudio demostró que la relación entre la remoción de heces y las otras funciones puede variar según el uso del suelo (Carvalho et al., 2020). En este sentido, cuando el objeto de la investigación es determinar los efectos que tiene el cambio en el uso del suelo en los ecosistemas, se ha recomendado la medición de varias funciones ecológicas (Manning et al., 2016). Por el contrario, si el propósito de la investigación es realizar monitoreos, la medición de una función podría bastar. Por último, podría considerarse el uso de estos insectos también para el monitoreo de programas de conservación y restauración, dada la reconocida relación entre la diversidad de mamíferos, sus heces y los escarabajos coprófagos. Estudios futuros podrían investigar si los escarabajos coprófagos del bosque andino se pueden usar como un indicador de defaunación, como se ha sugerido para la mata atlántica (e.g., Culot et al., 2013).
Los bosques andinos se caracterizan por una gran biodiversidad, compleja geología y clima variado (Young, 2011). La Cordillera de Los Andes representa el 30 % del territorio colombiano y cruza de norte a sur la nación. Actualmente, más de la mitad de los bosques andinos han sido sustituidos por sistemas agropecuarios (Aguilar-Isaza et al., 2010). Para la conservación de los bosques andinos se requieren acciones basadas en evaluaciones rápidas y económicas. Por ello, cuando el interés principal es determinar cómo está siendo afectado el funcionamiento de los ecosistemas, tan solo con medir las funciones de los organismos se puede generar información precisa que refleje los procesos naturales y los cambios provocados por algún disturbio. En el caso de los escarabajos coprófagos, varias funciones pueden medirse de manera relativamente fácil y esta aproximación puede ahorrar recursos (Gollan et al., 2013). Entonces, incluso si no se quiere evaluar el funcionamiento de los ecosistemas, sino simplemente se quiere monitorear la recuperación del ecosistema (tanto en términos de biodiversidad como de funcionalidad) se podría fácilmente cuantificar las funciones, ya que requieren menos esfuerzo y no requiere de experiencia en la identificación taxonómica (a diferencia de los muestreos de escarabajos).
Finalmente, en la hacienda “El Ocaso” la guadua fue sembrada con el objetivo de crear una barrera natural para el ganado, pero ha proliferado rápidamente y ha invadido los bosques. Los bosques mixtos resultantes, forman un continuo con los bosques secundarios. Por lo tanto, es probable que en poco tiempo la guadua domine completamente la vegetación boscosa dado que forma colonias dominantes conocidas como guaduales, reduciendo la complejidad estructural de los últimos remanentes de bosque secundario de la región. Al ser ecosistemas invadidos, la sucesión no progresa normalmente y no hay una recuperación natural del ecosistema. Es necesario que la guadua sea manejada con el fin de evitar que invada los bosques, y su utilidad como cerca viva en la hacienda “El Ocaso” debería ser reconsiderada.
El presente trabajo contribuye a incrementar nuestro conocimiento sobre la relación entre la biodiversidad y el funcionamiento de los ecosistemas andinos altamente transformados. Esperamos que nuestros resultados motiven actividades productivas más sostenibles para estos paisajes modificados por el hombre, así como estrategias que conserven y restauren los últimos remanentes de bosque de la región.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.
Ver Apéndice digital











 uBio
uBio 


