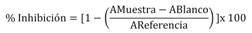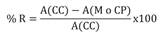Introducción
Los ambientes marinos comprenden más del 70 % de la superficie de la tierra, desde las heladas aguas del Ártico y la Antártida hasta las cálidas aguas de los trópicos (Kodzius & Gojobori, 2015). Gracias a su abundante riqueza de sistemas de vida únicos, los biomas marinos se han convertido en un objeto de estudio importante para la bioprospección (Müller et al., 2016), permitiendo la identificación de posibles moléculas bioactivas útiles para la fabricación y el desarrollo de diferentes tipos de productos (Bhatia & Chugh, 2015; , y es que las diversas condiciones físicas del medio contribuyen a la formación de interacciones complejas entre organismos, y en consecuencia, el desarrollo de metabolitos en las especies, que generan resistencia a muchos patógenos (Morgado & Vieira, 2020).
Como parte fundamental de los organismos, los lípidos son una fuente de energía y componentes clave de la membrana celular; sin embargo, también son medidores bioactivos de fenómenos fisiopatológicos y fisiológicos como la homeostasis, la respuesta inmune y la biosíntesis hormonal (Ohba et al., 2018). Los compuestos lipídicos han sido estudiados ampliamente porque actúan como trazadores ecológicos, además de que el metabolismo lipídico de muchas especies está vinculado fuertemente a la taxonomía (Sardenne et al., 2018).
Las esponjas (Phylum Porifera) y sus microorganismos asociados, son los principales contribuyentes de sustancias aisladas en especies marinas (Mehbub et al., 2016). Estos organismos han desarrollado como mecanismo de defensa química la producción de diferentes tipos de metabolitos secundarios bioactivos para protegerse de depredadores (Lopeztegui-Castillo et al., 2020; Ortiz, 2016). Las actividades biológicas evaluadas con extractos y metabolitos secundarios provenientes de poríferos son variadas, desde la actividad antiparasitaria, antimicrobiana, antifúngica, citotóxica hasta la inhibición enzimática, por lo que estas especies tienen un gran potencial en la industria farmacéutica y la medicina (Blunt et al., 2017). La familia Tetillidae a la que pertenece Tetilla rodriguesi, se caracteriza por estar conformada por géneros con caracteres morfológicos conflictivos, lo que resulta en una ambigüedad de las relaciones filogenéticas, por lo que el género Tetilla carece de cualquier sinapomorfia morfológica conocida (Szitenberg et al., 2013). La especie T. rodriguesi tiene forma de pera, de aproximadamente 4 mm de diámetro y 9 mm de altura, posee una consistencia corporal bastante suave y una superficie ligeramente híspida, excepto en el extremo posterior donde se localiza un rizoide (Fernandez et al., 2011).
Dado que en la actualidad existen muy pocos reportes bibliográficos sobre la composición química y estudios de bioprospección en especies del género Tetilla, surgió el interés de identificar los ácidos grasos presentes en la esponja marina T. rodriguesi, recolectada en la región, además de analizar las actividades antimicrobiana y antioxidante de su extracto metanólico.
Materiales y métodos
Equipos: Para la obtención del extracto metanólico primario por destilación a presión reducida se empleó un rotoevaporador Büchi R-114. Para la obtención de la subfracción lipídica se utilizaron columnas cromatográficas soportadas sobre gel de Silica Merck con tamaño de partícula entre 40-63 µm y solventes grado analítico marca Merck. Para la obtención del cromatograma y los espectros de masas de la subfracción lipídica se empleó un cromatógrafo de gases Agilent 6 890 N, con columna capilar DB-1MS, acoplado a un espectrómetro con detector selectivo de masas Agilent 5 973 N. Para los ensayos de actividad antioxidante se empleó un espectrofotómetro (GENESYS 20 thermo spectronic modelo 4 001) y para la actividad antimicrobiana se usó un lector de ELISA (ChroMate 4 300).
Área de estudio: La bahía de Cispatá está ubicada en el litoral Caribe colombiano (9º20’-9º25’ N & 75º47’-75º55’ W), al costado suroccidental del golfo de Morrosquillo; específicamente en el departamento de Córdoba, entre los municipios de San Antero y San Bernardo del Viento (Castaño et al., 2010). Esta región presenta una temperatura promedio de 30 °C, una humedad relativa del 80 % y un patrón de distribución de lluvias de tipo unimodal-biestacional, con montos anuales de 1 337 mm entre mayo y noviembre, siendo abril y diciembre, meses de transición (Jiménez-Escobar & Rangel-Churio, 2012). El sector como conocido la Ahumadera (9°24’44.90” N & 75°47’43.73” W) está formado por fondos de tipo lodoso y arenoso, con pequeños parches de pastos marinos (Quirós & Arias, 2013). A su vez, el Banco de Arena (9°25’26.15” N & 75°47’33.62” W) es una zona que se caracteriza por presentar sustratos lodo-arenosos, ampliamente colonizados por céspedes multiespecíficos de algas, pastos, poríferos, tunicados, entre otra gran diversidad de organismos (Nisperuza Pérez et al., 2018).
Obtención y derivatización de ácidos grasos: Los organismos recolectados en la Ahumadera y en el Banco de Arena, fueron identificados a nivel taxonómico mediante los registros fotográficos de los mismos en el medio natural, y la posterior observación de espículas en un microscopio óptico (Zea, 1987; Zea et al., 2014). Uno de los ejemplares fue depositado en el Laboratorio de Zoología de la Universidad de Córdoba (CZUC-PR: 0020). El material recolectado de T. rodriguesi (295 g peso húmedo) fue cortado en pequeños pedazos y sometido a maceración en frío con metanol (MeOH) durante siete días (3 repeticiones), posteriormente se filtró y se sometió a destilación a presión reducida a una temperatura de 45 °C para concentrarlos y obtener el extracto metanólico (Santafé et al., 2009). Parte del extracto metanólico (2 g) fue sometido a cromatografía en columna, comenzando con un sistema de elución bencina: acetato de etilo (7:1), aumentando la polaridad hasta metanol, las subfracciones con Rf similares al ácido oleico (monitoreadas por cromatografía de capa delgada), fueron reunidas y concentradas (Pastrana et al., 2016). Para la obtención de esteres metílicos se empleó la metodología utilizada por Chaves et al. (2018) con ciertas variantes, en donde la subfracción lipídica (250 mg) se sometió a reflujo con una solución 2 N de hidróxido de potasio en metanol (KOH/MeOH). Luego se adicionó trifluoruro de boro metanólico (BF3/MeOH) al 20 % p/p en reflujo a 80 °C. La mezcla se extrajo con diclorometano (DCM), se adicionó sulfato de sodio anhidro, se filtró y se concentró. Posteriormente se separaron los compuestos por cromatografía de gases acoplado a espectrometría de masas en modo de impacto electrónico (CG-EM) (Quiroz Lobo et al., 2021) y se estudiaron los espectros obtenidos, teniendo en cuenta las fragmentaciones características para cada compuesto y su coincidencia con las bases de datos NIST02.L, NIST5a.L y NIST98.L.
Actividad antioxidante: En esta sección se detalla la actividad antioxidante por los métodos ABTS+• y DPPH• siguiendo las metodologías empleadas por (Pastrana Franco et al., 2019).
Ensayos de actividad antioxidante por el método del ácido 2,2’-azino-bis (3-etilbenzotiazolin-6 sulfónico) (ABTS+•): Se mezclaron 9.9 ml de radical ABTS+• 3.43 mM y 0.1 ml de persulfato de potasio (S2O8K2) 125 mM y se guardó en la oscuridad por 12 h mientras se activaba el radical. Se tomaron 1.5 ml de la mezcla preparada y se diluyó con buffer fosfato de pH 7.4 hasta obtener una absorbancia de 0.700 ± 0.05 en un espectrofotómetro a una longitud de onda λ = 732 nm, ajustando con un blanco de buffer fosfato. Para la evaluación de la actividad antioxidante se mezclaron 40 µl de las muestras en DMSO con 1 960 μl de catión radical ABTS+•, la medición de la absorbancia de las mezclas se llevó a cabo 30 min después de ser incubadas en la oscuridad. Para los blancos de muestra se mezclaron 40 µl de las muestras con 1 960 µl de buffer de fosfato y para la referencia se mezclaron 40 µl de DMSO con 1 960 µl de catión radical ABTS+•. Todas las mediciones fueron realizadas por triplicado y el porcentaje de inhibición fue calculado utilizando la Ecuación 1, donde AMuestra, es la absorbancia de la muestra, ABlanco, es la absorbancia de la muestra y AReferencia, la absorbancia de la referencia. Luego se graficó el % Inhibición vs la concentración para determinar la concentración inhibitoria media (IC50) por interpolación lineal (Montaño & Santafé, 2011).
Ecuación 1: Porcentaje de inhibición.
Ensayos de actividad antioxidante por el método del 2,2-difenil-1-picrilhidrazil (DPPH•): Se preparó una solución de radical DPPH• 54.34 mM y se guardó por 24 h en ausencia de luz, de esa solución se tomaron 1.5 mL y se diluyeron con metanol hasta obtener una absorbancia de 0.300 ± 0.05 en un espectrofotómetro a una longitud de onda λ = 517 nm. Para la evaluación de la actividad antioxidante se mezclaron 40 µl de las muestras en DMSO con 1 960 μl de catión radical DPPH•, la medición de la absorbancia de las mezclas se llevó a cabo 30 min después de ser incubadas en la oscuridad. Para los blancos de muestra se mezclan 40 µL de las muestras con 1 960 µL de MeOH y para la referencia se mezcló 40 µL de DMSO con 1 960 µL Radical DPPH•. Todas las mediciones fueron realizadas por triplicado y el porcentaje de inhibición a esa concentración se calculó utilizando la ecuación 1. Luego se graficó el % Inhibición vs la concentración para determinar el IC50 por interpolación lineal.
Ensayos de la actividad antimicrobiana: La actividad antimicrobiana de los extractos (concentraciones desde 25 hasta 2 500 ppm) se evaluó frente a cepas de referencia de Pseudomonas aeruginosa (ATCC 27 852), Escherichia coli (ATCC 25 922), Staphylococcus aureus (ATCC 29 213), Klebsiella pneumoniae (ATCC 10 031), Enterococcus faecalis (ATCC 29 212) y Candida albicans (ATCC 10 231); además de aislados clínicos de Candida albicans (obtenida en sangre) y Candida krusei (obtenida en catéter). En las microplacas se adicionaron 50 μL de los extractos y 50 μL de la suspensión microbiana estandarizada, fueron selladas con adhesivos e incubadas a 36 °C para bacterias y 27 °C para hongos, durante 24 h. Tras la incubación, el crecimiento microbiano se evaluó midiendo los valores de absorbancia a 630 nm en el lector de ELISA. Como control positivo se utilizó Fluconazol a 500 ppm, para hongos y Ciprofloxacina a 500 ppm para bacterias; como control negativo se usó DMSO al 10 %, así como su respectivo control de crecimiento (Méndez et al., 2016).
Para determinar el grado de inhibición de los extractos y del control positivo, se calculó el porcentaje de reducción del crecimiento microbiano por parte del extracto y del control positivo (% R) utilizando la Ecuación 2 (Belal et al., 2017), donde A (CC) es la absorbancia del control de crecimiento, A (M) es la absorbancia de la muestra y A (CP) la absorbancia del control positivo.
Ecuación 2: Porcentaje de Reducción del crecimiento bacteriano.
Resultados
Composición de ácidos grasos de la esponja marina Tetilla rodriguesi: Con ayuda de la cromatografía de gases, y por medio del análisis de los espectros de masas de impacto electrónico de los compuestos encontrados se llevó a la identificación de 19 ácidos grasos de diferente naturaleza en la especie T. rodriguesi (Tabla 1).
Tabla 1 Composición de ácidos grasos de lípidos totales en la esponja T. rodriguesi. / Table 1. Fatty acid composition of total lipids in T. rodriguesi.
| No | Compuesto | Tiempo de retención (min) | Abundancia Relativa (%) |
| 1 | Ácido dodecanoico | 18.02 | 0.18 |
| 2 | Ácido tridecanoico | 20.86 | 0.28 |
| 3 | Ácido tetradecanoico | 23.61 | 8.88 |
| 4 | Ácido 4,8,12-trimetiltridecanoico | 24.96 | 3.73 |
| 5 | Ácido pentadecanoico | 25.27 | 2.11 |
| 6 | Ácido 12-metiltetradecanoico | 25.46 | 0.60 |
| 7 | Ácido 14-metilpentadecanoico | 27.81 | 0.92 |
| 8 | Ácido 9-hexadecenoico | 28.12 | 20.71 |
| 9 | Ácido hexadecanoico | 28.72 | 10.21 |
| 10 | Ácido 14-metilhexadecanoico | 29.75 | 1.49 |
| 11 | Ácido 7-metil-6-hexadecenoico | 29.92 | 0.54 |
| 12 | Ácido 2-hexilciclopropaneoctanoico | 30.64 | 0.82 |
| 13 | Ácido heptadecanoico | 31.06 | 0.26 |
| 14 | Ácido 9,12-octadecadienoico | 32.57 | 2.04 |
| 15 | Ácido 9,12,15-octadecatrienoico | 32.67 | 1.74 |
| 16 | Ácido 10-octadecenoico | 32.85 | 2.36 |
| 17 | Ácido 7-octadecenoico | 33.06 | 14.90 |
| 18 | Ácido octadecanoico | 33.70 | 2.15 |
| 19 | Ácido 10-nonadecenoico | 35.80 | 1.98 |
Columna cromatográfica utilizada: DB-1MS. / Chromatographic column used: DB-1MS.
En la agrupación numérica de los ácidos grasos identificados de acuerdo a diferentes características estructurales, se encontró que el número de ácidos grasos de cadena recta (68.4 %) poseen porcentaje mayor que los ramificados (31.6 %); en cuanto a las insaturaciones, es evidente la prevalencia de ácidos grasos saturados (AGS) (63.1 %) sobre los monoinsaturados (AGMI) (26.3 %).
Actividad Antioxidante: Se graficaron los porcentajes de inhibición (% Inhibición) obtenidos frente a las concentraciones evaluadas (Fig. 1), y por medio de regresión lineal utilizando el método de los mínimos cuadrados, se logró obtener el IC50 por interpolación gráfica, dando como resultado 296.98 ppm para ABTS+• en la Fig. 1 A (coeficiente de correlación = 0.9928) y 3 523 ppm para DPPH• en la Fig. 1 B (coeficiente de correlación = 0.9992).
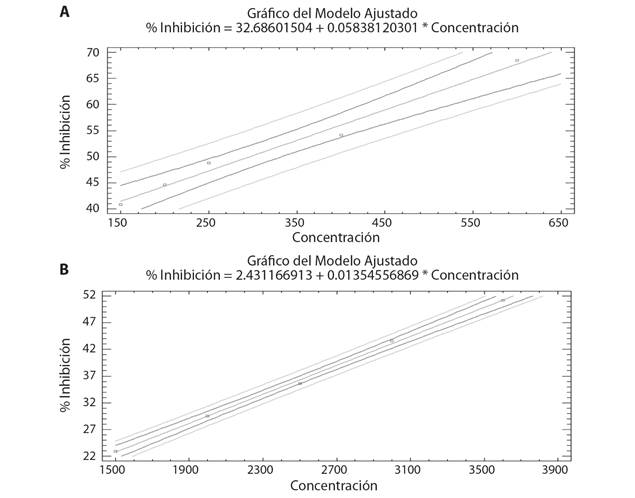
Fig. 1 Porcentaje de inhibición vs concentración por el método A. ABTS+• y B. DPPH• para T. rodriguesi. / Fig. 1. Percentage of inhibition vs concentration by method A. ABTS+• and B. DPPH• for T. rodriguesi.
Actividad Antimicrobiana: Las concentraciones del extracto metanólico de T. rodriguesi más efectivas frente a cada uno de los microorganismos tratados se muestran en la Tabla 2.
Tabla 2 Concentración efectiva del extracto metanólico de T. rodriguesi frente a los microorganismos utilizados. / Table 2. Effective concentration of the methanolic extract of T. rodriguesi vs the microorganism used.
| Microorganismo | Concentración (ppm) | % RM | % Rf |
| P. aeruginosa | 50 | 52.1 | 98.7 |
| K. pneumoniae | 250 | 56.3 | 91.0 |
| S. aureus | 2 250 | 36.6 | 91.0 |
| E. faecalis | 2 250 | 24.4 | 19.7 |
| E. coli | 2 500 | 46.2 | 15.8 |
| C. albicans (sangre)* | 1 000 | 68.6 | 43.3 |
| C. krusei (catéter) | 2 250 | 67.2 | 52.8 |
| C. albicans ATCC 10231 | 2 500 | 40.9 | 38.6 |
Discusión
Muchas investigaciones realizadas han informado que los poríferos contienen cantidades significativas de ácidos grasos libres (Dembitsky et al., 2003), cuya diversidad significativa se debe tanto a los requisitos específicos que necesitan sus membranas celulares para subsistir en diversas condiciones ambientales (Botic et al., 2015), como de ácidos grasos exógenos con los cuales se alimenta haciendo que la concentración y presencia de estos compuestos, pueda diferir para una misma especie muestreada en diferentes lugares o en diferentes estaciones (Koopmans et al., 2015). El ácido graso más abundante (cerca del 20 % de la composición) identificado en el extracto metanólico de la especie T. rodriguesi fue el ácido 9-hexadecenoico (palmitoleico), característico de las materias grasas de origen marino (Romero et al., 2000); también es significativo la presencia del ácido hexadecanoico (palmítico), siendo el principal ácido graso saturado presente, ambos ácidos son compuestos comunes en poríferos (Swantara et al., 2019) y muy utilizados en la dieta alimenticia humana (Jamebozorgi et al., 2019). La prevalencia de ácidos grasos saturados sobre los insaturados en esta especie puede ser explicado por el área de recolección, ya que los compuestos insaturados tienen como función principal en muchos organismos, de mantener la fluidez de la membrana a altas presiones y bajas temperaturas en aguas muy profundas (Aydın et al., 2011).Pese a que las esponjas marinas son una de las fuentes más ricas de ácidos grasos novedosos (Rezanka & Sigler, 2009), con una gran cantidad de compuestos con cadenas carbonadas largas (Bennett et al., 2018), en este estudio no se evidenció la presencia de ácidos grasos con cadena carbonada mayor a 20 miembros, sin embargo se resalta la aparición del ácido 2-hexilciclopropaneoctanoico, por la presencia de un ciclopropano en la cadena hidrocarbonada, siendo este, uno de los anillos más comunes presentes en las cadenas de ácidos grasos en invertebrados marinos, como consecuencia de interacciones con organismos asociados (Christie & Holman, 1966; Hanus et al., 2008).
El resultado obtenido de evaluar la actividad antioxidante de una esponja depende del crecimiento local de la esponja, las condiciones en que se encuentra, las sustancias biológicas presentes y la polaridad del extracto (Cuong et al., 2019). Existe una correlación directa entre el contenido fenólico de los extractos obtenidos de los organismos y la actividad antioxidante de este (Oogarah et al., 2020). Los valores de IC50 encontrados en T. rodriguesi (296.98 y 3 523 ppm para ABTS+• y DPPH• respectivamente) son muy altos con respecto a organismos de la misma clase (Demospongiae) tales como Zygomycale parishii y Callyspongia diffusa (cuyo IC50 es aproximado a 550 ppm para DPPH•) (Krishnan & Keerthi, 2016), pero se asemeja a la capacidad captadora de radicales de las esponjas Agelas oroides, Axinella damicornis, Ircinia spinulosa, Ircinia fasciculata, Ircinia variabilis, Dysidea avara y Sarcotragus spinulosus frente al radical DPPH• (IC50 mayor a 2 000 ppm) (Orhan et al., 2012). En cuanto a la actividad antioxidante frente al radical ABTS+•, el extracto metanólico presentó un mejor resultado que el reportado para Suberites aurantiaca (IC50 mayor a 2 000 ppm) (Garcia-Davis et al., 2018).
Las esponjas procesan naturalmente un gran volumen de agua diariamente, concentrando una amplia variedad de patógenos y, como consecuencia, han desarrollado sistemas de defensa eficaces basados en metabolitos secundarios bioactivos (Welter Giraldes et al., 2020). Diversos estudios han mostrado el efecto de compuestos aislados de esponjas marinas, así como sus extractos crudos, sobre bacterias y hongos (El-Damhougy et al., 2017), siendo muy útiles en el desarrollo de nuevos antibióticos y fármacos antimicrobianos (Ibrahim et al., 2020). Se han realizado varias investigaciones que comprueban la capacidad antimicrobiana que poseen los ácidos grasos y sus derivados (Zhang et al., 2012). Compuestos como los ácidos 9-hexadecenoico y hexadecanoico son catalogados la defensa más potente de ciertos los organismos, para prevenir infecciones (Subramanian et al., 2019). En esta investigación, se evidenció que el extracto metanólico de T. rodriguesi disminuyó el crecimiento de todas las cepas bacterianas utilizadas, siendo P. aeruginosa la bacteria más susceptible. Se resalta la inhibición del 52 % del crecimiento a 50 ppm del extracto. En cuanto a la actividad presentada por el extracto metanólico frente a organismos fúngicos aquí evaluados, se pudo establecer que el aislado clínico de C. albicans (sangre) fue el más susceptible, aunque en el aislado clínico de C. krusei (catéter) y en la cepa de referencia de C. albicans (ATCC 10 231) a medida que se aumentaba la concentración del extracto, decrecía el crecimiento fúngico.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio