Introducción
Los ecosistemas marino-costeros y su biodiversidad están experimentando una presión cada vez mayor en todo el mundo debido a la contaminación, a la mala planificación de infraestructura, a la sobrepesca y al cambio climático (He & Silliman, 2019). Conocer la biodiversidad marina es esencial para evaluar el estado, los cambios y el alcance de la pérdida en estos ecosistemas (Costello, Michener, Gahegan, Zhang, & Bourne, 2013; Worm et al., 2006). Los hábitats marino-costeros tropicales, como los arrecifes de coral, los manglares, zonas intermareales y los lechos de pastos marinos, han sido el foco de investigación en las últimas décadas. Sin embargo, en muchos sitios el estudio de otros ecosistemas, como los bosques submarinos de algas o los fondos submareales de sustratos blandos ha sido menor (Gouvêa et al., 2020; Mecho, Easton, Sellanes, Gorny, & Mah, 2019).
En el Pacífico costarricense, los ambientes marinos más estudiados han sido principalmente los arrecifes rocosos, los arrecifes y comunidades coralinas, las zonas rocosas intermareales, las playas y los manglares (Cortés, 2016). En Costa Rica, los estudios de diversidad se han concentrado en los ambientes más someros, desde las zonas intermareales hasta los 10 m de profundidad, posiblemente relacionado con las facilidades en el muestreo y con especies de importancia comercial, y por lo tanto son sitios que han tenido mejores medidas de conservación en el país (Alvarado, Beita-Jimenez, Mena, Fernández-García, Cortés, Sánchez-Noguera, Jimenez & Guzmán-Mora, 2018; Alvarado, Beita, Mena, Fernández-García, & Guzman-Mora, 2015; Alvarado, Beita, Mena, Fernández-García, Guzman-Mora & Cortés, 2016; Alvarado, Herrera, Corrales, Asch, & Paaby, 2011; Alvarado, Sánchez-Noguera, Arias-Godínez, Araya, Fernández-García & Guzmán, 2020; Samper-Villareal, Bourg, Sibaja-Cordero, & Cortés, 2014; Sibaja-Cordero & Cortés, 2008; Sibaja-Cordero & Vargas-Zamora, 2006). También se han realizado investigaciones en ambientes que van de los 10 a los 40 m utilizando buceo autónomo, no obstante, están más relacionados con estudios taxonómicos en grupos como los octocorales (Breedy & Guzmán, 2003).
Recientemente, varios trabajos han recopilado la diversidad marina del Área de Conservación Guanacaste (ACG), enfocándose en la revisión de colecciones y literatura científica, así como del Proyecto BioMar-ACG (Chacón-Monge, Azofeifa-Solano, Alvarado, & Cortés, 2021; Cortés, 2017; Cortés & Joyce, 2020; Vargas & Cortés, 2019). No obstante, hay muy pocas investigaciones que estudien la diversidad de los bosques de Sargassum (ver Suárez, Riosmena-Rodríguez & Cortés, 2021) y de zonas arenosas a profundidades mayores de los 20 m, entre otros ambientes. A pesar de que estos ecosistemas resguardan una diversidad muy específica, en Costa Rica se han investigado poco (Cortés, Samper-Villarreal, & Bernecker, 2014). Por lo tanto, el objetivo de esta investigación es caracterizar la biodiversidad de ambientes submareales en la península de Santa Elena y las Islas Murciélago, en el Pacífico norte de Costa Rica.
Materiales y métodos
Sitio de estudio: Los ambientes costeros del ACG incluyen accidentes geográficos característicos, tales como playas, costas rocosas, bahías e islotes en la Península de Santa Elena, la Bahía Santa Elena y las Islas Murciélago (Fig. 1). Actualmente, están bajo alguna categoría de protección 430 km2 y 150 km de línea de costa del Parque Nacional Santa Rosa, así como 7.28 km2 del Área Marina de Manejo Bahía Santa Elena. Esta zona presenta una estacionalidad marcada debido al afloramiento costero, que ocurre de diciembre y marzo, meses en los cuales se reportan bajas temperaturas y un aumento en la concentración de nutrientes en la columna de agua (Alvarado et al., 2018; Legeckis, 1988; Lizano & Alfaro, 2014; McCreary, Lee, & Enfield, 1989; Rodríguez, Alfaro & Cortés, 2021).
La Península de Santa Elena está compuesta por una secuencia de basaltos alcalinos, radiolarita y brechas polimícticas que datan del Jurásico-Cretácico (Denyer, Cortés, & Cárdenes, 2005; Denyer & Gazel, 2009). La Bahía de Santa Elena es relativamente somera, con las mayores profundidades entre 30 y 35 m en su zona externa; está rodeada por playas de arena hacia las zonas externas, y planicies de limo y arena hacia la zona interna cerca del Estero Grande, con fondos submareales dominados por arena y rocas coralinas en algunas zonas (BIOMARCC-SINAC-GIZ, 2012). Por su parte, las Islas Murciélago, compuestas por cinco islas principales y al menos 10 rocas e islotes, se ubican a 5 km al sur de la península, y están conformadas por basaltos columnares, en almohadilla y masivos que datan del Cretácico (Denyer et al., 2005; Hauff et al., 2000).
Recolecta de datos: Del 21 de abril al 02 de mayo del 2018 se visitaron un total de 28 sitios para analizar los hábitats costeros de la Península de Santa Elena, Bahía Santa Elena e Islas Murciélago durante la Expedición Santa Elena Waitt Foundation-MarViva, a bordo del yate Plan B (Fig. 1). Durante esta visita se realizó un listado de especies para cuatro tipos de hábitats submareales: arrecifes y comunidades coralinas, arrecifes rocosos, bosques del alga parda Sargassum y fondos de sedimentos.
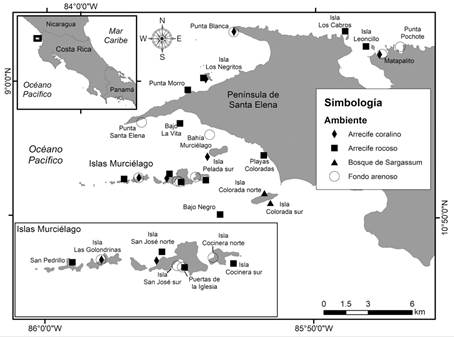
Fig. 1 Sitios de muestreo de distintos hábitats submareales durante la expedición Santa Elena Waitt Foundation-MarViva (2018), Pacífico Norte de Costa Rica. / Fig. 1. Sampling sites at different subtidal habitats during the Santa Elena expedition Waitt Foundation-MarViva (2018), North Pacific of Costa Rica.
En los arrecifes y las comunidades coralinas, los arrecifes rocosos y los bosques de Sargazo se realizaron censos visuales para determinar la diversidad de peces e invertebrados móviles y la composición del sustrato (invertebrados sésiles y algas) siguiendo la metodología de Alvarado et al. (2018) y Alvarado et al. (en prensa). Para el caso de fondos arenosos, se hicieron buceos a una profundidad inicial máxima de 35 m, en los cuales se realizaron transectos perpendiculares de 10 m a la costa siguiendo un rumbo, hasta llegar a los 5 m de profundidad. En estos transectos se anotaron las especies de vertebrados observadas y se recolectaron macroinvertebrados móviles y sésiles, además de algas. Adicionalmente, se realizaron observaciones mediante buceos errantes y se recolectaron organismos manualmente durante los buceos con SCUBA. En algunos fondos blandos se utilizó una draga metálica (50 cm x 25 cm) arrastrada sobre el fondo durante 20 minutos, entre 15 y 30 m de profundidad. Los organismos de esta expedición científica fueron depositados en las colecciones del Herbario Dr. Luis A. Fournier Origgi (USJ) y el Museo de Zoología (MZUCR) de la Universidad de Costa Rica.
Resultados
En total se observaron 254 especies de organismos marinos, distribuidas en 192 géneros, 153 familias, 69 órdenes, 17 clases y 10 filos (Tabla 1). Entre estas se encuentran cuatro reportes nuevos para el país, incluyendo una especie de alga (Scinaia spp., que no coincide con ninguna de las especies del género conocidas para el Pacífico Tropical Oriental), dos géneros de algas (Gaylliela y Siphonocladus) y la subclase de anémonas tubícolas Ceriantharia (orden Spirularia, familia Cerianthidae). El grupo con mayor riqueza de especies fueron los peces óseos (90), seguidos de Gastropoda con (25 spp.), las algas rojas del filo Rhodophyta (20 spp.) y Anthozoa (19 spp.) (Tabla 1, Fig. 2).
Tabla 1 Taxonomía de las especies encontradas por ambiente durante la Expedición Santa Elena Waitt-MarViva, Pacífico norte de Costa Rica, 2018. AR: Arrecife rocoso; AC: Arrecife de Coral; BS: Bosque de Sargassum; FA: Fondo arenoso. / Table 1. Taxonomy of the species found by environment during the Waitt-MarViva Santa Elena Expedition, North Pacific of Costa Rica, 2018. AR: Rocky reef; AC: Coral Reef; BS: Sargassum forest; FA: Sandy bottom
| Taxa | AR | AC | BS | FA |
| Filo Chlorophyta | ||||
| Clase Ulvophyceae | ||||
| Orden Bryopsidales | ||||
| Familia Bryopsidaceae | ||||
| Bryopsis pennata | X | X | ||
| Familia Caulerpaceae | ||||
| Caulerpa chemnitzia | X | X | X | |
| Caulerpa sertularioides | X | X | ||
| Familia Codiaceae | ||||
| Codium isabelae | X | X | ||
| Codium spp. | X | X | ||
| Familia Halimedaceae | ||||
| Halimeda discoidea | X | X | ||
| Familia Udoteaceae | ||||
| Chlorodesmis caespitosa | X | |||
| Orden Cladophorales | ||||
| Familia Siphonocladaceae | ||||
| Siphonocladus spp. | X | |||
| Orden Ulvales | ||||
| Familia Ulvaceae | ||||
| Ulva cf. lactuca | X | X | X | |
| Ulva cf. lingulata | X | |||
| Filo Rhodophyta | ||||
| Clase Florideophyceae | ||||
| Orden Bonnemaisoniales | ||||
| Familia Bonnemaisoniaceae | ||||
| Asparagopsis taxiformis | X | X | ||
| Orden Ceramiales | ||||
| Familia Ceramiaceae | ||||
| Gayliella spp. | X | X | ||
| Ceramium spp. | X | X | X | |
| Familia Delesseriaceae | ||||
| Hypoglossum spp. | X | |||
| Familia Rhodomelaceae | ||||
| Chondria platyclada | X | |||
| Orden Peyssonneliales | ||||
| Peyssonneliales spp. | X | X | ||
| Orden Corallinales | ||||
| Familia Lithophyllaceae | ||||
| Amphiroa misakiensis | X | X | X | |
| Amphiroa sp. 1 | X | |||
| Amphiroa sp. 2 | X | X | ||
| Lithophyllum spp. | X | X | ||
| Familia Lithothamniaceae | ||||
| Lithothamnion muelleri | X | |||
| Orden Gigartinales | ||||
| Familia Cystocloniaceae | ||||
| Hypnea pannosa | X | X | ||
| Hypnea spicifera | X | X | ||
| Orden Gracilariales | ||||
| Familia Gracilariaceae | ||||
| Gracilaria sp. 1 | X | X | X | |
| Gracilaria sp. 2 | X | X | ||
| Gracilariopsis sp. | X | |||
| Orden Halymeniales | ||||
| Familia Halymeniaceae | ||||
| Halymenia spp. | X | |||
| Orden Nemaliales | ||||
| Familia Scinaiaceae | ||||
| Scinaia spp. | X | |||
| Scinaia complanata | X | |||
| Familia Peyssonneliaceae | ||||
| Peyssonnelia spp. | X | X | X | |
| Orden Rhodymeniales | ||||
| Familia Rhodymeniaceae | ||||
| Botryocladia beaudettei | X | |||
| Filo Ochrophyta | ||||
| Clase Phaeophyceae | ||||
| Orden Dictyotales | ||||
| Familia Dictyotaceae | ||||
| Dictyota stolonifera | X | X | X | |
| Dictyota humifusa | X | X | X | |
| Dictyota sp. nov. | X | X | ||
| Lobophora adpressa | X | |||
| Padina durvillei | X | X | X | |
| Padina caulescens | X | X | X | |
| Orden Ectocarpales | ||||
| Familia Scytosiphonaceae | ||||
| Chnoospora implexa | X | X | ||
| Colpomenia sinuosa | X | X | ||
| Rosenvingea intricata | X | |||
| Orden Fucales | ||||
| Familia Sargassaceae | ||||
| Sargassum liebmannii | X | X | X | |
| Filo Cnidaria | ||||
| Clase Anthozoa | ||||
| Orden Actiniaria | ||||
| Familia Hormathiidae | ||||
| Calliactis spp. | X | X | ||
| Orden Alcyonacea | ||||
| Familia Clavulariidae | ||||
| Carijoa riisei | X | |||
| Familia Gorgoniidae | ||||
| Leptogorgia alba | X | X | X | |
| Orden Antipatharia | ||||
| Familia Antipathidae | ||||
| Antipathes spp. | X | |||
| Orden Pennatulacea | ||||
| Pennatulacea sp. 1 | X | |||
| Pennatulacea sp. 2 | X | |||
| Familia Renillidae | ||||
| Renilla spp. | X | |||
| Familia Virgulariidae | ||||
| Virgularia spp. | X | |||
| Orden Scleractinia | ||||
| Familia Agariciidae | ||||
| Pavona clavus | X | |||
| Pavona gigantea | X | X | X | |
| Pavona varians | X | |||
| Pavona chiriquiensis | X | |||
| Familia Dendrophylliidae | ||||
| Tubastraea coccinea | X | X | ||
| Familia Pocilloporidae | ||||
| Pocillopora spp. | X | X | X | |
| Familia Poritidae | ||||
| Porites panamensis | X | X | X | |
| Porites lobata | X | X | X | |
| Familia Psammocoridae | ||||
| Psammocora stellata | X | |||
| Orden Spirularia | ||||
| Familia Cerianthidae | ||||
| Cerianthidae sp. 1 | X | X | ||
| Orden Zoantharia | ||||
| Familia Sphenopidae | ||||
| Palythoa spp. | X | X | ||
| Clase Hydrozoa | ||||
| Orden Anthoathecata | ||||
| Familia Pennariidae | ||||
| Pennaria spp. | X | |||
| Orden Leptothecata | ||||
| Familia Aglaopheniidae | ||||
| Macrorhynchia philippina | X | X | X | |
| Filo Phoronida | ||||
| Familia Phoronidae | ||||
| Phoronopsis albomaculata | X | |||
| Filo Annelida | ||||
| Clase Polychaeta | ||||
| Orden Amphinomida | ||||
| Familia Amphinomidae | ||||
| Amphinomidae spp. | X | |||
| Orden Echiuroidea | ||||
| Familia Echiuroidea | ||||
| Echiuroidea spp. | X | |||
| Orden Phyllodocida | ||||
| Familia Iphionidae | ||||
| Iphione ovata | X | |||
| Familia Nereididae | X | |||
| Infraclase Canalipalpata | ||||
| Familia Sabellariidae | X | X | ||
| Orden Sabellida | ||||
| Familia Sabellidae | ||||
| Sabellidae spp. | X | X | ||
| Familia Serpulidae | ||||
| Serpulidae spp. | X | X | ||
| Filo Mollusca | ||||
| Clase Bivalvia | ||||
| Orden Arcida | ||||
| Familia Arcidae | ||||
| Arcidae spp. | X | |||
| Orden Cardiida | ||||
| Familia Tellinidae | ||||
| Tellina spp. | X | |||
| Orden Limida | ||||
| Familia Limidae | ||||
| Limaria pacifica | X | |||
| Orden Mytilida | ||||
| Familia Mytilidae | ||||
| Lithophaga sp. | X | X | ||
| Orden Nuculanida | ||||
| Familia Nuculanidae | ||||
| Nuculanidae spp. | X | |||
| Orden Ostreida | ||||
| Familia Gryphaeidae | ||||
| Hyotissa hyotis | X | X | ||
| Familia Margaritidae | ||||
| Pinctada mazatlanica | X | X | ||
| Familia Pinnidae | ||||
| Atrina texta | X | |||
| Pinna rugosa | X | |||
| Orden Pectinida | ||||
| Familia Pectinidae | ||||
| Pectinidae spp. | X | |||
| Familia Spondylidae | ||||
| Spondylus sp. | X | |||
| Orden Venerida | ||||
| Familia Veneridae | ||||
| Veneridae spp. | X | |||
| Clase Cephalopoda | ||||
| Orden Octopoda | ||||
| Familia Octopodidae | ||||
| Octopus spp. | X | X | X | X |
| Clase Gastropoda | ||||
| Familia Plakobranchidae | ||||
| Plakobranchidae spp. | X | X | ||
| Orden Aplysiida | ||||
| Familia Aplysiidae | ||||
| Stylocheilus striatus | X | X | ||
| Orden Littorinimorpha | ||||
| Familia Bursidae | ||||
| Bursidae spp. | X | |||
| Familia Cypraeidae | ||||
| Eclogavena quadrimaculata | X | |||
| Familia Naticidae | ||||
| Sinum spp. | X | |||
| Familia Ovulidae | ||||
| Simnia avena | X | X | X | |
| Familia Strombidae | ||||
| Lobatus galeatus | X | |||
| Familia Tonnidae | ||||
| Malea ringens | X | X | ||
| Familia Vermetidae | ||||
| Vermetidae sp. | X | X | X | |
| Orden Neogastropoda | ||||
| Familia Columbellidae | X | |||
| Familia Fasciolariidae | ||||
| Opeatostoma pseudodon | X | X | X | |
| Triplofusus princeps | X | |||
| Familia Muricidae | ||||
| Hexaplex princeps | X | |||
| Murex spp. | X | X | ||
| Familia Olividae | ||||
| Oliva spp. | X | |||
| Olivella spp. | X | |||
| Familia Terebridae | ||||
| Terebridae sp. | X | |||
| Familia Turbinellidae | ||||
| Vasum spp. | X | X | ||
| Orden Nudibranchia | ||||
| Familia Chromodorididae | ||||
| Doriprismatica sedna | X | X | X | |
| Felimare agassizii | X | |||
| Familia Dorididae | ||||
| Conualevia alba | X | |||
| Familia Facelinidae | ||||
| Favorinus spp. | X | |||
| Familia Fionidae | ||||
| Fiona pinnata | X | |||
| Familia Flabellimidae | ||||
| Flabellina spp. | X | |||
| Orden Pleurobranchida | ||||
| Familia Pleurobranchidae | ||||
| Berthellina ilisima | X | |||
| Filo Arthropoda | ||||
| Clase Malacostraca | ||||
| Orden Decapoda | ||||
| Familia Alpheidae | ||||
| Alpheus lottini | X | |||
| Familia Calappidae | ||||
| Calappa spp. | X | |||
| Familia Dairidae | ||||
| Daira americana | X | |||
| Familia Diogenidae | ||||
| Aniculus elegans | X | |||
| Familia Inachoididae | ||||
| Stenorhynchus debilis | X | X | X | |
| Familia Leucosiidae | ||||
| Leucosilia jurinii | X | |||
| Familia Mithracidae | ||||
| Teleophrys cristulipes | X | X | X | |
| Familia Palaemonidae | ||||
| Gnathophyllum panamense | X | |||
| Palaemonella holmesi | X | |||
| Pontonia margarita | X | X | ||
| Zenopontonia soror | X | X | X | |
| Familia Palinuridae | ||||
| Panulirus gracilis | X | X | ||
| Familia Parthenopidae | ||||
| Parthenopidae sp. | X | |||
| Familia Penaeidae | ||||
| Metapenaeopsis kishinouyei | X | |||
| Familia Pinnotheridae | ||||
| Pinnotheridae spp. | X | |||
| Familia Porcellanidae | ||||
| Petrolisthes spp. | X | X | X | |
| Familia Portunidae | ||||
| Portunidae sp. 1 | X | |||
| Portunidae sp. 2 | X | |||
| Familia Trapeziidae | ||||
| Trapezia bidentata | X | X | X | |
| Familia Xanthidae | ||||
| Heteractaea lunata | X | |||
| Filo Echinodermata | ||||
| Clase Asteroidea | ||||
| Orden Paxillosida | ||||
| Familia Astropectinidae | ||||
| Astropecten spp. | X | |||
| Luidia spp. | X | |||
| Orden Valvatida | ||||
| Familia Asteropseidae | ||||
| Asteropsis carinifera | X | |||
| Familia Ophidiasteridae | ||||
| Pharia pyramidata | X | X | X | |
| Phataria unifascialis | X | X | X | |
| Familia Oreasteridae | ||||
| Nidorellia armata | X | |||
| Pentaceraster cumingi | X | |||
| Clase Echinoidea | ||||
| Orden Arbacioida | ||||
| Familia Arbaciidae | ||||
| Arbacia stellata | X | |||
| Orden Camarodonta | ||||
| Familia Toxopneustidae | ||||
| Toxopneustes roseus | X | X | ||
| Tripneustes depressus | X | X | X | |
| Orden Cidaroida | ||||
| Familia Cidaridae | ||||
| Eucidaris thouarsii | X | X | X | |
| Orden Diadematoida | ||||
| Familia Diadematidae | ||||
| Astropyga pulvinata | X | X | X | X |
| Diadema mexicanum | X | X | X | |
| Orden Spatangoida | ||||
| Familia Loveniidae | ||||
| Loveniidae spp. | X | |||
| Clase Holothuroidea | ||||
| Orden Apodida | ||||
| Familia Synaptidae | ||||
| Euapta godeffroyi | X | |||
| Orden Dendrochirotida | ||||
| Familia Cucumariidae | ||||
| Cucumaria flamma | X | X | X | |
| Familia Phyllophoridae | ||||
| Pentamera chierchiae | X | |||
| Orden Holothuriida | ||||
| Familia Holothuriidae | ||||
| Holothuria (Stauropora) fuscocinerea | X | |||
| Holothuria (Stauropora) pluricuriosa | X | |||
| Holothuria (Lessonothuria) pardalis | X | |||
| Holothuria (Mertensiothuria) hilla | X | |||
| Orden Synallactida | ||||
| Familia Stichopodidae | ||||
| Isostichopus fuscus | X | X | ||
| Stichopus horrens | X | |||
| Clase Ophiuroidea | ||||
| Orden Amphilepidida | ||||
| Familia Ophiactidae | ||||
| Ophiactis spp. | X | X | X | |
| Familia Ophiotrichidae | ||||
| Ophiothela spp. | X | X | X | |
| Ophiothrix spp. | X | X | ||
| Orden Ophiacanthida | ||||
| Familia Ophiocomidae | ||||
| Ophiocoma alexandri | X | |||
| Familia Ophiodermatidae | ||||
| Ophioderma spp. | X | |||
| Filo Chordata | ||||
| Clase Ascidiacea | ||||
| Orden Aplousobranchia | ||||
| Familia Diazonidae | ||||
| Rhopalaea birkelandi | X | X | ||
| Clase Elasmobranchii | ||||
| Orden Myliobatiformes | ||||
| Familia Dasyatidae | ||||
| Hypanus longus | X | |||
| Familia Myliobatidae | ||||
| Aetobatus laticeps | X | X | ||
| Rhinoptera steindachneri | X | |||
| Familia Urotrygonidae | ||||
| Urobatis halleri | X | X | ||
| Urotrygon chilensis | X | |||
| Urotrygon rogersi | X | |||
| Orden Orectolobiformes | ||||
| Familia Ginglymostomatidae | ||||
| Ginglymostoma unami | X | |||
| Orden Rajiformes | ||||
| Familia Rhinobatidae | ||||
| Pseudobatos prahli | X | |||
| Orden Torpediniformes | ||||
| Familia Narcinidae | ||||
| Diplobatis ommata | X | X | ||
| Clase Actinopterygii | ||||
| Orden Anguilliformes | ||||
| Familia Muraenidae | ||||
| Echidna nebulosa | X | |||
| Gymnomuraena zebra | X | X | ||
| Gymnothorax panamensis | X | |||
| Gymnothorax castaneus | X | X | ||
| Gymnothorax dovii | X | |||
| Muraena clepsydra | X | |||
| Muraena lentiginosa | X | |||
| Familia Ophichthidae | ||||
| Myrichthys tigrinus | X | X | ||
| Orden Aulopiformes | ||||
| Familia Synodontidae | ||||
| Synodus lacertinus | X | X | ||
| Orden Beryciformes | ||||
| Familia Holocentridae | ||||
| Myripristis berndti | X | |||
| Sargocentron suborbitale | X | X | X | |
| Orden Perciformes | ||||
| Familia Acanthuridae | ||||
| Acanthurus triostegus | X | |||
| Acanthurus xanthopterus | X | X | ||
| Prionurus laticlavius | X | X | ||
| Familia Apogonidae | ||||
| Apogon atricaudus | X | |||
| Apogon dovii | X | |||
| Familia Blenniidae | ||||
| Ophioblennius steindachneri | X | X | ||
| Plagiotremus azaleus | X | X | ||
| Familia Carangidae | ||||
| Alectis ciliaris | X | |||
| Caranx caballus | X | X | ||
| Caranx caninus | X | |||
| Caranx sexfasciatus | X | |||
| Elagatis bipinnulata | X | |||
| Gnathanodon speciosus | X | |||
| Selene spp. | X | |||
| Seriola rivoliana | X | X | ||
| Trachinotus rhodopus | X | X | ||
| Familia Chaenopsidae | ||||
| Acanthemblemaria exilispinus | X | |||
| Acanthemblemaria hancocki | X | |||
| Familia Chaetodontidae | ||||
| Chaetodon humeralis | X | X | X | |
| Johnrandallia nigrirostris | X | X | X | |
| Familia Cirrhitidae | ||||
| Cirrhitichthys oxycephalus | X | X | ||
| Cirrhitus rivulatus | X | X | X | |
| Familia Ephippidae | ||||
| Chaetodipterus zonatus | X | X | ||
| Familia Gobiidae | ||||
| Coryphopterus urospilus | X | |||
| Elacatinus puncticulatus | X | X | ||
| Tigrigobius digueti | X | X | ||
| Familia Haemulidae | ||||
| Anisotremus interruptus | X | |||
| Anisotremus taeniatus | X | |||
| Haemulon flaviguttatum | X | X | X | |
| Haemulon maculicauda | X | X | ||
| Haemulon sexfasciatum | X | X | ||
| Familia Kyphosidae | ||||
| Kyphosus elegans | X | |||
| Familia Labridae | ||||
| Bodianus diplotaenia | X | X | X | |
| Halichoeres chierchiae | X | X | X | |
| Halichoeres dispilus | X | X | X | |
| Halichoeres nicholsi | X | X | X | |
| Halichoeres notospilus | X | X | ||
| Novaculichthys taeniourus | X | X | ||
| Thalassoma lucasanum | X | X | X | |
| Familia Labrisomidae | ||||
| Malacoctenus zonifer | X | |||
| Familia Lutjanidae | ||||
| Lutjanus argentiventris | X | X | X | |
| Lutjanus guttatus | X | X | ||
| Lutjanus inermis | X | |||
| Familia Malacanthidae | ||||
| Malacanthus brevirostris | X | |||
| Familia Mullidae | ||||
| Mulloidichthys dentatus | X | X | ||
| Familia Pomacanthidae | ||||
| Holacanthus passer | X | X | ||
| Pomacanthus zonipectus | X | X | ||
| Familia Pomacentridae | ||||
| Abudefduf concolor | X | |||
| Abudefduf troschelii | X | X | X | |
| Chromis atrilobata | X | X | ||
| Microspathodon dorsalis | X | X | X | |
| Stegastes acapulcoensis | X | X | ||
| Stegastes flavilatus | X | X | X | |
| Familia Scaridae | ||||
| Nicholsina denticulata | X | |||
| Scarus ghobban | X | X | X | |
| Scarus rubroviolaceus | X | |||
| Familia Serranidae | ||||
| Alphestes immaculatus | X | X | ||
| Cephalopholis panamensis | X | X | ||
| Epinephelus labriformis | X | X | X | |
| Paranthias colonus | X | X | ||
| Rypticus bicolor | X | X | X | |
| Rypticus nigripinnis | X | |||
| Serranus psittacinus | X | |||
| Familia Sparidae | ||||
| Calamus brachysomus | X | |||
| Familia Tripterygiidae | ||||
| Lepidonectes clarkhubbsi | X | X | ||
| Orden Scorpaeniformes | ||||
| Familia Scorpaenidae | ||||
| Scorpaena mystes | X | X | ||
| Orden Syngnathiformes | ||||
| Familia Fistulariidae | ||||
| Fistularia commersonii | X | X | ||
| Familia Syngnathidae | ||||
| Doryrhamphus excisus | X | |||
| Orden Tetraodontiformes | ||||
| Familia Balistidae | ||||
| Balistes polylepis | X | X | ||
| Pseudobalistes naufragium | X | X | X | |
| Sufflamen verres | X | X | X | |
| Familia Diodontidae | ||||
| Chilomycterus reticulatus | X | |||
| Diodon holocanthus | X | X | X | |
| Familia Monacanthidae | ||||
| Aluterus scriptus | X | |||
| Familia Ostraciidae | ||||
| Ostracion meleagris | X | |||
| Familia Tetraodontidae | ||||
| Arothron meleagris | X | X | ||
| Arothron hispidus | X | X | ||
| Canthigaster punctatissima | X | X | X | |
| Sphoeroides lobatus | X | X | ||
| TOTALES | 175 | 130 | 64 | 72 |
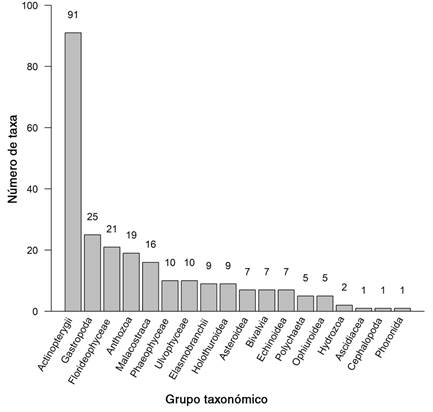
Fig. 2 Número de taxones observados por grupo taxonómico durante la expedición Santa Elena Waitt-MarViva (2018), Pacífico Norte de Costa Rica. / Fig. 2. Number of taxa observed by taxonomic group during the Waitt-MarViva Santa Elena expedition (2018), North Pacific of Costa Rica.
De los cuatro hábitats principales visitados durante la expedición (Fig. 1), los arrecifes rocosos tuvieron la mayor riqueza de especies con 175 en total (Tabla 1, Fig. 3), correspondientes a 78 especies de peces, 25 de algas (pardas, verdes y rojas), y 24 especies de moluscos, entre otras. Los arrecifes de coral fueron segundos en términos de riqueza con 130 especies en total, incluyendo 52 de peces óseos y batoideos, 24 de algas, y 14 especies de cnidarios (corales escleractinios y corales blandos). Los bosques de Sargazo tuvieron una riqueza de 64 especies, donde los peces dominaron con 28 especies, mientras que los otros grupos presentaron menos de 10 especies. Finalmente, los fondos arenosos tuvieron una riqueza de 72 especies, con una dominancia de peces óseos y batoideos con 21 especies, y al igual que el bosque de Sargazo, los demás grupos fueron representados por menos de 10 especies. A continuación, se presenta una descripción de cada ambiente estudiado.
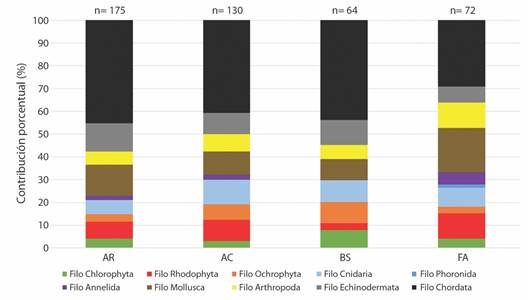
Fig. 3 Contribución porcentual de cada grupo taxonómico a nivel de filo al total de las especies encontradas en cada hábitat submareal estudiado durante la expedición Santa Elena Waitt-MarViva (2018), Pacífico Norte de Costa Rica. AR: Arrecife rocoso; AC: Arrecife de Coral; BS: Bosque de Sargassum; FA: Fondo arenoso. n = # total de especies por hábitat. / Fig. 3. Percent contribution of each taxonomic group at the phylum level to the total of the species found in each subtidal habitat studied during the Waitt-Marviva Santa Elena expedition (2018), North Pacific of Costa Rica. AR: Rocky reef; AC: Coral Reef; BS: Sargassum Forest; FA: Sandy bottom. n = Total # of species by habitat.
Arrecifes coralinos (Fig. 4): Se consideraron arrecifes de coral los ambientes cuyo fondo estaba compuesto por basamento coralino principalmente, y los corales crecen sobre el mismo. Los sitios donde se observó dicha característica fueron: Isla Golondrina Sur, Isla Negritos, Isla Pelada Sur, Isla San José Norte, Matapalito y Punta Blanca (Fig. 1). El ámbito de profundidad fue de 3.3-10.5 m. Muchos arrecifes están construidos principalmente por el coral Pavona gigantea. Otras especies de Pavona (P. clavus, P. varians, P. chiriquiensis) y Psammocora stellata, únicamente fueron observados en arrecifes y comunidades coralinas a lo largo de esta investigación.

Fig. 4 Arrecifes coralinos. A) Arrecife dominado por Pocillopora spp. en Matapalito; B). coral formador de arrecife Pavona clavus; C) basamento coralino cubierto por Pavona varians; D) el erizo de mar Diadema mexicanum entre colonias de Pavona gigantea. / Fig. 4. Coral reefs. A) Coral reef dominated by Pocillopora spp. in Matapalito; B) coral reef formed by the coral Pavona clavus; C) coral framework covered by Pavona varians; D) sea urchin Diadema mexicanum among colonies of Pavona gigantea.
El fondo estuvo dominado por tapetes algales en la mayoría de los sitios, con excepción de Isla San José Norte, donde los crustáceos de la infraclase Cirripedia fueron predominantes. Los tapetes de algas están dominados por especies filamentosas de los órdenes de algas rodófitas Ceramiales y Gelidiales. Dentro del grupo de las algas se informa por primera vez en esta zona el género Gayliella, también presente en los arrecifes rocosos. Otros organismos también formaron parte de la cobertura del fondo, como anémonas y corales blandos. Algunos invertebrados móviles solo fueron vistos en los arrecifes coralinos (Alpheus lottini, Aniculus elegans, Gnathophyllum panamense, el erizo Arbacia stellata y el bivalvo Pinna rugosa).
Los peces óseos fue el grupo predominante con 52 taxa observados. Al igual que otros grupos, algunas especies sólo fueron observadas en arrecifes coralinos: el muraénido Muraena lentiginosa, los chaenópsidos Acanthemblemaria exilispinus y A. hancocki, el serránido Serranus psittacinus, el diodóntido Chilomycterus reticulatus y el monacántido Aluterus scriptus.
Arrecifes rocosos (Fig. 5): Los hábitats más comúnmente observados fueron los arrecifes rocosos, principalmente alrededor de las puntas, islotes y en bajos conocidos de la zona como Bajo La Vita y Bajo Negro. Los arrecifes rocosos corresponden al ambiente con mayor riqueza de especies. En estos ambientes la cobertura estuvo dominada por los tapetes de algas, seguidos por las algas calcáreas costrosas del orden Corallinales y algas costrosas del orden Peyssonneliales. Otros componentes comunes, pero no dominantes fueron los corales, las macroalgas, las esponjas, los cirripedios y las ascidias. En algunos de estos arrecifes se pudieron observar algunas colonias aisladas de coral (principalmente de Pavona gigantea, Porites lobata y Pocillopora spp.), formaciones de Tubastrea coccinea, y también varias colonias de octocorales como Leptogorgia alba y Carijoa riisei, y en algunos casos formaciones relativamente extensas de coral negro (Anthipates spp.), como en Bajo Negro. Asimismo, es común observar talos de algas como Dictyota, Padina, Amphiroa, Asparagopsis (tetraesporófito), Hypnea y Gracilaria.

Fig. 5 Arrecifes rocosos. A) Colonias coralinas aisladas en medio de las rocas; B) tapetes de algas rojas y verdes cubriendo el sustrato rocoso; C) el pez Johnrandallia nigrirostris en un arrecife rocoso cubierto con cirripedios y algas rojas calcáreas; D) colonias del poliqueto Salmacina tribranchiata. / Fig. 5. Rocky reefs. A) Isolated coral colonies in the middle of the rocks; B) red and green algae mats covering the rocky substrate; C) the fish Johnrandallia nigrirostris on a rocky reef covered with barnacles and calcareous red algae; D) colonies of the polychaete Salmacina tribranchiata.
En los arrecifes rocosos también fue posible encontrar una gran diversidad de invertebrados móviles, particularmente erizos de mar (con predominancia de Diadema mexicanum). En cuanto a los ensambles de peces, estos fueron bastante diversos y heterogéneos, donde era posible apreciar la dominancia de cardúmenes de piscívoros, principalmente pargos (Lutjanus argentiventris y Lutjanus guttatus) y roncadores (Haemulon flaviguttatum, Haemulon maculicauda y Haemulon sexfasciatum).
En dos de los arrecifes rocosos, Puertas de La Iglesia y Bajo La Vita, observamos colonias de poliquetos tubícolas sobre los promontorios rocosos, con un contorno esférico de 20-40 cm de diámetro, conformadas por estructuras rígidas ramificadas. La especie formadora de estas colonias es Salmacina tribranchiata, de la familia Serpulidae. En el campo fue posible observar que las estructuras construidas por las colonias de S. tribranchiata proveían también superficies para el crecimiento de los tapetes de algas, y refugio para algunos invertebrados (como cangrejos ermitaños y gasterópodos), e incluso algunos peces pequeños, los cuales se escondían entre las ramificaciones de las colonias cuando los buzos se aproximaban.
Bosques de Sargassum (Fig. 6): Se encontraron dos sitios alrededor de Isla Colorada (Fig. 1) con alta cobertura de Sargassum.Cortés et al. (2014), mencionan que estos bosques están compuestos por la especie Sargassum liebmanni. Sin embargo, al revisar el material de este trabajo se encontraron dos morfologías que podrían referir a dos especies diferentes que están entremezcladas. Para este trabajo se manejó solo una especie ya que se requieren análisis moleculares y morfológicos en más detalle para esclarecer la taxonomía de este género en la región. En comparación con otros sitios de estudio, en los bosques de Sargassum, la presencia de pulpos y gasterópodos fue mayor. Asimismo, se encontraron otras especies de macroalgas asociadas y espacios de arena como elementos predominantes (Fig. 6).

Fig. 6 Bosques de Sargassum. A) Espacios de arena entre los bosques de Sargassum; B) Sargassum liebmannii mezclado con otras macroalgas como Padina y Dictyota; C) hábitat de S. liebmanii en zona rocosa; D) Tripneustes depressus ramoneando entre las macroalgas. / Fig. 6. Sargassum forests. A) sand spaces between Sargassum forests; B) Sargassum liebmannii mixed with other macroalgae such as Padina and Dictyota; C) habitat of S. liebmanii in rocky area; D) Tripneustes depressus browsing among macroalgae.
Planicies arenosas (Fig. 7): Diferentes sitios presentaron planicies arenosas, a saber, Matapalito profundo, Isla Las Golondrinas, Punta Santa Elena, Punta Pochote y Punta Blanca (Fig. 1). Los fondos arenosos muestreados se encontraron en un ámbito de profundidad entre los 5 y los 35 m de profundidad. Para este tipo de hábitat, se utilizaron diferentes metodologías, entre ellas el uso de dragas, las cuales aportan una idea de la macrofauna presente en cada sitio. Otros de los métodos utilizados, fueron censos visuales y recolectas errantes, lo que nos permite conocer puntualmente la riqueza de especies.

Fig. 7 Planicies arenosas. A) Raya redonda Urobatis halleri sobre sustrato arenoso; B) buzo recolectando la anémona tubícola de la familia Cerianthidae; C) pensamiento de mar, Renilla sp.; D) nuevo reporte de alga verde del género Siphonocladus sp. / Fig. 7. Sandy plains. A) Round ray Urobatis halleri on sandy substrate; B) diver collecting the tube anemone of the family Cerianthidae; C) the Sea pansy, Renilla sp.; D) new report of green algae of the genus Siphonocladus sp.
El filo Chordata fue el más representado para este ambiente, debido al tipo de muestreo. Las especies de cordados que más se observaron en los fondos arenosos fueron Urobatis halleri, Diplobatis ommata y Ripticus bicolor. Entre los invertebrados más comunes se observaron Pentaceraster cumingi, Zenopontonia soror (asociado a las diferentes especies de estrellas de mar) y Astropyga pulvinata (Fig. 7). Uno de los invertebrados sésiles más conspicuos que se reportan para este ambiente son las anémonas tubícolas de la familia Cerianthidae, que corresponde al primer registro para el país. Sin embargo, por dificultades en la capacidad de identificación no se reporta por ahora la especie (Fig. 7).
Por otro lado, el filo con menos representación en la investigación fue Phoronida, con una especie, Phoronopsis albomaculata. Estos invertebrados son un grupo pequeño, integrado solo por 11 especies y dos géneros (Santagata, 2015). Phoronopsis albomaculata, se reporta por primera vez para la costa costarricense. Anteriormente había sido informada únicamente en la Isla del Coco (Dean, Sibaja-Cordero, & Cortés, 2009).
Con respecto a las macroalgas, se encontró que hay especies muy particulares que no se encuentran en ninguno de los otros ambientes aquí estudiados. Este es el caso del nuevo reporte del alga verde Siphonocladus spp. para Costa Rica. Este género sólo había sido reportado en el Pacífico de América en dos islas de México (Isla Socorro parte de las Islas Revillagigedo y en la Isla Guadalupe) (Pedroche, Aguilar-Rosas, Dreckmann, & Aguilar-Rosas, 2005). Por lo que este representa una ampliación de rango del género en aguas tropicales.
Por otro lado, en estos ambientes arenosos de profundidad destacan las algas rojas de los géneros Hypoglossum, Halymenia, Ceramium, Scinaia spp. y Chondria platyclada y las algas pardas del género Dictyota. Todas estas algas se observan en este ambiente en alturas superiores (más de 7 cm) de lo que se encuentran en los arrecifes de coral y zonas rocosas.
Discusión
Cortés (2017) hace referencia al desconocimiento y a los vacíos de información sobre la biodiversidad marina para el ACG en comparación con otras localidades del Pacífico costarricense. No obstante, en los últimos años el Proyecto BioMar-ACG (Cortés, 2017) ha realizado nuevos aportes a la diversidad marina de esta zona (Cortés & Joyce, 2020; Vargas & Cortés, 2019). Todos los hábitats que se trataron en esta investigación ya habían sido citados en trabajos previos (Cortés & Joyce, 2020; Vargas & Cortés, 2019); sin embargo, pocos trabajos describen la historia natural y diversidad específica para los mismos.
Muchos arrecifes coralinos del ACG están construidos principalmente por el coral Pavona gigantea. Esta especie de coral masivo provee estructuras tridimensionales densas que sirven de hábitat para numerosas especies, lo que ha contribuido con el mantenimiento a largo plazo de las comunidades arrecifales (Tortolero-Langarica, Carricart-Ganivet, Cupul-Magaña, & Rodríguez-Troncoso, 2017). Algunas especies de peces únicamente fueron observadas en arrecifes coralinos, esto evidencia la importancia que tienen estos ambientes como reservorio de ciertas especies (Riginos & Leis, 2019). Los arrecifes coralinos son hábitats muy complejos y cambiantes; en las últimas décadas se ha resaltado la importancia de conservar las funciones críticas de estos ecosistemas, como la formación de hábitat y otras formas de mantenimiento de la biodiversidad (Bellwood, Streit, Brandl, & Tebbett, 2019).
En estudios realizados por Alvarado et al. (2011), Alvarado et al. (2015), Alvarado et al. (2016), Alvarado et al. (2018), Alvarado et al. (2020) en arrecifes del Pacífico, se ha observado que, por lo general, las algas tienden a tener un tamaño menor a 10 cm de alto y suelen formar tapetes. Sin embargo, en la zona norte de Costa Rica es común encontrar macroalgas de más de 10 cm de altura. En particular, se han encontrado bosques submarinos estacionales conformados por el alga parda del género Sargassum; estos bosques fueron descritos por primera vez en la Isla Bolaños, Bahía Salinas, al norte de nuestra zona de estudio (Cortés et al., 2014). En toda la zona de estudio es común encontrar algas de este género que se mezclan con otras algas como Dictyota y Padina. Sin embargo, se encontraron dos sitios alrededor de Isla Colorada, donde la cobertura de este género es alta (Alvarado et al., en prensa).
Los bosques de Sargassum presentan estacionalidad a lo largo del año, de manera que son abundantes en la época de afloramiento de aguas frías ricas en nutrientes (Cortés et al., 2014; Stuhldreier et al., 2015). Ecológicamente estos bosques destacan debido a que son zonas de criaderos de juveniles de peces, zonas de alimentación y refugio de herbívoros (Cheminée et al., 2017; Suárez et al., 2021). Debido a su estacionalidad, importancia ecológica, y al hecho de que el reporte de S. liebmanni por Cortés et al. (2014) para los bosques de estas algas en el Pacífico norte se podría tratar de diferentes especies, este ecosistema necesita ser estudiado con más detalle.
Dos de los nuevos reportes que se presentan en este estudio provienen de planicies arenosas, demostrando que se trata de un ambiente aún poco estudiado. Las planicies arenosas son ambientes muy cambiantes en cuanto a la biodiversidad, según las particularidades que presente cada sitio. Algunos de los factores más influyentes en marcar las diferencias en cuanto a composición son: características de corriente, de granulometría y de entrada de luz. A nivel de observación, el grosor y la composición del sustrato varió entre los sitios incluidos en esta investigación, sin embargo, estos datos no formaron parte de nuestro estudio.
Este estudio presenta información sobre las planicies arenosas a partir del uso de diferentes metodologías, una de ellas el uso de dragas para conocer la macrofauna. En sustratos blandos, la macrofauna se ha estudiado desde diferentes enfoques, entre ellos midiendo su aporte en la red trófica, así como bioindicadores de salud del ecosistema (Dauvin et al., 2017). Los fondos arenosos son importantes sitios de alimentación de batoideos y otros peces, tienen una gran influencia en el ciclo de nutrientes y de materia orgánica, y además funcionan como sitios de descanso de especies grandes (Dauvin et al., 2017; Link, 2001; Reiss & Kroncke, 2005). La fauna bentónica asociada a sustratos blandos funciona como bioindicador, a medida que se relaciona con las características del entorno, como por ejemplo poliquetos de las familias Capitellidae y Spionidae (Dean, 2008). Estos organismos presentan poca movilidad y en algunos casos ciclos de vida largos, teniendo una estrecha relación con el sedimento, lo que los convierte en organismos modelo para la evaluación de perturbaciones y cambios ambientales (Clarke & Warwick, 1994; Frithsen & Holland, 1990). Otro de los métodos utilizados en las planicies arenosas fueron censos visuales y recolectas errantes, permitiendo conocer puntualmente la riqueza de especies. Sin embargo, sería enriquecedor para futuros estudios investigar anualmente los cambios en la diversidad debido al afloramiento costero (Jiménez, Cortés, León, & Ruiz, 2001), ya que las características abióticas que presentan las planicies arenosas tienen un efecto directo en la biodiversidad específica asociada a estos ambientes (Gray, 1981).
Conclusiones: El ACG es un sitio que presenta una gran biodiversidad marina. Durante esta expedición, se encontraron cuatro nuevos reportes para el país, entre ellos el reporte de la subclase Ceriantharia, dos nuevos géneros de algas (el alga roja Gaylliela spp. y alga verde Siphonocladus spp.) y la especie Scinaia complanata. Es esperable que con un mayor esfuerzo de muestreo, que abarque un periodo más extenso, se pueda registrar mayor riqueza de especies para esta zona.
La Península de Santa Elena y las Islas Murciélago presentan ecosistemas muy particulares, como las comunidades coralinas donde predomina el género Pavona, arrecifes rocosos cubiertos principalmente con algas calcáreas, colonias de poliquetos, bosques de Sargassum y planicies arenosas con características abióticas muy cambiantes. Estos ecosistemas se encuentran expuestos al afloramiento costero, de manera que los cambios en las corrientes, la temperatura o el ingreso de agua dulce, pueden ocasionar cambios en la composición de especies.
El valor de este estudio, al igual que otros estudios de biodiversidad, se centra en el registro histórico de los organismos. Estos registros pueden ser aprovechados para definir vínculos empíricos entre rasgos funcionales y las funciones ecosistémicas que permitan mejorar las estrategias de conservación (Bellwood et al., 2019). El registro de la biodiversidad y sus cambios a través del tiempo son fundamentales para justificar y diseñar estrategias de conservación que impulsen el desarrollo de forma sostenible.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


