Introducción
La elaboración de plástico a nivel global es de 300 millones de toneladas al año, donde aproximadamente el 50 % es eliminado al medio ambiente (Manchala & Ramana, 2020). La acumulación de estos residuos, cerca de los ríos, facilita el transporte del plástico a otros cuerpos de agua, lo que permite que se depositen en los océanos (Horton et al., 2017). La contaminación por plásticos es una problemática que afecta el estado de los hábitats marinos y su composición biológica (Avio et al., 2017). El fraccionamiento natural y artificial de los plásticos ha dado como resultado partículas sólidas llamadas microplásticos (MPs, < 5mm) (GESAMP, 2015), como producto de procesos físicos causados por la radiación ultravioleta (UV), abrasión e interacción con las corrientes oceánicas (MPs secundarios) (Frias & Nash, 2019). Además, los MPs se originan por la fabricación de productos de cuidado personal (usados como exfoliantes), y la aplicación en procesos de granallado y relleno de algunos productos textiles (MPs primarios) (GESAMP, 2015). La presencia de MPs, se ha reportado en playas (De-la-Torre et al., 2020), sedimentos (Courtene-Jones et al., 2020), aguas superficiales (Li et al., 2020) y organismos marinos (Walkinshaw et al., 2020); es a partir de aquí que los estudios han evidenciado que los MPs generan efectos perjudiciales sobre procesos fisiológicos como alimentación, reproducción y crecimiento (Botterell et al., 2019).
Los moluscos bivalvos adquieren alimento y energía de su entorno a través de la filtroalimentación, con la captura de partículas de reducido tamaño (microseston), lo cual los hace buenos indicadores del efecto de los MPs sobre ecosistemas acuáticos (Rosa et al., 2018). Es así, como diversos trabajos, han demostrado las consecuencias negativas de los MPs en moluscos, donde se ha reportado malformaciones en el crecimiento para Mytilus edulis (Rist et al., 2019), alteraciones en la demanda de alimento y eficiencia de absorción de Crassostrea gigas (Sussarellu et al. 2016), e incremento en la tasa de respiración en Ostrea edulis (Green, 2016).
El cambio climático se ha convertido en uno de los tópicos más relevantes de los últimos años, debido a la influencia que ejerce en el incremento de la temperatura de los océanos según la Organización Meteorológica Mundial (World Meteorological Organization, 2019). Esto ha generado la alteración de la sensibilidad en la tolerancia térmica de los organismos marinos, especialmente de especies con nichos ecológicos conservados a nivel local (Bennett et al., 2019), como es el caso de los invertebrados (González et al., 2014). Se pueden apreciar los efectos del incremento de la temperatura, por ejemplo, en Musculista senhousia y Limnoperna fortunei, con perturbaciones de sus tasas de filtración (TF) (Inoue & Yamamuro, 2000; Sylvester et al., 2005); mientras que, en Mytilus edulis, se ha reportado el incremento de la mortalidad post-desove por temperaturas elevadas (Clements et al., 2018).
El efecto combinado de temperatura y MPs ha sido estudiado en invertebrados acuáticos, como: Daphnia magna, donde se vio afectada negativamente su supervivencia y capacidad de filtración (Serra et al., 2020), y Gammarus pulex que presentó alteraciones de la tasa de respiración (Kratina et al., 2019). Dentro de este escenario, los organismos sésiles como los bivalvos podrían ser afectados por el efecto conjunto del incremento de temperatura y la contaminación por MPs, ocasionando alteraciones metabólicas como las reportadas en Mytilus trossulus y Crassostrea gigas (Lenz, 2016).
Dentro de la lista de bivalvos del Perú se encuentran Semimytilus algosus (Paredes et al., 2016) formando parte de los ecosistemas costeros rocosos (Paredes et al., 1999). Este organismo se encuentra posicionado y agrupado en el intermareal, respecto a sus adaptaciones fisiológicas (Brante et al., 2019), formando frondas calcáreas que son el refugio de otras especies (Paredes et al., 1999). Además, es parte de la trasferencia energética, los cuales constituyen parte de la dieta de especies de interés comercial como Mugil cephalus, Sciaena deliciosa y Paralonchurus peruanus (Fernández, 2014; Gutiérrez-Díaz, 2017; Pérez-Carrasco, 2017). La recolecta local de este organismo se debe a su musculatura, y es utilizada como carnada para la pesca artesanal (Molinet et al., 2007). Por lo tanto, la función ecológica y comercial están sustentadas por densidades predominantes que logran formarse en espacios representativos en el litoral marino, los cuales están expuestos a cualquier tipo de contaminación costero como la de los MPs y exposiciones térmicas extremas (Alfaro-Mudarra et al., 2016; Tejada-Pérez et al., 2018). En este contexto, el presente estudio tuvo como objetivo evaluar el efecto de diferentes temperaturas y concentraciones de MPs sobre la TF de Semimytilus algosus.
Materiales y métodos
Obtención y aclimatación de organismos: Los ejemplares de S. algosus (72 individuos, 40.5 ± 1.15 mm) fueron recolectados de la orilla rocosa (submareal) de la playa San Bartolo (balneario) el 15 de julio del 2019 en la estación de invierno (Lima, Perú) (12°23’22.48’’ S & 76°46’57.44’’ W). Los organismos fueron transportados en envases plásticos de 20 l conteniendo agua de mar al Laboratorio de Larvicultura Experimental de la Universidad Científica del Sur, donde se acondicionaron por 7 días (Filgueira et al., 2009) con aireación constante y condiciones de agua de mar de 18 ± 1 °C y 35 ppm de salinidad (Pinochet et al., 2018). Los organismos fueron alimentados con la microalga Isochrysis galbana (1x106 cel/ml/día), siguiendo el protocolo de Pinochet et al. (2018) durante la aclimatación y experimentación. Previo al experimento, los individuos de S. algosus se aclimataron a las cuatro temperaturas (17, 20, 23 y 26 °C), considerando las estimaciones térmicas del Grupo Intergubernamental de Expertos sobre el Cambio Climático (IPCC, 2014; IPCC, 2018) e Instituto del Mar del Perú (2017). Se tomó un día para el acondicionamiento a 17 °C, mientras que para las otras temperaturas se aumentó 1 °C por día, durante 8 días (Filgueira et al., 2009).
Preparación de los microplásticos (MPs): Los MPs se obtuvieron frotando una lija metálica (# 150) sobre botellas nuevas de tereftalato de polietileno (PET) (esto se indicaba en la base de la botella) (Erni-Cassola et al., 2017). El trabajo se desarrolló en un ambiente separado, dentro de una caja cubierta con un envoltorio plástico que solo permitía el ingreso de las manos para lijar las botellas. En la base, se ubicó una placa Petri de 150 mm, con papel aluminio y sobre este un tamiz metálico de 125 µm para obtener partículas menores a esta medida (Munno et al., 2017). Únicamente se trabajó con la placa Petri cerrada, la cual fue llevada con el material tamizado a una balanza analítica, donde se separó con un pincel y se pesó cada concentración de MPs en placas Petri de 100 mm con papel aluminio respectivamente. Este procedimiento se repitió hasta conseguir las cantidades necesarias para el recambio de partículas. Previamente a cada recambio se separaron envases con agua para cada temperatura para evitar el estrés térmico en los organismos. Además, con el fin de evitar la contaminación de las partículas a otras unidades experimentales, durante el proceso de obtención de las partículas y exposición de estas mismas, las unidades experimentales sin MPs se mantuvieron cerradas, únicamente se hizo un agujero para el ingreso del conducto de aireación. Por otro lado, para asegurar la exposición y suspensión de los MPs se mantuvo la manguera de aireación hasta el fondo de los vasos de vidrio (500 ml de capacidad); con ello, las partículas se mantuvieron en constante resuspensión en la columna de agua. Esto de definió a partir de la densidad del MPs PET de 1.38 mg/l, la cual es mayor a la densidad del agua de mar (1.025 mg/l)
Diseño experimental: Los ejemplares fueron colocados en unidades experimentales de vidrio de 0.5 l, y se expusieron por 21 días a dos concentraciones de MPs en combinación con la microalga I. galbana (1x106 cel/ml/día). Los tratamientos fueron: Un control, MPs0 = I. galbana sin MPs, concentración 1, MPs1 = I. galbana y 0.125 mg/l de MPs, y concentración 2, MPs2 = I. galbana y 0.250 mg/l de MPs, para cada una de las cuatro temperaturas experimentales (17, 20, 23 y 26 °C) (Fig. 1). Las concentraciones de MPs fueron tomadas a partir de la densidad de partículas plásticas descrita para las islas de basura en el Océano Pacífico (Goldstein et al., 2013; Elías, 2015). Además, se realizó la renovación de agua y partículas de MPs tres veces por semana, con la finalidad de mantener limpia el agua de mar y concentraciones de MPs (Bråte et al., 2018).
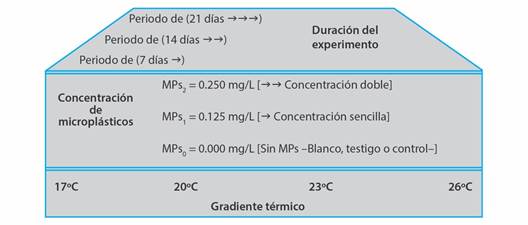
Fig. 1 Diseño experimental. Se indica a la temperatura en grados centígrados °C, tres concentraciones de microplásticos (MPs) y los días de toma de muestras como periodos de evaluación. / Fig. 1. Experimental design. The temperature in degrees centigrade °C, three concentrations of microplastics (MPs) and the days of sampling are indicated as evaluation periods.
Tasa de Filtración (TF): Para determinar variaciones de la capacidad de filtración de S. algosus por efecto del incremento de temperatura y MPs, se evaluó la TF cada 7 días durante 1 hora (Bøhle, 1972). Primero, los mitílidos se trasladaron a unidades experimentales de 0.5 l con aireación constante, según las temperaturas por tratamiento, y se mantuvieron sin alimento por 24 horas previo a la evaluación de TF. Luego, se estimó la TF utilizando la microalga I. galbana (1x106 cel/ml). Para evaluar la TF se aplicó la fórmula de Jørgensen (1996):
TF = V * (LogCi - LogCf) / (0.434 * T)
Donde: TF es la Tasa de Filtración (mL/ind/h), Ci es la concentración de microalga inicial, Cf es la concentración de microalga final, 0.434 es el valor de logaritmo de e y T es el tiempo en horas (h).
Mortalidad (%): Luego de 21 días de exposición a las diferentes temperaturas y concentraciones de MPs, se determinó la mortalidad dividiendo el número de organismos muertos al final del experimento entre el número inicial de organismos (Freitas et al., 2019).
Análisis estadístico: Los análisis estadísticos se realizaron utilizando el programa estadístico IBM SPSS versión 25.0 para Windows. En el análisis de prerrequisitos, se comprobó la normalidad (test de Shapiro Wilk) y homocedasticidad (test de Levene) para los datos de la TF (mL/ind/h). A partir de satisfacer estas condiciones, se empleó la prueba de ANOVA III (de tres vías) para demostrar diferencias significativas (α ≤ 0.05) del efecto separado y conjunto de ambos factores (temperatura y MPs) y el tiempo, además de la prueba de Tukey para las comparaciones múltiples por tratamiento para la TF (ml/ind/h) en el tiempo (días).
Resultados
A los 21 días de experimentación, se determinó que la presencia de MPs ocasionó variaciones en la TF de S. algosus (F = 244.36, g.l. = 2, P < 0.05). Esto se evidenció para individuos del tratamiento MPs1 (Media = 10.76 ± 3.86 ml/ind/h) y MPs2 (Media = 7.67 ± 3.19 ml/ind/h), donde ambas TF fueron inferiores al testigo sin MPs (Media = 14.81 ± 4.57 ml/ind/h) (P < 0.05). Durante el día 7 de evaluación, la menor TF fue para MPs2 (Media = 10.75 ± 2.29 ml/ind/h) frente al testigo, MPs0 (Media = 18.31 ± 2.98 ml/ind/h) (P < 0.05). Esta reducción de la TF para MPs2 continuó para el día 14 (Media = 5.62 ± 2.18 ml/ind/h) y día 21 (Media = 6.38 ± 2.18 ml/ind/h) (Fig. 2).
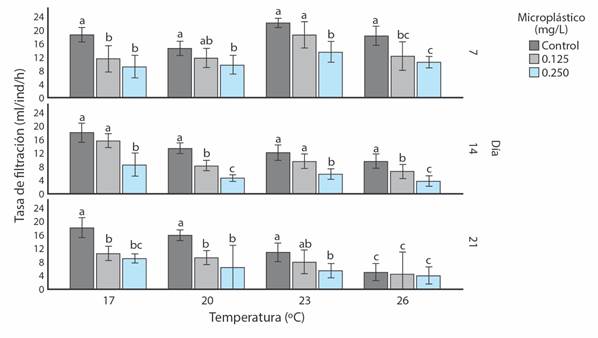
Fig. 2 Valores promedio de la Tasa de Filtración (± desviación estándar, N = 6) para S. algosus, bajo el efecto de cuatro temperaturas (17 °C, 20 °C, 23 °C y 26 °C), evaluado contra el Testigo (MPs0 = 0.00 mg/l) y dos concentraciones de MPs (MPs1= 0.125 mg/l y MPs2 = 0.250 mg/l) y después de 7, 14 y 21 días de experimentación. Letras distintas indican diferencias significativas (P < 0.05). / Fig. 2. Average values of the Filtration Rate (± standard deviation, N = 6) for S. algosus, under the effect of four temperatures (17 ° C, 20 ° C, 23 ° C and 26 ° C), evaluated against the Control (MP’s0 = 0.00 mg/l) and two concentrations of MPs (MPs1 = 0.125 mg/l and MPs2 = 0.250 mg/l) and after 7, 14 and 21 days of experimentation. Different letters indicate significant differences (P < 0.05).
El incremento de temperatura redujo la TF de los bivalvos (ANOVA, P < 0.05), asimismo, se observaron diferencias significativas para todas las temperaturas (F = 61.69, g.l. = 3, P < 0.05). La TF de los organismos presentó variaciones a lo largo del estudio, donde los primeros 7 días de evaluación la TF fue menor a 20 °C (Media = 12 ± 2.48 ml/ind/h) que a 23 °C (Media = 18.00 ± 4.00 ml/ind/h). Durante las evaluaciones de los días 14 y 21, se observó una reducción continua de la TF de 20 a 23 °C, donde los menores valores fueron para los individuos sometidos a 26 °C (Fig. 2)
El efecto combinado de temperatura y MPs afectó la TF de S. algosus (F = 37.45, g.l. = 6, P < 0.05). Se evidenció que a mayor temperatura (de 20 a 26 °C) y aumento de la concentración de MPs se reduce la TF (Fig. 2). Al finalizar el experimento, no se observó mortalidad para ningún tratamiento a 17 °C, mientras que la menor mortalidad en los individuos mantenidos sin MPs a 23 °C, y la mayor cantidad de muertos sucedió en los tratamientos sin y con MPs a 26 °C, y MPs2 a 20 °C. (Tabla 1).
Tabla 1 Mortalidad (%) de S. algosus a cuatro temperaturas (17, 20, 23 y 26 °C), en el Blanco o Testigo (MPs0 = 0.00 mg/L) y dos concentraciones de MPs (MPs1 = 0.125 mg/l y MPs2 = 0.250 mg/l) expuesto por un periodo de 21 días (N = 6), t = tiempo. / Table 1. Mortality (%) of S. algosus at four temperatures (17, 20, 23 and 26 ° C), on white or witness (MPS0 = 0.00 mg/l) and two MPS concentrations (MPS1 = 0.125 mg/l and MPS2 = 0.250 mg/l) Exposed for a period of 21 days (N = 6), t = time.
| Microplásticos (MPs) | Temperatura (°C) | Mortalidad, t = 21 días (%) |
| MPs0 | 17 | 0 |
| 20 | 0 | |
| 23 | 17 | |
| 26 | 50 | |
| MPs1 | 17 | 0 |
| 20 | 33 | |
| 23 | 33 | |
| 26 | 67 | |
| MPs2 | 17 | 0 |
| 20 | 67 | |
| 23 | 0 | |
| 26 | 50 |
Discusión
El presente estudio demostró que la presencia de MPs de PET (< 125 μm), a diferentes concentraciones (0.125 y 0.250 mg/l), redujo la TF de S. algosus. Esto también se evidenció en otros bivalvos, donde el incremento en la concentración de MPs (fibras de PET de 500 µm, de 3 a 30 MP’s/l) ocasionó la disminución de la TF en Dreissena bugensis (Pedersen et al., 2020); y la exposición de fibras de PET (500 µm, 30 MPs/ml) en M. edulis, afectó negativamente la TF (Woods et al., 2018). Estas alteraciones de la TF a causa de MPs, podrían explicarse por procesos de deciliación e hipertrofia en branquias y glándula digestiva, respectivamente, causadas por el aumento en la concentración de MPs (Alnajar et al., 2020). Además, se puede considerar cierta retención de partículas de MPs durante la filtración e ingesta de alimento para S. algosus, dado que se ha reportado esta situación en bivalvos como Ennucula tenuis y Abra nitida, las cuales retuvieron partículas de MPs de tamaños similares a las utilizadas en nuestro estudio (< 125 μm), posterior a 4 semanas de exposición (Bour et al., 2018). Asimismo, se debe tener presente que los MPs se mantienen un mayor tiempo dentro del organismo al mezclarse con el alimento, como microalgas (Chae & An, 2020).
En cuanto al efecto de la temperatura, durante la primera evaluación (7 días), la TF se incrementó a 23 °C, pero a 20 y 26 °C hubo una reducción de la TF. Esto se puede relacionar con un proceso de aclimatación que desarrollaron los organismos frente a la variación de temperatura (Widdows, 1978). Para los días 14 y 21, los individuos tuvieron una reducción de la TF a 23 y 26 °C, lo cual pudo generar la reducción de la frecuencia de la apertura valvar, conducta natural de sobrevivencia de los mitílidos frente a condiciones adversas como el incremento de la temperatura (Weber et al., 2020).
Kratina et al. (2019), consideran que la interacción de MPs y temperatura se presenta de manera antagonista; sin embargo, nuestro estudio demostró que ambos factores (0.125 mg/l y 0.250 mg/l) (17, 20, 23 y 26 °C), dentro de los rangos límites para S. algosus, ocasionaron la reducción de la TF. Es así como, durante los días 14 y 21, se observó una reducción de la TF por efecto de ambos factores; es posible que el incremento de la TF, provocada por el aumento de temperatura, haya inducido la ingesta de MPs en los primeros días de evaluación, lo cual magnificó el efecto negativo sobre la TF en los días posteriores.
Por otro lado, no se evidenció mortalidad para S. algosus en ausencia y presencia de MPs a 17 °C, así como para los individuos mantenidos como Blancos o Testigos a MPs0 para 20 °C. Sin embargo, para estos organismos Blanco o Testigos MPs a 23 y 26 °C, se presentó una mortalidad del 17 y 50 %, respectivamente. Esto se podría relacionar con el rango de tolerancia térmica, donde Lenz et al. (2018) reportaron mortalidades del 70 % a 28 °C para S. algosus. Además, las alteraciones originadas por el aumento de temperatura y la presencia de MPs, pueden ocasionar una menor ingesta de alimento, lo que lleva a los organismos a un estado de inanición (Rist et al., 2016), que se relaciona con las altas mortalidades reportadas para MPs1 a 26 °C y MPs2 para 20 °C.
Finalmente, el estudio demuestra que el incremento de la temperatura y la exposición a MPs, ocasiona una reducción de la TF, y genera mortalidad para S. algosus, que puede variar según el tiempo de exposición o evaluación. Esta situación puede ocasionar modificaciones en los ecosistemas marino-costeros, debido a que los bivalvos controlan el crecimiento de las poblaciones planctónicas y las concentraciones de micropartículas, a través del mecanismo de filtración (Marroni, 2019), y pueden transmitir los MPs a otros niveles de la cadena trófica, por la interrelación con sus depredadores (Farrell & Nelson 2013; Li et al., 2019).
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


