Introducción
Los hemípteros semiacuáticos (infraorden Gerromorpha), son insectos que habitan en la superficie del agua (Spence & Andersen, 1994; Ilie & Olosutean, 2009), donde se mueven en busca de alimento, y parejas reproductivas aprovechando la tensión superficial de ese medio (Andersen, 1982; Moreira, 2015). Usualmente se refugian en la vegetación ribereña y pueden formar grupos de 40 individuos o más (Padilla-Gil, 2020). Por lo general, los factores que más afectan la presencia de hemípteros en los cuerpos de agua son la dimensión de los ríos, la velocidad de la corriente, los ecosistemas circundantes, la vegetación acuática y ribereña, y la composición química del medio acuático (Hufnagel, Bakonyi, & Vásárhelyi, 1999; Karaouzas & Gritzalis, 2006; Giehl, Fonseca, Dias-Silva, Brasil, & Cabette, 2015; Giehl et al., 2020).
En este sentido, la contaminación de las aguas también afecta la presencia y abundancia de los hemípteros acuáticos y semiacuáticos, dependiendo de la sensibilidad de la especie (Dias-Silva, Cabette, & Juen, 2010; Cunha, Assis-Montag, & Juen, 2015). Por ejemplo, Eyre y Foster (1989), encontraron que los hemípteros no funcionan correctamente como indicadores de la calidad del agua, e Ilie y Olosutean (2009), afirman que la mayoría de especies de hemípteros no son sensibles al impacto humano moderado. Por el contrario, Savage (1990) y Savage (1994) propone que algunos hemípteros son sensibles a la contaminación del agua, sirviendo como indicadores de la calidad de este ambiente. De manera que hay controversia sobre si la contaminación afecta o no a los hemípteros acuáticos y semiacuáticos.
Esta discrepancia podría ser debido al tipo de contaminación estudiada en cada investigación. Por ejemplo, según Aristizábal-García (2002), los gerromorfos, podrían ser de los mejores indicadores de contaminación del agua por aceites, grasas y sustancias tensoactivas como detergentes y jabones, que rompen la tensión superficial. En el caso específico de los jabones y detergentes, se ha observado que la adición de estas sustancias provoca que el organismo comience a dar zancadas en el agua, hasta hundirse en la interfaz (Hu & Bush, 2010). Sin embargo, se requiere de estudios experimentales que especifiquen el efecto de la contaminación acuática por jabones, sobre los gerromorfos (Aristizábal-García, 2017).
Conocer cómo los cambios en la tensión superficial del agua por adición de jabones o detergentes afectan a los gerromorfos, permitiría mejorar los índices de calidad de agua adicionando información sobre los contaminantes específicos que pueden estar afectando esta calidad. Además, puede generar información para el entendimiento de la dinámica ecológica de los ríos y quebradas dando información del biomonitoreo, y también para la conservación de los ecosistemas acuáticos. Por tanto, nuestro objetivo es determinar el efecto que tienen las aguas jabonosas sobre la capacidad de locomoción de tres especies de hemípteros semiacuáticos. Nuestra hipótesis es que la capacidad de locomoción de los hemípteros se verá afectada por las aguas jabonosas. Esperamos que, a mayor concentración de jabón en las aguas, la tensión superficial disminuirá, por lo que será más difícil el desplazamiento y habrá menor estabilidad en la superficie del agua, provocando cambios en la locomoción de los hemípteros, lo que a su vez genera cambios en el comportamiento (en términos de permanencia en el agua), y posibles hundimientos.
Materiales y métodos
Sitios de recolección de individuos y sitios de estudio: El estudio fue realizado durante los meses de agosto a noviembre del 2020. Para esto, se seleccionaron individuos de la parte alta de la quebrada Patal (Q.P.) que constituye una cuenca de primer orden, y que pertenece a la cuenca del río Grande de Tárcoles, en la Vertiente Pacífica de Costa Rica (Alvarado-García, 2020). La quebrada se localiza específicamente en Goicochea, San José (9°57’10.1781” N & 83°58’37.343” W). El sitio de muestreo se encuentra a una elevación de 1 623 m.s.n.m. y de acuerdo a la clasificación de Holdridge (1967), se localiza dentro de la zona de vida del bosque muy húmedo montano bajo, que se caracteriza por precipitaciones que oscilan entre los 2 000 a 3 000 mm anuales, y temperatura promedio de 20 ºC (Alvarado-García, 2020).
El segundo sitio donde se recolectaron individuos, fue en la parte media de la microcuenca del río Abanico (R.A.), que constituye una cuenca de segundo orden (Municipalidad de San Carlos, 2004), dentro de la cuenca del río San Carlos, en la Vertiente Atlántica de Costa Rica (Barrientos, 2005; Rojas, 2011). El R.A. se ubica en Venecia de San Carlos, Alajuela (10°20’30.257” N & 84°17’6.656” W). El sitio exacto de muestreo se encuentra a una elevación de 560 m.s.n.m., y según la clasificación de Holdridge (1967) se encuentra dentro de la zona de vida del bosque muy húmedo tropical en transición a premontano (Rojas, 2011), con precipitaciones que oscilan entre los 5 000 a 6 000 mm anuales, y presenta una temperatura promedio de 22-24 ºC (Rojas, 2011). Según el uso de suelo, ambos ecosistemas se localizaban en parches de bosque secundario, cuyas cercanías se consideran como zonas de cultivos y pastos (Gómez-Vega, 1996; Alvarado-García, 2020), en las que hay muy poca urbanización, y en su mayoría las fincas son utilizadas para actividades ganaderas como producción de leche a pequeña escala.
Los experimentos fueron realizados ex situ, en sitios que se encontraban a menos de 3.5 km de distancia respecto al río o quebrada, donde se recolectó a los individuos. De manera que, al seleccionar estos sitios, variables como la altitud, temperatura y precipitación, eran muy similares a donde se localizan los cuerpos de agua, por lo que no hubo necesidad de controlar dichas variables.
Especies de estudio: Las especies estudiadas fueron Rhagovelia solida, Platygerris caeruleus y Potamobates unidentatus. Se escogieron estas especies, porque eran las más abundantes en los lugares seleccionados, lo cual facilitaba su recolección. Para la identificación de las mismas, se utilizó la clave taxonómica para el género Rhagovelia en Costa Rica (Moreira, Pacheco-Chaves, Springer, & Cordeiro, 2015) y la clave taxonómica de gérridos de Costa Rica (Pacheco-Chaves, 2010). Individuos ápteros de R. solida (familia Veliidae), fueron seleccionados en Q.P., constituyendo así el segundo registro de esta especie para la provincia de San José, y el primero para el cantón de Goicochea (Moreira et al., 2015). Actualmente sólo existe registro de esta especie en Costa Rica, en altitudes que van de 900 a 2 000 m.s.n.m. (Padilla-Gil & Moreira, 2013), y su género forma parte del grupo dominante en los ecosistemas tropicales lóticos (Polhemus, 1997; Padilla-Gil, 2016).
En R.A. las especies seleccionadas fueron P. caeruleus y P. unidentatus (familia Gerridae). La primera se registra en Costa Rica, en altitudes que van de 100 a los 2 100 m.s.n.m., mientras que P. unidentatus está registrada para Costa Rica, Panamá y Colombia, en altitudes que van de 100 a los 1 500 m.s.n.m. (Aristizábal-García, 2017). Ambas especies suelen escoger los rápidos de los ríos como hábitat (Pacheco-Chaves, 2010).
Recolección, traslado y aclimatación de individuos: Para la recolección de los hemípteros se utilizaron tamices de plástico de 22 cm de diámetro y se elaboraron redes entomológicas de 20 cm de diámetro, cuyo poro de red era de 1 mm de diámetro. Una vez recolectados los hemípteros en el río, se trasladaron en recipientes cilíndricos de plástico de 12 cm de altura y 15 cm de diámetro, o bien en cajas grandes de plástico de 30 x 30 x 30 cm (dependiendo de la cercanía al río). Para trasladarlos, fue necesario llenar los recipientes con un volumen de agua del río, que resultara en menos de 3 cm de altura, para evitar que, por el movimiento del recipiente durante el traslado, el agua cubriera a los insectos y los mojara, ya que de suceder esto se pueden hundir en el agua y quedar muy afectados o morir.
Una vez en el sitio del experimento, se llenó con agua (un volumen de 5 cm de altura) recipientes cilíndricos de plástico como los descritos anteriormente o cajas de plástico (60 x 45 x 50 cm). Posteriormente en cada recipiente se colocó un total de 10 individuos y se les dio como mínimo, un día completo de aclimatación. Durante este proceso se observó si su comportamiento y desplazamiento eran normales, es decir, similar al observado en los ríos. De manera que, se definió el comportamiento y desplazamiento normal, como el estado en el que los hemípteros presentaban un patinaje fluido (Apéndice 1) y se mantenían en la superficie del agua sin hundimiento parcial (patas y abdomen) o total (todo el cuerpo). De no ser así, se dejarían aclimatándose hasta 4 días más como máximo, en los que se verificaría que el individuo pudiera mantenerse y desplazarse bien sobre el agua. Si esto no ocurría, no serían tomados en cuenta para el experimento. Además, los hemípteros fueron alimentados con pequeños insectos ( 2 cm de largo) que flotaban en la superficie del agua, especialmente moscas y zancudos, que son uno de los grupos que más depredan en los ríos (Padilla-Gil, 2019). La alimentación se realizó diariamente, para evitar que incurrieran en canibalismo (Moreira, 2015), ya que se tuvo a los individuos durante tres semanas en condiciones ex situ para realizar los experimentos.
Recolección y análisis de muestras de agua: Para evaluar las condiciones fisicoquímicas momentáneas de la parte de los ríos en donde se recolectó a los hemípteros, se tomaron cinco muestras de agua en la sección escogida de cada río, con una distancia de 10 metros entre cada muestra. Para los análisis de nutrientes se filtraron las cinco muestras de agua, mediante el uso de una jeringa de 60 ml, que hacía pasar el agua recolectada a través de un equipo de soporte de filtración de acero inoxidable, marca Millipore. Dicho equipo de filtración, contenía un filtro de micro fibra de vidrio de 47 mm de diámetro, con poros de 1 micra de tamaño, marca Advantec, modelo GA100. Después de cada filtración, se retiraba el filtro para envolverlo con papel aluminio, y se guardaba para análisis de materiales en suspensión. Para los análisis de variables fisicoquímicas no hubo necesidad de filtrar el agua, sino que se recolectó directamente con las botellas. Todas las muestras de agua (tanto filtradas, como no filtradas) se depositaron en botellas de plástico oscuras. Posteriormente, se trasladaron las muestras en una hielera con hielo, al Laboratorio de Oceanografía Química del Centro de Investigación en Ciencias del Mar y Limnología (CIMAR), de la Universidad de Costa Rica, para análisis de nutrientes y variables fisicoquímicas como pH, alcalinidad total, demanda bioquímica de oxígeno (DBO) y materiales en suspensión.
Modelo de acuario con flujo por gravedad: Se elaboró un acuario que consistió en tres cajas plásticas denominadas A, B y C (Fig. 1). La caja B de 57 x 40.2 x 30.4 cm. Mientras que las cajas A y C, eran de 48.6 x 34.7 x 28 cm. Es importante que la caja B, fuera más grande que las otras dos, para que el agua no se desbordara, ya que en dicha caja se colocaría a los hemípteros. La caja A se ubicó a 165.8 cm de altura respecto al suelo, la B a 66.5 cm, y la C a nivel del suelo. Una manguera de 1 cm de diámetro se insertó en la caja A, a 1.3 cm arriba respecto a la base de dicha caja, y se conectaba con la B en un orificio que se encontraba a 9.5 cm arriba respecto a la base de dicha caja. Mientras que la caja B tenía en su otro extremo una manguera en un orificio que estaba a 9.5 cm respecto a la base de la caja, que la conectaba con la C, donde se unía a un orificio que se ubicaba 8.2 cm arriba respecto a la base de esta caja. La distancia entre A y B fue de 72.3 cm, y entre B y C de 69.9 cm. El flujo de la manguera de la caja A hacia la B era de 8.64 l/min, mientras que de la B a la C era de 6.86 l/min.
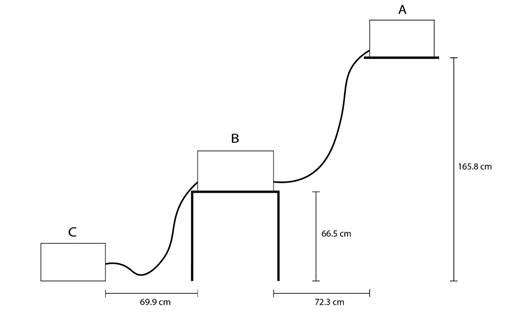
Fig. 1 Diseño de acuario con flujo de agua por gravedad utilizado en el experimento, con sus respectivas medidas. A. Caja que contenía las aguas jabonosas. B. Caja con agua limpia que contenía a los hemípteros. C. Caja que recibía la descarga de agua generada por el flujo. Fig. 1. Aquarium design with gravity flow of water used in the experiment, with their respective measurements. A. Box containing the soapy water. B. Box with clean water containing the hemipterans. C. Box that received the water discharge generated by the flow.
Como la caja B contenía a los hemípteros, se le colocó una roca, que sobresaliera de la superficie del agua, para asegurar que los hemípteros salieran en caso de necesitarlo. En la caja A se colocó 22 l de agua jabonosa, mientras que la B se llenó con agua limpia hasta unos 15 cm de altura, que correspondían a 22 l de agua, y la C iniciaba vacía. De esta forma el agua de A drenaba hacia B, y el agua de B drenaba hacia C, debido a las diferencias de altura entre las cajas. Con esto se simuló a pequeña escala la entrada de aguas contaminadas que experimentaría un río debido a las pendientes del mismo. Las entradas y salidas de las mangueras se taparon con espuma viscoelástica de poliuretano, para que el agua sólo fluyera en el momento en que se retiraban las mismas. Además, se colocó una cámara a 74 cm de distancia respecto a la base de la caja B, para posteriormente analizar los videos.
Diseño experimental: Se utilizaron tres tipos de jabón: en polvo para ropa, con dodecilbenceno sulfonato de sodio (LAS) como tensoactivo, en porcentaje de 10-20 %, jabón líquido para manos, con lauril sulfato de sodio (SLS) como tensoactivo, en un porcentaje de 9 %, y jabón lavaplatos, con alquil sulfonato de sodio (LAS) como tensoactivo, en un porcentaje 20 %. De cada tipo de jabón se prepararon tres concentraciones: la primera de 9 ppm, que al mezclarse con el agua limpia de la caja B, resultó en una concentración final que iba desde 3 a 8 ppm aproximadamente; la segunda de 50 ppm, que al mezclarse con el agua limpia resultó en una concentración de 18 a 44 ppm aproximadamente; y la tercera fue de 200 ppm, que al mezclarse resultó en una concentración de 72 a 179 ppm aproximadamente. Para calcular estas concentraciones se tomó en cuenta los litros de agua limpia que salían después de un minuto y los litros de agua contaminada que entraban al pasar un minuto, esto para cada uno de los tres minutos donde hubo entrada de agua contaminada. Así se logró obtener un aproximado de la concentración en el tiempo según la cantidad de agua limpia que se mezclaba con agua contaminada.
Una vez aclimatados, los hemípteros fueron sometidos a la entrada de aguas jabonosas durante 10 minutos (3 minutos con entrada de las aguas, y 7 minutos con el agua ya mezclada y en reposo). A nivel de familia, se dividieron 90 individuos en nueve grupos de diez individuos, por lo que los nueve grupos de la familia Gerridae, tenían individuos de las dos especies, mientras que los nueve grupos de Veliidae tenían a todos sus individuos de la única especie utilizada de esta familia. Cada uno de los grupos fue sometido a las tres distintas concentraciones de un solo tipo de jabón. Por lo que tres grupos experimentaron, individualmente, las tres concentraciones de un mismo jabón, teniendo tres réplicas para cada tipo de jabón para cada familia.
Cuando pasaron los 10 minutos, se limpió el acuario, y se llenó con agua no contaminada, y entre el paso de una concentración a otra, se dio como mínimo 30 minutos de reposo, esto con el fin de que los insectos no estuvieran afectados o estresados por la concentración anterior. En caso de que un grupo, después de los 30 minutos, tuviera individuos muy afectados, se daba el tiempo necesario hasta verlos recuperados, es decir, con su comportamiento y desplazamiento normal. Por último, siempre se aplicó las concentraciones desde la más baja, hasta la más alta, debido a que en la última concentración algunos individuos quedaban muy afectados o incluso morían. Durante cada uno de los experimentos se intervino únicamente cuando veíamos a un individuo totalmente hundido, ya que era evidente que no lograba salir, y se buscó salvaguardar la vida de los insectos en la medida de lo posible.
Es importante mencionar, que no se tuvo un grupo control que se sometiera a la entrada de agua limpia. Esto en parte, porque todos los grupos de hemípteros, ya se encontraban la mayoría del tiempo sometidos al agua limpia, en los recipientes donde fueron depositados o en el acuario antes de comenzar los experimentos. De manera que, en el mismo proceso de aclimatación y mantenimiento de los hemípteros, se registraron observaciones (durante 3 semanas), del comportamiento y desplazamiento de los insectos en condiciones de no exposición a jabón.
Análisis de datos: Se consideró un experimento de parcelas divididas (Montgomery, 2005), donde la parcela era cada grupo de diez hemípteros, la subparcela era la aplicación de la concentración, el factor de parcela correspondía al tipo de jabón, y el factor de la subparcela correspondía a los valores de concentración aplicados. El grupo de individuos funcionó como parcela ya que este estuvo expuesto a todos los niveles del factor de subparcela (concentración), pero solo estaba asociado a un nivel del factor de parcela (tipo de jabón).
Una vez realizados todos los experimentos, se analizaron los videos, contemplando todo el periodo de duración (10 minutos), incluyendo el inicio con corriente. Además, se hizo un seguimiento de cada individuo, de manera que, se determinó el tiempo que cada uno de los 10 hemípteros permaneció en el agua en condiciones normales, para registrar un promedio por cada grupo. Por otro lado, se registró como hundimiento, cuando un individuo se mostraba completamente (todo el cuerpo) o parcialmente (patas y abdomen) sumergido en el agua.
Se registraron tres variables respuesta: 1) el tiempo promedio (en minutos) que el grupo de 10 individuos permanecía en el agua con desplazamiento y comportamiento normal, 2) si cada individuo tenía la capacidad de salir del agua hacia la piedra o no, y 3) si cada individuo se hundía en el agua o no. Para el tiempo promedio se usó un modelo mixto donde los factores fijos eran el factor de parcela (tipo de jabón) y el factor de subparcela (concentración), así como su interacción, declarando el grupo de individuos como factor aleatorio. En este caso se asumió mediante la prueba de Shapiro-Wilk, que la respuesta en cada tratamiento seguía una distribución normal. Se realizó un análisis de varianza para parcelas divididas con una prueba F que consideraba los grados de libertad del error de parcela cuando se probó el efecto de parcela, y los grados de libertad del error de subparcela cuando se probó el efecto de interacción o el efecto del factor de subparcela. Las otras variables (capacidad de salir y hundimiento) eran binarias y para ellas se usó un modelo mixto con respuesta binomial y la misma estructura del modelo anterior, lo que lo convirtió en un modelo logístico mixto. En este modelo se registró el número de éxitos (sale o se hunde) y el número de fracasos (no sale o no se hunde) para cada grupo de 10 individuos. Para probar cualquiera de los efectos, se procedió a comparar dos modelos, uno que tenía el factor de interés y otro que no lo tenía; ambos modelos se compararon usando la prueba de razón de verosimilitud (LRT, siglas en inglés), mediante una distribución chi-cuadrado (c2) con los grados de libertad asociados al factor que se probó. Realizamos todos los análisis estadísticos con el lenguaje R (R Core Team, 2020) mediante RStudio (RStudio Team, 2020). Usamos las siguientes librerías de R: ggplot2 (Wickham, 2016) para los gráficos, así como nlme (Pinheiro, Bates, DebRoy, Sarkar, & R Core Team, 2017) y lme4 (Bates, Maechler, Bolker, & Walker, 2015) para el ajuste de los modelos normal y logístico, respectivamente.
Resultados
En general, encontramos que, conforme aumenta la concentración de jabón, disminuye la cantidad de tiempo que los hemípteros permanecen sobre el agua. La concentración de jabón tuvo un efecto en la capacidad de salir del agua, ya que en concentraciones más bajas de jabón un porcentaje mayor de individuos salieron del agua sin problemas. La concentración de jabón también tuvo un efecto en la probabilidad de hundirse, ya que en concentraciones bajas hay un menor porcentaje de hundimientos. Encontramos que, existe una diferencia en el tiempo que permanecen los hemípteros en el agua, según la concentración de jabón, en donde los grupos de individuos permanecen menor tiempo en el agua, a medida que la concentración aumenta (F2.32 = 46.05, P < 0.001). Además, no encontramos interacción entre el tipo de jabón y la especie, por lo que el efecto del tipo de jabón fue el mismo para las especies, de manera que el daño que experimentan no depende del tipo de jabón (F2.14 = 0.054, P = 0.95), sino de la concentración en sí. Por otro lado, encontramos que sí hay interacción entre la concentración de jabón y la especie, ya que el efecto de la concentración es diferente entre las especies (Fig. 2), donde R. solida presenta en promedio tiempos diferentes de permanencia en el agua respecto a P. unidentatus y P. caeruleus. Específicamente fue R. solida, la especie menos afectada por las aguas contaminadas, en comparación con P. caeruleus y P. unidentatus (F2.32 = 11.21, P < 0.001), que mostraron menor tiempo de permanencia en dichas condiciones.
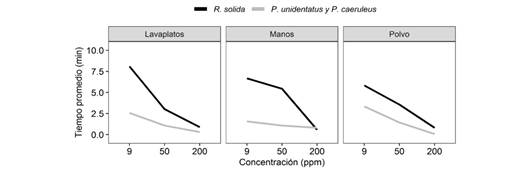
Fig. 2 Tiempo promedio de duración en el agua según la concentración y el tipo de jabón para tres especies de hemípteros semiacuáticos. Fig. 2. Average time in water according to concentration and type of soap for three species of semiaquatic hemipterans.
En cuanto a la capacidad de salir del agua de manera óptima (es decir, sin ayuda del investigador), no encontramos interacción entre el tipo de jabón y las especies, por lo que el efecto del tipo de jabón a la hora de salir del agua, es el mismo para las tres especies. Además, los hemípteros no mostraron diferencias según el tipo de jabón (x2= 0.15, g.l. = 2, P > 0.05). Por otro lado, tampoco encontramos interacción entre la concentración y las especies, por lo que el efecto de la concentración a la hora de salir del agua, es el mismo para las tres especies. Sin embargo, sí observamos diferencias según la concentración (x2= 12.76, g.l. = 2, P < 0.05), de modo que, a mayor concentración, menor porcentaje de individuos podían salir del agua (Fig. 3). Además, observamos diferencias en la capacidad de salir de manera óptima del agua según la especie (x2= 3.86, g.l. = 1, P < 0.05), siendo R. solida la especie que presentó mayor porcentaje de individuos que podían salir de forma óptima, mientras que los individuos de P. caeruleus y P. unidentatus tenían mayores problemas para salir del agua contaminada, a cualquiera de las tres concentraciones.
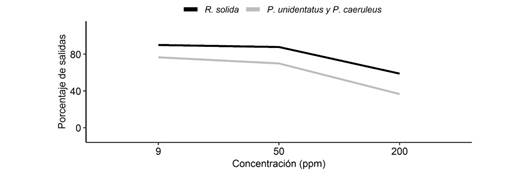
Fig. 3 Porcentaje de individuos en promedio que lograban salir de manera óptima del agua según la concentración de jabón. Fig. 3. Percentage of individuals on average that managed to optimally exit the water according to soap concentration.
Por último, encontramos que las especies en general, presentan una mayor cantidad de hundimientos conforme aumenta la concentración de jabón (x2= 59.34, g.l. = 2, P < 0.05). Además, no encontramos interacción entre la concentración de jabón y las especies, por lo que el efecto de la concentración a la hora de salir del agua, es el mismo para las tres especies. Sin embargo, la cantidad de hundimientos según la especie varía en la concentración más baja, en donde R. solida presenta menor cantidad de hundimientos que las otras especies (Fig. 4), mientras que en las concentraciones restantes las tres especies no presentan una diferencia en la cantidad de hundimientos (x2= 0.03, g.l. = 1, P > 0.05). Por otro lado, no encontramos interacción entre el tipo de jabón y las especies, por lo que el efecto del tipo de jabón sobre los hundimientos, es el mismo para las tres especies. Además, encontramos que no existen diferencias en la cantidad de hundimientos según el tipo de jabón (x2= 0.70, g.l. = 2, P > 0.05).
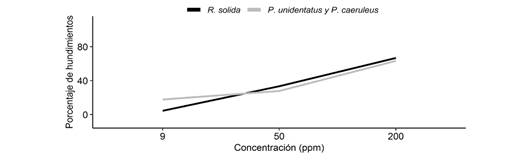
Fig. 4 Porcentaje de individuos en promedio que se hundían en el agua según la concentración de jabón. Fig. 4. Percentage of individuals on average sinking in the water according to soap concentration.
En cuanto a las muestras de agua de cada río, se encontró que en general, los valores para los nutrientes analizados, así como pH, alcalinidad, DBO y materiales en suspensión están dentro del ámbito de valores de aguas superficiales limpias o que permiten conservar a las comunidades acuáticas (Tabla 1), esto según el Reglamento para la Evaluación y Clasificación de la Calidad de Cuerpos de Agua Superficiales para Costa Rica (MINAE, 2007).
Discusión
A pesar de que los gerromorfos presentan en sus patas una densa capa de pelos hidrofóbicos, y un material ceroso recubriendo el integumento que le confiere características repelentes al agua (Bush, Hu, & Prakash, 2007; Goodwyn, Voigt, & Fujisaki, 2008), sus patas se sumergen cuando se rompe la tensión superficial del agua al adicionarle jabón (Aristizábal-García, 2002; Hu & Bush, 2010). De esta forma, la pata sumergida absorbe agua, lo que provoca un integumento humedecido, que resulta en la pérdida de repelencia al agua, y genera el hundimiento del individuo (Hu & Bush, 2010). Esto explica el notorio cambio en su comportamiento, permaneciendo en el agua por menos tiempo, cuando la concentración de jabón era mayor (Fig. 2), ya que suponía mayor dificultad para desplazarse y mantenerse en la superficie del agua, así como una mayor probabilidad de hundirse (Fig. 4). Sin embargo, el resultado fue el mismo sin importar el tipo de jabón, lo cual se puede explicar porque, en general, los jabones utilizan los mismos compuestos tensoactivos o muy similares, y en porcentajes parecidos (Jiawkok & Nakajima, 2012). No obstante, es necesario considerar que, exponer a tres tipos de concentración a los mismos 10 individuos, podría tener un efecto en la respuesta del comportamiento. Sin embargo, consideramos que dicho efecto, sería mínimo, porque entre el paso de una concentración a otra, se dio el tiempo necesario hasta ver a los organismos con su comportamiento normal. Además, aunque los diseños de bloques pueden tener la desventaja de que se expone al mismo grupo de individuos a todos los niveles de concentración, en general son más eficientes estadísticamente para las comparaciones.
Aunque para las tres especies el efecto al aumentar la concentración de jabón es evidente, las especies P. caeruleus y P. unidentatus, mostraron menor tiempo de permanencia en el agua contaminada, que la especie R. solida. Nosotros proponemos que esta diferencia pronunciada entre especies, se debe a las variaciones morfológicas de cada taxón. La estructura tipo abanico ubicada en la pata media de R. solida, ha evolucionado exclusivamente en este género, y se ha visto que confiere ventajas evolutivas en cuanto a la estabilidad, y ahorro energético para mantenerse en la superficie del agua, en ambientes lóticos (Santos, Le Bouquin, Crumière, & Khila, 2017). Esta estructura podría conferir una mayor resistencia a pequeños cambios en la tensión superficial, mientras que P. caeruleus y P. unidentatus, al carecer de dicha estructura, se verían en desventaja. Además, en Gerridae, existen estructuras sensoriales como setas ventrales, que se pueden traducir en una mayor sensibilidad a los cambios físicos y químicos en la superficie del agua, las cuales no están presentes en otros gerromorfos (Goodwyn et al., 2008; Goodwyn, Katsumata-Wada, & Okada, 2009). Por lo que estas estructuras posiblemente tienen un papel importante en explicar la mayor sensibilidad de P. caeruleus y P. unidentatus a las aguas contaminadas.
Por otro lado, a pesar de que no se tuvo un grupo control, sí se pudo observar el comportamiento y desplazamiento de los hemípteros en agua no contaminada con jabones. Como era de esperar, en condiciones de agua limpia, los individuos de las tres especies presentaban un comportamiento y desplazamiento idéntico o muy similar al observado en la quebrada y el río, permaneciendo la mayoría del tiempo en el agua, con patinaje fluido, y saliendo solo ocasionalmente durante breves periodos. De manera que, aunque no se cuantificó mediante un grupo control, basados en nuestras observaciones proponemos que, en el caso de R. solida, es muy probable que haya una leve disminución en el tiempo de permanencia en el agua, desde la concentración más baja, respecto a cuando están en agua totalmente limpia. Mientras que, para P. caeruleus y P. unidentatus la disminución en el tiempo de permanencia en el agua, sería mucho más drástica desde la concentración baja, respecto a un posible grupo control (Fig. 1). Lo cual tendría sentido tomando en cuenta las diferencias morfológicas descritas anteriormente. Sin embargo, estudios posteriores podrán tomar esto en cuenta, para cuantificarlo y hacer una comparación, para confirmar lo que nosotros proponemos respecto a comparaciones con un grupo control.
En cuanto a la capacidad de salir del agua, P. caeruleus y P. unidentatus, se vieron más afectadas con el aumento en la concentración de jabón, en comparación con R. solida. Una posible explicación, es que varios gérridos tienen la capacidad de realizar saltos prácticamente verticales en el agua (Armisén et al., 2015; Koh et al., 2015; Yang, Son, Jablonski, & Kim, 2016), lo cual no es un comportamiento observado en el género Rhagovelia. Al realizar este tipo de saltos, se ejerce una presión casi vertical sobre la superficie de agua, generando un hoyuelo asimétrico en la misma, que es fundamental para su salto (Gao & Feng, 2011; Yang et al., 2016). Aunque se podría pensar que P. caeruleus y P. unidentatus, lograrían salir de mejor forma, ya que sus saltos los alejan con más rapidez del agua, es posible que este tipo de movimiento, al contrario, los afecte más a la hora de salir del agua. El salto podría ejercer una mayor presión sobre el agua, incrementando así la penetración de la pata en el agua con tensión superficial reducida, lo que explicaría su menor capacidad para salir en comparación con R. solida.
El hecho de que R. solida presente menor cantidad de hundimientos en la concentración más baja, concuerda con una mayor resistencia a cambios en la tensión superficial comparado con P. caeruleus y P. unidentatus. Sin embargo, en las concentraciones más altas de jabón todas las especies presentan una cantidad de hundimientos similares. Esto probablemente se debe porque los individuos de R. solida permanecían mayor tiempo en el agua, pudiendo llegar hasta el punto donde comenzaban a hundirse, mientras que los individuos de P. caeruleus y P. unidentatus permanecían menos tiempo en el agua, y a partir de la primera concentración, sus individuos se mostraron más cuidadosos con el tiempo que duraban en el agua, a diferencia de R. solida.
De acuerdo a los análisis de las muestras de agua, los niveles de nitratos y nitritos, así como los valores de pH y materiales en suspensión, estuvieron dentro de la categoría clase 1 según el Reglamento para la evaluación y clasificación de la calidad de cuerpos de agua superficiales para Costa Rica (MINAE, 2007) (Tabla 1), por lo que los sitios donde se extrajeron los individuos en ambos ríos, se podrían considerar como sitios limpios de contaminación. Sumado a esto, los bajos niveles de amonio y fosfatos, los valores positivos de las alcalinidades totales, y los bajos valores de DBO, indican un ambiente sin contaminación (Addy, Green, & Herron, 2004; Skrobialowski, Mize, & Demcheck, 2004; Mackenzie, 2005; Beita-Sandí, 2008). De manera que, las tres especies se encuentran en hábitats que, al menos en el momento del estudio, se encontraban bastante limpios, lo cual era de esperar por dos razones: 1) alrededor de los sitios de recolecta se encuentran pocos asentamientos urbanos, lo que mantiene estos ríos y quebradas (o al menos los sectores analizados) relativamente libres de la contaminación antropogénica, ya que la actividad que más podría contaminar estos ecosistemas es la ganadería, pero se realiza a pequeña escala, y 2) la sensibilidad observada en los gerromorfos hacia la contaminación por jabones y detergentes.
TABLA 1 Valores de nutrientes y variables fisicoquímicas de los sitios de muestreo en la Quebrada Patal y Río Abanico. Table 1. Nutrient values and physicochemical variables of the sampling sites in Quebrada Patal and Río Abanico
| Punto de muestreo | Fosfatos (mg/l) | Inc ± | Amonio (mg/l) | Inc ± | Nitritos (mg/l) | Inc ± | Nitratos (mg/l) | Inc ± | pH | Inc ± | DBO (mg/l) | A. T. (mg/l) | Inc ± | M. S. (mg/l) |
| Quebrada Patal | ||||||||||||||
| M 1 | 0.054 | 0.013 | nq* | 0.0090 | 0.075 | 0.022 | 0.335 | 0.022 | 7.52 | 0.01 | 0.00 | 84.91 | 1.36 | 8.33 |
| M 2 | 0.054 | 0.013 | 0.0395 | 0.0086 | nq | 0.023 | 0.342 | 0.022 | 7.56 | 0.01 | 0.00 | 88.30 | 0.68 | 6.67 |
| M 3 | 0.063 | 0.013 | 0.0592 | 0.0085 | nd* | 0.024 | 0.405 | 0.022 | 7.60 | 0.01 | 0.00 | 85.59 | 0.01 | 6.67 |
| M 4 | 0.046 | 0.013 | 0.0180 | 0.0090 | nd | 0.023 | 0.510 | 0.022 | 7.60 | 0.01 | ― | 86.95 | 0.68 | 8.33 |
| M 5 | 0.046 | 0.013 | 0.0395 | 0.0086 | nd | 0.023 | 0.445 | 0.022 | ― | ― | ― | ― | ― | 4.33 |
| Río Abanico | ||||||||||||||
| M 1 | 0.035 | 0.013 | 0.0334 | 0.0086 | nq | 0.023 | 0.054 | 0.024 | ― | ― | 0.00 | ― | ― | 0.00 |
| M 2 | 0.051 | 0.013 | 0.0247 | 0.0088 | nq | 0.023 | 0.044 | 0.024 | 7.60 | 0.01 | 0.00 | 51.62 | 0.68 | 0.00 |
| M 3 | 0.046 | 0.013 | 0.0316 | 0.0088 | nq | 0.023 | 0.053 | 0.024 | ― | ― | 0.00 | ― | ― | 0.00 |
| M 4 | 0.047 | 0.013 | nd | 0.0094 | nd | 0.024 | 0.099 | 0.024 | 7.66 | 0.01 | ― | 55.70 | 0.68 | 0.00 |
| M 5 | 0.036 | 0.013 | nq | 0.0092 | 0.035 | 0.023 | 0.081 | 0.024 | ― | ― | ― | ― | ― | 0.00 |
DBO = Demanda Bioquímica de Oxígeno, A.T. = Alcalinidad Total, M.S. = Materiales en Suspensión, Inc = Incertidumbre, nq = no cuantificable, nd = no detectable. DBO = Biochemical Oxygen Demand, A.T.= Total Alkalinity, M.S.= Materials in Suspension, Inc = Uncertainty, nq = not quantifiable, nd = not detectable.
Las respuestas evaluadas en nuestra investigación, tienen importantes alcances, ya que nos permiten empezar a visualizar el latente riesgo al que podrían estar sometidas estas comunidades de insectos, por la contaminación de los ecosistemas acuáticos con jabones y detergentes. Es importante tomar en cuenta que, para 1998 se producían a nivel mundial 2.4 millones de toneladas de tensoactivos (Karsa, 1998), mientras que para el 2006, la producción de tensoactivos aumentó a 12.5 millones de toneladas (Edser, 2006). Esta situación probablemente ha aumentado aún más, durante los últimos dos años en particular, a causa de la pandemia por COVID-19, ya que se ha evidenciado un incremento masivo en el uso de jabones y detergentes durante dicho periodo (Kumar et al., 2021). Además, la contaminación con jabones, al afectar su comportamiento, podría generar que ciertas especies de gerromorfos se vean afectadas (al permanecer menos tiempo en el agua), ya sea a nivel de reproducción o alimentación, lo que podría incluso disminuir las poblaciones. De manera que, es importante tomar medidas que eviten la descarga de aguas residuales domésticas directamente en las aguas naturales, e implementar plantas de tratamiento para dichas aguas, que sean cada vez más eficientes (Eichhorn, Rodrigues, Baumann, & Knepper, 2002).
Nosotros concluimos que, según las especies de hemípteros semiacuáticos, el grado de afectación de su comportamiento (en términos de permanencia en el agua), por adición de detergentes en el medio acuático, variará debido a las características morfológicas y de locomoción propias de cada taxón. Por lo que el uso de estas especies como bioindicadores de la tensión superficial puede ser muy útil, y funcionar como un gradiente del nivel de contaminación de las superficies de los ríos y quebradas, ya que como demostramos, las especies tienen diferente grado de sensibilidad. Como recomendación proponemos que el sistema de acuarios que utilizamos en el experimento, podría funcionar aún mejor si la salida y entrada del agua en la caja B están a desnivel, así como si se pudiera controlar el flujo del agua de manera simple con una llave adaptada. Este es el primer estudio que evalúa cómo afecta la contaminación de la tensión superficial el comportamiento de los hemípteros semiacuáticos dependiendo de la especie. Por tanto, invitamos a más investigadores a seguir por esta ruta de estudios, para generar un conocimiento más amplio sobre un fenómeno, hasta ahora, poco explorado.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.
Apéndice 1. doi.org/10.5281/zenodo.4774401












 uBio
uBio 


