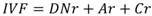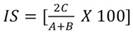Introducción
En la zona intertropical se encuentran las comunidades vegetales terrestres más antiguas en el mundo como las selvas tropicales húmeda y seca (Koleff, Urquiza-Hass, & Contreras, 2012), ecosistemas ricos, diversos y complejos (Pennington & Sarukhán, 2005) que cubren cerca del 7 % de la superficie terrestre con 1 172 millones de hectáreas (Sánchez-Gutiérrez, Valenzuela-Gómez, Valdez-Hernández, & González-González, 2017). De ellas, 656 millones de ha (56 %) se encuentran en América (Dirzo, Aguirre, & López, 2009); 32.1 millones de ha (4.9 %) en México (CONABIO, 2008) y 1.3 millones (3 %) de ha en el estado de Chiapas (Cruz-Lara, Lorenzo, Soto, Naranjo, & Ramírez, 2004). Mientras tanto, con solo el 0.16 % del territorio del país, la selva lacandona alberga más del 20 % del total de las especies existentes en México (Durán-Fernández, Aguirre-Rivera, García-Pérez, Levy-Tacher, & Nova-Vázquez, 2016).
Aunque las selvas del neotrópico poseen gran biodiversidad son los ecosistemas más amenazados, principalmente por la deforestación, extracción de madera, caza, urbanización y aperturas de vías de comunicación; además de eventos naturales como huracanes, incendios, plagas y enfermedades (Sánchez-Gutiérrez et al., 2017). En los últimos 150 años se ha perdido más del 30 % de su superficie a nivel mundial (ter Steege et al., 2015), debido a la falta de la aplicación de las políticas públicas relacionadas con el cambio y uso de suelo, causando modificaciones en la estructura y composición florística de los reductos de selvas (Sánchez-Gutiérrez, Valdez-Hernández, Hernández-de la Rosa, & Beltrán-Rodríguez, 2019), así como en su composición de especies de las comunidades arbóreas a través de la reducción del hábitat causado por las actividades antropogénicas (González & Hamrick, 2005). Además, la fragmentación provoca que se reduzca la mayoría de las plantas del sotobosque en la selva tolerante a la sombra, al tiempo que se fomenta la presencia de especies de plantas generalistas y pioneras (Clark & Clark, 1987). Por lo tanto, cualquier alteración en las características del dosel, pone en riesgo al sotobosque para mantener la estructura, el funcionamiento y la dinámica de la selva (Brienen & Zuidema, 2006).
Los estudios sobre la estructura y diversidad arbórea en las selvas y bosques, proporcionan información botánica y ecológica con respecto a su dinámica y favorecen la definición de estrategias para el manejo sustentable (Basáñez, Alanís, & Badillo, 2008). El análisis de los cambios en la vegetación en gradientes altitudinales, contribuyen a determinar los patrones de distribución de especies arbóreas en condiciones ambientales diversas y en extensiones geográficas amplias, además de conocer como el cambio climático (CC) influye en la migración de las especies (Mateo, Felicísimo, & Muñoz, 2011). En este sentido Guariguata, Cornelius, Locatelli, Forner y Sánchez-Azofeifa (2008) proponen el manejo de las selvas, con base en aprovechamiento selectivo, manteniendo especies que pueden adaptarse a las variaciones climáticas. A su vez Grubb (1977) argumenta que los gradientes altitudinales están relacionados con la composición y distribución de las especies, debido a factores como el relieve, temperatura, precipitación. Además la nubosidad, limita la radiación fotosintéticamente activa disponible, responsables de la productividad de las selvas (Grubb, 1977).
La Selva Lacandona es considerada uno de los últimos reductos de selvas del trópico húmedo de México. A pesar de la diversidad de especies de flora y fauna que alberga son escasos los estudios, principalmente los que describen la estructura y diversidad de las especies arbóreas y los cambios en estos atributos con relación a la altitud (Sánchez-Gutiérrez et al., 2019). Por lo expuesto, el presente estudio tuvo como objetivo principal describir la estructura y la composición de las especies arbóreas en un gradiente altitudinal en el área natural protegida (ANP) Metzabok, Selva Lacandona, Chiapas.
Materiales y métodos
Área de estudio: Se localiza en el área natural protegida (ANP) Metzabok, la cual se ubica al noreste de la Selva Lacandona en la comunidad de Puerto Bello Metzabok, Ocosingo, Chiapas, México, entre las coordenadas geográficas (17°08’36” N & 91°34’42” W), en una superficie de 3 368 ha. El clima se caracteriza por ser cálido húmedo con lluvias todo el año Af (m), la temperatura media anual es de 24 °C y precipitación total anual de 3 160 mm. Los tipos de suelo son redzinas, luvisoles, gleysoles, vertisoles, cambisoles y litosoles, la vegetación predominante es selva alta, mediana perennifolia, subperennifolia y vegetación secundaria (Sánchez-Gutiérrez et al., 2017).
Muestreo y medición de variables: Con base en el mapa de curvas de nivel se determinaron cinco estratos altitudinales (EA) en intervalos de 100 m; en ellos se instalaron aleatoriamente 21 unidades de muestreo (UM) de 20 x 50 m (1 000 m2): seis en el estrato altitudinal 1 (EA1), cinco en el EA2, cuatro en el EA3, tres en el EA4 y tres en el EA5 (Fig. 1). Cada UM fue subdividida en 10 subunidades de muestreo (SUM) de 10 x 10 m.
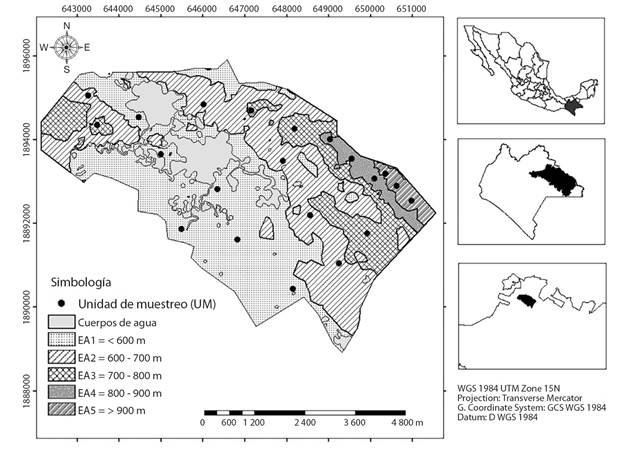
Fig. 1 Fig. 1 Distribución de las unidades de muestreo (UM) en cinco estratos altitudinales. Distribution of sampling plots (UM) in five altitudinal strata.
Composición de especies arbóreas: A los individuos con diámetro ≥ 2.5 cm se les midió su diámetro normal (DN), altura total (Ht) y el diámetro de copa (menor y mayor) (Carreón-Santos & Valdez-Hernández 2014). La identificación taxonómica de las especies arbóreas se realizó con ayuda de manual y guía de campo (Pennington & Sarukhán, 2005). De los árboles desconocidos se recolecto material botánico que se herborizó e identificó en el herbario ECOSC-H del ECOSUR en San Cristóbal de las Casas, Chiapas. Los nombres científicos se verificaron en el sitio web theplantlist.org/. Se elaboraron curvas especies-área para los cinco EA, que representan gráficamente la riqueza acumulada de especies en una superficie determinada (Beltrán-Rodríguez et al., 2018).
Análisis de la estructura arbórea: La categoría de altura (individuos con DN ≥ 2.5 cm) se determinó mediante las inflexiones de curvas generadas al graficar el número de individuos contra su altura (López-Toledo, Valdez-Hernández, Pérez-Farrera, & Cetina-Alcalá, 2012). Para las diamétricas se establecieron en intervalos de 10 cm de amplitud para cada EA. Para jerarquizar la dominancia de cada especie se calculó el índice de valor de importancia (IVI) (Zarco et al., 2010) con la ecuación: ; donde: Dr = Densidad relativa; ABr = Área basal relativa; Fr = Frecuencia relativa. También se determinó el índice de valor forestal (IVF), que incluye la variable vertical de altura (Carreón-Santos & Valdez-Hernández, 2014) con la ecuación:
donde: DNr = Diámetro normal relativo; Ar = Altura total relativa; Cr = Cobertura de copa relativa.
Diversidad de especies arbóreas: Se calcularon los índices de Shannon-Wiener (H´), alfa de Fisher (α), que en todos los casos cumplió con la restricción para su uso de N/S ≥ 1.4; en donde N es el número total de observaciones y S es la riqueza e índice de Simpson (S) (Zarco et al., 2010).
Se utilizó la prueba de “t” modificada por Hutcheson (Carreón-Santos & Valdez-Hernández, 2014), para verificar diferencias estadísticamente significativas en el índice de Shannon-Wiener; los demás índices de diversidad y los valores de área basal, altura y densidad fueron comparados entre cada estrato mediante un análisis de varianza (ANOVA) y prueba de Tukey (P ≤ 0.05) con el software SAS 9.4.
Semejanza florística entre los estratos altitudinales: Se utilizó el índice de Sørensen, que se basa en la presencia-ausencia de especies entre dos comunidades (Sánchez-Gutiérrez et al., 2017). La ecuación utilizada fue:
donde: A = número de especies en la comunidad 1; B = número de especies en la comunidad 2; C = número de especies comunes en ambas comunidades.
Resultados
Composición florística arbórea: Se registraron 4 584 individuos de 65 familias, 155 géneros y 209 especies arbóreas. De las especies registradas, ocho se encuentran enlistadas en la NOM-059-SEMARNAT-2019 como vulnerables; cinco como amenazadas: Astronium graveolens Jacq., Calophyllum brasiliense Cambess, Geonoma pinnatifrons Willd., Guatteria anomala R.E. Fr. y Magnolia lacandonica; dos en peligro de extinción: Louteridium donnell-smithii S. Watson y Vatairea lundellii (Standl.) Record; y una en protección especial: Cedrela odorata L.
En el EA1, las UM instaladas cerca de las lagunas (100 a 500 m) registró alta frecuencia de Haematoxylum campechianum L. y Pachira aquatica Aubl. Las UM situadas en áreas perturbadas por la deforestación e incendio en 1983, presentaron a Heliocarpus appendiculatus Turcz., y Bursera simaruba (L.) Sarg., como las especies dominantes. En los EA2 y 3 las especies comunes fueron: Pouteria reticulata (Engl.) Eyma, Pseudolmedia glabrata (Liebm.) C.C.Berg, Quararibea funebris (La Llave) Vischer y Brosimum alicastrum Sw. y en los EA4 y 5 fueron: Pouteria durlandii (Standl.) Baehni, Dialium guianense (Aubl.) Sandwith, Pseudolmedia spuria (Sw.) Griseb. y Guarea glabra Vahl.
La curva de acumulación de especies muestra que ninguno de los EA analizados alcanzó el nivel de la asíntota (Fig. 2). Por lo tanto, se necesita un mayor esfuerzo de muestreo para registrar la mayoría de las especies.
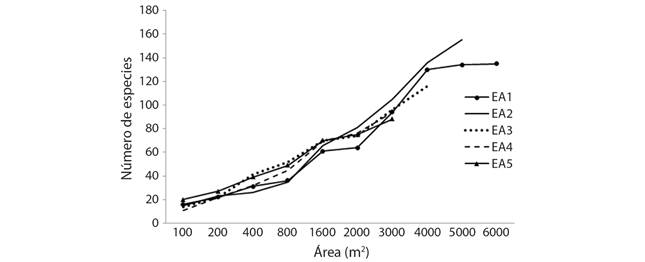
Fig. 2 Fig. 2 Curva especies-área con cinco estratos altitudinales (EA). Species-area curve with five altitudinal strata (EA).
Estructura vertical: En los cinco estratos se registraron tres rangos de altura (baja, media y alta). La baja con altura promedio de 5 ± 3 m, las especies más frecuentes fueron: Myriocarpa longipes Liebm, Piper psilorhachis C. DC., Randia aculeata L. y Trichilia pallida Sw; media con altura promedio de 17 ± 5 m, dominaron Garcinia intermedia (Pittier) Hammel, Pseudolmedia spuria (Sw.) Griseb., Pseudolmedia glabrata (Liebm.) C.C. Berg, Pouteria multiflora (A. DC.) Eyma y Quararibea funebris (La Llave) Vischer; y alta con altura promedio de 17 ± 42 m, fue representado por Calophyllum brasiliense Cambess., Dialium guianense (Aubl.) Sandwith, Guatteria anomala R.E.Fr., Manilkara chicle (Pittier) Gilly, Manilkara zapota (L.) P. Royen y Terminalia amazonia (J.F. Gmel.) Exell (Fig. 3). Los EA1 y 2 mostraron diferencias estadísticas significativas (Tukey, P < 0.05) en altura con los EA3, 4 y 5, registrando árboles de hasta 53 m de altura.
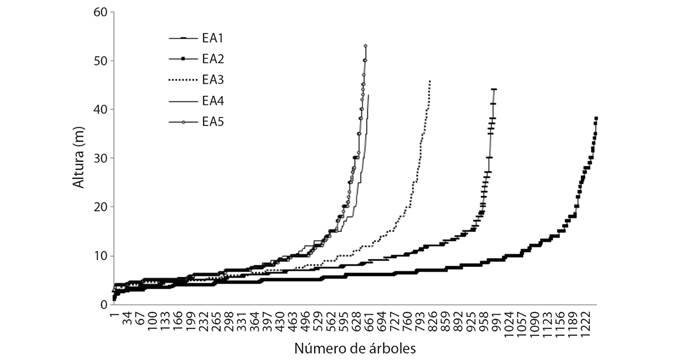
Fig. 3 Fig. 3 Altura de árboles en cinco estratos altitudinales (EA). Tree height in five altitudinal strata (EA).
Distribución horizontal: La densidad de individuos fue mayor en el EA2 con 2 504 ind. ha-1, y menor en el EA1 con 1998 ind. ha-1 y no hubo un patrón de distribución en relación con la altitud. El diámetro presenta diferencias significativas (Tukey, P < 0.05) entre EA, con una escala de 2.5 a 199 cm y una media de 9.7 cm. El área basal registró valor más alto en el EA5 con 80.8 m2 ha-1 y menor en el EA2 con 35.6 m2 ha-1. En todos los EA se obtuvieron un mayor número de individuos en la primera categoría diamétrica con una disminución progresiva en las siguientes mostrando una distribución de “J” invertida (Fig. 4).
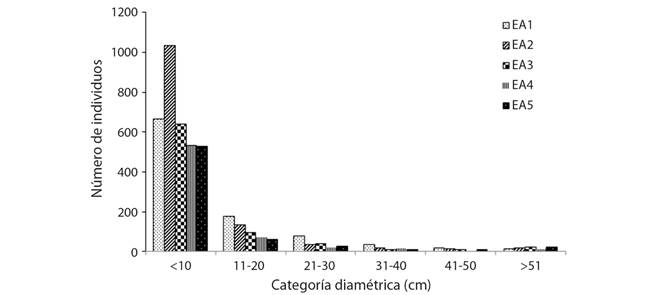
Fig. 4 Fig. 4 Distribución diamétrica de árboles en cinco estratos altitudinales (EA). Diametric distribution of trees in five altitudinal strata (EA).
Índice de valor de importancia (IVI) y forestal (IVF): Las especies con los valores estructurales más altos fueron: H. campechianum, M. zapota para el EA1, Rinorea guatemalensis (S. Watson) Bartlett, P. reticulata y B. alicastrum para el EA2, M. zapota, B. alicastrum, R. guatemalensis en el EA3, G. anomala, P. spuria y P. durlandii en EA4 y T. amazonia, P. durlandii y D. guianense para el EA5 (Tabla 1).
Tabla 1 TABLE 1 Especies arbóreas con mayores índices de valor de importancia (IVI) y de valor forestal (IVF) Tree species with higher indices of importance value (IVI) and forest value (IVF)
| Especie | IVI | Especie | IVF | |
| Estrato altitudinal 1 (500-600 m) | Estrato altitudinal 1 (500-600 m) | |||
| Haematoxylum campechianum L. | 66.4 | Haematoxylum campechianum L. | 81.5 | |
| Manilkara zapota (L.) Royen | 16.5 | Manilkara zapota (L.) Royen | 14.4 | |
| Eugenia gaumeri Standl. | 12.7 | Heliocarpus appendiculatus Turcz. | 12.7 | |
| Hauya elegans DC. | 9.9 | Rinorea guatemalensis (S. Watson) Bartlett | 9.4 | |
| Pachira aquatica Aubl. | 8.9 | Bursera simaruba (L.) Sarg. | 8.0 | |
| 130 especies restantes | 185.6 | 130 especies restantes | 174.1 | |
| Estrato altitudinal 2 (600-700 m) | Estrato altitudinal 2 (600-700 m) | |||
| Rinorea guatemalensis (S. Watson) Bartlett | 27 | Rinorea guatemalensis (S. Watson) Bartlett | 32.2 | |
| Pouteria reticulata (Engl.) Eyma | 15.2 | Pseudolmedia glabrata (Liebm.) C.C.Berg | 14.5 | |
| Brosimum alicastrum Sw. | 14 | Pouteria reticulata (Engl.) Eyma | 14.4 | |
| Pouteria durlandii (Standl.) Baehni | 12.5 | Brosimum alicastrum Sw. | 12.3 | |
| Manilkara zapota (L.) Royen | 10.9 | Dialium guianense (Aubl.) Sandwith | 10.8 | |
| 150 especies restantes | 220.4 | 150 especies restantes | 215.8 | |
| Estrato altitudinal 3 (700-800 m) | Estrato altitudinal 3 (700-800 m) | |||
| Manilkara zapota (L.) Royen | 20.9 | Brosimum alicastrum Sw. | 25.05 | |
| Brosimum alicastrum Sw. | 19.2 | Rinorea guatemalensis (S. Watson) Bartlett | 21.67 | |
| Rinorea guatemalensis (S. Watson) Bartlett | 16.4 | Pouteria reticulata (Engl.) Eyma | 17.09 | |
| Dialium guianense (Aubl.) Sandwith | 13.5 | Manilkara zapota (L.) Royen | 15.44 | |
| Pouteria reticulata (Engl.) Eyma | 13 | Dialium guianense (Aubl.) Sandwith | 14.54 | |
| 111 especies restantes | 216.9 | 111 especies restantes | 206.2 | |
| Estrato altitudinal 4 (800-900 m) | Estrato altitudinal 4 (800-900 m) | |||
| Guatteria anomala R.E. Fr. | 23.2 | Pseudolmedia spuria (Sw.) Griseb. | 25.7 | |
| Pseudolmedia spuria (Sw.) Griseb. | 20.1 | Pouteria durlandii (Standl.) Baehni | 25.5 | |
| Pouteria durlandii (Standl.) Baehni | 19.3 | Dialium guianense (Aubl.) Sandwith | 17.7 | |
| Dialium guianense (Aubl.) Sandwith | 14.7 | Rinorea guatemalensis (S. Watson) Bartlett | 17.1 | |
| Pouteria multiflora (A. DC.) Eyma | 13.2 | Lacistema aggregatum (P.J. Bergius) Rusby | 14.6 | |
| 89 especies restantes | 209.6 | 89 especies restantes | 199.4 | |
| Estrato altitudinal 5 (> 900 m) | Estrato altitudinal 5 (> 900 m) | |||
| Terminalia amazonia (J.F. Gmel.) Exell | 46.2 | Terminalia amazonia (J.F. Gmel.) Exell | 31.1 | |
| Pouteria durlandii (Standl.) Baehni | 17.8 | Pouteria durlandii (Standl.) Baehni | 25.4 | |
| Dialium guianense (Aubl.) Sandwith | 17 | Dialium guianense (Aubl.) Sandwith | 25.2 | |
| Pseudolmedia spuria (Sw.) Griseb. | 14.9 | Pseudolmedia spuria (Sw.) Griseb. | 23.6 | |
| Manilkara zapota (L.) Royen | 12.6 | Saurauia sp. | 20.5 | |
| 83 especies restantes | 191.3 | 83 especies restantes | 191.3 | |
Diversidad de especies arbóreas: Existe diferencias significativas (P < 0.05) entre la diversidad de los EA, de acuerdo con la prueba de la t modificada de Hutcheson, corroborado con los valores de índices de Shannon. El mayor valor se presenta en el EA1 (H´ = 3.7) y el menor en el EA5 (H´= 3.2) (Tabla 2). Este orden coincide con el valor de Simpson e indica la dominancia de ciertas especies a una mayor altitud. Estos valores muestran que la selva del ANP Metzabok presenta una relación inversa, a mayor altitud menor diversidad de especies arbóreas. El mayor valor de alfa de Fisher se presenta en el EA2 (Tabla 2), debido a la mayor densidad de individuos en comparación con los otros EA.
Tabla 2 TABLE 2 Índices de diversidad, número de riqueza y familia, promedio de diámetro y altura Diversity indices, number of wealth and family, average diameter and height
| Estrato altitudinal | |||||
| EA1 | EA2 | EA3 | EA4 | EA5 | |
| DN | 10. 95 c | 8.32 a | 9.75 abc | 9.0 ab | 10. 61 bc |
| Ht | 7.8 a | 7.4 a | 9.2 b | 9.4 b | 9.6 b |
| R | 135 abc | 155 c | 116 ab | 96 b | 87 b |
| F | 42 ab | 46 a | 41 ab | 37 ab | 33 b |
| S | 3.91 a | 3.89 ab | 3.85 ab | 3.75 ab | 3.72 c |
| Α | 39.06 a | 46.15 b | 36.44 a | 29.97 ab | 27.38 ab |
| H´ | 3.71 a | 3.37 ab | 3.36 ab | 3.30 ab | 3.27 b |
DN = diámetro normal, Ht = altura total, R = riqueza de especies, F = Familia, S = índice de Simpson, α = alfa de Fisher, H´ = índice de Shannon. Letras diferentes significa que hay diferencias significativas (P < 0.05) entre los estratos altitudinales.
DN = normal diameter, Ht = total height, R = species richness, F = Family, S = Simpson Index, α = a Fisher alpha, H´ = Shannon Index. Different letters mean significant differences (P < 0.05) between altitudinal strata.
Semejanza florística: Al comparar los valores del índice de Sørensen, los EA más semejantes fueron el 2 y 3 con un IS = 58.7 % y el valor menor se presentó entre el EA1 y 5 con un IS = 39.5. Todos los EA son florísticamente parecidos al compartir el 50 % de las especies arbóreas.
Discusión
El Área Natural Protegida Metzabok, registro una riqueza de 209 especies, valor superior comparando con otros trabajos realizados en selvas de la región tropical como las de China por Ding, Zang, Liu, He y Letche (2012) con 171 especies, de Australia por Bradford, Metcalfe, Ford, Liddell y Mckeown (2014) con 208 especies, de India por Sagar, Raghubanshi y Singh (2003) con 49 especies, así como de México por Zarco, Valdez-Hernández, Ángeles-Pérez y Castillo-Castillo (2010) con 71 especies y López-Toledo et al. (2012) con 83 especies. Estos resultados demuestran que el área de estudio, se encuentra entre las selvas con mayor riqueza de especies arbóreas en el mundo, favorecido por la suma de factores ecológicos del lugar como, altitud, temperatura, precipitación y el estado de conservación además de su ubicación geográfica.
Las especies más abundantes en los cinco estratos estudiados, se comportaron de manera similar a los registros de Levy, Aguirre, García y Martínez (2006) y Meave, Romero-Romero, Valle-Doménch, Rincón-Gutiérrez, Martínez y Ramos (2008), reconocidas como parte de la selva alta perennifolia de México (Pennington & Sarukhán, 2005). Además de la R. guatemalensis que coloniza los claros de las selvas, causados por la caída de las ramas o de árboles completos (Zarco et al., 2010; Vázquez-Negrín, Castillo-Acosta, Valdez-Hernández, Zavala-Cruz, & Martínez-Sánchez, 2011).
En el EA1, las UM instaladas cerca de las lagunas registraron alta frecuencia de H. campechianum y P. aquatica, especies que habitan en planicies y soportan inundación hasta seis meses al año (Tun-Dzul, Vester, & Schmook, 2008). Las UM situadas en áreas perturbadas presentaron a H. appendiculatus y B. simaruba, consideradas como pioneras (Vázquez-Negrín et al., 2011) y comunes de la vegetación secundaria (Carreón-Santos & Valdez-Hernández, 2014).
Los géneros Dialium, Pouteria, Pseudolmedia y Guarea, fueron registrados también en la selva amazónica de Bolivia por Araujo-Murakami et al. (2015), Terminalia en Nigeria por Gourlet-Fleury et al. (2013), Randia, Bauhinia, Casearia y Mimosa en la India por Sagar et al. (2003). La presencia de estos géneros en los otros países, se debe a que geográficamente se encuentran en la región tropical y las condiciones ambientales son similares.
En el rango de altura baja, las especies comunes fueron: M. longipes, P. psilorhachis, R. guatemalensis y T. pallida, lo que concuerda el estudio de Vázquez-Negrín et al. (2011); son demandantes de mucha luz solar durante su primera etapa de crecimiento y colonizan claros en la selva (Zarco et al., 2010). En el rango de altura alta estuvo representada por C. brasiliense, D. guianense, G. anomala, M. chicle, M. zapota y T. amazonia; las cuales se encuentran en la selva alta perennifolia de México (Pennington & Sarukhan, 2005). La altura de los árboles de hasta 53 m en los EA3, 4 y 5, se le atribuye a la lejanía de la comunidad y el difícil acceso, impidiendo la extracción de madera en donde son empleadas para el uso doméstico. Algunos árboles de mayor altura registran densidad baja, lo que concuerda con los registros de Zarco et al. (2010) y Vázquez-Negrín et al. (2011), debido a que se convierten en árbol lobo impidiendo la regeneración de la misma especie.
La densidad de los árboles por hectárea no presentó relación entré la altitud, similar a lo obtenido por Brown, Grau, Malizia y Grau (2001) en Argentina. En todos los EA se obtuvieron un mayor número de individuos en la primera categoría diamétrica con una disminución progresiva en las siguientes mostrando una distribución de “J” invertida, lo cual coincide con los resultados de Vázquez-Negrín et al. (2011) y López-Toledo et al. (2012), sugiriendo una buena repoblación de las especies arbóreas y asegurando la permanencia de la selva.
El mayor valor de área basal se encontró en el EA5, por la presencia de T. amazonia, M. zapota y G. anomala con diámetros de hasta 190 cm y con dominancia en la selva (Pennington & Sarukhán, 2005). Encontramos un patrón de a mayor altitud, mayor área basal, tendencia similar con el estudio de Lieberman, Lieberman, Peralta y Hartshorn (1996) en Costa Rica.
Las especies con más altos valores estructurales (IVI e IVF), fueron similares en todo los EA donde no hay perturbación. Lo cual coincide con el estudio de Levy et al. (2006) y Meave et al. (2008), ambos autores argumentan que son parte de la selva alta perennifolia, a excepción de H. campechianum y E. gaumeri que son de baja subperennifolia o inundable (Tun-Dzul et al., 2008). Estos valores se deben a que, en altitudes de 400 a 900 m, presentan las mismas condiciones de temperatura y precipitación, que ayuda a la coexistencia de ciertas especies en estas escalas. Debido que el ambiente se modifica en altitudes mayores de 1 000 m y de la mano con la estructura y composición de la vegetación (McAuliffe, 1994).
La diversidad según el índice de H´, se presentó con menor valor a mayor altitud, coincide con el valor de S que mostró dominancia de ciertas especies en cada EA. Esto se atribuye a la altitud que actúa como barrera en la distribución de las especies (Sulca, 2013). Aunque estudio de Ding et al. (2012) en China encontraron mayor diversidad en áreas perturbadas, al proporcionar nichos de regeneración (Chazdon, 2003). La semejanza entre los EA disminuye al aumentar el intervalo de altitud, afirmando la preferencia ambiental particular de cada especie (Araujo-Murakami et al., 2015).
En conclusión, la estructura y diversidad de las especies arbóreas, presentaron mayores cambios a intervalos altitudinales más amplios, y se debe a los requerimientos ecológicos de cada especie, conforme asciende la altitud la temperatura y precipitación disminuye, factores que influyen directamente en la riqueza de especie. La riqueza registrada se debe a la suma de los factores ambientales, provocando que a mayor altitud haya menor diversidad de las especies arbóreas. Las especies inscritas en la NOM-059-SEMARNAT-2019, se deben de estudiar de manera particular, para poder implementar estrategias de conservación.
Los estratos altitudinales estudiados presentaron una repoblación aceptable, esto se debe a la estructura horizontal y vertical de las diferentes especies, que permiten las interacciones entre ellas asegurando la permanencia de la selva, con este resultado se demuestra que la selva del área natural protegida Metzabok es una de las menos afectadas por el disturbio en México.












 uBio
uBio