Introducción
La composición del sustrato es una de las características principales que determina el ensamblaje de macroinvertebrados dulceacuícolas en un cuerpo de agua, debido a las diferentes preferencias y adaptaciones de los organismos a este. Así, se espera encontrar cambios en dichos ensamblajes según se modifican las características geomorfológicas del río, desde la cuenca alta hasta la cuenca baja (Czerniawska-Kusza, 2004; Duan, Wang, & Tian, 2008). En la cuenca alta se observan principalmente sustratos rocosos y heterogéneos, mientras que en las cuencas bajas se suelen observar sustratos arenosos o lodosos inestables para el asentamiento de los organismos bentónicos (Vannote, Minshall, Cummins, Sedell, & Cushing, 1980; Phillips, 2003). Aunado a esto, los ríos de cuencas bajas se caracterizan generalmente por tener un cauce ancho y profundo que dificulta la recolecta de macroinvertebrados acuáticos presentes en los microhábitats alejados de la ribera (De Pauw, Roels, & Fontoura, 1986; Hernández, Rueda, Tapia, & Martínez-López 1998; Boothroyd & Dickie, 2010).
Entre otras dificultades o riesgos para la recolecta de macroinvertebrados acuáticos en las cuencas bajas, se destacan los flujos altos de caudal, presencia de contaminantes, la composición del lecho, la irregularidad del fondo y la presencia de cocodrilos (en regiones tropicales; Hernández et al., 1998). Debido a estas circunstancias, es necesaria la implementación de técnicas que permitan recolectar los macroinvertebrados acuáticos disminuyendo el riesgo para el investigador. Entre las técnicas utilizadas en este tipo de cuerpos de agua, está la aplicación de sustratos artificiales. Esta metodología consiste en colocar en el punto de muestreo trampas compuestas por elementos naturales o artificiales, contenidos en bolsas o cajas con agujeros que permiten la entrada y colonización de los organismos al sustrato elegido (De Pauw et al., 1986; Saliu & Ovuorie, 2006). Finalizado el período óptimo de 30 a 40 días, las trampas se retiran para el conteo e identificación de los organismos que colonizaron (Hilsenhoff, 1969; Boothroyd & Dickie, 2010).
Los sustratos artificiales presentan la ventaja de permitir la estandarización de variables como la oferta de sustratos en el cauce, para realizar un análisis comparativo de diferentes secciones de una cuenca, o incluso, entre cuencas independientes, al homogenizar los tipos de microhábitats evaluados. Así, las muestras obtenidas están asociadas en primera instancia a la calidad del agua en el sitio, y no a la disponibilidad del microhábitat (Meier, Penrose, & Polakf, 1979; Mirto & Danovaro, 2004; Boothroyd & Dickie, 2010).
El tipo de sustrato comúnmente utilizado es el rocoso, mediante el uso de ladrillos o bloques de concreto, pues ofrece una rugosidad adecuada para formar refugios para los organismos. Además, permiten la estimación de densidades al proporcionar un área de colonización conocida (Trama, Rizo, & Springer, 2009). Este sustrato ha mostrado ser efectivo y suele ser recomendado para estudios de biomonitoreo (De Pauw et al., 1986; Czerniawska-Kusza, 2004). Sin embargo, hay una gran variedad de materiales que podrían ser utilizados como sustrato, algunos estudios han evaluado el uso de láminas de acrílico, canicas y plásticos, obteniendo resultados favorables en la colonización de organismos (De Pauw, Lambert, Van Kenhove, & Bij De Vaate, 1994; Czerniawska-Kusza, 2004). No obstante, el uso simultáneo de diferentes materiales, tanto orgánicos como inorgánicos, para la construcción de los sustratos artificiales ha resultado más efectivo pues otorga diversidad de microhábitats para ser colonizados por un mayor número de macroinvertebrados (De Pauw et al., 1986; Pashkevich & Pavluk, 1996; Phillips, 2003; Molokwu et al., 2014, Leite-Rossi, Nunes, & Trivinho-Strixino, 2015; Milesi, Dolédec, & Melo, 2016).
Los estudios con sustratos artificiales en ríos de cuenca baja han sido realizados principalmente en regiones templadas y subtropicales, donde en algunos países la metodología se utiliza para el monitoreo biológico de la calidad del agua (De Pauw et al., 1994; Czerniawska-Kusza, 2004; Boothroyd & Dickie, 2010). Adicionalmente, en la región tropical se han llevado a cabo investigaciones recientes que han probado la importancia de la heterogeneidad de microhábitats en la colonización de macroinvertebrados (Molokwu et al., 2014, Leite-Rossi et al., 2015; Milesi et al., 2016). En Costa Rica, la metodología de sustratos artificiales se ha utilizado en pocos estudios en los que únicamente se ha empleado el sustrato rocoso (Trama et al., 2009), por lo que resulta importante analizar la influencia de otros sustratos, principalmente orgánicos, en la colonización de los macroinvertebrados debido a la aplicabilidad que tiene esta metodología en el monitoreo de ríos de cuenca baja. El objetivo de esta investigación fue evaluar la efectividad de tres tipos de sustratos artificiales en la colonización de macroinvertebrados dulceacuícolas, en la cuenca baja del río Parismina, Costa Rica.
Materiales y métodos
Sitio de estudio: Los muestreos se realizaron de manera bimensual entre los años 2013 y 2017, en el río Parismina, en el sector del Silencio, Guácimo, Limón, Costa Rica. El área de estudio comprende la cuenca baja del río, el cual, se considera como un río estable durante las cuatro épocas del año (seca, lluviosa y transiciones), debido a que el canal tiene forma de U y el fondo está compuesto por arena y limo. Por lo tanto, los muestreos se llevaron a cabo en transporte acuático. El tramo muestreado se encuentra entre los 16 y los 10 msnm; y presenta variaciones en cuanto a la composición de la vegetación de ribera, que va desde vegetación nula, mezcla entre árboles y pastizal y bosque en ambas márgenes. El estudio se desarrolló en los sitios del río denominados Silencio (10°14’32.42”N & 83°29’43.24”W), Desanti (10°15’52.93”N & 83°29’4.63”W), Jiménez (10°17’20.30”N & 83°28’17.91”W) y Quebrada Seca (Q.S) (10°17’27.72”N & 83°26’42.30”W). El sitio Silencio se caracteriza por poseer una menor perturbación en el bosque de ribera, mientras los sitios de Desanti y Jiménez, cuentan con una perturbación media, principalmente por la presencia de potreros. Por último, el sitio Quebrada Seca, con alta perturbación en su ribera, sin presencia de árboles y una matriz de potreros.
Metodología: En los cuatro sitios de muestreo, se emplearon tres tipos de sustratos artificiales compuestos por (1) hojas de sotacaballo (Zygia longifolia; peso total de 20 g), (2) madera de sotacaballo (120 g) y (3) canto rodado (310 g). La madera y las piedras fueron lavadas, para eliminar presencia de contaminantes, mientras que las hojas se adquirieron de los árboles del propio margen del río. Cada material se introdujo en una bolsa de malla con 0.6 cm de luz de poro (para permitir la entrada de distintas tallas de macroinvertebrados acuáticos), se ataron de forma independiente con una cuerda de nylon de 1.5 m de largo y se sumergieron (la profundidad del río Parismina varió entre los 0.8 m y 3 m, según estación del año). En cada sitio se colocó un total de tres réplicas por tipo de sustrato artificial, separadas por 50 m de distancia entre sí (150 m de distancia total) y por un periodo de 30 días, para promover la colonización (Trama et al., 2009), luego del cual se retiraron de forma manual, halando la cuerda lentamente y depositándolos inmediatamente en bandejas para evitar la pérdida de individuos (no se pudo introducir una red o malla para extraer los sustratos debido a la presencia de ramas y raíces sumergidas) .
Posteriormente, se colocaron en bolsas plásticas, para ser transportadas al laboratorio y realizar la búsqueda manual de cada organismo. Los individuos extraídos se depositaron en frascos de vidrio y se preservaron en etanol al 80 % para su identificación a la menor categoría taxonómica posible, usando las claves taxonómicas de Courtney & Merritt (2008), White & Rougley (2008), Flowers & De la Rosa (2010), Ramírez (2010), Springer (2010), mientras que Oligochaeta, Nematoda e Hydrachnidia se identificaron a nivel de orden a través de Roldán (1998).
Análisis estadístico: Para evaluar la diversidad y equitatividad del ensamblaje de macroinvertebrados acuáticos, según cada tipo de sustrato se calculó el índice de Shannon-Wiener y la dominancia a través del índice de Simpson. Debido a que la abundancia de macroinvertebrados acuáticos por tipo de sustrato no presentó distribución normal, se realizó una prueba Kruskal-Wallis, para determinar si existían diferencias entre la cantidad de individuos registrados por tipo de sustrato y por sitio de muestreo, seguido por la prueba Holm post-hoc para determinar cuáles medias diferían entre ellas. Además, para determinar si existe una diferencia entre los sustratos por sitio, se aplicó una prueba PERMANOVA de dos vías. Por último, se realizó un análisis de correspondencia múltiple (ACM), para determinar la asociación de cada género o familia de macroinvertebrados acuáticos a un tipo de sustrato (madera, hojas o piedra).
Resultados
Un total de 1 159 individuos fueron recolectados, pertenecientes a 52 géneros de 29 familias, representados en 12 órdenes. Los órdenes Diptera y Ephemeroptera mostraron mayor abundancia de organismos en los tres sustratos artificiales, mientras que Hemiptera y Megaloptera presentaron una menor abundancia (Fig. 1). La familia Chironomidae (Diptera), y los géneros Tricorythodes sp. (Ephemeroptera: Leptohyphidae) y Farrodes sp. (Ephemeroptera: Leptophlebiidae) fueron los taxa más abundantes.
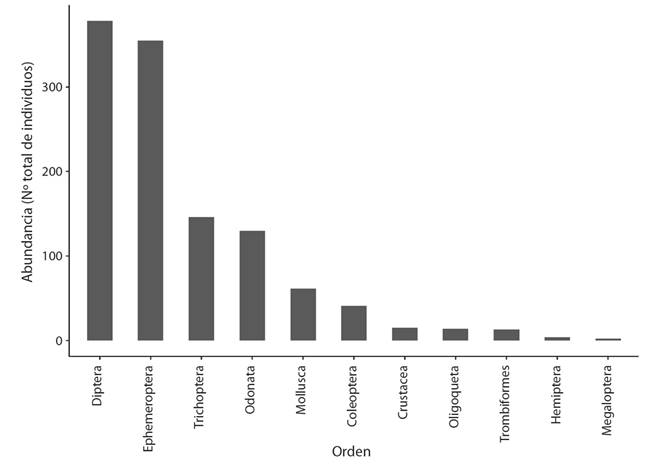
Fig. 1 Fig. 1 Abundancia total a nivel de orden de macroinvertebrados acuáticos recolectados en los tres tipos de sustratos artificiales, en los cuatro sitios de muestreo en el Río Parismina, entre los años 2013 y 2017. Total abundance at the level of order of aquatic macroinvertebrates collected in three types of artificial substrates, in four sampling sites in the Parismina River, between the years 2013 and 2017.
En cuanto a la abundancia por sustratos, la madera de sotacaballo albergó la mayor cantidad de taxa y la mayor abundancia, mientras que, el sustrato de piedras obtuvo el menor registro, tanto en riqueza como en abundancia (Tabla 1). Sin embargo, los tres sustratos tuvieron valores similares respecto al índice de Shanon-Wiener y el de Dominancia. Aun así, se encontró que los sustratos madera y hojas albergan una mayor cantidad de organismos que el sustrato piedra, mientras que, entre los sustratos madera y hojas la cantidad de organismos resulta similar (Kruskal-Wallis: 10.15; P < 0.05) (Fig. 2 A; Tabla 1).
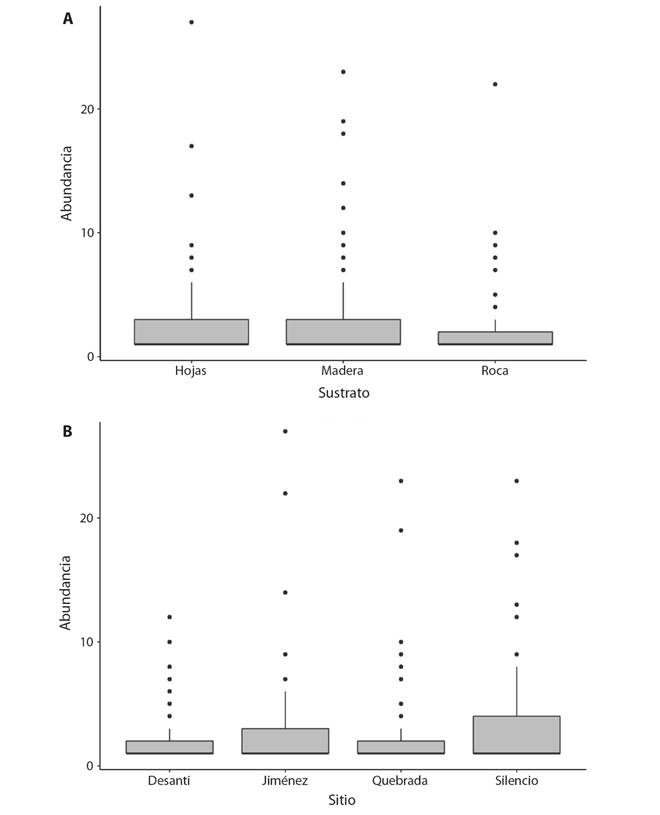
Fig. 2 Fig. 2 Abundancia media de macroinvertebrados acuáticos registrados por tipo de sustrato (A), y por sitio (B), en el río Parismina, Costa Rica, entre los años 2013-2017. Average abundance of aquatic macroinvertebrate registered by type of substrate (A), and by site (B), Parismina River, between the years 2013 and 2017.
TABLA 1 TABLE 1 Número de taxa, abundancia e índices de diversidad de macroinvertebrados acuáticos, para en tres sustratos artificiales colocados en el río Parismina, entre los años 2013-2017 Abundance and diversity index of aquatic macroinvertebrates in three artificial substrates in Parismina River, between the years 2013 and 2017
| Sustratos | Sitios | ||||||
| Hojas | Madera | Piedra | Desanti | Jiménez | Quebrada Seca | Silencio | |
| Taxa | 37 | 42 | 29 | 24 | 27 | 30 | 45 |
| Abundancia | 363 | 494 | 196 | 156 | 184 | 200 | 268 |
| Shannon-Wiener | 3.061 | 3.133 | 2.889 | 2.051 | 2.097 | 2.142 | 2.343 |
| Dominancia | 0.065 | 0.064 | 0.076 | 0.272 | 0.272 | 0.268 | 0.263 |
En el sitio Silencio se obtuvo el mayor valor dentro del índice de Shannon-Weiner, así como la mayor abundancia. Sin embargo, los cuatro sitios evaluados presentaron valores similares de diversidad y sin una clara dominancia entre los géneros encontrados (Tabla 1).
La abundancia de organismos registrados difirió significativamente entre los sitios. Silencio y Jiménez presentaron mayores abundancias respecto a Quebrada Seca y Desanti (Kruskal-Wallis: 10.15; P < 0.05; Fig. 2 B). No obstante, no hubo diferencia en la abundancia entre los sustratos por sitio (Permanova, F = -11.509, p = 0.99).
El ACM indicó que la varianza entre los tres tipos de sustratos y los géneros puede ser explicada por los 2 primeros ejes en un 100% (66.3% primer eje y 33.7% segundo eje). El primer eje presentó una relación positiva con los sustratos hojas (0.51) y roca (0.20) y negativa para el sustrato madera (-0.37). Mientras que, el segundo eje presentó una relación positiva para el sustrato roca (0.62) y negativa para los sustratos hojas (-0.21) y madera (-0.07). Algunos géneros tales como, Traverella (Ephemeroptera: Leptophlebiidae), Maccaffertium (Ephemeroptera: Heptageniidae), Oecetis (Trichoptera: Leptoceridae) y Polycentropus (Trichoptera: Polycentropodidae), presentaron una asociación con el sustrato tipo roca. Los géneros Smicridea y Macronema (Trichoptera: Hydropsychidae), Corydalus (Megaloptera: Corydalidae) y Macrelmis (Coleoptera: Elmidae), presentaron mayor asociación con el sustrato tipo hojas. Mientras que, el sustrato tipo madera fue seleccionado por algunos géneros como, Farrodes (Ephemeroptera: Leptophlebiidae), Callibaetis, Americabaetis (Ephemeroptera: Baetidae) y la especie Melanoides tuberculata (Mollusca: Thiaridae) (Fig. 3).
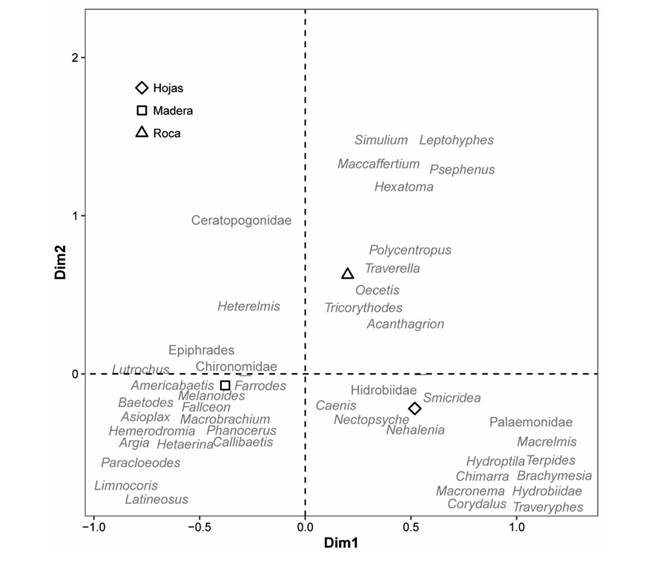
Fig. 3 Fig. 3 Análisis de correspondencia múltiple, para los géneros y algunas familias de macroinvertebrados acuáticos según un sustrato artificial, en la cuenca baja del río Parismina. Entre los años 2013 y 2017. Multiple correspondence analysis to genera and families of aquatic macroinvertebrates according to an artificial substrate, in Parismina River, Costa Rica. Between the years 2013 and 2017.
Discusión
En el presente estudio se halló que el uso de sustratos artificiales es una técnica efectiva para la evaluación de la estructura de los ensamblajes de macroinvertebrados acuáticos en sitios con acceso restringido. De los parámetros estudiados, la abundancia fue la característica que mejor diferenció los ensambles, no siendo así la diversidad. La similitud en la diversidad podría deberse a que las condiciones de hábitat y alteraciones son uniformes en el tramo del río estudiado, por lo que no se reflejó la desaparición de organismos sensibles, ni dominancia de organismos tolerantes.
Los sustratos artificiales se colonizaron por una variedad de familias y géneros, sin embargo, la familia más abundante fue Chironomidae. Algunos representantes de la familia Chironomidae se caracterizan por la capacidad de establecerse en una gran variedad de hábitats y en distintas condiciones de la calidad del agua y entorno (Griffith, Kaufmann, Herlihy, & Hill, 2001; Hedrick et al., 2010; Silva, Ruiz, Bochini, & Moreira, 2008; Wagner et al., 2008). Similarmente, el género Tricorythodes sp. (Ephemeroptera: Letohyphidae) se registró durante todos los muestreos realizados. Esto podría atribuirse a que, son organismos tolerantes a las perturbaciones del hábitat y pueden sobrevivir en ríos con alta carga de sedimentos (Mesa, 2010). El tercer género más abundante fue Farrodes (Ephemeroptera: Leptophlebiidae). Su flexibilidad alimentaria podría ser una de las razones por las cuales se distribuyó tan ampliamente; este género se alimenta raspando y filtrando (Polegatto & Froehlich, 2003), por lo que sacan provecho al colonizar los sustratos, ya que pueden raspar el biofilm que se produce o bien en época lluviosa filtrar los sedimentos que acarrea el río, mientras permanecen en un sustrato estable sin ser arrastrados. Por otro lado, la baja abundancia de organismos como Corydalus sp. (Megaloptera: Corydalidae; únicamente dos registros) durante el muestreo, se puede deber a que esta larva prefiere los hábitat rápidos con presencia de canto rodado y roca y no es común registrarlos en ríos de cuencas bajas con fondo arenoso (Cover & Resh, 2007). Por lo que se puede tratar de un caso de arrastre por deriva, presencia de una pequeña población en el sector de Silencio donde se obtuvo el registro, o bien, que las larvas no son afines a los sustratos artificiales colocados. Mientras que la baja abundancia en Hemiptera pudo deberse a que estos organismos son nadadores activos y no suele aferrarse a un tipo de sustrato (Zettel, Nieser, & Polhemus, 1999).
La valores cercanos entre sí del índice de Shannon y de dominancia, dan a entender que las condiciones de hábitat son similatres en el tramo del río estudiado, por lo que no se observó familias y géneros en común entre los sitios de muestreo y sin dominancia de un organismo sobre otros. En ríos alterados por contaminación o modificación del cauce y ribera, suelen dominar organismos tolerantes a este tipo de modificaciones tales como el género Chironomus y la familia Hydrobiidae (Al-shami et al., 2011; Benetti, Perez-Bilbao, & Garrido, 2012).
Los sustratos artificiales compuestos de madera y hojas, a diferencia de las rocas fueron capaces de albergar una mayor abundancia de macroinvertebrados acuáticos en la cuenca baja del río Parismina. La preferencia de los organismos por los sustratos tipo madera y hojas, puede deberse a que su colonización por microorganismos como hongos, bacteria y algas (Cortes, Abelho, & Rebelo, 1996; Matt & Wallace, 1997). Estos conforman una capa que puede ser utilizada como fuente de alimento por algunos macroinvertebrados acuáticos raspadores, como por ejemplo, Farrodes sp., Callibaetis sp., Americabaetis sp. (Ephemeroptera), Heterelmis sp. (Coleoptera) e Hydrobiidae (Mollusca) (Ramírez & Gutiérrez-Fonseca, 2014), lo cual fomenta a su vez el establecimiento a posteriori de depredadores en el sustrato. La madera, además de la capa de biofilm, genera espacios que brindan refugio a los organismos contra depredadores de mayor tamaño y también por su superficie áspera provee soporte y evita el arrastre (Molokwu et al., 2014; Phillips & Phillips, 2011). Las hojas también fueron ampliamente colonizadas por distintos macroinvertebrados acuáticos que aprovechan los espacios que se originan y a la vez, son aprovechadas por organismos fragmentadores como Smicridea y Macronema (Trichoptera: Hydropsychidae) (Ramírez & Gutiérrez-Fonseca, 2014), como se observó en el análisis ACM.
El estudio realizado por Leite et al. (2015), empleó sustratos artificiales compuestos por hojas, madera, esponja Luffa, arcilla expandida y brácteas de pino y observaron que los sustratos compuestos de hojas y madera, presentaron una mayor riqueza y abundandancia en la colonización, ya que son sustratos típicos de los fondos de los ríos, que los macroinvertebrados suelen aprovechar. Por esta razón, es posible que, los macroinvertebrados en el río Parismina hayan presentado en ambos sustratos la mayor abundancia (por encima de las piedras). Sin embargo, a pesar de que el sustrato piedras presentó una menor abundancia y riqueza, en comparación con los otros dos, éste también genera espacios intersticiales, por lo tanto, es un hábitat disponible para que algunos macroinvertebrados acuáticos puedan colonizar (Duan et al., 2008). Se destaca que, el género Traverella (Leptophlebiidae), únicamente se registró en este tipo de sustrato. Este género es abundante en ríos con carga de sedimentos y con presencia de sustrato tipo canto rodado, y al ser un organismo filtrador, aprovecha los espacios intersticiales para protegerse y al mismo tiempo alimentarse (Flowers & de la Rosa, 2010; Quesada-Alvarado, 2014).
En estudios realizados por Hernández et al. (1998), Czerniawska-Kusza (2004) y Trama et al. (2009) utilizaron únicamente sustrato artificial tipo bloque de concreto y comparados con este estudio se obtuvo valores similares en cuanto a la riqueza de géneros utilizando los tres sustratos. Por otro lado, Kayode y Reubena (2006) utilizaron sustratos artificiales de grava y madera, siendo la grava la que presentó mayor riqueza. Por lo que, la preferencia hacia un sustrato puede depender de la composición de la comunidad o quizás el tipo de cuerpo de agua. Si bien en el presente estudio, no hallamos una fuerte asociación al sustrato piedra, recomendamos el uso del mismo con el propósito de registrar la mayor cantidad de organismos posibles. Sin embargo, cabe destacar que la desventaja de utilizar este tipo de material, es que debido a su peso precipita al lecho o al margen del río y se colmatan con los sedimentos finos que son transportados. Así, sugerimos colocarlos asegurando que éstos no toquen en el lecho, para que mantengan su funcionamiento.
Durante el estudio, se esperaba que las hojas fueran colonizadas principalmente por fragmentadores, la madera por raspadores y las piedras por filtradores. Sin embargo, se registró una mezcla de estos organismos en cada uno de los tres tipos de sustratos (Análisis de Correspondencia Multiple), debido a que cuentan por igual con espacios para refugio, capa de biofilm y soporte para evitar ser arrastrados. Siendo pocos organismos (los géneros Traverella, Polycentropus, Corydalus y Limnocoris) los que se registraron en un único tipo de sustrato.
Las diferencias entre organismos registrados por sitio, pueden deberse a la presencia y conformación del bosque de ribera, ya que, en el punto de muestreo Silencio se observa una mayor cantidad de árboles y arbustos en comparación con los otros sitios. Se ha documentado que esta condición suele favorecer una mayor riqueza y abundancia de organismos, debido a que les confiere hábitat para el estadio adulto de los macroinvertebrados acuáticos y sombra, para las larvas y ninfas que se encuentran en el cuerpo de agua (García & Jiménez, 2003; Arcos, 2006; Harvey, Casanoves, & León, 2006). Siendo esta una de las posibles razones, que evidencia la diferencia en cuanto a su riqueza y abundancia, entre los sitios Silencio y Quebrada Seca.
En resumen, nuestro estudio demostró que los tres sustratos artificiales en conjunto son efectivos, ya que logran albergar una alta riqueza de macroinvertebrados acuáticos y permiten registrar organismos en sitios que presentan condiciones adversas, o en aquellos donde no se puede caminar con facilidad por ambas márgenes. Por último, se recomienda siempre utilizar hojas y madera típicas de ribera y sin presencia de taninos, que eviten la colonización.
Declaración de ética: los autores declaran que están de acuerdo con esta publicación; que no existe conflicto de interés de ningún tipo; y que ha cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

