Introducción
La Isla del Coco es una isla oceánica situada en el Pacífico Tropical Oriental, aproximadamente a 530 km al suroeste de Puntarenas, Costa Rica, 970 km noroeste de Esmeraldas, Ecuador, a 1 176 km sureste de Tapachula, México y a 770 km noreste de las islas Galápagos. Es de origen tectónico- volcánico, posee un área de 24 km2 y su máxima altitud es el Cerro Iglesias (634 m.s.n.m.). Los grupos taxonómicos que integran la aracnofauna actualmente, parecen estar mayormente relacionados a la fauna de Centroamérica, Suramérica y Norteamérica, sin embargo, también existen relaciones faunísticas con las islas del Caribe y en menor grado con las islas Galápagos, a esto se suman las especies endémicas y las cosmopolitas de reciente introducción (Tabla 1).
TABLA 1 Relaciones biogeográficas de la fauna aracnológica de la Isla del Coco, Costa Rica. Algunas especies están representadas en varias zonas geográficas
| Categoría | Especies | Porcentaje |
| Cosmopolitas | 5 | 10 |
| Galápagos | 6 | 12 |
| Endémicas | 10 | 20 |
| Caribe | 11 | 22 |
| Norteamérica | 22 | 44 |
| Suramérica | 25 | 50 |
| Centroamérica | 27 | 54 |
Hogue & Miller (1981) hacen referencia a 22 expediciones a la Isla del Coco desde 1891 hasta 1980, en las que se recolectaron más de 24 000 especímenes de artrópodos, principalmente insectos, utilizando entre otros métodos las trampas de Malaise. Los especímenes de estas expediciones se depositaron principalmente en colecciones de Estados Unidos. Dichos autores, también tienen el mérito de haber publicado la primera lista de arácnidos de la isla, en la que citaron tres órdenes, nueve familias y 15 especies, de las cuales solo nueve eran especies correctamente descritas y publicadas (Hogue & Miller, 1981). Armas & Víquez (2014) publicaron una nueva lista con cinco órdenes, 15 familias y 21 especies. Montoya (2016), resumió la información publicada acerca de los arácnidos de la isla, principalmente destacando la información referente a las arañas, opiliones y la únicaespecie de escorpión presente en el lugar.
A la fecha, solo una fracción de la isla ha sido muestreada, durante periodos muy cortos y con pocos métodos de recolecta, esfuerzo que aún no ha sido suficiente para comprender cuál es la verdadera riqueza de especies y mucho menos la historia natural y evolutiva detrás de cada una de ellas. Las islas Galápagos, para ejemplificar un punto cercano a la Isla del Coco, tienen una aracnofauna que alcanza las 76 especies y de estas, 50 fueron descritas con el macho y la hembra correctamente asociados (un 65.7%) (Baert & Maelfait, 2000). En el caso de la Isla del Coco podemos enlistar 50 especies, de las cuales 24 (un 49%) poseen descripción del macho y la hembra (incluyendo las tres especies nuevas de este trabajo). Otro factor muy importante a considerar es que, en la lista de especies publicada por Hogue & Miller (1981) y Armas & Víquez (2014), no se listaba ninguna especie cosmopolita, pero sí algunas especies de amplio rango de distribución como Eriophora edax o Gasteracantha cancriformis (Araneidae). Sin embargo, en la lista que se incluye en este trabajo, ya se registran cinco especies sinantrópicas y cosmopolitas, que posiblemente son de reciente introducción en la isla. En el otro extremo, están las especies raras o de dudosa ubicación taxonómica: por ejemplo, Lycosa sp. (Lycosidae), identificada a nivel de morfoespecie en otros trabajos, debería ser fácil de encontrar en la isla ya que esta familia suele ser muy abundante en sus sitios de distribución, pero a la fecha no se han encontrado especímenes, por lo que el registro para esta familia permanece dudoso. Otros casos interesantes los constituyen Anyphaenoides cocos (Anyphaenidae) y Neotama sp (Hersiliidae), en ambos casos los registros son antiguos, pero a la fecha no ha sido posible recolectar nuevos especímenes; en el caso de la segunda especie, al menos se poseen fotografías recientes que confirman su presencia actual en la isla.
Debido a que el trabajo de inventario de arácnidos de la isla aun no llega a integrar la fauna total y el conocimiento que se posee sobre los arácnidos de la Isla del Coco, el presente trabajo tiene como objetivo seguir avanzando en el desarrollo de este conocimiento, en este caso con la descripción de tres especies endémicas de la isla y 50 registros de especies en total.
Materiales y métodos
El material estudiado se recolectó durante dos expediciones, llevadas a cabo del 11 al 22 de abril 2013 y la segunda del 8 al 18 julio 2017. Ambas expediciones contaron con la autorización de investigación por parte del Sistema Nacional de Áreas de Conservación (SINAC) con las resoluciones R-ACMIC-I-2013-01, R-ACMIC-I-2013-02 y 12-2017-I-ACMC. Los métodos de recolecta utilizados incluyeron embudos de Berlese, golpe de vegetación, luz ultravioleta y recolecta manual activa tanto diurna como nocturna.
Las muestras se conservaron en etanol en concentraciones de 80% y 95% y fueron depositadas en la Colección de Arácnidos y Miriápodos Neotropicales (CoAMiN), ubicada en Llorente de Flores, Heredia y en la colección Aracnológica del Museo Nacional de Costa Rica (MNCR-Ar), ubicada en Santo Domingo de Heredia. Las medidas corporales se tomaron con un “calibrador digital marca Mitutoyo, Absolute Digimatic, CD-4” CS, y un micrómetro ocular acoplado a un estéreo-microscopio marca Olympus SZ45; todas las medidas se presentan en milímetros (mm). Los genitales fueron aclarados con KOH al 20% para permitir la observación de las estructuras internas. Las imágenes digitales se hicieron con un estereomicroscopio marca Olympus SZ45 adaptado a una cámara digital Olympus OM-D E-M5. Las imágenes de foco compuesto se digitalizaron con el software Adobe Photoshop CC 2015 en la modalidad de “photomerge”. Los rangos de distribución, están basadas en el catálogo de arañas del mundo (World Spider Catalog, 2019), las identificación realizadas, se respaldan en la literatura específica citada para cada caso y las sugerencias biogeográficas presentadas de los grupos o especies tratadas, surgen del análisis de los patrones de distribución general que presenta el género o grupo citado. Se utilizan las siguientes abreviaturas para el estudio de especímenes, m= macho; f= hembra; j-juvenil; A= ancho y L= longitud.
Resultados
Lista comentada de las especies de arácnidos de la Isla del Coco.
Orden Araneae (Arañas)
Familia Anyphaenidae Bertkau, 1878
Anyphaenoides cocosBaert, 1995 (m)
El género Anyphaenoides Berland, 1913, posee 20 especies y es un género de distribución principalmente sudamericana, con su límite norte en Panamá; también han sido descritas tres especies en las Islas Galápagos. A. cocos, fue recolectada en Bahía Chatham en marzo de 1964, el espécimen macho holotipo está depositado en el museo de historia natural de Los Ángeles County. Es una especie de talla mediana (5 mm), de coloración (en alcohol) crema o café claro (Baert, 1995). Es endémica de la isla y no se conoce la hembra. Hasta la fecha este ejemplar estudiado por Baert es el único conocido.
Sillus sp. (h)
Este género de arañas está distribuido desde México hasta Brasil, se han descrito diez especies. Son arañas de talla mediana, entre 4 y 5.70 mm de longitud. De patas alargadas y con pocos pelos, el abdomen alargado y de forma ovalada (Brescovit, 1997). Se han estudiado dos hembras de este género que aún no han sido identificadas a especie (CoAMiN).
Familia Araneidae Clerck, 1757
Las arañas de esta familia son tejedores de redes orbiculares y en la isla fue observado el parasitismo por la avispa Sceliphron assimile (Sphecidae), la cual posiblemente es una especie introducida. La avispa fabrica nidos de barro formados por filas de celdas, en cada una de ellas deposita una araña. Fue posible recolectar algunos de estos nidos, en los cuales se hallaron principalmente las especies Eriophora edax y Eustala sp.

Fig. 1 Fotografías de especies de arácnidos de la Isla del Coco. A) hembra de Eriophora edax; B) hembra de Gasteracantha cancriformis; C) hembra de Neotama sp. (fotografía por Guillermo Blanco); D) hembra de Menemerus bivittatus; E) hembra Leucauge argéntea; F) hembra Chrysso sp.
Eriophora edax(Blackwall, 1863) (h) (Fig. 1A)
Es una araña de amplia distribución desde E.U.A. hasta Brasil. Es un registro que proviene de los primeros trabajos sobre la isla. La especie ha sido bien estudiada por varios autores, sin embargo, solo se posee un ejemplar hembra adulto para estudio (CoAMiN). La coloración de los especímenes (juveniles) estudiados de la isla es café-rojiza, con los fémures de coloración rojo más intenso, en general su coloración varia considerablemente a la descrita por Levi (1971).
Eustala sp. (m, h)
Con 86 especies descritas, Eustala Simón, 1895, es un género de arañas tejedoras de amplia distribución, abarcando toda América y el Caribe. Se han examinado cuatro machos y nueve hembras (CoAMiN), de lo que posiblemente represente una nueva especie, la compleja identificación de estas arañas no es un hecho único para estos especímenes, por ejemplo, Baert (2014), describió tres nuevas especies de las Islas Galápagos, que debido a la complejidad del grupo habían sido históricamente mal identificadas y que es hasta ese trabajo que se descubre que se trataba de un complejo de tres especies.
Gasteracantha cancriformis(Linnaeus, 1758) (m, h) (Fig. 1B)
Arañas tejedoras de amplia distribución, abarcando toda América y el Caribe, conocida con el nombre común de “araña panadera”, el cual está dado por la forma abultada de su abdomen y su parecido con las bolsas o sacos de pan que se acarreaban a hombros en épocas pasadas. Esta especie fue una de las primeras citas para la isla, incluso Banks (1905), describió una nueva especie (Gasteracantha biolleyi) como endémica de la isla, basado principalmente en las diferencias existentes entre la forma, largo y curvatura de las espinas del abdomen de la hembra. Esa especie posteriormente fue considerada como sinónimo de G. cancriformis. Se han examinado un espécimen macho y dos hembras (CoAMiN).
Familia Ctenidae Keyserling,1877
Spinoctenus ginae n. sp. (Fig. 2)
Datos del tipo:Costa Rica: Isla del Coco: Macho holotipo (CoAMiN), cercanías de la estación hidroeléctrica (represa) Río Genio (5º 32’ 30.717”N -87º 3’ 19.7064”W); 24 m s.n.m.), 13 de julio, 2017, C. Víquez. Paratipos: dos hembras, un macho (CoAMiN), iguales datos que el holotipo.

Fig. 2 Spinoctenus ginae n. sp. A-D) Macho A) bulbo; B) bulbo lateral, nótese la iridiscencia; C) espinación tarso IV; D) ejemplar vivo, vista dorsal. E-H) hembra E) epigino; F) espermatecas; G y H) ejemplar vivo, nótese la iridiscencia (H).
Distribución: Solo se conoce de la localidad tipo (Fig. 9).
Etimología: El nombre específico es un matronímico en honor a la esposa del autor, Gina Marcela Chaves Sancho.
Spinoctenus ginae n. sp. es el primer registro del género para Centroamérica, Costa Rica y la Isla del Coco, es la especie número 12 de este género en describirse. En la descripción se sigue a Hazzi, Polotow, Brescovit, González-Obando & Simó (2018).
Diagnosis: Los machos de Spinoctenus ginae sp.n. se parecen a los de S. chocoensis, S. escalerete y S. pericos por la forma recta del émbolo, pero difieren por la forma que presenta el émbolo en vista ventral del bulbo y por el patrón de espinación en el metatarso IV (Fig. 2A, Fig. 2B, Fig. 2C). Las hembras se diferencian de las demás especies por la combinación de la forma de las espermatecas (Fig. 2E, Fig. 2F) y la existencia de un área estrecha a manera de una banda, poco esclerotizada, que une el sector medio con el área posterior y anterior del epigino.
Macho holotipo: Largo del caparazón 9.50; ancho 7.90; longitud del abdomen 7.30, ancho 4.50. longitud total 16.80. Caparazón marrón con una línea media longitudinal de color amarillo o blanco, estos pelos amarillentos vistos al estereomicroscopio son de color dorado brillante y también pueden encontrarse en otras partes del cuerpo, principalmente en la patas. Presenta iridiscencia en quelíceros y pedipalpos la cual se produce en la cutícula (Fig. 2B, Fig. 2G). Ojos rodeados de coloración negra; Ranura torácica longitudinal, de color negro, ubicada en la parte más alta del cefalotórax. Ojos redondos, con fondo de color amarillo. Quelíceros de color marrón, con tres dientes promarginales, cuatro dientes de tamaño similar y tres dientes pequeños en el retromargen. Tarso con dos uñas con un número variable de dientes (entre tres y siete). Abdomen ovalado, coloración mayormente dorada con la parte anterior más oscura, vientre marrón con una figura en línea semicuadrada de color negra entre los pulmones. Con un área clara de forma triangular con su ápice en la base de las hileras, toda esta área presenta manchas pequeñas de coloración negra sin un patrón u orden definido.
Palpo: RTA apical curvada dorsalmente, recta ventralmente, cercana al cimbio (Fig. 2A, Fig. 2B) con un pequeño lóbulo esclerotizado redondeado en su base. Cimbio alargado, puntiagudo. Tegulum grande y redondeado con una proyección alargada en la base; apófisis media de forma semirectangular, redondeada en los bordes, curva hacia el interior del bulbo, semi traslúcida; embolo con su borde anterior recto, formando un ángulo casi de 90° con su borde interno con una protuberancia interna grande de forma triangular; conductor membranoso, enrollado en forma de “C”, de coloración blanquecina nacarada.
Patas:Fórmula: 4123; I: fémur 9.10 / patela 4.40 / tibia 9.80 / metatarso 8.60 / tarso 3.60 / total 35.50; II: fémur 9.60 / patela 4.60 / tibia 8.65 / metatarso 8.35 / tarso 2.86 / total 34.06; III: fémur 8.56 / patela 3.89 / tibia 7.71 / metatarso 7.59 / tarso 2.41 / total 30.16; IV: fémur 10.99 / patela 4.76 / tibia 9.86 / metatarso 12.05 / tarso 3.55 / total 41.21.
Hembra: Largo del caparazón 11.20; ancho 8.66; largo del abdomen 12.56, ancho 8.01. largo total 23.76. Coloración y aspecto general como en el macho excepto que los ojos laterales anteriores son semiovales. Además, los quelíceros, pedipalpos y patas de coloración más oscura. El área ventral de forma triangular en el abdomen es menos marcada y las manchas negras están esparcidas dentro y fuera de ella. Dorsalmente el abdomen es más manchado de negro y presenta un área oscura anteriormente.
La placa epiginal consiste en un sector medio que forma un surco entre dos lóbulos laterales, el área mediana anterior de forma oval y el área media posterior de forma triangular, ambas escavadas, los lóbulos son muy delgados anteriormente y muy gruesos posteriormente, con una espuela de forma triangular ubicada medialmente en su borde lateral; aberturas copulatorias en forma de bolsas laterales; conductos copulatorios grandes y fuertemente esclerotizados; espermatecas grandes, semitraslúcidas, con gránulos ubicados en su borde anterior, ductos de fertilización basales (Fig. 2E, Fig. 2F).
Patas:Fórmula: 4123; I: fémur9.26 / patela 4.77 / tibia 9.20 / metatarso 7.64 / tarso 3.05 / total 33.92; II: fémur 8.77 / patela 4.88 / tibia 8.40 / metatarso 7.45 / tarso 2.57 / total 32.07; III: fémur 8.17 / patela 3.90 / tibia 6.78 / metatarso 6.57 / tarso 2.42 / total 27.84; IV: fémur 10.22 / patela 4.06 / tibia 9.09 / metatarso 11.32 / tarso 2.71 / total 37.40.
Historia natural: Son arañas errantes que deambulan en el suelo de la isla o sobre la vegetación del sotobosque, a todo lo largo y alto de la isla (en los sitios visitados). Es activa principalmente durante la noche. Es la única especie de la familia que ha sido encontrada en la isla. Heteropoda venatoria (Linnaeus, 1767) (Sparassidae), podría considerarse su competidor más cercano en captura de presas, ya que ambas arañas son errantes y de similar tamaño (las más grandes de la isla), aunque esta última prefiere utilizar la vegetación y principalmente lugares antropizados. Una hembra paratipo estudiada mostraba un tapón epiginal que cubría la abertura copulatoria derecha, este hecho no había sido descrito anteriormente para el género (Fig. 2E).
Familia Dipluridae Simon,1889
Masteria angienae n. sp. (Fig. 3).
Datos del tipo:Costa Rica: Isla del Coco: Macho holotipo (CoAMiN), cercanías de la estación en Bahía Chatham (5°32’ 52.7”N -87° 02’ 35.4W”; 13 m s.n.m.), 13 de julio, 2017, C. Víquez. Paratipos: cuatro hembras (CoAMiN).
Distribución: Solo se conoce de la localidad tipo (Fig. 9).

Fig. 3 Masteria angienae n. sp. A-C) macho A) Vista dorsal; B) bulbo; C) proceso prolateral. D-G) hembra D) vista dorsal; E) espermatecas; F) tela; G) ejemplar vivo.
Etimología: El nombre específico es un matronímico en honor a la hija mayor del autor, Angie Pamela Víquez Chaves.
Masteria angienae n. sp. es el primer registro de una araña migalomorfa para la Isla del Coco y la segunda especie reportada para Costa Rica del género Masteria. Para la descripción se sigue a Passanha & Brescovit (2018).
Diagnosis: Los machos de Masteria angienae sp.n. se diferencia de todas las otras especies del género por la constitución del proceso prolateral de la tibia I (Fig. 3C). Las hembras se diferencian de las demás especies por poseer una espermateca bilobulada, la forma y tamaño de los lóbulos y porque el lóbulo ectal está conectado al lóbulo ental (Fig. 3E).
Macho holotipo: Largo del caparazón 2.60; ancho 1.90; largo del abdomen 3.00, ancho 1.80. largo total 5.60. Seis ojos, línea posterior recurva, ojos anteriores medianos (AME) ausentes. Quelíceros con 11 dientes prolaterales y un grupo de 16 dientes muy pequeños ubicados basalmente en el margen retrolateral. Uñas de las patas con entre tres y cinco dientes. Tibia I: P1 ausente, P2 con una espina fuerte apical, recta y más gruesa que P3; P3 con una espina apical más larga y curva hacia P2 (Fig. 3C); área retrolateral sin ninguna estructura, metatarso I sin ninguna estructura accesoria, solo se observan tres placas esclerotizadas en la superficie de la cutícula.
Palpo: Cimbio dos veces más largo que ancho, con cuatro espinas apicales, con un pequeño lóbulo basal prolateral, con una pequeña área esclerotizada justo encima de este. Otra espina retrolateral, ubicada subapicalmente. Bulbo piriforme con tegulum oval, émbolo tan largo como el tegulum, estrechándose y curvándose distalmente (Fig. 3B). Coloración general blanca-amarillenta, un poco más oscura en el caparazón.
Patas:Fórmula: 4132; I: fémur 2.50 / patela 1.30 / tibia 2.00 / metatarso 1.60 / tarso 1.40 / total 8.50; II: fémur 1.90 / patela 0.90 / tibia 1.20 / metatarso 1.30 / tarso 1.10/ total 6.40; III: fémur 2.00 / patela 0.90 / tibia 1.30 / metatarso 1.40 / tarso 1.00 / total 6.60; IV: fémur 2.30 / patela 0.90 / tibia 2.20 / metatarso 1.90 / tarso 1.40 / total 8.70.
Hembra: Largo del caparazón 3.10; ancho 2.30; largo del abdomen 3.00, ancho 1.80. largo total 6.10. Características general y coloración como en el macho. Quelíceros con 11 dientes prolaterales y un grupo de 20 dientes muy pequeños ubicados basalmente en el margen retrolateral. Uñas de las patas con entre siete y diez dientes, palpo con 16.
Espermatecas bilobuladas, lóbulo ental más alto, curvo, tubular, apicalmente globoso, región glandular ubicada basalmente, conectado al lóbulo externo, con conducto delgado, ápicegloboso (Fig. 3E).
Patas:Fórmula: 4123; I: fémur2.30 / patela 1.20 / tibia 1.80 / metatarso 1.50 / tarso 0.90 / total 7.70; II: fémur 2.00 / patela 1.00 / tibia 1.90 / metatarso 1.40 / tarso 0.90 / total 7.20; III: fémur 1.70 / patela 0.90 / tibia 1.20 / metatarso 1.50 / tarso 1.00 / total 6.30; IV: fémur 2.70 / patela 1.10 / tibia 1.90 / metatarso 2.20 / tarso 1.30 / total 9.20.
Historia natural: Una de las hembras fue recolectada con un saco de huevos, el cual contenía 17 arañitas en primer estadio y un huevo sin fertilizaro dañado de coloración negruzca. Todas las arañas fueron recolectadas en pequeñas cavidades entre piedras en el suelo, estas eran utilizadas o construidas por cangrejos (Decapoda). Son de movimientos rápidos y suelen desaparecer rápidamente entre los detritos del suelo. La figura 3F ilustra la coloración de un adulto vivo.
Familia Gnaphosidae Pocock, 1898
Lygromma nicolae n. sp. (Fig. 4)
Datos del tipo: Costa Rica: Isla del Coco: Macho holotipo, cercanías de la estación en Bahía Chatham (5° 32’ 52.7”N-87° 02’ 35.4W”; 13 m s.n.m.), 13 de julio, 2017, C. Víquez. Paratipos: un macho y cuatro hembras (CoAMiN).
Distribución: Solo se conoce de la localidad tipo (Fig. 9).
Etimología: El nombre específico es un matronímico en honor a la hija menor del autor, Nicole Angélica Víquez Chaves.
Diagnosis: Los machos de Lygromma nicolae n.sp. se parecen a los de L.gertschi Platnick y Shadab, 1976, L anopsPeck & Shear, 1987 y L. ybyguara Rheims y Brescovit, 2004 por sus troglomorfías, en especial la ausencia de ojos funcionales (Fig. 4A, Fig. 4H), pero se diferencia de L. gertschi, por la presencia de dientes en las uñas tarsales (machos y hembras), L. anops, por la forma de las apófisis retrolateral de la tibia y la apófisis media y de L. ybyguara por presentar dos apófisis retrolaterales en la tibia (Fig. 4B). Las hembras de L. ybyguara no se conocen y de L. anops por la presencia de un par de manchas blanquecinas, como ojos vestigiales ubicadas anteriormente.
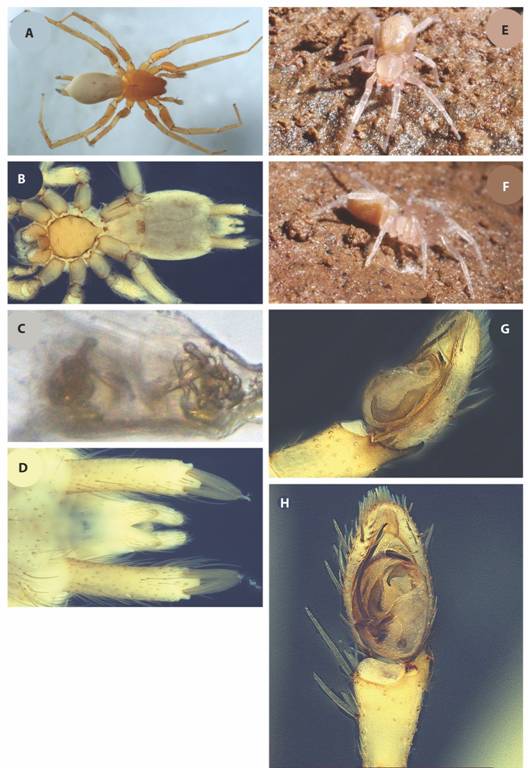
Fig. 4 Lygromma nicolae n. sp. A-F) hembra A) vista dorsal; B) vista ventral; C) espermatecas; D) hileras; G-F) ejemplar vivo. G-H) macho G) bulbo lateral; H) bulbo ventral.
Macho: Subadultos despigmentados de mayor manera, algunos especímenes presentan cierta coloración amarillenta homogénea en el cuerpo, excepto por el abdomen que siempre es despigmentado. En algunas fotografías (Fig. 4E, Fig. 4F) se aprecia iridiscencia en algunas partes del cuerpo, sin embargo, en la observación al microestereoscopio no se encontraron setas iridiscentes. Longitud total 4.30. Abdomen 2.40 de largo, 1.30 ancho; caparazón 1.90 de largo, 1.50 de ancho. Ojos ausentes, aunque se puede observar un par de manchas blanquecinas como ojos vestigiales ubicadas anteriormente, caparazón de apariencia granulosa, con escasas setas. Quelíceros con seis dentículos en fila promarginal, tres basales de mayor tamaño y tres distales de menor tamaño, retromargen con un solo diente medial pequeño. Una seta promarginal larga y curva, otra más pequeña retrolateralmente, también existen tres líneas de setas modificadas longitudinalmente alineadas al margen de los dentículos promarginales, también se aprecia una estructura independiente, liriforme compuesta de cinco setas curvas modificadas y de mayor longitud que las anteriores. Por su parte el lado retrolateral del quelícero se muestra basal y medialmente una serie de tubérculos espiniformes y una estructura liriforme adicional compuesta por cinco setas delgadas, largas y plumosas ubicada medialmente.
Patas:Fórmula: 4123; I: fémur 1.70 / patela 0.70 / tibia 1.60 / metatarso 1.40 / tarso 1.20 / total 6.60; II: fémur 1.50 / patela 0.70 / tibia 1.20 / metatarso 1.20 / tarso 1.10 / total 5.70; III: fémur 1.40 / patela 0.70 / tibia 1.10 / metatarso 1.10 / tarso 1.10 / total 5.40; IV: fémur 1.90 / patela 0.90 / tibia 1.60 / metatarso 1.60 / tarso 1.30 / total 7.30; espinación: I: fémur: d1-1-0, p0-1-1; tibia, r0-0-1, v2-1-1; metatarso: r2-0-0; II: fémur: d1-1-0, r0-1-1; tibia, v1-1-0, metatarso: v2-0-0; III: fémur: d1-1-3; tibia, d0-1-0, v2-2-1, r1-1-0, p1-0-1; metatarso: d0-1-0, v0-2-1, r0-1-0, p0-1-2; IV: fémur: d1-1-1, r0-0-1, p0-0-1; tibia, d0-1-0, v1-1-1, r1-0-0, p1-0-0; metatarso: v1-1-0, r1-2-0, p1-1-0.
Palpo: Con dos apófisis retrolaterales fusionadas en su base, la de menor tamaño y de forma sigmoide. Embolus curvado hacia el margen del tegulum, largo y robusto, insertado en el lado retrolateral del tegulum. Apófisis mediana subapical y en forma de garra, más ancha en su base y aguda en su extremo. Conductor presente, traslúcido (Fig. 4G, Fig. 4H). Uñas en patas I y II con dientes largos, III y IV cortos.
Hembra: Coloración igual que en el macho. Longitud total 5.60. Abdomen 3.20 de largo, 1.90 ancho; caparazón 2.40 de largo, 1.80 de ancho. Ojos y caparazón igual que en el macho. Quelíceros con seis dentículos en fila promarginal, uno basal de menor tamaño los demás de mayor tamaño, retromargen con un solo diente medial pequeño. Setas igual que en el macho, pero la estructura liriforme retrolateral está compuesta por 12 setas delgadas, largas y plumosas ubicada subbasalmente.
Patas:Fórmula: 4123; I: fémur 1.90 / patela 0.90 / tibia 1.80 / metatarso 1.40 / tarso 1.30 / total 7.30; II: fémur 1.60 / patela 0.80 / tibia 1.30 / metatarso 1.30 / tarso 1.10 / total 6.10; III: fémur 1.60 / patela 0.80 / tibia 1.30 / metatarso 1.30 / tarso 1.10 / total 6.10; IV: fémur 2.20 / patela 1.00 / tibia 2.00 / metatarso 1.90 / tarso 1.50 / total 8.60; espinación (se anota solo las diferentes que en el macho): I: fémur: r0-0-1; tibia, r0-0-0, v2-2-0; metatarso: r0-0-0, v0-2-1; II: fémur: r0-0-1; tibia, v2-2-0; III: metatarso: v0-2-2, r0-2-0; IV:; tibia, v2-2-2, r1-1-1, p1-0-1; metatarso: v2-1-0, r0-2-0, p1-1-2. Epigino en vista ventral esclerotizado, con ángulo posterior recto y bordes laterales inclinados divergiendo en la región anterior del epigino, ductos copulatorios semi visibles por transparencia expandiéndose en la parte anterior hacia los lados, dos aberturas pequeñas esclerotizadas ubicadas medialmente (Fig. 4C). Internamente (dorsal), con espermatecas orientadas antereroventralmente, pequeñas y globosas, ligadas a duetos copulatorios estrechos que se enrolladan de forma compleja (Fig. 4C). Uñas en patas I y II con dientes largos, III y IV cortos.
Variación: De los especímenes examinados, los dos machos son muy semejantes en longitud, donde el abdomen es el que determina la variación. En el caso de las hembras también el abdomen determina la longitud total, sin embargo, solamente una hembra paratipo presentó un tamaño adulto donde había diferencia notable en el largo del caparazón (Tabla 2).
TABLA 2 Variación en longitud y ancho de Lygromma nicolae sp. n., de la Isla del Coco, Costa Rica
| Caracteres | ♂♂ | ♀♀ (paratipos) | ||||
| Holotipo | Paratipo | 1 | 2 | 3 | 4 | |
| L total | 4.10 | 4.30 | 5.60 | 5.70 | 5.10 | 4.20 |
| Caparazón, L/A | 1.90/1.50 | 1.90/1.50 | 2.40/1.80 | 2.40/1.80 | 2.40/1.80 | 1.70/1.40 |
| Abdomen, L/A | 2.20/1.30 | 2.40/1.30 | 3.20/1.90 | 3.30/1.90 | 2.70/1.70 | 2.50/1.50 |
Historia natural: Las arañas fueron encontradas escavando alrededor de dos metros cuadrados de terreno, siguiendo pequeñas cavidades que se formaban entre rocas y que eran usadas por cangrejos terrestres (Decapoda). Se encontraron junto con Surazomus antonioi y Oonopoides cartago. Los animales edafobitos son aquellos animales que viven en la hojarasca y que a menudo son despigmentados y sin ojos, en el caso de las Islas Galapagos, se han citado varias especies, que como la especie aquí descrita, presentan estas condiciones, Lygroma anops, una Metagonia (Phocidae), un Pisauridae, un Theridiidae, dos especies de Pseudoscorpiones y un Opilión de la familia Gonyleptidae (Peck & Finston, 1993; Peck & Shear, 1987).
Familia Hersiliidae Thorell, 1870
Neotama sp.
En América es un género de amplia distribución desde E.U.A. hasta Brasil. Originalmente citada de la isla como Tama sp. Son arañas que pueden variar de coloración según el sustrato donde viven y muestran un camuflaje casi perfecto, se reconocen fácilmente por poseer dos hileras extremadamente largas. Gracias a una fotografía confiable del guardaparques Guillermo Blanco, se puede asegurar su presencia en la isla. En este caso, la fotografía (Fig. 1C) fue tomada el 20 de agosto del 2015, en una roca cercana a la estación Chatham, en la roca había dos hembras de similar tamaño (Guillermo Blanco, com. pers). No se han encontrado más especímenes de esta araña.
Familia Linyphiidae Blackwall, 1859
Agynetasp.
De amplia distribución a nivel mundial y está representado por 197 especies, sin embargo, este registro es el primero para Costa Rica y el segundo para Centroamérica, la otra especie conocida para el género es Agyneta plagiata (Banks, 1929) de Panamá. Un macho y una hembra examinados. (CoAMiN).
Familia Lycosidae Sundevall, 1833
Lycosa sp.
Actualmente el género Lycosa está compuesto por 224 especies, distribuidas ampliamente a nivel mundial; a nivel centroamericano están reportadas 11 especies (Víquez & Longhorn, 2019). El registro de este género para la isla es antiguo, sin embargo, podría tratarse de un error de identificación. Generalmente los individuos de la familia Lycosidae son confundidos con otras familias similares como Ctenidae, además, en las localidades donde existen son abundantes. Banks (1902), en su revisión de arácnidos de las Galápagos identificó tres especies de Lycosa, de las cuales anotó que eran abundantes, sin embargo hoy en día todas han sido colocadas en otro género (Hogna Simon, 1885). Por otro lado este mismo autor (1905), quien revisó el material colectado por la expedición Hopkins-Stanford Galapagos Expedition, anota sobre los especímenes que identifica como Lycosa “Muchos especímenes juveniles, (pag. 21)”. A la fecha no ha sido posible encontrar ningún individuo de esta familia en la isla.
Familia Mysmenidae Petrunkevitch,1928
Microdipoena guttataBanks, 1895
Con tan solo 16 especies a nivel mundial, M. guttata es la única especie reportada para Centroamérica. Es de talla muy pequeña llegando a alcanzar un milímetro de longitud. M. guttata, está distribuida desde E.U.A. hasta Paraguay y el Caribe. El registro para la isla fue citado por Baert (1984), y la recolecta fue realizada por S. Jacquemart en octubre de 1978 y se encuentra depositado en el Museo de Historia Natural de Ginebra, Suiza. No hay especímenes recolectados en las colecciones estudiadas.
Mysmenopsis sp. (m, h)
Al igual que el género anterior son arañas de talla muy pequeña, se han descrito 31 especies, desde E.U.A. hasta Brasil y el Caribe, en Centroamérica, se han descrito tres especies en Panamá y una en Costa Rica. Dos hembras y dos machos han sido estudiados (CoAMiN).
Familia Ochyroceratidae Fage,1912
Speocera sp.(h)
Un género compuesto por 52 especies, de las cuales diez están distribuidas en América y una en el Caribe. Este registro representa el primero para Centroamérica. Son arañas de talla pequeña de aproximadamente un milímetro de longitud, viven entre la hojarasca del bosque y fabrican telas de forma irregular. Se han estudiado cinco hembras (CoAMiN).
Familia Oecobiidae Blackwall, 1862
Oecobius concinnus Simon, 1893(m, h)
Una especie sinantrópica, la primera de cinco, de hábitos cosmopolitas, junto con O.eberhardi Santos & Gonzaga, 2008 son los únicos representantes del género en la región Centroamericana, la segunda, además, es endémica de Costa Rica. De esta especie se conoce la introducción a otros archipiélagos a nivel mundial como Seychelles, Laos y Japón. En el caso de la Isla del Coco, la especie es abundante en gritas y orificios en las paredes y ventanas de la estación en bahía Chatham. Se estudiaron cinco machos y 13 hembras (CoAMiN).
Familia Oonopidae Simón, 1890
Ischnothyreus peltifer(Simon, 1892) (h)
La especie es originaria de Asia tropical, pero ha sido introducida en múltiples territorios a nivel mundial al igual que a la isla. Habita en la hojarasca y es de talla pequeña llegando a alcanzar cerca de dos milímetros de longitud. Solo una hembra ha sido estudiada (CoAMiN).
OonopoidescartagoPlatnick & Berniker,
2013 (m, h)
Araña de talla pequeña, 1.53 mm de longitud, es una especie que se encuentra en Costa Rica y Panamá. En la isla fue recolectada por primera vez en mayo del 2002 (Platnick & Berniker, 2013) en Cerro Pelón. Se estudiaron dos machos (CoAMiN).
OpopaeadeserticolaSimon, 1892 (m, h)
Araña de talla pequeña, 1.25 mm de longitud, con una amplia distribución, se cree que es originaria del Viejo Mundo y que todas las poblaciones en América son introducidas (Platnick & Dupérré, 2009). En la isla fue recolectada por primera vez en marzo del 2002 en Bahía Wafer a través de trampas amarillas (Platnick & Dupérré, 2009).
ReductoonopsnaciPlatnick & Berniker, 2014 (m, h)
Araña de talla pequeña, 0.97 mm de longitud, se distribuye en Costa Rica y Panamá. En Costa Rica con amplia distribución, en la isla fue recolectada por primera vez en abril del 2013 (Platnick & Berniker, 2014).
Familia Pholcidae C. L. Koch, 1850
Modisimus cocoHuber, 1998 (Fig. 5D, Fig. 5E, Fig. 5F)
Datos del tipo:Costa Rica: Isla del Coco: Macho holotipo (MNCR-Ar), Bahia Wafer, al nivel del mar, mayo de 1994. Recolectado por Yolanda Camacho.
Distribución: Solo se conoce de la localidad tipo (Fig. 9).
La especie fue descrita únicamente con el macho, por lo que se aportan algunos detalles adicionales a la descripción original y se describe la hembra.
Coloración: La descripción original cita un espécimen con mayor tiempo de permanencia en alcohol, de colores más amarillentos. En los especímenes vivos (macho y hembra) la coloración es verde brillante (Fig. 5F). Los ojos son de coloración negra, el prosoma y opistosoma en su mayoría de color blanco -verduzco, el prosoma presenta manchas de coloración morada sin patrones definidos. El abdomen presenta dos líneas de manchas blancas longitudinales, en la hembra son cuatro de mayor tamaño ubicadas anteriormente y en el macho son ocho de forma más alargada y delgada, los pedipalpos del macho son de coloración amarillenta. Patas del mismo color, sin anillos, las patelas café rojizas.
Epigino con una protuberancia grande expandiéndose posteriormente, con un par de marcas oscuras en la parte central (Fig. 5D, Fig. 5E). Mediciones de la hembra: Longitud total: 2.90, longitud del prosoma: 0.90, anchura: 1.00, longitud del opistosoma: 2 .00; anchura: 1.10. Patas: I: fémur 5.80 / patela 0.30 / tibia 5.60 / metatarso 9.80 / tarso 2.10 / total 23.60; II: fémur 4.30 / patela 0.30 / tibia 4.00 / metatarso 5.90 / tarso 1.40 / total 11.30; III: fémur 3.50 / patela 0.30 / tibia 4.00 / metatarso 4.30 / tarso 1.00 / total 13.10; IV: fémur 4.00 / patela 0.30 / tibia 3.40 / metatarso 5.20 / tarso 1.00 / total 13.90.
Material examinado: Se examinó un macho y cuatro hembras (CoAMiN).
Historia natural: Estas arañas viven en redes cuya característica dominante es que poseen una especie de lámina de seda con forma de cúpula. Los especímenes estudiados fueron recolectados en la zona de las anonas, al inicio de bahía Wafer.
Physocyclusglobosus(Taczanowski, 1874) (h)
La segunda especie sinantrópica y cosmopolita de la isla, según Valdez-Mondragón (2010), esta especie ha sido introducida ampliamente en los trópicos del mundo, en la isla, al igual que en otros sitios, estas arañas viven asociadas a las viviendas humanas, generalmente fabrica sus telas en las esquinas de techos, ventanas, debajo de muebles, en general buscando un lugar con poca luz y perturbaciones. Se examinó una hembra (CoAMiN).
Familia Salticidae Blackwall, 1841
Género indeterminado sp. 1 (h) (CoAMiN).
Género indeterminado sp. 2 (h) (CoAMiN).
Género indeterminado sp. 3 (h) (CoAMiN).
Menemerus bivittatus(Dufour, 1831)
(Fig. 1D).
Es una especie sinantrópica y cosmopolita de amplia distribución en el mundo (Prószyński, 2016). En la isla es fácilmente observable cazando en las paredes de los edificios en Bahía Wafer. Se examinaron una hembra y un macho (CoAMiN).
Familia Scytodidae Blackwall,1864
Scytodes fuscaWalckenaer, 1837 (h)
A esta familia de arañas se les conoce como “arañas escupidoras”, por la forma en que capturan sus presas. S. fusca es una especie sinantrópica y cosmopolita, de tamaño mediano y patas cortas, puede llegar a alcanzar hasta seis milímetros de longitud, son de coloración café-rojiza oscura. De distribución pantropical, en el caso de la isla, fueron encontrados múltiples especímenes en las paredes de la casa en estación Chatham, donde fabricaban sus telas entre las rendijas de las tablas. Se examinaron dos hembras (CoAMiN).
Familia Sparassidae Bertkau, 1872
Heteropoda venatoria(Linnaeus, 1767) (m, h)
Conocida como “araña cangrejo gigante”, es una especie de gran tamaño (30 mm), introducida desde Asia tropical, tiene una gran capacidad de dispersión y es frecuente en navíos en toda las regiones calientes del planeta y actualmente es considerada una especie pantropical (Taucare-Ríos, & Brescovit, 2011). Junto con Spinoctenus ginae, sp. n. son las arañas de mayor tamaño que se pueden encontrar en la isla. H. venatoria es abundante y suele estar asociadas a plantas con hojas anchas, principalmente musáceas, son nocturnas y durante el día permanecen ocultas en rendijas u hojas enrolladas. Las hembras cargan los sacos de huevos entre los quelíceros, estos sacos tienen forma de plato aplanados y suelen ser de gran tamaño en comparación con el tamaño de la araña (Fig. 6A). Se examinó una hembra y un macho (CoAMiN).
Familia Tetragnathidae Menge, 1866
Chryssometanigroventris(Keyserling, 1879)
Banks (1902), Banks (1905) cita el ejemplar con el nombre Argyroepeira nigriventris, proveniente de la isla y hace una pequeña descripción de la especie. Banks (1902) establece que “Esta especie es el arácnido más común de la Isla del Coco, donde generalmente construye una tela fina, ligera y muy delicada, pero a menudo simplemente una red irregular de hilos rectos” (p. 78). Este autor establece esta observación, a pesar de que en ese trabajo este solamente revisó un ejemplar de esta especie.
La araña mide 2.5 mm, caparazón y patas de color anaranjado claro, labio y esternón negro, dorso del abdomen con una banda de puntos plateados a ambos lados, con parches posteriores transversales negros y algunos plateados anteriormente, con una línea distintiva media de coloración gris, coloración ventral negra con dos líneas plateadas anchas paralelas (Levi, 1986). No fue posible encontrar ningún espécimen.
Dolichognatha pentagona(Hentz, 1850)
(m, h)
Esta araña llega a medir menos de cuatro milímetros de longitud, fabrica telas delicadas cerca del suelo o cerca de troncos de árboles, procurando sitios oscuros. Su distribución se establece desde E.U.A. hasta Venezuela. En la isla fueron encontrados y examinados un macho y tres hembras (CoAMiN).
Leucauge argentea(Keyserling, 1865) (m,h) (Fig. 1E, Fig. 5A, Fig. 5B, Fig. 5C)
Este es el primer registro de la especie para Centroamérica y Costa Rica. Solo se conocía una hembra. Se aportan nuevos datos sobre las características de la hembra y se describe por primera vez el macho.
Datos del tipo: Una hembra adulta de Colombia (citado como Nueva Granada), sin fecha. El tipo posiblemente está depositado en el Museo Británico. Banks (1898) cita “muchos especímenes de Tepic”, México (p. 257).
Distribución: Isla del Coco, bahía Wafer (Fig. 9), Colombia y México.
Coloración:Keyserling (1865) describe un espécimen con el cefalotórax de color amarillo, poco más largo que ancho, con una profunda impresión en el centro. Ojos: Los anteriores medios están un poco más juntos que los posteriores medios. Los laterales yacen juntos en un pequeño montículo, y están dos veces más alejados de los ojos medios. Las mandíbulas son fuertes, arqueadas al frente, esternón ancho, con algunos pelos oscuros. Las maxilas son dos veces más largas que anchas y el borde frontal redondeado casi más ancho que largo. Las patas son amarillas como todas las partes del cuerpo mencionadas anteriormente. El abdomen es ovalado, de color amarillo grisáceo, poco más ancho en la parte posterior que en la parte frontal, está decorado con parches densos de color plateado brillante, pero que dejan libre una zona dorsal ancha y ramificada. El epigino se divide en el medio por una elevación frontal angosta (Fig. 5B).
Los nuevos especímenes de la isla presentan una coloración en alcohol amarillo-verduzca, más oscura en los extremos de las patas a partir de las patelas, el abdomen es como se describe originalmente, solamente se agrega que ventralmente el mismo presenta dos líneas de manchas angostas, plateadas longitudinales que se extienden desde el área del epigino hasta las hileras. El esternón es de coloración verde más oscura. Los ejemplares vivos son de coloración verde oscuro, con las manchas plateadas muy llamativas, las patas de coloración cafezusca a partir de las patelas (Fig. 1E).
Epigino (ventral) (Fig. 5B), con dos aberturas copulatorias semitriangulares, divididas por una elevación, orientadas ventralmente, con un área esclerotizada que se extiende anteriormente del mismo ancho que elepigino. Las espermatecas, traslúcidas, de forma globosa, se extienden anteriormente hasta cubrir prácticamente toda el área esclerotizada de la cutícula. (Fig. 5C).
Mediciones de la hembra: Longitud total: 5.30, longitud del prosoma: 1.80, anchura: 1.10, longitud del opistosoma: 3.50; anchura: 2.10.
Patas: I: fémur 3.50 / patela 0.90 / tibia 3.40 / metatarso 3.80 / tarso 1.20 / total 12.80; II: fémur 2.90 / patela 0.90 / tibia 2.60 / metatarso 3.00 / tarso 1.00 / total 10.40; III: fémur 1.60 / patela 0.50 / tibia 1.10 / metatarso 1.10 / tarso 0.60 / total 4.90; IV: fémur 2.90 / patela 0.50 / tibia 1.90 / metatarso 2.20 / tarso 0.80 / total 8.30.
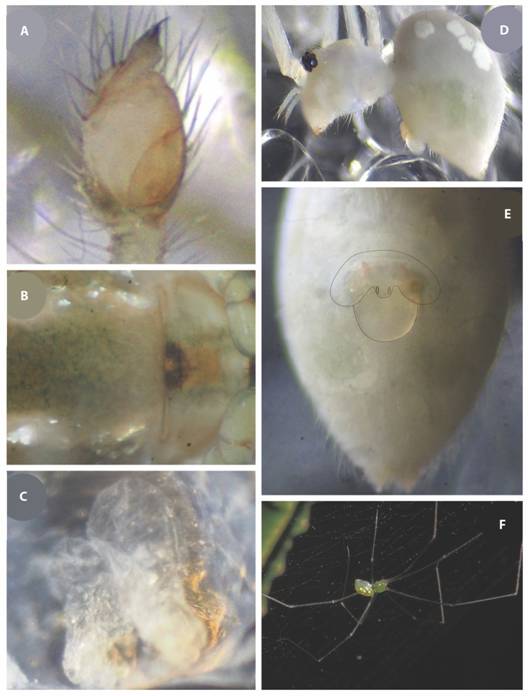
Fig. 5 Leucauge rgéntea. A) bulbo del macho; B) hembra, epigino, ventral; C) espermatecas de la hembra. D-F) Modisimus coco D) vista lateral de la hembra; E) epigino, vista ventral del abdomen de la hembra, se resalta la forma con línea; F) hembra, ejemplar vivo.
Macho: Morfología general como en las hembras. Conductor poco esclerotizado en la base, fusionado al tegulum, con su ápice mayormente esclerotizado. Embolus corto en forma de espina, muy puntiagudo y esclerotizado en su ápice. Apófisis basal del cimbio corta, semi transparente y en forma de espátula surectangular. Conductos de esperma apenas visibles (Fig. 5ª).
Mediciones del macho: Longitud total: 3.70, longitud del prosoma: 1.80, anchura: 1.30, longitud del opistosoma: 1.90; anchura: 1.50.
Patas: I: fémur 3.80 / patela 0.50 / tibia 4.50 / metatarso 4.40 / tarso 1.00 / total 14.20; II: fémur 3.20 / patela 0.50 / tibia 2.70 / metatarso 3.00 / tarso 0.80 / total 10.20; III: fémur 1.90 / patela 0.40 / tibia 1.20 / metatarso 1.40 / tarso 0.70 / total 5.60; IV: fémur 3.00 / patela 0.40 / tibia 2.00 / metatarso 2.40 / tarso 0.90 / total 8.70.
Material examinado: Se examinó un macho y dos hembras (CoAMiN).
Leucaugeargyra(Walckenaer, 1841) (m, h)
Se distribuye desde E.U.A. hasta Brasil, es una araña muy común en la isla y fabrica telas principalmente en zonas abiertas, suelen agruparse varios ejemplares para aprovechar mejor los recursos alimenticios, muchas veces unen sus telas con este fin. Se examinaron dos machos y cinco hembras (CoAMiN).
Tetragnatha tenuissimaO. Pickard-Cambridge, 1889 (m, h) (Fig. 6D).
Se distribuye en México, Centroamérica y el Caribe hasta Brasil. Según Okuma (1992), esta especie parece ser la más común en Centroamérica, especialmente en Costa Rica y Panamá. Las hembras suelen alcanzar tamaños que van entre ocho y diez milímetros. Estas arañas fabrican telas muy frágiles encima de corrientes de agua, en este caso fueron encontradas fácilmente en las pequeñas quebradas que cruzan Bahía Wafer. Se examinaron un macho y dos hembras (CoAMiN).

Fig. 6 Fotografías de especies de arácnidos de la Isla del Coco. A) hembra de Heteropoda venatoria; B) macho Mecaphesa sp; C)hembra Parasteatoda sp; D)macho Tetragnatha tenuissima; E) hembra Theridion sp; F) hembra Chrysso sp.
Familia Theridiidae Sundevall, 1833
Chrysso spp. (h,m) (Fig. 1F, Fig. 6F)
El género está representado por 64 especies a nivel mundial, con nueve especies en Panamá y dos en Costa Rica. Llegan a alcanzar unos cinco milímetros de longitud. Posiblemente se trate de un complejo de varias especies, de la cuales al menos una (Fig. 6F) es muy abundante y fácilmente localizable ya que fabrica pequeñas telas en las paredes de edificaciones. Se examinaron ocho machos y diez hembras.
Una morfoespecie estudiada es de coloración verduzca, las patas alargadas y delgadas son semi traslúcidas, el abdomen es oval, alargado, con dos líneas laterales de puntos pequeños y de color negro. Es una especie común en la isla y fácilmente observable quieta debajo de hojas de diversas plantas, donde construye sus telas, las hembras utilizan la pata IV para sostener el saco de huevos al final del abdomen (Fig. 1F). Se examinaron ocho machos y dos hembras (CoAMiN).
Episinuschiapensis Levi, 1955
Este es el primer registro de esta especie para Centroamérica y Costa Rica. Antes se conocida solo paraMéxico. Especie de talla pequeña que llega a medir hasta 1.4 mm de longitud, el espécimen macho estudiado (CoAMiN) es el segundo espécimen que se conoce de la especie. La hembra no ha sido descrita.
Parasteatoda sp. (h, m) (Fig. 6E).
El género está representado por 44 especies a nivel mundial, algunas especies han sido introducidas en varias partes del mundo y otras son de amplio rango de distribución en América. Son de tamaño muy variable y se revisaron especímenes que posiblemente representen al menos tres especies. Se examinaron nueve machos y 25 hembras (CoAMiN).
Parasteatoda tepidariorum(C. L. Koch, 1841)
Originaria de Sudamérica, introducida a nivel mundial. Posiblemente es una de las especies más comunes de arañas que viven dentro de las casas, junto con Physocyclus globosus (Pholcidae) conforman las principales arañas sinantrópicas de la isla. Villegas-Retana, Picado-Rossi, & Durán-Apuy (2016) establecen que la dieta de la lagartija Hemidactylus frenatus (Squamata: Gekkonidae), está basada en más de un 50% en arañas y en sus análisis identifican a la especie encontrada como Theridium spp (la forma correcta de escribir el género es Theridion, según opinión No. 517 (ICZN, 1958)), sin embargo, esta identificación puede ser errónea y más bien, esta información puede ser atribuida a P. tepidariorum, ya que en la isla no existe ninguna especie de Theridion que sea sinantrópica. Se examinaron tres hembras (CoAMiN).
RhomphaeaprojiciensO. Pickard-Cambridge, 1896 (m, h)
Distribuida desde E.U.A. hasta Argentina, es una araña de cuatro milímetros de longitud. Muchas especies son comensales en telas de otras arañas de mayor tamaño (Exline & Levi, 1962), en el caso de la isla, frecuentan las telas de G. cancriformis. Fueron examinados dos machos y tres hembras (CoAMiN).
TheridioncocosenseStrand, 1906
Citada por Armas y Víquez (2014) como T. cocoense, lo que constituye un error tipográfico. Es una de las especies endémicas de la isla. La descripción y su designación con ese nombre es sin duda un poco confusa. Banks (1905), cita “Theridium sp, unos pocos especímenes de una pequeña especie, con abdomen amarillo y cefalotórax negro, muy posiblemente nueva” (p. 21). Posteriormente Strand (1906) publicó una revisión de varios trabajos donde incluyo los de Banks, en esta revisión Strand denomina la especie con su nombre definitivo, esto a pesar que, en apariencia el nunca tuvo acceso al material y solamente tradujo lo descrito por Banks de ingles a alemán. Levi (1963), considera que Strand nombró la especie de forma arbitraria, que el espécimen observado por Banks originalmente, “Probablemente fue una araña inmadura que luego fue descartada” (p. 544). Realiza una descripción más profunda, anotando que es de coloración blanquecina, sin pigmento, excepto en los ojos. Abdomen suboval, dos veces más largo que ancho. Longitud total tres milímetros.
A la fecha el holotipo hembra es el único ejemplar confiable conocido de esta especie, el ejemplar se encuentra depositado en la colección del Museo Americano de Historia Natural (AMNH) en New York, E.U.A. Según Louis N. Sorkin del AMNH, quien revisó el espécimen tipo, confirma que “se trata de una hembra. El cefalotórax definitivamente no es negro solo de color pálido como en otras especies. Es muy extraño que la palabra negro se use en la descripción” (com. per). No se pudo recolectar ningún espécimen adicional.
Theridion sp. (f, m) (Fig. 6C).
Con 586 especies distribuidas en todo el mundo, este género representa un reto a la hora de identificar especímenes. Para la región Centroamericana se han descrito 31 especies (Víquez & Longhorn, 2019). Se examinaron cuatro machos y dos hembras (CoAMiN).
Tidarren sp. (h)
El género está representado por 24 especies que se distribuyen en África con tres especies de amplio rango en América y el Caribe. Son arañas que fabrican telas enmarañadas y colocan en el centro una hoja u otro objeto donde la araña fabrica su refugio y también utiliza para resguardar los sacos de huevos. Se examinaron dos hembras (CoAMiN).
Familia Theridiosomatidae Simon, 1881
Ogulnius sp. (m)
Representado por 18 especies, es un género de mayoría americano y caribeño, con algunas especies en Asia tropical. En Centroamérica solo existe otra especie en Panamá, por lo que este es el primer registro del género para Costa Rica. Al igual que Wendilgarda, este grupo de arañas prefiere ambientes extremadamente húmedos, son pequeñas de 0.5 hasta 2 mm de longitud. Suelen dejar colgados los sacos de huevos que poseen forma de “gota” y de apariencia corácea. Solo se examinó un ejemplar macho (CoAMiN).
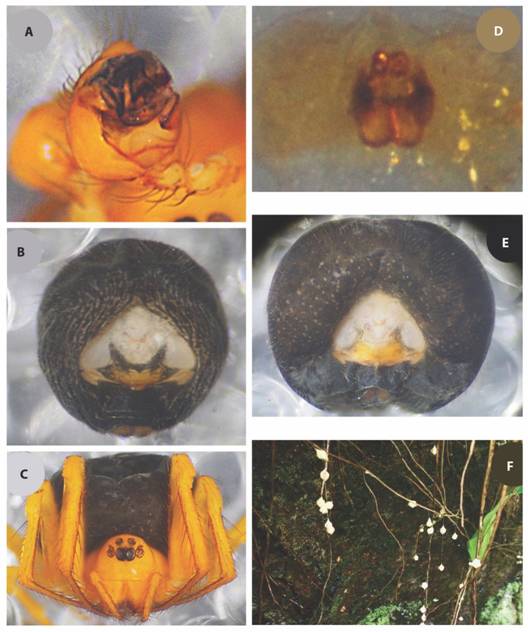
Fig. 7 Wendilgarda galapagensis. A) bulbo del macho; B) abdomen ventral del macho C) vista frontal de la hembra; D) espermatecas de la hembra; E) abdomen ventral de la hembra; F) agregaciones de sacos de huevos.
WendilgardagalapagensisArcher, 1953
(m, h) Fig. 7).
El género está representado por 13 especies a nivel mundial y tres a nivel Centroamericano. Presenta una distribución similar a la especie anteriormente citada. Fue descrita a partir de los tipos, macho y hembra, sin embargo, esta última estaba severamente deteriorada, por estas razones aquí se complementa la descripción de la especie. El autor original realiza una corta descripción y menciona que la especie proviene de la Isla del Coco, pero refiere la misma erróneamente a las Galápagos (Archer, 1953). La especie hasta la fecha es endémica de la Isla del Coco.
Es muy común, principalmente cerca de las quebradas y ríos, Eberhard (1989) describe que esta araña fabrica tres tipos de telas, una de agua, que es similar a la de otras especies del género y consiste en una serie de líneas horizontales que soportan una serie de líneas cortas, verticales, pegajosas y muy espaciadas, unidas a la superficie del agua, aunque Coddington (1986) hace referencia a una comunicación personal de Eberhard donde dice que “algunos individuos no fijan la tela al agua, a diferencia de otros miembros del grupo” (p. 83). La red de tierra consiste en largas líneas pegajosas unidas al final de líneas no adherentes que se dirigen directamente al sustrato, y en el otro lado a una red central dispersa de líneas no pegajosas donde la araña descansaba y finalmente una variación de la tela de agua, donde la araña la ubica en la tierra, pero en contacto con el suelo o la vegetación baja. A lo largo de la isla es posible ver cientos o hasta miles (Eberhard, 1991) de sacos de huevos de esta especie de araña, estos son fácilmente reconocibles ya que la araña los deja guindando de un solo hilo, los sacos son de coloración amarillenta-anaranjada y presentan forma pentagonal. Por lo general suelen ser ubicados en sitios frescos y oscuros como paredones en orillas de ríos o bien en las partes bajas de enredaderas o plantas densas (Fig. 7F).
Datos del tipo: El material estudiado por Archer debe estar depositado en el Museo Americano de Historia Natural (AMNH).
Distribución: Endémica de la Isla del Coco.
Descripción general:
Macho: Longitud total 3.1 Cefalotórax de 1.30 de largo, 1.30 de ancho, 0.90 de alto. Esternón de 0,80 de largo, 0,60 de ancho. Caparazón amarillo pálido, patas amarillas, de color más anaranjado distalmente. Palpo, como en la Fig. 9A. Abdomen 1.80 de largo, 1.60 de ancho, 1.30 mm de alto; de color pálido grisáceo a negro, ovoide, ventralmente presenta una placa esclerotizada ubicada entre los pulmones y el pliegue epigástrico, la cual se proyecta hacia las hileras, terminando de forma redondeada sin función conocida (Fig. 7B).
Hembra: Longitud total 4.60. Cefalotórax de 1.70 de largo, 1.50 de ancho, 0.90 de alto. Esternón de 0,80 de largo, 0,80 de ancho. Coloración igual que en el macho. Abdomen 2.90 de largo, 2.90 de ancho, 2.00 de alto; de color pálido grisáceo a negro, redondeado. El epigynum es una placa lisa, de forma rectangular, con un escapo corto y cónico truncado distalmente (Fig. 7D, Fig. 7E).
Variación: El ancho y el largo del abdomen de la hembra puede variar de tamaño entre 2.50 y 3.00.
Se examinaron diez machos y 20 hembras (CoAMiN).
Familia Thomisidae Sundeval, 1833
Mecaphesa sp. (m, h) (Fig. 6B).
El género está representado por 52 especies, siete especies en Centroamérica. Los especímenes estudiados (cuatro machos y tres hembras, CoAMiN) parecen representar una única especie, sin embargo, aun están en estudio.
Familia Uloboridae Thorell, 1869
Uloborus sp.
Representado por 80 especies a nivel mundial y tan solo cuatro a nivel Centroamericano, algunas veces son comensales de telas de arañas de mayor tamaño. Se estudió una hembra y un macho que podría representar una nueva especie (CoAMiN).
Orden Opiliones (Pendejos)
Familia Cosmetidae Koch, 1839
Eucynortainsularis(Banks, 1905) (h, m) (Fig. 8A)
Especie endémica de la isla, descrita por Banks (1905) a partir de dos especímenes sin indicar sexo de los mismos, Pueden llegar a alcanzar unos cinco milímetros de longitud. La especie es común en la isla y suele verse durante la noche caminado sobre el suelo o la superficie de los árboles. Se examinaron cuatro machos y seis hembras (CoAMiN).
Familia Samoidae Sørensen, 1886
PellobunusinsularisBanks, 1905 (m, f)
Descrita por Banks (1905), en este caso de un solo ejemplar sin especificar de que sexo se trataba, posteriormente Goodnight y Goodnight (1983), la describieron de mejor manera y citaron los sexos del material que habían revisado, ellos mismos sinonimizan una especie (Psyctrapus metatarsalis) descrita por Roewer (1933) originaria de la región de Parismina, Limón, Costa Rica, al igual que añaden a la distribución de la especie material de Panamá. La especie es común en la isla y suele verse durante la noche caminado sobre el suelo o la superficie de los árboles, también fueron recolectados varios ejemplares entre cavidades y acumulaciones de piedras. Fueron examinados cinco machos y tres hembras (CoAMiN).
Orden Pseudoscorpiones
Familia Chernetidae Menge, 1855
Género y sp. indeterminados
Los pseudoscorpiones son arácnidos pobremente estudiados en Costa Rica, a la fecha no existen estudios sistemáticos que permitan tener datos fidedignos de su verdadera diversidad en el país. A la fecha, de la región centroamericana han sido citadas 11 familias, 31 géneros y 62 especies (Víquez & Longhorn, 2019). El grupo requiere mucho trabajo para poder realizar identificaciones confiables, principalmente por su pequeño tamaño y la necesidad de utilizar equipo óptico de muy buena calidad, así como procedimientos técnicos especiales y minuciosos. En el material estudiado se encuentran al menos dos morfoespecies provenientes de métodos de recolecta distintos, una de ellas fue capturada mediante golpe de vegetación y la otra con embudos de Berlese. Se han examinado dos machos y dos hembras (CoAMiN).

Fig. 8 Fotografías de especies de arácnidos de la Isla del Coco. A) hembra Eucynorta insularis; B)hembra Opisthacanthus valerioi; C) Tanatosis, macho O. valerioi; D) Ammotrechula sp; E) macho Surazomus antonioi; F) hembra, S. antonioi.
Orden Schizomida
Familia Hubbardiidae Cook, 1899
Surazomus antonioi (m, f) (Fig. 8C, Fig. 8F).
Descrita por Armas y Víquez (2014), es una especie endémica de la isla, originalmente fue encontrada en los alrededores de la Bahía Wafer, pero actualmente se tienen ejemplares también en los alrededores de Bahía Chatham, una de las hembras recolectadas estaba cargando un saco con seis huevos en la parte ventral del abdomen (Fig. 8F). La especie es abundante en la isla. Se examinaron cinco machos y cinco hembras (CoAMiN).
Orden Scorpiones (Alacranes, escorpiones)
Familia Hormuridae Laurie, 1896
OpisthacanthusvalerioiLourenço, 1980
La única especie de alacrán que habita la isla. Es endémica y el género es originario de la región de Etiopía. La ubicación de este grupo de alacranes en una familia específica ha sido discutida en años recientes pasando de Ishnuridae a Hemiscorpiidae, Liochelidae hasta Hormuridae, donde se ubica actualmente (Soleglad & Fet, 2003; Fet & Soleglad, 2005; Prendini & Wheeler, 2005; Monod & Prendini, 2015). Es una especie de talla mediana a grande que llega a alcanzar entre 45 y 55 milímetros de longitud (Francke & Stockwell, 1987; Víquez, 1999).
De coloración café-rojiza con patas y aguijón amarillentos, sus principales características son el gran tamaño de las tenazas y una cola corta. La especie es común en toda la isla (zonas exploradas para este trabajo), principalmente usa los troncos de helechos arborescentes que han muerto. Una hembra fue encontrada en un pequeño hueco en el suelo, cuando se escavó, se encontraron cuatro ejemplares juveniles más en el mismo lugar. Durante las noches, en la zona de pre-manglar (anonas) se observaron varios ejemplares en huecos y cavidades entre los troncos de los árboles. En una caminata nocturna por medio de luz ultravioleta (UV) realizada en el año 2013 entre Cerro Iglesias y Bahía Wafer, se observaron (sin recolección)múltiples especímenes en todo el transepto, por lo quese puede decir que la especie habita desde el nivel del mar hasta al menos los 500 m. Los cerdos cimarrones (Sus scrofa, Suidae), parecen no alimentarse de este escorpión, en un experimento empírico se le dio a comer un escorpión a varios animales mientras se les ofrecía coco picado, a lo cual los cerdos rechazaban al escorpión y procuraban no comer cerca de el, cuando un animal rozaba el escorpión, emitía sonidos chillantes de rechazo. En varias ocasiones, cuando se trabajaba con los escorpiones, estos se dejaban caer y se quedaban quietos, incluso se les podía voltear con las patas hacia arriba y a pesar de la manipulación no se movían hasta después de varios minutos. Este mecanismo de defensa se ha observado también en otras especies de alacranes de Costa Rica y se conoce como tanatosis (Fig. 8E). Se examinaron un macho y una hembra (CoAMiN).
Orden Solifugae
Familia Ammotrechidae Roewer, 1934
Ammotrechula sp. (j) (Fig. 8D).
Se recolectó un espécimen juvenil (CoAMiN), en las cercanías del radar en Bahia Wafer (cod. de recolecta 4883) el 17 de julio, 2017. D. Cotoras.
La longitud del propeltidio es de 1.70 y el ancho 1.40, longitud del quelícero, 2.30, ancho en la base, 1.20; longitud del tubérculo ocular 0.30, ancho; 0.50. Ammotrechinae cuyo 2do y 3er tarso de las patas tienen cada uno 1.2.2/2.1 espinas ventrales y cuyo 4to tarso tiene 2.2/2/2/2 espinas. El dedo inmóvil de los quelíceros con dos dientes anteriores delante del diente mediano y dedo móvil con un diente basal. El margen del propeltidio se inclina posteriormente al tubérculo ocular. Cuerpo de color general castaño grisáceo, excepto las coxas y la parte ventral del animal. Los quelíceros presentan tres franjas longitudinales de coloración más clara y el propeltidio presenta una marca romboidal central y dos franjas posteriores que se extienden lateralmente, ambas de coloración más clara. Las patas son de coloración homogénea sin presentar bandas.
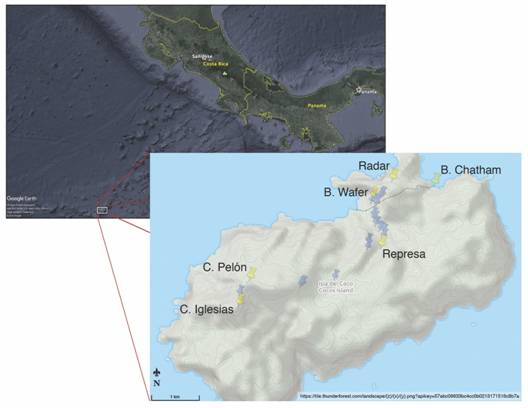
Fig. 9 Mapa de puntos de interés y recorridos de recolecta para el proyecto de investigación. Puntos azules: recorridos; puntos amarillos, sitios de referencia.
Generalidades: Víquez & Cotoras (2018) citan la presencia del orden en la isla, el espécimen fue recolectado por medio de una manta utilizando el método de golpe de vegetación en las cercanías al sitio donde se ubicó el sistema de radar. Debido a esta metodología, el espécimen está dañado, le falta un pedipalpo y el abdomen.
El orden está representado en el área Centroamericana por 13 especies, del género Ammotrechula solo se conoce otra especie en El Salvador (Víquez & Longhorn, 2019), entre otras cosas, el ejemplar de la isla carece de espínulas que cubran el propeltido y quelíceros, carácter que lo diferencia de Ammotrechula schusterae Roewer, 1954, la especie citada para El Salvador. Se requiere mayor esfuerzo de recolecta para poder encontrar ejemplares adultos y obtener más datos de su historia natural y distribución.
Discusión
En el presente trabajo se describieron tres nuevas especies, demostrando que aún la aracnofauna de la Isla del Coco no se conoce por completo. Debido a su lejanía respecto a tierras continentales, se puede considerar que la Isla del Coco ha estado rezagada en estudios sistemáticos sobre los arácnidos que la habitan, pero que conforme se incrementen los estudios, es probable que la fauna endémica conocida del lugar sea cada vez más abundante.
A nivel biogeográfico, la fauna de arañas que habita en la isla está mayormente relacionadas con la fauna de la región Centroamérica. Del total de especies presentes en la isla, 27 de ellas son compartidas en ambas regiones (54%). En un segundo lugar se ubican Sudamérica con un 50% y Norteamérica con 44% de representación, la región Caribe con un 22%, especies endémicas (20%), las especies relacionadas a la fauna de las Galápagos (12%) y finalmente las especies cosmopolitas (10%), que posiblemente sean de más reciente introducción (Tabla 2). Los orígenes de esta fauna no han sido estudiados hasta el momento, quizás el caso que ha sido mejor documentado es el del escorpión Opistacanthus valerioi, donde se han establecido varias teorías, que se pueden considerar como una base para proponer nuevas hipótesis para el resto de la fauna. Newlands (1973), establece que la ocurrencia del género en el Nuevo Mundo era producto del transporte transoceánico de los animales en balsas flotantes a la deriva, sin embargo en ese momento Opisthacanthus valerioi no había sido descrita ni citada de la isla, por lo que es posteriormente que se plantean nuevas opciones. Francke (1974), al citar a la especie (erróneamente identificada como O. lepturus) menciona dos posibilidades, que llegaran por medio de balsas flotantes y corrientes marina y la introducción accidental en tiempos históricos, por los navíos que han visitado la isla desde su descubrimiento, para el autor “ambas posibilidades no son excluyentes y por tanto no puede descartarse la posibilidad de que ambos hayan ocurrido. Las probabilidades de dispersión natural son mínimas dado el tamaño de la isla, su distancia al continente, y la dirección de las corrientes marinas en esa zona del océano (p. 34).
Lourenço (1988), por su parte, considera los trabajos de Croizat (1958, capítulos 7 y 8) y establece que los patrones de distribución son concordantes con la ruta sudoeste de Perú-Galápagos-México propuesta por este autor, otorgándole poco valor a la colonización por medio de balsas flotantes ya que no se detecta una dispersión reciente de especies. Finalmente debido a que O. valerioi no existe en ninguna otra parte del continente, propone que se puede hipotetizar que se puede tratar de un caso de vicarianza.
Estas relaciones de la fauna isleña con tierras lejanas continentales ha sido también observada en otros grupos existentes en la isla, por ejemplo, Trusty et al. (2012) analizaron filogenias moleculares para plantas de la Isla del Coco y las Galápagos, encontrando que al menos en cuatro géneros, los parientes más cercanos de las especies endémicas estaban en áreas distantes de Norteamérica o el Caribe y que posiblemente la pequeña área de extensión de la Isla del Coco y sus diferencias ecológicas podrían actuar como barreras para la dispersión de especies, en el caso estudiado de los arácnidos la relación de fauna con las Galápagos tan solo alcanza un 12 %.
Respecto al inventario de la aracnofauna, es necesario realizar nuevos muestreos, principalmente en la parte sur de la isla, donde no se ha podido explorar en ninguna ocasión, también la implementación de nuevos métodos de recolecta, como la fumigación de copas (muestras de dosel) pueden resultar de mucho interés, tomando en cuenta que el registro del único solifugido (Solifugae) recolectado proviene de vegetación. A la fecha los datos que se poseen son específicos para dos periodos del año (abril y julio), por lo que es necesario realizar muestreos en otros periodos, ya que algunas especies podrían tener cierta estacionalidad, como podría ser el caso de Neotama sp.
Es importante considerar que la Isla del Coco sufre un importante deterioro en su sistema forestal, por lo que el impacto negativo de la perdida de los suelos por erosión y de la poca regeneración natural está afectando a muchas especies, entre ellas los arácnidos.Los cerdos, venados, así como las ratas y lagartijas introducidas son sin duda enemigos sistemáticos y constantes que afectan las poblaciones naturales de la isla, ya sea alterando las condiciones naturales del suelo o bien depredando directamente a las especies nativas. De no tomarse las debidas medidas de mitigación, que deben incluir la continuación del inventario de la fauna aracnológica, la biodiversidad de la isla pudiera verse severamente afectada, debido a la fragmentación ypérdida de hábitats, con la consiguiente e irreversible desaparición de especies.
En conclusión, este estudio muestra que la diversidad total de arácnidos de la Isla del Coco esta aun en proceso y que el lugar es ideal para desarrollar investigaciones que culminen en la descripción de nuevas especies. Este trabajo puede ser útil comolínea basetaxonómica para futuras investigaciones, sin embargo, las relaciones filogenéticas y la biogeografía de los grupos incluidos aquí, aun no ha sido desarrollada. Es necesario iniciar nuevos procesos para conocer mejor aspectos ecológicos de las especies y la incorporación de nuevas herramientas para evaluar esta fauna, como por ejemplo la utilización de el código genético (Barcoding).
Declaración de ética: el autor declara que está de acuerdo con esta publicación; que no existe conflicto de interés de ningún tipo; y que ha cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

