Introducción
Algunas comunidades de helechales son dominadas por especies de Pteridium y Dicranopteris, plantas con capacidad de establecerse posterior a la transformación de una formación vegetal original (Slocum, Aide, Zimmerman, & Navarrro, 2000; Velázquez, 2001). Las alteraciones y pérdida de los bosques se debe a diferentes usos del suelo como agricultura, silvicultura, y ganadería, principales causas de transformaciones de la vegetación (Vitousek, Mooney, Lubchenco, & Mellilo, 1997; Rodríguez, 2017; Tinjacá-Pérez, 2017); por lo anterior, estas especies colonizan rápidamente, por sus características heliófitas, acelerado crecimiento, y reproducción por esporas; además, son conocidas como invasoras, por la facultad inhibidora en los procesos de sucesión natural (Le Duc, Pakeman, Putwain, & Marrs, 2000; Slocum et al., 2000; Hartig & Beck, 2003).
Especies de Pteridium llamadas “helecho marranero o helecho macho” son consideradas invasoras e inhibidoras para el establecimiento en el proceso de sucesión, por ser de amplia distribución, activo crecimiento, colonización y capacidad competitiva (Alonso-Amelot, 1999; Velázquez, 2001; Ghorbani et al., 2003). Se desarrollan por estolones (tallo subterráneo) y producen sustancias alelopáticas que dificultan el establecimiento de plántulas de otras especies; razón por la cual, influyen directamente en la estructura y composición de una comunidad vegetal (Parks & Werth, 1993; Gallegos et al., 2016). Es así como, Schwartsburd, Yanñez y Prado (2018) reorganizan los Pteridium de América del Sur, con criterios morfológicos y geográficos, lo cual, permite sinonimizar a P. arachnoideum del Parque Nacional Natural Serranía de Los Yariguíes (PNN SYA) bajo P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre, por caracteres como, venas abaxiales, indumento estrigoso y tricomas aciculares de 0.2-0.3 mm de longitud.
Según, Ghorbani et al. (2003), Gallegos, Hensen y Schleuning (2014) y Gallegos, Hensen, Saavedra y Schleuning (2015) en el trópico la diversidad de bosques en regeneración disminuye, debido a la dominancia de los helechos sobre las especies arbóreas y herbáceas; sin embargo, Gallegos et al. (2016) documentan que existe un predominio de especies herbáceas, mientras que la diversidad de especies arbóreas disminuye, ya que los helechos pueden permanecer en la sucesión temprana y limitar la sucesión tardía.
Recientemente, ha surgido el interés por conservar y preservar los ecosistemas, para amortiguar los efectos causados por las transformaciones en el suelo, la atmosfera y la biosfera (Vitousek et al., 1997; Lippok et al., 2013); profundizar en estos temas implica el conocimiento de la composición y la estructura de estas formaciones vegetales, soporte para implementar estrategias de restauración, y comprensión de ambientes perturbados (Fuentes, 2011).
PNN SYA es un área de reserva importante para Colombia, por su estado de conservación, diversidad, ecosistemas que posee, y zonas de vida (Holdridge, 1967; Donegan & Huertas, 2005; Duarte, 2011; Rodríguez, 2017); es de interés para el PNN SYA los procesos de restauración ecológica, particularmente, en áreas dominadas por P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre; por lo anterior, se presenta la composición y estructura florística de una comunidad de helechal en este Parque.
Materiales y métodos
Área de estudio: El PNN SYA se ubica en la cordillera Oriental colombiana, departamento de Santander, y cubre siete municipios, incluido el Hato donde se realizó el estudio, en el área denominada Golconda. La extensión de Yariguíes es de 59 063 ha, de las cuales, el 39 % pertenecen a bosque, 35 % a pastizales y 26 % a cultivos, entre los 700-3 400 m, a los (6°19’43.36”-6°53’35.17” N & 73°29’59.21”-73°21’29.01” W) (Donegan & Huertas, 2005; Duarte, 2011).
Golconda tiene un rango de 2 181-2 188 m, (a 6°35’37.43”-6°35’38.39” N & 73°21’26.98”-73°21’26.45” W), con dominio de helechales, pastizales y relictos de bosque. También dominaban gramíneas exóticas para ganado, y cinco años atrás según pobladores, se evidenció la colonización del helecho (Caro, Gil, Alvarado, & Morales, 2017).
Método: Se realizaron 15 parcelas de 25 m2 cada una (área total = 375 m2), en ellas se registraron datos de riqueza y abundancia por formas de crecimiento: árbol, arbusto, hierba, epifito, bejuco (Font Quer, 2000) y terrestre para clonales como helechos y plantas afines. La estructura horizontal, se determinó con datos de altura, cobertura, frecuencia y DAP para arbustos y árboles. Para cada parcela se tomaron datos de localidad, coordenadas, grados de inclinación y descripción del helechal, con el fin de definir el lugar de muestreo.
Los ejemplares se recolectaron en su mayoría con estructuras reproductivas. El material se identificó con claves especializadas (Gentry & Vasquez, 1993; Steyermark, Berry, Holst, & Yatskievych, 1995; Stevens, Ulloa, Pool, & Montiel, 2001) y se corroboró la escritura científica con bases de datos como “Tropicos” (www.tropicos.org) y Jstor (www.jstor.org). Los exsicados se encuentran en el Herbario UPTC con duplicados en UIS, con numeración de Castro-Martínez A.L.
Análisis de datos: Para la composición y riqueza se identificó el total de familias, géneros y especies, las familias con mayor número de géneros y especies, y géneros con mayor riqueza. Se estimó la diversidad, con el índice de Shannon, dominancia de Simpson y la comparación entre parcelas con el índice de similitud de Jaccard, mediante el software PAST ver. 2.17c.; se cuantificó la representatividad del muestreo con el promedio de los estimadores ACE, ICE, Chao 1, Chao 2, Jack 1, Jack 2, Bootstrap, para calcular las curvas de acumulación con uso de EstimateS ver. 9.1.0.
En cuanto a la estructura horizontal, se tomó en cuenta las formas de crecimiento dominantes según abundancia y riqueza; de igual forma, para identificar las especies arbóreas y arbustivas con mayor representatividad ecológica, se estimó el índice de valor de importancia (IVI según Rangel-Ch & Velázquez, 1997), evaluado a partir de la abundancia, la frecuencia y la dominancia, y para las herbáceas, el índice de valor de importancia relativa (IVR, según; Álvarez-Lopeztello, Rivas-Manzano, Aguilera-Gómez, & González-Ledesma, 2016).
Resultados
Composición y diversidad: Se registraron 65 especies, distribuidas en 52 géneros y 24 familias; las familias más ricas son Melastomataceae (13 especies/6 géneros), Asteraceae (8/10), Poaceae (6/5), Cyperaceae (5/3), Apocynaceae, Orchidaceae y Rubiaceae (3 especies cada una); familias como Campanulaceae, Ericaceae, Gentianaceae, Myrtaceae, Piperaceae con dos especies cada una, y las 12 restantes están representadas por un solo género y una especie (Apéndice digital 1). Las 12 familias más ricas corresponden al 77.4 % de los géneros (41) y el 81.5 % de especies (53). Los géneros más ricos son: Miconia (5 especies), Tibouchina (3), Rhynchospora (3), Clidemia (2), Baccharis (2), Piper (2), Andropogon (2) y Panicum (2); los 45 géneros restantes están representados por una especie.
El promedio de los estimadores de riqueza es del 91.31 %, siendo este un valor representativo para el área muestreada, por lo que, el valor de 3.178 para Shannon es representativo. Los valores de diversidad probable de Shannon entre parcelas no fueron contrastantes (de 2.21 a 2.89); es decir, estos datos determinaron baja diversidad en cada unidad de muestreo; lo anterior, debido a la alta dominancia (Simpson, entre 0.87 y 0.93). En la comunidad de helechal, las especies más abundantes son: Coccocypselum lanceolatum (147 individuos), Clethra fagifolia (92), Ageratina cf. fastigiata (73), Chromolaena tacotana (62) y Tibouchina lindeniana (54).
Similitud: Revela que es inferior al 54 % entre la mayoría de las parcelas; solo cuatro tienen una similitud entre 70 y 72 %, siendo este último el valor máximo entre parcelas. La baja similitud indica alta heterogeneidad en las abundancias de las especies en cada parcela, lo que se asocia con recambio en composición.
Formas de crecimiento: Se registraron 924 individuos, en seis formas de crecimiento. De la abundancia total, 79 individuos estaban en etapa de plántula.Los arbustos son los más abundantes (363 individuos/39.3 %), seguido de hierbas (342/37 %) y terrestres (112/12.2 %). A nivel específico, las hierbas fueron las más representativas (21 sp./31.25 %), seguido de árboles (17/26.6 %), y arbustos (13/20.3 %); y aunque, los helechos presentan grandes coberturas (6.25 m2), su porcentaje de especies es significativamente menor (5 sp./8.9 %) (Fig. 1).
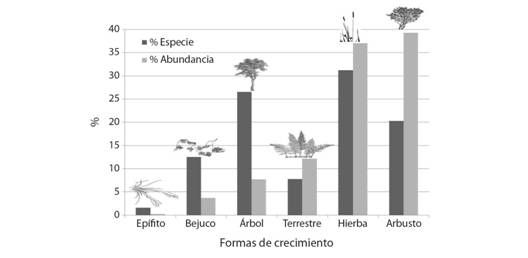
Fig. 1 Fig. 1 Formas de crecimiento, abundancia y riqueza registrados en el área de estudio. Growth forms, abundance and richness recorded in the study area.
Especies de importancia ecológica. Árboles y arbustos: Tibouchina lindeniana, Clethra fagifolia y Ageratina cf. fastigiata son las especies más representativas, aunque esta última, presenta el valor más alto de importancia por ser dominante (74.42 %).
Las especies dominantes son Tibouchinalindeniana (10.93 %) y T.lepidota (4.93 %), frecuentes y abundantes Ageratina cf. fastigiata (17.24 %/27.16 % respectivamente), Clethra fagifolia (16.09 %/22.22 %) y T.lindeniana (12.64 %/19.75 %); las especies restantes presentan valores de importancia inferiores al 20 % (Fig. 2A).
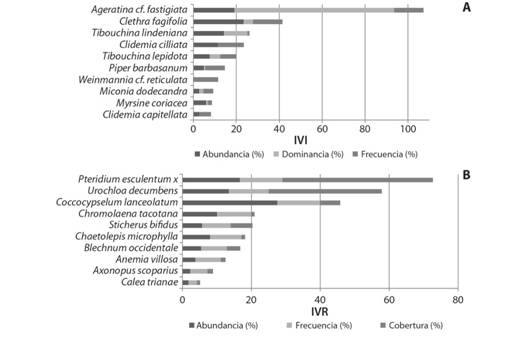
Fig. 2 Fig. 2 Las 10 especies más importantes para el helechal (P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre) a partir del IVI e IVR. A. Árboles y arbustos B.Hierbas. The 10 most important species for bracken from IVI e IVR. P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre. A. Trees and shurbs B.Herbs.
Herbáceas:P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre y Urochloa decumbens son las más importantes debido a las coberturas relativas (43.6 y 32.8 % respectivamente), seguido de Coccocypselum lanceolatum por abundancia (27.5 %) (Fig. 2B).
Los valores altos de coberturas los presentan, P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre (43.6 %), U. decumbens (32.8 %) y Sticherus bifidus (6.3 %); especies frecuentes son, P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre, C. lanceolatum con el mismo valor (12.39 %), U. decumbens (11.57 %), Chromolaena tacotana (9.91 %) y Chaetolepis microphylla (9.09 %); mientras que las especies abundantes son: C. lanceolatum (27.5 %), P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre (16.61 %) y U. decumbens (13.46 %), y las restantes con valores inferiores al 10 % (Fig. 2B).
Discusión
Composición y diversidad: Los registros de 65 especies y 24 familias en el helechal (P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre) de Golconda (PNN SYA) (Apéndice digital 1), son similares a las cantidades identificadas por Ribeiro, Botelho, Leite Fontes, Garcia, & Almeida (2012), en zonas con condiciones de dominancia de P. aquilinum (= P. esculentum subsp. arachnoideum,Sierra de la Mantiqueira, Brasil), con 53 especies distribuidas en 21 familias; son comunes, Melastomataceae, Asteraceae, Myrsinaceae, Clethraceae y Myrtaceae, y géneros como Miconia, Tibouchina y Clethra; sin embargo, Ribeiro et al. (2012), solo hizo muestreo de leñosas, por tal razón, este estudio presenta mayor riqueza, debido al estado de conservación del bosque andino e igualmente la composición difiere.
Melastomataceae, Poaceae y Asteraceae son representativas en riqueza, lo que concuerda con Hartig & Beck (2003), Peters, Diertl, Gawlik, Rankl y Richter (2010) y Lippok et al. (2013), ya que, para algunas especies la dispersión anemócora les permite ser pioneras en la colonización de lugares perturbados. Según Ribeiro et al. (2012), Melastomataceae es rica y abundante, atribuido a la producción de semillas pequeñas y numerosas, característica que le permite sobrepasar barreras ecológicas y geográficas, y así, facilita su dispersión y establecimiento; a su vez, los helechos forman barreras físicas, que dificultan la colonización de especies leñosas, debido a la densidad de raíces en el suelo y cambios en la disponibilidad de nutrientes (Slocum et al., 2000); sin embargo, la presencia de estas familias determina procesos de recuperación natural en Golconda.
Especies como Weinmannia cf. reticulata y Drimys granadensis propias de bosque fueron encontradas en helechal, lo que sugiere que el banco de semillas y/o la lluvia de semillas están aportando a la recuperación de esta formación; esto puede ser apoyado con el estudio de Tinjacá-Pérez (2017), donde se evaluó el banco de semillas de helechales, y concluye que estas formaciones vegetales no son limitantes en la regeneración natural, puesto que, el banco de semillas alberga gran diversidad y puede ser potencializado al controlar especies invasoras.
Similitud: La dominancia de Ageratina cf. fastigiata, T.lindeniana, C. fagifolia, C. lanceolatum y C.ciliata, coincide con los resultados obtenidos por diferentes autores, donde reportan dominancia para pocas especies (Slocum et al., 2000; Hartig & Beck, 2003; Rodrigues Da Silva & Silva Matos, 2006; Peters et al., 2010); lo anterior, atribuido a la competencia de Pteridium sp. y otros helechos, sobre especies leñosas que restringe el espacio para colonizar (Alonso-Amelot, 1999; Hartig & Beck, 2003; Le Duc et al., 2000; Slocum et al., 2000); sin embargo, este estudio muestra que existe una diversidad representativa y es afectada por la heterogeneidad en las abundancias presentes en las parcelas según el análisis de Jaccard, y por la riqueza de especies, ya que, 20 de las familias encontradas presentan tres o menos especies.
Formas de crecimiento:Slocum et al. (2000), afirman que la diversidad de plantas arbóreas puede verse favorecida por el microclima generado por las frondas, y Hartig y Beck (2003), Peters et al. (2010) y Gallegos et al. (2016) concuerdan en que, las especies leñosas pioneras al establecerse, permiten la dispersión de semillas por aves.
Independiente del proceso de competencia, de barreras físicas y químicas que el helecho genera, o de la distancia entre las áreas de helechal y bosque (Parks & Werth, 1993; Alonso-Amelot, 1999; Ghorbani et al., 2003; Gallegos et al., 2016), los resultados expuestos, permiten mostrar que existe dispersión y establecimiento de plántulas, evidenciado en la riqueza de leñosas encontradas (30 sp./65 sp. totales).
Se identificó alta abundancia y riqueza en herbáceas y leñosas, esta última con 513 individuos de 30 especies (Fig. 1), en contraste Slocum et al. (2000) afirman que, la vegetación leñosa asociada a helechales presenta menor abundancia y riqueza; lo que puede indicar que, los helechales de P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre en Golconda no generan limitaciones para la sucesión temprana, al encontrarse especies pioneras, y tampoco en la sucesión tardía porque permite el establecimiento de especies leñosas; por el contrario, puede que actúe como una especie facilitadora en estos procesos.
Ghorbani, Le Duc, Mcallister, Pakeman y Marrs (2006) y Ribeiro et al. (2012), concluyeron que P. arachnoideum tiene una influencia negativa en la abundancia y riqueza de especies típicas de sucesión temprana, debido a las sustancias alelopáticas que produce y limitan el establecimiento de plántulas; sin embargo, las abundancias en este estudio son representativas en las formas de crecimiento arbustivo, herbáceo y arbóreo, lo cual puede indicar que, el banco de semillas presenta buena representación de diásporas y solo está latente, como lo indica también Tinjacá-Pérez (2017), o que las frondas, no obstruyen el arribo de especies por la lluvia de semillas; no obstante, la abundancia de plántulas es baja comparado con el número de individuos registrados.
Especies de importancia ecológica: Los índices IVI e IVR reflejan que las especies más importantes para el helechal son Ageratina cf. fastigiata (Asteraceae), P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre (Dennstaedtiaceae), T. lindeniana (Melastomataceae), C. fagifolia (Clethraceae) y U. decumbens (Poaceae) (Fig. 2A, Fig.2B), pertenecientes a las familias también reportadas por Rodrigues Da Silva & Silva Matos (2006) y Ribeiro et al. (2012); puesto que, se caracterizan por tener dispersión anemócora, o esporas y semillas de tamaño relativamente pequeño que pueden colonizar con facilidad áreas que han pasado por disturbios.
Ageratina cf. fastigiata, tiene un valor de importancia alto, con DAP hasta de 10 cm; de manera similar, las herbáceas como P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre y U. decumbens tienen valores altos de importancia atribuidos a la cobertura, asociado a la reproducción asexual que permite la colonización de nuevas áreas; mientras que, las mayores abundancias son para C. lanceolatum común en zonas perturbadas y, C. fagifolia importante en los procesos de colonización por la dispersión de sus semillas pequeñas (Cardona & Vargas, 2014).
La diversidad no disminuye a pesar de la dominancia de P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre,ya que se presenta una mayor riqueza respecto a otros estudios y, la abundancia es equitativa entre especies; de igual forma, se indica dominancia para especies leñosas como Ageratina cf. fastigiata, T.lindeniana, C. fagifolia y C.ciliata importantes en procesos de sucesión al ser claves en el arribo de especies; además se registran especies de interior de bosque que indican la recuperación de esta formación vegetal.
La riqueza de especies leñosas no se ve afectada por la presencia de P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre, ya que éstas (pertenecientes a Melastomataceae y Asteraceae) pueden beneficiar la sucesión tardía; sin embargo, las abundancias de plántulas (79 respecto al total de la abundancia registrada) no son representativas; el helechal en Golconda posiblemente no impide el crecimiento y establecimiento de otras especies, sin embargo, dadas las características reproductivas y fisiológicas de P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre, posiblemente si restrinja el desarrollo rápido de los taxa, por lo cual, en términos de trayectorias ecológicas, direccionadas a la restauración de áreas disturbadas, estos helechales pudiesen ser considerados como un estado alternativo estable; lo anterior sugiere estudios respecto al efecto del helecho sobre el desarrollo de plántulas.
La importancia ecológica de Ageratina cf. fastigiata (por valor de IVI) está asociada con modificaciones en la composición y estructura del helechal y por ser facilitadora en la dispersión de semillas; de igual forma P. esculentum subsp. arachnoideum x P. esculentum subsp. campestre (por valores de IVR), genera un microambiente que permite la colonización de otras especies.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

