Introducción
El escudo Guayanés se compone de alrededor de 2.5 millones de km2 que se ubican al norte de Suramérica entre Venezuela, Guyana, Surinam, Guayana Francesa, Colombia y Brasil (Hammond, 2005). Dada su ubicación geográfica, en la que confluyen tanto elementos amazónicos como orinocenses y andinos, y sus características ambientales únicas, es una región muy biodiversa en la que se registra un alto número de endemismos (e.g. Giraldo-Cañas, 2001, Salerno et al., 2012). Sin embargo, en la actualidad, es también una región en la cual gran parte de esta biodiversidad, y de los factores que la determinan, es aún desconocida.
Dentro de los estudios llevados a cabo en la región del escudo guyanés destacan algunas caracterizaciones de vegetación (Giraldo-Cañas, 2001; Cárdenas López, Castaño Arboleda, Zubieta Vega, & Jaramillo Echeverry, 2008), fauna y algunos grupos de algas y macrófitas (e.g. Lasso & Morales-Betancourt, 2017; Lasso, Morales-Betancourt, & Escobar-Martínez, 2019; Atuesta-Ibargüen, 2019). En el caso particular de los macroinvertebrados acuáticos, su diversidad sólo ha sido descrita en ríos de la Serranía de la Macarena (Granados-Martínez & Batista, 2017; Granados-Martínez, Lasso, & Núñez-Avellaneda, Marcela Morales-Betancourt, 2018) y en el río Bita (Granados-Martínez & Montoya, 2017).
Si bien caracterizar la diversidad mediante listados de especies es un paso esencial, es importante considerar que los patrones de diversidad no son estáticos, sino que, por el contrario, varían dependiendo de la acción de factores actuando en distintas escalas espaciales y temporales (Ligeiro, Melo, & Callisto, 2010; Gabbud, Robinson & Lane, 2019). Por tanto, caracterizar la diversidad y su variación en el tiempo y espacio es de gran relevancia en aras de la conservación de zonas de gran biodiversidad, como el escudo guyanés. Teniendo en cuenta este panorama, este trabajo tiene como objetivo describir la estructura taxonómica y funcional de las comunidades de macroinvertebrados de la Serranía la Lindosa (Colombia), evaluando su variación a lo largo de escalas espaciales y temporales.
Materiales y métodos
Área de estudio: Los arroyos estudiados fueron La Lindosa (2°30’ N & 72°38’ W), Tranquilandia (2°30’ N & 72°42’ W), el Rincón de los Toros (2°31’ N & 72°41’ W) y Retirito (2°29’ N & 72°43’ W) todos ubicados en la Serranía de La Lindosa (Fig. 1). Esta formación rocosa de aproximadamente 12 000 ha se encuentra en el departamento del Guaviare, cerca al municipio de San José del Guaviare, y forma parte de la zona norte de la amazonia colombiana, en la transición con la región de la Orinoquía (Cárdenas López et al., 2008). En general, el clima se cataloga como tropical lluvioso y la precipitación tiene un régimen monomodal con un promedio de 2 800 mm al año; el período lluvioso va de marzo a octubre y el seco de noviembre a febrero (Cárdenas López et al., 2008).
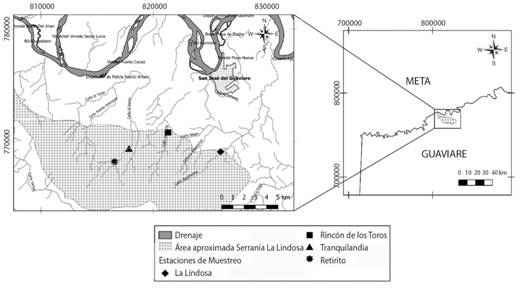
Fig. 1 Serranía de La Lindosa (San José De Guaviare, Colombia). Location of the four studied streams.
Los arroyos de formaciones como La Lindosa se caracterizan por tener lechos compuestos por grandes losas que corresponden a relictos del escudo guyanés y secuencias marcadas de rápidos y pozos cuyas transiciones están dadas frecuentemente por cascadas de altura variable. A lo largo del cauce pueden encontrarse un gran número de especies de macrófitas dentro de las cuales Rhyncholacis clavigera (P. Royen) es de las más representativas. En cuanto a los aspectos físico-químicos (Tabla 1) los arroyos de la Guayana pueden ser considerados como ultra-oligotróficos. Esto se refleja en que el agua que los recorre tiene una baja concentración y disponibilidad de nutrientes y valores de conductividad cercanos a los 2 µS/cm3. Adicionalmente, se caracterizan por registrar algunos de los pHs más ácidos en todo el neotrópico con rangos que oscilan entre 4.5 y 6.0 (Hammond, 2005).
TABLA 1 TABLE 1 Valores promedio de variables geomorfológicas, hidrológicas, físicas y químicas de los cuatro arroyos de la Serranía de La Lindosa medidas durante la época seca del 2017 y del 2018 Average values of geomorphological, hydrological, physical and chemical variables in the four streams of the Serranía de La Lindosa measured during the dry season of 2017 and 2018
| Componente | Variables | La Lindosa | R. de los Toros | Tranquilandia | Retirito |
| Geomorfológico | Elevación (m.s.n.m) | 208.0 | 228.0 | 227.0 | 273.0 |
| Pendiente del tramo (º) | 2.6 | 2.7 | 2.7 | 2.0 | |
| Hidrológico | Caudal promedio (m3/s) | 0.28 (0.05) | 0.26 (0.05) | 0.29 (0.09) | 0.36 |
| Profundidad promedio (m) | 0.11 (0.02) | 0.12 (0.04) | 0.10 (0.04) | 0.58(0.06) | |
| Ancho promedio (m) | 9.2 (2.2) | 10.4 (1.4) | 10.1 (3.2) | 13.6 | |
| Solidos disueltos totales (mg/l) | 0.0478 | 0.0016 | 0.0160 | 1.000 | |
| Solidos suspendidos (mg/l) | 0.0043 | 0.0001 | 0.0005 | - | |
| Físico | Coeficiente de extinción de la luz (k) | 18.0 | 15.6 | 9.8 | 1.7 |
| Temperatura promedio (ºC) | 27.7 (1.2) | 26.1 (0.2) | 25.4 (0.1) | 25.3(0.5) | |
| Conductividad promedio (uS/cm) | 3.8 (0.2) | 2.4 (0.4) | 3.1 (0.2) | 2.5(0.71) | |
| pH | 5.9 (0.1) | 5.2 (0.2) | 5.8 (0.5) | 5.3(0.01) | |
| Oxígeno disuelto promedio (mg/l) | 7.1 (0.3) | 7.2 (0.2) | 7.2 (0.2) | 2.2(0.1) | |
| Porcentaje de saturación de O2 | 89.8 | 89.5 | 91.4 | 28.1 | |
| Químico | Fósforo reactivo (ug/l PRS) | 5.6 | 5.4 | 5.5 | 16.2 |
| Amonio (ug/l N-NH4) | 9.9 | 24.9 | 23.7 | 10.6 | |
| Nitratos (N-NO3 (mg N/l)) | 0.007 | 0.006 | 0.013 | 0.040 | |
| Materia orgánica total | 3.4 | 5.8 | 2.5 | - | |
| Fosfatos (P-PO4 (mg N/l)) | 0.001 | 0.001 | 0.001 | - |
Dentro de los paréntesis se indican las desviaciones estándar.
Muestreo y procesamiento de las muestras: En enero de 2017, se muestrearon los afluentes de La Lindosa, Tranquilandia y el Rincón de los Toros y en enero del 2018, se llevó a cabo el muestreo del arroyo El Retirito. En cada afluente se estableció un tramo representativo (150-200 m) que contuviera la mayor diversidad de sustratos observados a lo largo de todo el afluente: roca madre (> 100 cm), bloques (25-100 cm), cantos (6-25 cm), guijarros (2-6 cm), gravas (0.2-2 cm), macrófitas (R. clavigera) y hojarasca. Posteriormente, se realizó un muestreo multihábitat según la metodología propuesta por Elosegi y Sabater (2009) utilizando una red Surber de 0,09 m2 de diámetro y 200 µm de abertura de malla. En la campaña del 2017 se tomaron 15 muestras por arroyo y en el 2018, 10 muestras en el arroyo el Retirito, por lo que el esfuerzo de muestreo total correspondió a 55 muestras (3 ríos x 15 muestras + 1 río x 10 muestras). Las muestras fueron preservadas de forma individual en etanol al 96 % en frascos de plástico y llevadas al laboratorio para su posterior estudio taxonómico.
Caracterización de la diversidad taxonómica y funcional de los macroinvertebrados de la Lindosa: La identificación de los ejemplares de macroinvertebrados se realizó hasta el nivel de género mediante las claves de Domínguez y Fernández (2009) y Merritt, Cummins y Berg (2008). Los individuos de la familia Chironomidae fueron aclarados en KOH y montados con Euparal®, para ser determinados con la ayuda de las claves de Wiederholm (1983) y Trivinho-Strixino (2011). Se montaron las pupas y exuvias pupales de algunos taxones para corroborar las determinaciones taxonómicas siguiendo las claves de Prat, González-Trujillo y Ospina-Torres (2014).
Luego de su determinación taxonómica, los organismos fueron clasificados en grupos funcionales tróficos (FFG) de acuerdo a la bibliografía. De ser posible, se restringió la información utilizada a estudios realizados en el neotrópico para evitar la incorrecta categorización de los organismos. Para este propósito, se utilizaron los grupos definidos por Cummins (1973) y las traducciones sugeridas en la revisión de Ramírez & Gutiérrez-Fonseca (2014). Aquellos taxones de los que no se encontró clasificación alguna, fueron etiquetados como “sin información”. Por otro lado, aquellos taxones clasificados en más de un FFG se denominaron como de “hábitos variables”.
Para determinar la completitud de la comunidad, se utilizaron curvas de cobertura estimadas a partir de una matriz de presencias y ausencias (Chao & Jost, 2012). La cobertura es una medida que indica la proporción del número total de individuos en una comunidad que fueron capturados en las muestras (Chao & Jost, 2012). Por otro lado, la diversidad taxonómica se caracterizó mediante la estimación de los tres primeros números de Hill según la propuesta de Chao et al. (2014). Analizar estos tres números en conjunto permite evaluar no sólo la riqueza, entendida como el número efectivo de especies, sino también la dominancia de los diferentes taxones. El primer número de Hill (q = 0) es un equivalente a la riqueza de especies y no le da peso alguno a la abundancia de las especies; el segundo (q = 1) es equivalente al exponencial de la entropía de Shannon y da igual peso a especies dominantes (las de mayor abundancia) y a especies raras; y el tercero (q = 2), es equivalente a la diversidad de Simpson y le da un mayor peso a los taxones dominantes.
Variaciones espaciales en la diversidad: Para caracterizar la variación espacial en la comunidad se utilizaron los datos tomados durante enero del 2017 y 2018 (época seca) con el fin de disminuir la posible influencia de la estacionalidad. La variación de la diversidad fue caracterizada en dos escalas espaciales: entre los ríos (i.e. a escala regional) y dentro de los ríos (i.e. a escala de los sustratos, los cuales son considerados como distintos mesohábitats).
Los cambios en la composición taxonómica y de FFG a escala regional y de mesohábitat fueron explorados mediante un escalamiento multidimensional no métrico (NMDS, Kruskal, 1964) y la existencia de diferencias estadísticamente significativas fue evaluada mediante un análisis de similitudes (ANOSIM, Clarke, 1993). En ambos análisis se utilizó una matriz de distancias estimada con el coeficiente de Morisita-Horn (Horn, 1966), ideal para las matrices de datos de conteos biológicos que cuentan con gran número de ceros. Con el objetivo de quitar el peso de los taxones raros y ocasionales, no fueron considerados en el análisis aquellos géneros con un número de individuos menor a 10.
Variaciones temporales en la diversidad: Para el análisis de la variabilidad temporal en la diversidad se identificaron los individuos provenientes de muestras tomadas en octubre 2014 y abril y octubre 2015 así como de muestreos mensuales realizados en enero, febrero, marzo, abril y junio 2017 (en total, ocho ocasiones de muestreo). Todas las muestras fueron tomadas en el arroyo Tranquilandia bajo el mismo protocolo de muestreo. Aunque la red Surber utilizada fue la misma (0,09 m2 de diámetro y 200 micras de abertura de malla) el número de muestras tomadas en cada periodo varió, por lo que las abundancias en las muestras fueron ajustadas a la mayor área común (0.45 m2 - equivalente al área de 5 muestras de Surber).
Los cambios en la diversidad alfa fueron evaluados en términos de la riqueza y la diversidad de Simpson. Mientras que cambios en la composición fueron evaluados mediante el análisis de la diversidad beta calculada a partir del índice de Sørensen. La diversidad beta es una medida del grado de variación entre dos muestras en términos de la composición de especies. El índice de Sørensen, en particular, evalúa la variación de la composición de especies sin considerar sus abundancias, lo que disminuye el posible efecto de la diferencia en el número total de individuos recolectados en cada campaña de muestreo. Adicionalmente, permite descomponer esta variabilidad en dos componentes que brindan luces a la hora de generar hipótesis sobre los fenómenos ecológicos que subyacen los patrones observados: el anidamiento y el recambio. El anidamiento ocurre cuando las comunidades con menor número de especies son subconjuntos de las más ricas, lo que refleja una pérdida de especies resultado de un proceso no aleatorio; por otra parte, el recambio implica que algunas especies son reemplazadas por otras como consecuencia de filtros ambientales o de limitaciones históricas o espaciales (Baselga, 2010). Todos los análisis descritos fueron realizados en R v3.4.2 utilizando los paquetes “vegan” (Oksanen et al., 2017), “iNEXT” (Chao et al., 2014; Hsieh, Ma, & Chao, 2016) y “betapart” (Baselga et al., 2018).
Resultados
Caracterización de la diversidad taxonómica y funcional de los macroinvertebrados de la Lindosa: En total se contabilizaron 13 036 individuos distribuidos en 89 géneros pertenecientes a 41 familias y 10 órdenes de invertebrados acuáticos (Apéndice digital 2). En la Tabla 2 se presenta la riqueza de géneros y la abundancia de individuos de cada arroyo. El orden más representativo fue Diptera con 9 familias y 9 380 individuos identificados, seguido de Trichoptera (9 familias y 1 385 individuos) y Ephemeroptera (6 familias y 1 012 individuos). La familia Chironomidae presentó la mayor riqueza (26 géneros) y abundancia (6 685 individuos), seguido en riqueza por la familia Elmidae (9 géneros) y en abundancia por la familia Simulidae (2 582 individuos) y Baetidae (727 individuos). Cuatro géneros se registran por primera vez para el país: Luchoelmis (Elmidae), Macropelopia y Phaenopsectra (Chironomidae) y Mayatrichia (Hydroptilidae).
TABLA 2 TABLE 2 Promedio por muestra y número total de géneros y abundancia de individuos encontrados en cada punto de estudio y clasificados en cada grupo funcional trófico (FFG) The average number of genders and abundance of individuals found in the studied streams and classified in each functional feeding group (FFG)
| Géneros | Número de Individuos | Abundancia relativa (%) | |
| Retirito | 43 | 1 470 | 11.3 |
| La Lindosa | 50 | 3 371 | 25.9 |
| Rincón de los Toros | 53 | 5 290 | 40.6 |
| Tranquilandia | 38 | 2 905 | 22.3 |
| Grupo Funcional Trófico (FFG) | |||
| Depredador | 26 | 888 | 7.3 |
| Filtrador | 3 | 14 | 34.3 |
| Fragmentador | 6 | 518 | 2.0 |
| Raspador | 10 | 1 399 | 15.8 |
| Recolector | 21 | 6 440 | 25.7 |
| Sin información | 6 | 24 | 0.2 |
| Hábitos variables | 17 | 3 753 | 14.8 |
En lo que respecta a los FFG (Tabla 2; Apéndice digital 2, Tabla 1) los depredadores presentaron la mayor riqueza (26 géneros) mientras que la menor riqueza correspondió a los filtradores (3 géneros). Por otro lado, los recolectores fueron los más abundantes (6 440 individuos) y los filtradores los menos abundantes (14 individuos). El análisis de completitud indicó una cobertura de más del 90 %, lo que indica que el muestreo permitió capturar una gran proporción de los taxones que habitan en los cuatro arroyos (Fig. 1A, Apéndice digital 1). A menor escala, no todos los sustratos alcanzaron coberturas mayores al 80 %, siendo la roca madre y las macrófitas los mejor representados (Fig. 1B, Apéndice digital 1).
Variaciones espaciales en la diversidad: Se registraron diferencias en términos de diversidad alfa y composición de especies en las dos escalas espaciales de estudio. A escala regional (Fig. 2A), los cuatro arroyos presentaron comunidades con grados de dominancia similares, siendo La Lindosa y el Rincón de los Toros los arroyos con mayor riqueza de taxones. Dentro de cada río (Fig. 2B), la roca madre presentó el mayor número de géneros, pero según lo observado en q = 1 y q = 2, sólo algunos géneros concentran la mayor abundancia. Otros sustratos como la hojarasca y las macrófitas, tienen estimaciones de riqueza altas, pero sin marcadas diferencias entre q = 0, q = 1 y q = 2.
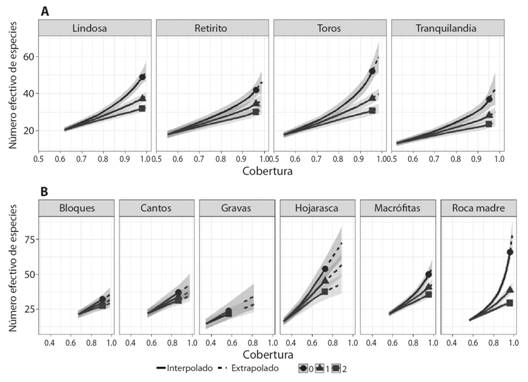
Fig. 2. Fig. 2. Estimación del número efectivo de especies como función de la cobertura de acuerdo a los tres primeros números de Hill (q = 0, q = 1 y q = 2) para arroyos (A) y mesohábitats (B). Las áreas sombreadas corresponden a intervalos de confianza del 95 %. Estimation of the effective number of species as a function of the coverage according to the first three numbers of Hill (q = 0, q = 1 and q = 2) at the stream (A) and mesohabitat (B) level. The shaded areas corresponded to 95 % confidence intervals.
De acuerdo al ANOSIM, la composición de las comunidades fue distinta entre sustratos (R = 0.210, p = 0.007) y entre ríos (R = 0.439, p= 0.001). Asimismo, la ordenación del NMDS (Fig. 3A) mostró una separación clara entre arroyos, dentro de los cuales a su vez se evidencia mayor cercanía entre las muestras tomadas en el mismo sustrato, especialmente de aquellas que corresponden a roca madre. En relación a los FFG, el ANOSIM mostró la existencia de diferencias entre ríos (R = 0.285, p = 0.001) pero no entre los tipos de sustrato (R = 0.100, p = 0.072). Esto se refleja en el NMDS (Fig. 3B), donde si bien la Lindosa parece separarse del resto de los arroyos, no se observan diferencias entre los distintos tipos de sustratos en términos de la composición de la comunidad.
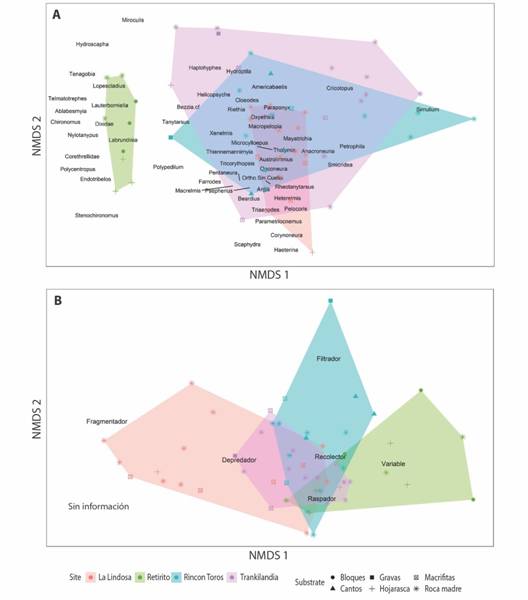
Fig. 3.(A) Fig. 3 Ordenación (NMDS) de las muestras de acuerdo a la composición de géneros de la comunidad de macroinvertebrados acuáticos. Distancia: Morisita-Horn. Estrés de la ordenación: 0.19. Ajuste no métrico, R2 = 0.968. (B) Ordenación (NMDS) de las muestras de acuerdo a la clasificación en FFG de la comunidad de artrópodos acuáticos. Estrés de la ordeación: 0.13. Ajuste no métrico, R2 = 0.984. (A) Ordination (NMDS) of the samples according to the composition of genera of the aquatic invertebrate community. Distance: Morisita-Horn. Ordination stress: 0.18. Non-metric adjustment, R2 = 0.968. (B) Ordination (NMDS) of the samples according to the FFG classification of the aquatic invertebrate community. Ordination stress: 0.13. Non-metric adjustment, R2 = 0.984.
Variaciones temporales en la diversidad: Se observaron cambios en la diversidad alfa y beta a lo largo de los años y los meses en el punto de estudio. Dentro de los ocho periodos evaluados (Fig. 4A), la mayor riqueza de géneros ocurrió durante el período de menor precipitación (enero 2017), mientras que los menores valores se observaron en la época de mayores precipitaciones (febrero-abril). En general, la diversidad beta entre muestreos fue alta (Fig. 4B). Entre 2014 y 2015 los procesos de recambio determinaron mayormente la diversidad beta observada, mientras que entre el 2015 y 2017 y a lo largo del 2017 el anidamiento fue el componente predominante en la diversidad beta.
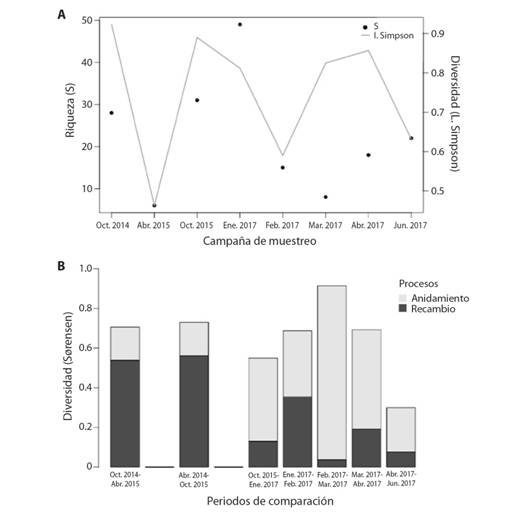
Fig. 4. Fig. 4 Cambios temporales de la comunidad de macroinvertebrados en el caño Tranquilandia en términos de la diversidad alfa por campaña de muestreo (A), y de la diversidad Beta entre campañas (B). La diversidad Beta fue descompuesta en términos de los procesos de recambio y anidamiento. Seasonal changes of the macroinvertebrate community in the Tranquilandia stream measured as alpha diversity per sampling campaign (A), and Beta diversity between campaigns (B). Beta diversity was partitioned in terms of turnover and nestedness
Discusión
La caracterización taxonómica mostró que la zona de estudio tiene una alta diversidad. La riqueza observada (89 géneros) fue mayor a la reportada para la Serranía de la Macarena (74 géneros), el río Bita (87 géneros) y otros ecosistemas fluviales en la Guayana venezolana (ver Mora-Day & Blanco-Belmonte, 2008; Pereira, Garcia, Marcano, Lasso-Alcalá, & Martínez-Escarbassiere, 2006; Souki et al., 2015). Asimismo, se observó que en la zona confluyen elementos de distintas regiones biogeográficas. Algunos de los géneros reportados en este trabajo han sido anteriormente asociados a la región de la Guayana (e.g. Scaphydra (Laython, 2017)), mientras que otros son de distribución andina (e.g. Parametriocnemus (Acosta & Prat, 2010)) o amazónica (e.g. Leptohyphodes o Tricorythopsis (Domínguez, Zúñiga, & Molineri, 2002)).
En cuanto a los cuatro nuevos registros para el país, se encontraron las siguientes consideraciones en su distribución geográfica. Se registra un nuevo género de la familia Elmidae: Luchoelmis. Este registro representa una importante ampliación de su distribución ya que esta estaba restringida al sur del continente, particularmente en Argentina, Chile y Bolivia (Archangelsky & Brand, 2014). Con relación a los nuevos registros de la familia Chironomidae, Macropelopia es un género cuya distribución reportada es predominantemente Paleártica (Cranston & Epler, 2013), no obstante, también ha sido reportado en Cuba (Bello González, Spies & Téllez Martínez, 2013) y en Brasil (Rosa, Dias-Silva, & Alvez, 2013), lo que sugería que una distribución más amplia. En el caso de Phaenopsectra, este sí había sido reportado previamente en Brasil y en la región andina (Acosta & Prat, 2010; Henriques-Oliveira, Nessiman & Dorvillé, 2003), por lo que su distribución se amplía a la región orinocense. Finalmente, el género Mayatrichia, del orden Trichoptera, ha sido reportado principalmente en norte y centro américa y una especie, M. illobia, en el sur del Ecuador (Holzenthal & Calor, 2017).
En lo que respecta a la caracterización trófica, esta primera aproximación mostró afinidad con la hipótesis de que los fragmentadores no son un grupo muy representado en la región tropical (e.g. Dobson, Magana, Mathooko, & Ndegwa, 2002). No obstante, es una afirmación que merece ser estudiada en un futuro ya que, si bien la información secundaria consultada proviene principalmente de estudios Neotropicales, muchos de los géneros encontrados pueden tener una alta variabilidad intra- e interespecífica de su dieta (Tomanova, Goitia, & Helešic, 2006; Boyero, Ramírez, Dudgeon, & Pearson, 2009). Estas descripciones de la dieta deben asimismo ir acompañadas de un estudio más profundo de la morfología y el comportamiento de los organismos, con el fin de asignar los FFG de una manera más precisa (Ramírez & Gutiérrez-Fonseca, 2014).
A pesar de la cercanía geográfica de los puntos de estudio y de sus aparentes características regionales similares (p.e. predominancia de roca madre, bajas conductividades, entre otras), se observó una alta variabilidad en la composición de la comunidad al comparar entre ríos. Esto podría estar asociado tanto a la baja capacidad dispersión de los taxones como a la influencia de características ambientales a pequeña escala (p.e. a escala de mesohábitat). Las restricciones a la dispersión son un factor relevante para explicar la alta disimilitud entre ríos que pertenecen a una misma red drenaje (Tonkin et al., 2018). Sin embargo, la falta de información acerca de la dispersión de las especies no nos permite evaluar el rol de este proceso en los patrones observados. Estudios futuros podrían ahondar en las habilidades de dispersión de las especies y cómo afectan los patrones de diversidad a escala regional.
Por otra parte, la variabilidad entre mesohábitats de un mismo río sugiere que la composición de la comunidad podría estar determinada por factores que actúan a pequeña escala. En particular, cambios en la diversidad alfa y en la composición de taxones indican que el tipo de mesohábitat podría ser determinante. Los mesohábitats tienen condiciones únicas en términos de tipo de sustrato, recursos y estrés hidráulico (Pardo & Armitage, 1997), y por tanto promueven la compartimentalización de la comunidad, donde cada taxón tiene alta afinidad por cierto tipo de mesohábitat. Esto ha sido descrito previamente en otros ríos Neotropicales (p.e. Silva et al., 2014; González-Trujillo, 2016) y apoya la idea de que los muestreos multihábitat son necesarios para caracterizar adecuadamente la diversidad a escala local y regional, como ha sido sugerido en otras regiones del mundo (e.g. Pardo & Armitage, 1997).
Encontrar que la variación en la composición de los FFG sea significativa a escala regional pero no con respecto a los mesohábitats parece ser contradictorio con los resultados obtenidos al analizar la composición taxonómica de la comunidad. De hecho, difiere de lo registrado por otros estudios donde se ha establecido una fuerte relación entre tipos sustratos y grupos funcionales alimenticios (Demars, Kemp, Friberg, Usseglio-Polatera, & Harper, 2012). Este resultado podría indicar que otras características diferentes al tipo de recurso (característica principal para definir mesohábitats en este estudio) tienen una mayor influencia sobre la presencia o ausencia de los grupos funcionales. Esto se soporta en otros estudios que han encontrado que las condiciones hidraúlicas podrían ser casi o más importantes que el tipo de recurso (Beisel et al., 1998; González-Trujillo, 2016; Silva et al., 2014; Tomanova et al., 2006).
La predominancia del anidamiento a lo largo del año 2017 parece indicar que existió una fuerte influencia de filtros ambientales relacionados con la estacionalidad (Baselga, 2010). Esto en conjunto con la disminución en la riqueza durante los meses de mayor cambio en el volumen de precipitaciones (febrero y marzo), sugieren que el anidamiento podría estar causado por una pérdida de especies a causa del aumento de eventos de creciente.
Los procesos de recambio en los meses de octubre a abril, por otra parte, podrían estar dados por cambios en la disponibilidad de los sustratos asociados también a la estacionalidad. La proliferación de las macrófitas (R. clavijera) durante los meses más lluviosos, que actúan como sustrato de colonización y refugio ante los aumentos en el caudal (Pardo & Armitage, 1997, Huttunen et al., 2017), podrían promover el establecimiento de nuevo taxones. Como lo demuestran los resultados, los parches de R. clavijera parecen tener una comunidad con una composición de taxones característica.
En conjunto, los resultados de este estudio demuestran que los ríos de la Serranía de la Lindosa albergan una alta diversidad de macroinvertebrados acuáticos. La estacionalidad y las diferencias en la heterogeneidad del hábitat dentro de los ríos parecen determinar los patrones de diversidad observados en escalas temporales y espaciales. Profundizar en su estudio es necesario para entender el funcionamiento de estos ecosistemas y mejorar la habilidad para generar estrategias de manejo y conservación.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.
Apéndice digital 1











 uBio
uBio 

