Introducción
La moneda o pez dólar, Metynnisorinocensis (Steindachner, 1908) tiene una participación en el mercado del 5 % de las exportaciones nacionales, con un equivalente aproximado de 3 millones de individuos por año (Arias, 2008). Sin embargo, entre el 70 y 80 % de peces de acuarios que son exportados en Colombia, provienen principalmente de los ríos Orinoco, Meta, Guaviare, Vichada e Inírida, más del 90 % son capturados del medio natural, lo que ha generado una disminución considerable de las poblaciones ícticas con potencial económico, panorama atribuido principalmente al desconocimiento de la biología básica de las especies y la falta de estudios que permitan el desarrollo de sistemas de cultivo a gran escala (Landines, Sanabria, &Daza, 2007).
La constate expansión del sector productivo de peces ornamentales y la creciente demanda tanto en los mercados internos como externos dependen de la intensificación de los sistemas de producción y de la generación de tecnologías apropiadas. Por eso, es necesario el conocimiento de los requerimientos nutricionales de cada especie a producir para formular dietas balanceadas que puedan satisfacer estas necesidades (Sales & Janssens, 2003).
Para determinar los requerimientos nutricionales en peces es necesario analizar en todos los aspectos detalles tales como, palatabilidad, tamaño de la partícula, estabilidad en el agua, concentración de nutrientes y energía (NRC, 1993; Lovell, 1998). Este proceso inicial se debe hacer con dietas experimentales, que deben ser formuladas con ingredientes semi-purificados de composición química bien conocida, permitiendo el control completo del efecto del nutriente evaluado (Gutiérrez-Espinosa, Velasco-Garzón, & León-Morales, 2019). Establecer el requerimiento de proteína es el primer paso debido a que este nutriente es el principal constituyente estructural de los tejidos; particularmente, son la base estructural de la materia viva y por ello esencial para el mantenimiento y crecimiento. Del 65 al 75 % del total de materia seca del cuerpo de un pez está compuesto por proteína y adicionalmente, es el componente más costoso en las dietas comerciales. Además, la proteína dietaría es usada en la formación de enzimas, hormonas, neurotransmisores, el mantenimiento de la homeostasis y salud de los peces (NRC, 1993; Zuanon et al., 2006). Las dietas con deficiencia de proteínas o aminoácidos esenciales causan una reducción en el crecimiento de los peces, debido, a que se reduce la síntesis de proteínas, mientras que, en exceso solo una parte de esta podrá ser usada para la producción de nuevas proteínas y el restante como fuente de energía se deposita como tejido adiposo (Bureau,Hua, & Azevedo, 2008; Molina-Poveda, 2016). La energía es producto de la desaminación de aminoácidos (AA) para producir amonio y un esqueleto de carbono (ceto-ácido). Entonces, excesos de la proteína en la dieta causa un incremento en la excreción branquial de nitrógeno amoniacal por el pez incrementando la eutrofización del agua y los efluentes (Ribero, Rodrigues, & Fernandes, 2007; Zuanon, Salaro, & Furuya, 2011).
El conocimiento de los requerimientos de proteína permite el uso de dietas más equilibradas para cada especie, mejorando los parámetros productivos, reduciendo la eutrofización del agua y el costo de las dietas. Además, contribuye a la reducción del uso de alimento vivo en algunas especies y permite la tecnificación de sistemas intensivos en piscicultura ornamental (Zuanon et al., 2013).
La nutrición y alimentación son puntos críticos de la industria de peces ornamentales y han recibido muy poca atención, generando una falencia del conocimiento de las necesidades nutricionales de las especies ornamentales en Colombia, lo que conlleva en gran medida a la extrapolación de los requerimientos nutricionales de peces de consumo o incluso a usar dietas comerciales destinadas a tilapia o trucha (Wedler, 1998; Arias, 2008). Por lo tanto, el objetivo de este estudio fue determinar el requerimiento de proteína en jovenes de Metynnis orinocensis.
Materiales y métodos
Localización: El experimento se llevó a cabo en la Universidad de los Llanos, ubicado en el kilómetro 4 vía a Puerto López, en la vereda Barcelona del Municipio de Villavicencio, departamento del Meta, Colombia (4°04’30’’ N & 73°35’07’’ W). Se encuentra ubicada a 418 m.s.n.m., con una temperatura ambiente promedio anual de 25º C y una precipitación pluvial media de 4 050 mm, una humedad relativa de 75 %.
Material biológico: Fueron seleccionados 425 alevinos de M. orinocensis, con peso promedio de 0.5 ± 0.1 g y longitud total promedio de 2.7 ± 0.3 cm, provenientes del municipio de Puerto Gaitán, Meta. Los peces fueron capturados con chinchorro en esteros y morichales en el período de aguas bajas (julio-agosto). Como medidas profilácticas, los peces fueron sometidos a baños de inmersión por 5 minutos en una solución con metronidazol (5 mg/L) y azul de metileno (1 mg/L) para luego ser puestos en cuarentena durante una semana. Posteriormente, las monedas fueron distribuidas aleatoriamente en siete tratamientos con tres réplicas para cada uno, en un sistema de recirculación cerrado con aireación constante. El sistema constaba de 21 acuarios aforados en 17 L c/u, con 4 filtros en serie de 40 litros cada uno, conectados a dos hidrobombas de ½ hp que suplieron un flujo continuo de agua de 0.5 L/min para cada acuario Se manejó una densidad 1 pez/L. Los peces fueron alimentados hasta aparente saciedad 2 veces al día (8:00 y 17:00) durante 60 días, registrando el consumo diario de alimento. Los datos de peso, longitud estándar y longitud total fueron tomados al inicio y al final del experimento. Se midieron y registraron los valores de pH, temperatura (°C), conductividad (µl) y sólidos totales (ppm) durante todo el experimento.
Dietas experimentales: Se formularon siete dietas variando el nivel de proteína (20, 24, 28, 32, 36, 40 y 44 % PB) conforme a la Tabla 1. Se emplearon ingredientes semi-purificados, siguiendo las recomendaciones de la literatura (Tacon, 1987; NRC, 1993; Fracalossi, Oeda, Silva, & Cyrino, 2013). Para los diferentes niveles de proteína se mantuvo constante la proporción de caseína 98.2 % y gelatina 10.8 %; la dextrina fue ajustada para mantener una relación proteína/energía de 100 mg/kcal. Como fuente de lípidos se usó la mezcla de aceite vegetal y de pescado en proporciones iguales para todas las dietas. Se adicionó una premezcla de vitaminas y minerales. Como material inerte no digestible se usó la celulosa microcristalina. En la preparación de las dietas los diferentes ingredientes fueron mezclados, humedecidos (20-35 %), homogenizados en un molino, para luego pasar la mezcla por el proceso de extrusión a 123 °C (Micro-extrusora Exteec®, Riberão Preto -Brasil). Las dietas fueron secadas por 24 horas en el laboratorio a 18 °C para luego ser almacenadas y suministradas a los peces.
Durante la fase experimental los peces mostraron una aceptación total de las dietas al cuarto día de alimentación. Se observó un comportamiento nervioso durante la primera semana de alimentación, caracterizado por presentar reflejo de huida con movimientos bruscos por todo el acuario, por lo que se brindó alimento por toda la superficie del acuario, dando un tiempo de diez minutos donde los peces permanecían solos para garantizar la tranquilidad y el consumo de alimento por todos los individuos en cada uno de los tratamientos.
TABLA 1 Composición de las dietas experimentales para M. orinocensis
| Ingrediente | Nivel de proteína en la dieta (%) | ||||||
| 20 | 24 | 28 | 32 | 36 | 40 | 44 | |
| Caseína1 | 21.2 | 25.4 | 29.6 | 33.8 | 38.1 | 42.3 | 46.5 |
| Gelatina2 | 2.6 | 3.1 | 3.6 | 4.1 | 4.6 | 5.1 | 5.6 |
| Dextrina | 12.1 | 17.5 | 22.9 | 28.2 | 33.6 | 39.0 | 38.5 |
| Alfa-Celulosa | 54.8 | 44.7 | 34.5 | 24.5 | 14.3 | 4.2 | 0.0 |
| Aceite vegetal | 2.6 | 2.6 | 2.6 | 2.6 | 2.6 | 2.6 | 2.6 |
| Aceite pescado | 2.6 | 2.6 | 2.6 | 2.6 | 2.6 | 2.6 | 2.6 |
| Macrominerales4 | 3.8 | 3.8 | 3.8 | 3.8 | 3.8 | 3.8 | 3.8 |
| Micro min + Vit3 | 0.3 | 0.3 | 0.3 | 0.3 | 0.3 | 0.3 | 0.3 |
| Vit C5 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 |
| Composición proximal6 | |||||||
| Matéria seca (% dieta) | 93.7 | 92.8 | 91.9 | 91.7 | 91.0 | 90.6 | 90.6 |
| Proteína Bruta (Nx6.25) | 20.6 | 24.6 | 28.7 | 33.5 | 37.8 | 42.2 | 45.6 |
| Lipídios | 5.2 | 5.2 | 5.2 | 5.2 | 5.2 | 5.2 | 5.2 |
| Cenizas | 2.7 | 2.8 | 2.9 | 3.0 | 3.1 | 3.2 | 3.3 |
| Energia Bruta (Kcal/kg) 7 | 2 406 | 2 858 | 3 327 | 3 737 | 4 310 | 4 792 | 5 110 |
| EM8 | 1 960 | 2 360 | 2 764 | 3 160 | 3 564 | 3 964 | 4 128 |
| Relación P/E (mg/kcal)9 | 105 | 104 | 104 | 106 | 106 | 106 | 110 |
1Composición analizada: MS 93 %; PB 83.2 %; lípidos 2.29 %, cenizas 3.66 %.
2Composición analizada: MS 91 %; PB 94.02 %.
3Rovimix Tilapias O DSM Nutritional Products Colombia S.A: Vit A 750 KUI, Vit D3 375 KUI, Vit E 10 833 mg, Vit K3 1 666 mg, Vit B1 1 833 mg, Vit B2 2 916mg, Vit B 1 833 mg Vit B12 3 mg, Vit C 41 666 mg, Niacina 7 500 mg, Ac. pantotenico 8 333 mg, Ac. Folico 833 mg, Biotina 166 mg, Cobre 2 500 mg, Hierro 28 333 mg, Manganesio 2 500 mg, Yodo 0.167 mg, Zinc 21 666 mg, Selenio 66.7 mg, Magnesio 91 666 mg, Inositol F.G. 58 333 mg, Luctanox E 25 g.
4Composición por 100 g de mezcla: Ca(H2PO4) 13.6 g; Lactato de Ca 34.85 g; 2MgSO 4.7 g H2O, 13.2 g; KH2PO4 24 g; NaCl 4.5 g; AlCl3 0.015 g, CMC 9 835 g.
5Stay-C, O DSM Nutritional Products Colombia S.A.
6Los valores se presentan como la media de 3 repeticiones.
7Determinada por bomba calorimétrica, descontando la energía aportada por la alfa- celulosa (4 120 Kcal/kg).
8Energía metabolizable, calculada por valores fisiológicos estándar, donde 1 g de carbohidratos, proteína y lípidos produce 4.4 y 9 kcal, respectivamente (Lee & Putnam, 1973).
9Proteína cruda/energía metabolizable.
Análisis de laboratorio: La composición de las dietas experimentales se presenta en la Tabla 1. La materia seca fue determinada mediante el secado de las muestras 105 °C por 12 horas, cenizas por incineración a 550 °C, lípidos por extracción con éter, proteína por método de Kjeldahl (Nx6.25), para los análisis se siguieron las metodologías establecidas por la Association of Official Agricultural Chemists (AOAC, 1995), y energía bruta por combustión en bomba calorimétrica PARR® (6 200 EA, USA).
Parámetros zootécnicos: Los siguientes parámetros fueron evaluados: ganancia de peso (Gp = peso final - peso inicial), consumo de alimento(FI = materia seca ingerida/días del experimento), Incremento de longitud (IL = longitud final - longitud inicial), conversión alimenticia aparente (CAA = Materia seca ingerida/ganancia de peso), tasa específica de crecimiento (SGR = 100 x (Ln(Peso final) - (Ln(Peso inicial))/días del experimento), tasa de eficiencia proteica (PER = ganancia de peso /proteína consumida)y sobrevivencia (S = 100 x (peces finales/peces iniciales).
Los datos de ganancia de peso, FI, IL, CAA, SGR, PER y sobrevivencia fueron sometidos a análisis de varianza (ANOVA) de una vía y las diferencias significativas entre tratamientos fueron determinadas por prueba de Tukey (P < 0.05). Adicionalmente, el requerimiento de proteína fue estimado, mediante la ganancia de peso, por un análisis de regresión polinomial de segundo orden utilizando el modelo y = a + bx + cx2, donde y = valor promedio de la variable por tratamiento, a= intercepto, b y c son los coeficientes de regresión y x= proporción de proteína en las dietas experimentales. El análisis estadístico fue realizado mediante el software estadístico IBM SPSS para Windows (IBM Corp, 2012).
Resultados
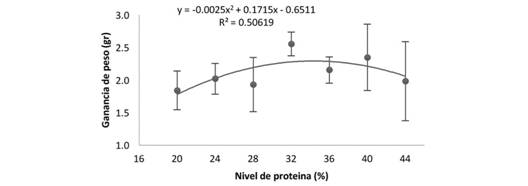
Los resultados de desempeño productivo de los jovenes son resumidos en la Tabla 2. La sobrevivencia no se vio afectada por ninguno de los tratamientos utilizados (P > 0.05). Sin embargo, se evidencia que fue mayor del 94 % para todos los tratamientos a excepción del tratamiento alimentado con 44 % de proteína que presentó 88.2 ± 11.8 %. Los datos de crecimiento muestran que se presentó un incremento gradual en la ganancia de peso en relación con el nivel de proteína en la dieta hasta un máximo de ganancia de 2.56; 0.18 g en los peces alimentados con 32 % de PB a diferencia de la dieta de 20 % de PB que mostró los menores valores de ganancia de peso (1.84 ± 0.3 g).
TABLA 2 Parámetros de desempeño productivo de Metynnisorinocensis
| Parámetros | Nivel de proteína en la dieta (%) | ||||||
| 20 | 24 | 28 | 32 | 36 | 40 | 44 | |
| Peso inicial (g) | 0.5 ± 0.1 | 0.5 ± 0.1 | 0.5 ± 0.1 | 0.5 ± 0.1 | 0.5 ± 0.1 | 0.5 ± 0.1 | 0.5 ± 0.1 |
| Lt inicial (cm)1 | 2.7 ± 0.3 | 2.7 ± 0.3 | 2.7 ± 0.3 | 2.7 ± 0.3 | 2.7 ± 0.3 | 2.7 ± 0.3 | 2.7 ± 0.3 |
| Peso final (g) | 2.3 ± 0.3 | 2.5 ± 0.2 | 2.4 ± 0.4 | 3.0 ± 0.3 | 2.7 ± 0.2 | 2.9 ± 0.5 | 2.5 ± 0.6 |
| Lt final (cm) | 4.8 ± 0.2 | 4.9 ± 0.1 | 4.8 ± 0.2 | 5.2 ± 0.1 | 4.8 ± 0.2 | 5.0 ± 0.3 | 4.7 ± 0.3 |
| FI (g) | 5.3 ± 0.1 | 5.6 ± 0.6 | 4.8 ± 0.2 | 5.5 ± 0.2 | 4.4 ± 0.4 | 4.6 ± 0.4 | 4.9 ± 0.5 |
| GP (g)2 | 1.8 ± 0.3 | 2.0 ± 0.2 | 1.9 ± 0.4 | 2.6 ±0.2 | 2.2 ± 0.2 | 2.4 ± 0.5 | 1.9 ± 0.6 |
| IL (cm)3 | 2.1 ± 0.2 | 2.2 ± 0.1 | 2.1 ± 0.2 | 2.5 ± 0.1 | 2.1 ± 0.2 | 2.3 ± 0.3 | 2.0 ± 0.3 |
| CCA4 | 2.9 ± 0.4 | 2.8 ± 0.5 | 2.6 ± 0.5 | 2.1 ± 0.2 | 2.1 ± 0.3 | 1.9 ± 0.3 | 2.6 ± 0.9 |
| TCE5 | 2.5 ± 0.2 | 2.7 ± 0.1 | 2.6 ± 0.3 | 2.9 ± 0.1 | 2.7 ± 0.1 | 2.8 ± 0.3 | 2.6 ± 0.4 |
| PER6 | 1.7 ± 0.3b | 1.5 ± 0.2ab | 1.4 ± 0.3ab | 1.4 ± 0.2ab | 1.3 ± 0.2ab | 1.2 ± 0.2ab | 0.9 ± 0.3a |
| S (%)7 | 94.1 ± 5.9 | 94.1 ± 5.9 | 96.1 ± 3.4 | 96.1 ± 6.8 | 96.1 ± 3.4 | 98.0 ± 3.4 | 88.2 ± 11.8 |
1Lt: Longitud total; 2GP: Ganancia de peso; 3IL: Incremento de longitud; 4CCA: Conversión alimenticia aparente; 5TCE: Tasa especifica de crecimiento; 6PER: Tasa de eficiencia proteica; 7S: Sobrevivencia. Los valores corresponden a la media ± desviación estándar de tres repeticiones por tratamiento, los Promedios con letras diferentes en el superíndice de las filas presentan diferencia estadística significativa (P < 0.05). Las pruebas de normalidad y homogeneidad de varianzas reportaron valores de P > 0.05.
Para la conversión alimenticia aparente los valores no presentaron diferencia estadística significativa (P > 0.05). No obstante, los datos obtenidos en M. orinocensis muestran una disminución progresiva de CAA a medida que se incremente el nivel de proteína del 20 % (2.9 ± 0.4) hasta el tratamiento con 40 % de PB (1.9 ± 0.3), a diferencia del tratamiento con 44 % PB que presentó un incremento considerable (2.6 ± 0.9). La PER difirió significativamente (P < 0.05) decreciendo gradualmente a medida que incrementó el nivel de proteína en la dieta, variando de 1.7 ± 0.26 (20 % PB) a 0.92 ± 0.39 (44 % PB).
En cuanto al incremento de longitud los valores no mostraron diferencia estadística significativa (P > 0.05). Sin embargo, los peces que fueron alimentados con el tratamiento de 32 % de PB presentaron los mayores valores de IL, con 2.52 ± 0.13 cm, a diferencia de los tratamientos alimentados con 20 % (2.06 ± 0.22 cm), 28 % (2.07 ± 0.23 cm) y 44 % (2.04 ± 0.31 cm).
La relación entre el nivel de proteína de la dieta y la ganancia de peso (Fig. 1) fue descrita por la ecuación Y = -0.0025x2 + 0.1715x - 0.6511, donde Y = GP y X = % de PB. Por lo tanto, el nivel de proteína óptimo para el máximo valor de ganancia de peso fue calculado derivando la función de GP = β 0 + β 1 *X + β 2 *(X) 2 e igualándola a cero. Entonces: δGP/δPB = 0.1715 - (2*0.0025) * PB = 0, al despejar se encontró que PB = 0.1715/0.005 = 34.3. Encontrando que la mayor ganancia de peso se obtiene con 34.3 % de PB y que por encima de este valor se presenta una disminución progresiva.
Discusión
La variación del requerimiento de proteína dentro de las diferentes especies de peces esta atribuido a factores como: los hábitos de alimentación, el estado fisiológico del animal, los ingredientes de la dieta, las condiciones experimentales, la temperatura ambiental, la homogeneidad de los peces, los criterios de respuesta, la frecuencia de alimentación, los modelos estadísticos usados, entre otros (Zhang et al., 2008). Por lo tanto, en el desarrollo de esta investigación estas condiciones se mantuvieron controladas dentro de los rangos descritos para la especie.
Según Gatlin III (2010) el satisfacer los requerimientos dietarios de proteína o la mezcla balanceada de aminoácidos es fundamental para el crecimiento y la salud de los peces. No obstante, proporcionar en las dietas niveles superiores a los requeridos de proteína genera un impacto ambiental y económico negativo, debido a que la proteína es el nutriente más costoso en la formulación de raciones y su exceso aumenta la excreción de compuestos nitrogenados. Para la determinación de los requerimientos en peces por lo general se utiliza el método de dosis vs respuesta. En el presente estudio los peces fueron alimentados con dietas elaboradas con los mismos ingredientes, pero con diferentes niveles de proteína, evaluando el efecto que genera en el animal. Aunque son varios los parámetros productivos que se evalúan como respuesta, la ganancia de peso es el más usado para la determinación del requerimiento de este nutriente. Los modelos de línea quebrada (rectilíneos) y lineales las herramientas matemáticas más usadas para determinar este requerimiento (Fracalossi et al., 2013).
Diferentes estudios sobre requerimientos nutricionales en peces no reportan rechazo ni disminución del consumo al ser alimentados con dietas balanceadas con ingredientes semi-purificados (López-Ortiz, 2002; Vásquez-Torres, Pereira-Filho, & Arias-Castellanos, 2011; Neto & de Borba, 2013) un comportamiento similar fue evidente en este trabajo.
En las condiciones experimentales de esta investigavión, el requerimiento óptimo de proteína resulto ser de 34.3 % PB para jovenes de Metynnisorinocensis correspondiente a la máxima ganancia de peso. Este valor es comparable con diferentes especies de la Familia Characidae como es el caso de Piaractusbrachypomus que para alcanzar su máximo crecimiento requieren dietas con 31.6 % de PB (Vásquez-Torres et al., 2011), mientras que en Brycon siebenthalae y Bryconamazonicus el máximo crecimiento se obtiene con niveles de 21 % PB y 3.2 kcal/g (López-Ortiz, 2002; Arias, 2006), en Colossomamacropomum los mejores resultados de desempeño zootécnico fueron obtenidos con 30 % PB (Oliveira, Miranda, & Correa, 2013); en Piaractus mesopotamicus el requerimiento de proteína en jovenes fueron de 27.1 % PB (Bicudo, Sado, & Cyrino, 2009; Bicudo, Abimorad, & Carneiro, 2013). Esto corrobora que la mayoría de los peces de hábitos herbívoros y omnívoros evaluados, requirieren entre 25 a 35 % de PB en la dieta.
Los resultados de este estudio son comparables con los obtenidos en diferentes especies ornamentales de gran importancia comercial como Trichogaster lalius quienes presentaron un requerimiento de 36.6 % PB (Zuanon et al., 2013), en Pterophyllumscalare diferentes estudios concuerdan con que el requerimiento de proteína en la dieta es de 32 % PB (Zuanon et al., 2006; Ribero et al., 2007; Franca et al., 2017), en Bettasplendens se reportan requerimientos óptimos de 28 % PD con 3 200 kcal/kg DE(Lemos et al., 2014). Es necesario resaltar que la mayoría de estos estudios fueron calculados a través de curvas de dosis vs respuesta, con condiciones experimentales similares y usando dietas semipurificadas. Por otra parte, Revelo (2008) y Arias (2008) recomiendan para la alimentación de jovenes M.orinocensis dietas prácticas con 30 % PB, teniendo en cuenta que con niveles inferiores de proteína los peces tuvieron menor tamaño.
Baldisserotto (2013) describe el tamaño de los peces como un factor biótico que influencia directamente en el crecimiento, afirmando que la tasa metabólica es mayor en peces grandes que en pequeños si es considerado el gasto total del pez. Sin embargo, si se considera la tasa metabólica en función de las unidades de peso (g o Kg) se observa que esta es mayor en peces pequeños, es decir que el gasto energético por unidad de peso es mayor en peces pequeños. Por lo tanto, cuanto menor es el pez mayor será el consumo de alimento para satisfacer su demanda metabólica.
En cuanto a la conversión alimenticia aparente (CAA) en M. orinocensis los resultados se encontraron entre los rangos reportados en peces ornamentales de gran importancia como Trichogasterlalius (de 3.92 a 6.26) (Zuanon et al., 2013), Paracheirodon innesi (de 2.7 a 5.48) (Sealey, Barrows, Casten, & Hardy, 2009), Xiphophorushelleri (de 2.02 a 2.45) (Chong, Ishak, Osman, & Hashim, 2004). En jovenes de Pterophyllumscalare alimentados con dietas prácticas, Ribeiro et al. (2007) encontraron que la CCA fue de 2.09 a 2.58 y Franca et al. (2017) reportan valores entre 1.63 y 1.2. Para peces de consumo de la Familia Characidae, como Piaractusbrachypomus reportaron valor de CAA (1.1) significativamente mejoresen los peces alimentados con 32 % PB (Vásquez-Torres et al., 2011), y para Bryconamazonicus, entre 1.5 y 2.0 en tiempo de cultivo de 4 a 6 meses, cosechando animales entre 400-600 g (Arias, 2006). En la mayoría de estos estudios se presentan resultados similares, de CCA, a los observados en esta investigación encontrándose que a medida que incrementa el nivel de la proteína en la dieta se presenta una disminución progresiva para los valores de la CAA. Esto es debido a que la mayoría de los animales consumen alimentos para satisfacer sus necesidades de nutrientes y energía para el metabolismo basal y el crecimiento. Cuando la dieta es deficiente en energía u otro nutriente esencial para el crecimiento como es el caso de la proteína, los peces pueden compensar esta deficiencia incrementando el consumo de alimento (Hepher, 1993).
Para la tasa especifica de crecimiento (TCE) los valores no presentaron diferencia estadística significativa (P > 0.05), sin embargo, el mayor de los valores observado en este estudio lo presentaron los peces alimentados con el tratamiento de 32 % de PB en la dieta, con valor de 2.98 ± 0.11. Los valores obtenidos de la tasa específica de crecimiento (PER) presentaron diferencia estadística significativa entre los tratamientos (P < 0.05). La PER está influenciada directamente por el nivel de proteína en la dieta y su efecto varía dependiendo la especie. Sin embargo, en el presente estudio la PER tiende a decrecer gradualmente a medida que incrementa el nivel de proteína en la dieta, variando de 1.7 ± 0.26 (20 % PB) a 0.92 ± 0.39 (44 % PB). Aparentemente, esta respuesta está asociada a la falta de energía digestible aportada por fuentes no proteicas, como se observa en los niveles más elevados de inclusión de PB, de tal manera que la proteína tiene que ser parcialmente utilizada como fuente de energía, induciendo a la reducción de valores de PER (Vásquez-Torres et al., 2011).
Los valores de PER obtenidos en esta investigación se comportaron de manera similar a los reportados por Zuanon et al. (2013) para Trichogasterlalius (0.93, 1.16, 1.32, 1.57 y 1.56). Elangovan y Shim, (1997) encontraron para Barbodesaltus valores de 2.68 a 1.17 y Franca et al. (2017) observaron en Pterophyllumscalare valores entre 5.30 ± 0.03 y 4.0 ± 0.08.
En cuanto al incremento de longitud (IL) los valores no mostraron diferencia estadística significativa (P > 0.05). Sin embargo, los peces que fueron alimentados con el tratamiento de 32 % de PB presentaron los mayores valores (2.52 ± 0.13 cm), comparados con los tratamientos alimentados con 20 % (2.06 ± 0.22 cm), 28 % (2.07 ± 0.23 cm) y 44 % (2.04 ± 0.31 cm) de PB. Estos valores son mayores a los reportados por Revelo (2008) para M. orinocensis que fueron de 1.91 ± 0.54 cm y 1.32 ± 0.69 cm alimentados con dietas prácticas de 20 y 30 % PB, respectivamente, durante un período experimental de 60 días. En comparación con otras especies de peces ornamentales Daza (2007)reportó que Hemigrammus huaanuary cf alimentados con dietas prácticas de 20 % y 30 % PB no presentaron diferencias estadísticas significativas en IL, con valores de 2.38 ± 0.11 mm y 2.21 ± 0.15 mm respectivamente. En Carassiusauratus alimentados con dietas de 24 a 32 % PB no obtuvieron diferencias estadísticas significativas en cuanto al IL (SRAC, 1998). Según Zuanon et al. (2013) la longitud del cuerpo es considerada como una característica que define los precios en la comercialización de peces ornamentales. En Trichogasterlalius recomiendan alimentarlos con dietas de 36.62 % de PB para obtener los peces de mayor IL (3.8 cm). Ardila-Meléndez, Albañil-Sánchez y Arias (2012) reportaron valores de IL entre 0.67 ± 0.09 y 0.85 ± 0.03 cm para la especie Otocinclusspectabilis alimentados con dietas de prácticas de 21 % PB.
En el presente trabajo se demostró que con base en los resultados obtenidos de ganancia de peso el requerimiento óptimo de proteína bruta para M. orinocensis es de 34.3 %, nivel con el cual se generó el máximo crecimiento de la especie con temperatura de 27.3 ± 0.8 °C.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio