Introducción
Los macro-invertebrados juegan un papel fundamental en la transformación de las propiedades físicas, químicas y/o biológicas del suelo (Lang-Ovalle et al., 2011; Cabrera, 2012). Por ejemplo, las lombrices de tierra (Clitellata: Crassiclitellata), contribuyen a mejorar la estructura y porosidad del suelo y reducen pérdidas de nitrógeno (Subler, Parmelee, & Allen, 1998); las termitas (Insecta: Blattodea) y hormigas (Insecta: Hymenoptera), influyen en la infiltración del agua, la humificación y mineralización de la materia orgánica (Lobry de Bruyn, 1999). Otros intervienen en la trituración de los restos vegetales (e.g. Coleoptera, Diplopoda, Isopoda, Gastropoda) o como reguladores de las poblaciones de macro- y meso-fauna edáfica (e.g. Araneae, Chilopoda) (Cabrera, Robaina, & Ponce, 2011).
La identificación y estudio de estos organismos como bio-indicadores de la calidad del suelo y de la biodiversidad de los ecosistemas permanece como un problema universal (Mummey, Stahl, & Buyer, 2002; Dinesh, Ghoshal-Chaudhuri, Ganeshamurthy, & Chanchal, 2003). Las comunidades de los macro-invertebrados varían en su composición, abundancia y riqueza, en dependencia del estado de perturbación del suelo causado por el cambio de uso de suelo, y por tanto son indicadores de la perturbación e impacto de las diferentes formas de manejo (Mummey et al., 2002; Dinesh et al., 2003; Concha-Lozada, Gallego, & Pardo-Locarno, 2010).
La ganadería extensiva en el sur de México es una de las principales actividades primarias que ha contribuido al cambio de uso del suelo, y que consecuentemente ocasiona efectos detrimentales en la conservación, particularmente en las comunidades de macro- y meso-fauna del suelo (Giraldo, Reyes, & Molina, 2011).
Los sistemas silvopastoriles (SSP) podrían ser una estrategia agroecológica para restablecer y aumentar las poblaciones y la actividad biológica del suelo (Concha-Lozada et al., 2010; Lang-Ovalle et al., 2011; Escobar, Bartolomé-Filella, & González-Valdivia, 2017) y, además, a mejorar su fertilidad, tal es el caso de asociar especies fijadoras de nitrógeno atmosférico como Leucaena leucocephala (Lam.) de Wit cv. Cunningham, con especies no leguminosas, como los pastos tropicales. Dada la importancia de los macro-invertebrados en la dinámica de la fertilidad del suelo, el propósito del presente estudio fue evaluar y comparar la riqueza y abundancia de los macro-invertebrados en dos SSP en la modalidad de pasturas en callejones conformados por L. leucocephala y pastos asociados (i.e. Panicum maximum Jacq. cv. Mombaza y Cynodon plectostachyus (K.Schum.) Pilg.), comparado con dos parches de vegetación contrastantes: un sistema ganadero con árboles dispersos en potrero en baja densidad y un parche de selva mediana subperennifolia, en el sur de Quintana Roo. Mediante la incorporación de especies leñosas en sistemas silvopastoriles se espera promover la diversidad funcional de macro-invertebrados, los cuales son bio-indicadores y participan en dinámica de los sistemas productivos.
Materiales y métodos
Área de estudio: El presente estudio se realizó en el Instituto Tecnológico de la Zona Maya (ITZM), ubicado en la carretera Chetumal-Escárcega km. 21.5, en el Ejido Juan Sarabia, Othón P. Blanco, Quintana Roo, México (21° 51’ N & 89° 41’ O). Los suelos predominantes son los Gleysoles de acuerdo con la clasificación de la Organización de las Naciones Unidas para la Alimentación (IUSS Working Group WRB, 2006). El clima es cálido subhúmedo (Aw1), con temperatura media anual de 25.4 °C, y una precipitación anual media de 1 246 mm, con algunas lluvias en la temporada seca (García, 1988).
Descripción de los sitios de estudio: Los SSP en la modalidad de pasturas en callejones estuvieron conformados por L. leucocephala asociado con pasto mombaza P. maximun (L+M) y otro de L. leucocephala asociado con pasto estrella C. plectostachyus (L+E). La distancia entre las cinco hileras de L. leucocephala fue de 2 m y entre plantas de 0.2 m. En los callejones de ambos sistemas, los pastos fueron establecidos 30 días después de la siembra de la leguminosa, con una densidad aproximada de 25 000 plantas/ha. Ambos sistemas poseen una extensión de una hectárea cada uno y fueron establecidos en el 2014. El sistema es de pastoreo rotacional de ovinos, en el cual cada hectárea fue dividida en cuatro potreros de 0.25 ha con ayuda de un cerco eléctrico. La ocupación de cada potrero fue de un periodo de 15 días, y con una recuperación de 30 días.
El SSP en la modalidad de árboles dispersos en potrero (ADP) en baja densidad está conformada por una pradera de Brachiaria brizantha (A.Rich.) Stapf., establecida en 2014, en una superficie de 2.5 ha, con un rango de 10 a 15 árboles/ha por potrero de Lysiloma latisiliquum (L.) Benth., Cordia dodecandra A.DC., Byrsonima crassifolia (L.) Kunth y Simarouba glauca DC., los cuales poseen una altura promedio que oscila entre 10-14 m y diámetros normales que van de 25 a 40 cm. La eliminación de malezas es principalmente de forma manual y en ocasiones se utiliza herbicidas para el control de las mismas (e.g. TordonTM 101 AgroSciences y FALCOM® SYNGENTA). Los potreros poseen una capacidad de carga de 30 bovinos cada 8 días. Las razas de ganado utilizado son Suizo Americano, Senopol y Gyr, con un promedio de peso de 400 kg, su objetivo de producción es doble propósito. A los animales se les aplica desparasitante dermetil y vitamina ADE, cada 6 meses.
Cabe señalar que previo al establecimiento de los sistemas silvopastoriles, estas áreas históricamente fueron cubiertas por selva mediana subperennifolia la cual fue removida para el establecimiento de gramíneas en monocultivo para el pastoreo de bovinos, durante un periodo de aproximadamente 25 años.
En el caso de la selva mediana subperennifolia (SMS) se utilizó un parche de vegetación con una superficie total de cuatro hectáreas de aproximadamente de 20 años de edad, la cual estuvo destinada para el aprovechamiento de maderas preciosas. Esta vegetación se caracterizada por presentar árboles que llegan a medir entre 15 a 25 m de altura y más o menos cerradas por la manera en que las copas de sus árboles se unen en el dosel, alrededor de (25-50 %) de los árboles que la forman pierden sus hojas en lo más acentuado de la época seca (Miranda & Hernández, 1963; Torrescano-Valle & Folan, 2015). Las especies de árboles más comunes son: Manilkara zapota (L.) P. Royen, Swietenia macrophylla King, Bucida buceras L., Brosimum alicastrum Sw., Bursera simaruba (L.) Sarg., Byrsonima bucidifolia Standl., Caesalpinia gaumeri Greenm., Coccoloba acapulcensis Standl., Gymnopodium floribundum Rolfe, Metopium brownei (Jacq.) Urb. y Nectandra coriacea (Sw.) Griseb (Miranda & Hernández, 1963; Trejo-Torres & Rodríguez, 2014).
Diseño y método de muestreo: En cada agro-ecosistema se delimitó una superficie de una hectárea y se estableció un transecto de 50 m de longitud en los que se colocaron cinco trampas de caída tipo pit-fall cada 10 m. El muestreo se realizó en febrero y mayo del 2018, donde las condiciones de temperatura y precipitación de la zona de estudio son contrastantes (al inicio de la época seca y de la lluviosa). En cada mes se realizaron cinco recolectas con intervalos de cinco días.
Las trampas consistieron en recipientes de plástico de un litro de capacidad y un diámetro de 14.4 cm, y se les agregó una mezcla de 250 ml de alcohol al 100 % y 250 ml de anticongelante, para preservar a los insectos atraídos, como sugiere Morón y Terrón (1984). Además, la trampa incluyó un contenedor de plástico para cebo de 50 ml de capacidad al cual se le realizaron perforaciones pequeñas para permitir la salida del olor fétido del cebo (aproximadamente 10 g de calamar). Los macro-invertebrados recolectados se trasladaron al Laboratorio de Estudios Avanzados en Agroecosistemas del ITZM, para su limpieza y fijación con acetato de etilo. La identificación del material recolectado se realizó hasta nivel de orden de acuerdo con sus características morfológicas utilizando las claves taxonómicas de Brues y Melander (1932), y se utilizó la nomenclatura de clasificación de acuerdo con Zhang (2011). Los especímenes recolectados se resguardaron en las instalaciones del Laboratorio de Control Biológico del ITZM para estudios futuros.
Análisis estadístico: Para calcular la riqueza esperada de órdenes se utilizó el estimador Chao 1 y curvas de rarefacción basados en cobertura (Chao & Jost, 2012). El análisis se realizó utilizando el programa en línea iNEXT (Hsieh, Ma, & Chao, 2013) configurado a 40 nudos (knots) y remuestreos (bootstraps) con 100 réplicas. Los índices de Shannon-Wiener (H’) se calcularon utilizando el programa EstimateS (Colwell, 2006). La homogenidad poblacional o equidad de Pielou (J’) se calculó utilizando el programa PAST versión 2.02 (Hammer, Harper, & Ryan, 2001). Los datos de diversidad de los macro-invertebrados en los diferentes agro-ecosistemas se compararon con una prueba de Kruskal-Wallis y para determinar qué muestra fue diferente se utilizó la prueba de comparaciones pareadas de Mann-Whitney con corrección de Bonferroni en el programa PAST (P < 0.05). La similitud/disimilitud entre las comunidades de órdenes de macro-invertebrados en los tres agroecosistemas y la selva mediana subperennifolia se evaluó con un análisis de conglomerados (UPGMA) basados en el coeficiente de similitud de Bray-Curtis. Para observar diferencias en la composición de órdenes de macro-invertebrados en los diferentes agro-ecosistemas y el fragmento de vegetación secundaria de selva mediana subperennifolia se realizó un análisis de escalamiento multidimensional no métrico (nMDS), donde los agroecosistemas se ordenaron con base en sus similitudes aplicando el índice de Bray-Curtis sobre las abundancias transformadas a raíz cuadrada, seguido de un análisis de similitud (ANOSIM) con corrección de Bonferroni. Para detectar cuáles fueron los órdenes de macro-invertebrados que más aportaron a la disimilaridad entre grupos se utilizó un análisis de porcentaje de similitud (SIMPER). Los análisis se realizaron con el programa PAST versión 2.02.
Resultados
Abundancia de macro-invertebrados: Se recolectaron 1 737 macro-invertebrados, la SMS registró la mayor abundancia seguido por los sistemas de L+E, L+M y ADP en orden decreciente (Tabla 1). No obstante, a pesar de las variaciones en la abundancia total de individuos en los cuatro sistemas (L+M, L+E, SMS y ADP), no se encontró diferencia estadística significativa (H = 0.63; P = 0.8854).
En el sistema de L+M se recolectaron 239 individuos adultos de macro-invertebrados y los órdenes con mayor abundancia fueron: Coleoptera (n = 91) e Hymenoptera (n = 52). En el sistema de L+E, se recolectaron 354 individuos adultos y los órdenes con mayor abundancia fueron: Hymenoptera (n = 151) y Coleoptera (n = 103). En el sistema con ADP en baja densidad se recolectaron 221 individuos adultos y los órdenes con mayor abundancia fueron: Coleoptera (n = 109) e Hymenoptera (n = 63). Finalmente, en la SMS se recolectaron 923 individuos adultos, los órdenes con mayor abundancia fueron: Hymenoptera (n = 507) y Coleoptera (n = 370).
De manera global en los cuatro sistemas, los tres órdenes más abundantes fueron: Hymenoptera, Coleoptera y Araneae. Por su parte, el orden Orthoptera fue más abundante en los sistemas de L+M y L+E que en la SMS y el sistema con ADP. El resto de los órdenes mantuvo una baja abundancia (i.e. Polydesmida, Diptera) o no se presentaron en todos los sistemas (i.e. Blattodea, Scorpiones, Hemiptera, Stylommatophora, Lepidoptera) (Tabla 1).
Diversidad de macro-invertebrados: En términos de riqueza los cuatro escenarios fueron similares, dado que los sistemas L+M, L+E y la SMS presentaron ocho órdenes y siete órdenes el sistema con ADP (Tabla 1). De acuerdo con los valores del índice de Dominancia (D), los SPS con L. leucocephala mostraron cierta homogeneidad de abundancias: L+M (D = 0.24) y L+E (D = 0.29), mientras que la SMS (D = 0.46) y el SSP con ADP (D = 0.34) mostraron mayor dominancia, con al menos dos órdenes de macro-invertebrados con abundancia notoriamente mayor que los demás órdenes (i. e. Hymenoptera, Coleoptera). Estos dos órdenes fueron abundantes en todos los sistemas. Por su parte, el índice de diversidad de Simpson (1-D) destaca la mayor diversidad de macro-invertebrados en los SSP de L+M (1-D = 0.75) y L+E (1-D = 0.70), seguido por el SSP con ADP (1-D = 0.65); sitios donde precisamente se encontró la mayor riqueza de órdenes.
Por otra parte, los valores del índice de Shannon Wiener (H’), muestran mayor equidad en la diversidad de macro-invertebrados en los SSP de L+M (H’ = 1.58) y L+E (H’ = 1.44), y menores valores encontrados en la SMS (H’ = 0.89) y el SSP con ADP (H’ = 1.26) (Tabla 1). Es decir que la uniformidad en la abundancia de órdenes de macro-invertebrados es mayor en los SSP de L+M y L+E.
En el caso de la diversidad de macro-invertebrados esperada entre sitios reflejada por el índice de equidad de Pielou (J), se observa que tanto los SSP de L+ M (J = 0.76) y L+E (J = 0.69) tienen proporciones mayores de diversidad conforme a lo esperado, seguido del SSP con ADP (J = 0.64) (Tabla 1). El sitio con la menor proporción de diversidad con respecto a la esperada fue la SMS (J = 0.43). Esto muestra que los tres SSP (L+M, L+E, ADP) pudieron alcanzar antes la diversidad esperada con el esfuerzo de muestreo realizado, y que la SMS necesitaría quizá mayor esfuerzo de muestreo para alcanzar su diversidad esperada.
Por su parte, el estimador de la diversidad esperada de Chao 1, no muestra grandes diferencias con respecto a los valores de riqueza encontrada entre los sitios pero si indica que en la SMS y el SSP con ADP se podría esperar una mayor diversidad a la encontrada, lo cual muestra la influencia de pocas especies raras en todos los sitios, pero además es consistente con las ligeras diferencias en la riqueza de ordenes entre los agro-ecosistemas mostrada por los otros índices de diversidad (Tabla 1).
TABLA 1 Abundancia (número de individuos) y diversidad de macro-invertebrados recolectados en cuatro agro-ecosistemas en el sur de Quintana Roo
| Órdenes | Agro- ecosistemas | Total | |||
| L+M | L+E | ADP | SMS | ||
| Blattodea | 3 | 1 | 0 | 0 | 4 |
| Hymenoptera | 52 | 151 | 63 | 507 | 773 |
| Coleoptera | 91 | 103 | 109 | 370 | 673 |
| Araneae | 35 | 34 | 31 | 33 | 133 |
| Polydesmida | 5 | 10 | 12 | 3 | 30 |
| Diptera | 9 | 5 | 1 | 2 | 17 |
| Orthoptera | 42 | 46 | 4 | 6 | 98 |
| Scorpiones | 0 | 0 | 1 | 0 | 1 |
| Hemiptera | 2 | 4 | 0 | 0 | 6 |
| Stylommatophora (Gastropoda) | 0 | 0 | 0 | 1 | 1 |
| Lepidoptera | 0 | 0 | 0 | 1 | 1 |
| Abundancia | 239 | 354 | 221 | 923 | 1 737 |
| Riqueza de órdenes | 8 | 8 | 7 | 8 | - |
| Dominance_D | 0.24 | 0.29 | 0.34 | 0.46 | - |
| Simpson_1-D | 0.75 | 0.70 | 0.65 | 0.53 | - |
| Shannon_H | 1.58 | 1.44 | 1.26 | 0.89 | - |
| Equitability_J | 0.76 | 0.69 | 0.64 | 0.43 | - |
| Chao-1 | 8 | 8 | 8 | 8.5 | - |
L+M, L. leucocephala asociado con Panicum maximum; L+E, L. leucocephala asociado con Cynodon plectostachyus; ADP y SMS.
El análisis multidimensional no métrico de la composición de macro-artrópodos muestra sobrelapamiento en los diferentes sitios, por lo que existe poca diferencia entre la composición de macro-invertebrados del suelo (Fig. 1). Sin embargo, el análisis de similitud ANOSIM mostró diferencias significativas (R = 0.12, P = 0.009) en las comunidades de macro-invertebrados entre el sistema L+E y la SMS. La mayoría de los órdenes se comparte entre los agro-ecosistemas, no obstante, el análisis SIMPER indicó que la mayor contribución a la diferencia entre los agro-ecosistemas fueron los órdenes Coleoptera (35.99 %), Hymenoptera (32.89 %) y Orthoptera (9.76 %). El dendograma de estructuración de la comunidad de órdenes de macro-invertebrados usando la matriz de Bray-Curtis agrupa a los sistemas silvopastoriles (L+M, L+E) con una similitud de cerca de 90 % y el sistema ADP con 80 % y una unidad con menor similitud de 65 % el SMS (Fig. 2).
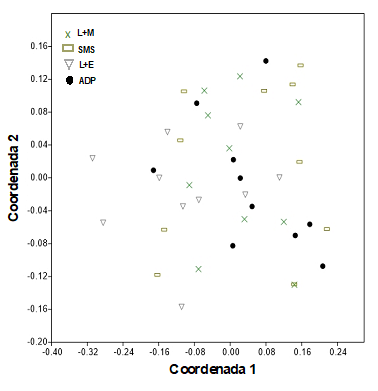
Fig. 1 Análisis Multidimensional no métrico (nmMDS) de la composición de órdenes de macro-invertebrados en L+M, L. leucocephala asociado con Panicum maximum, L+E, L. leucocephala asociado con Cynodon plectostachyus, ADP y SMS.
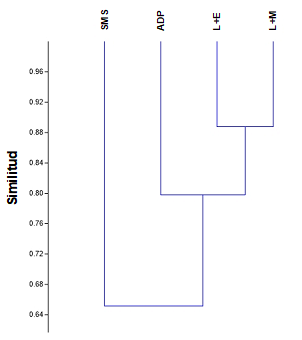
Fig. 2 Análisis conglomerados basado en el coeficiente de similitud Bray-Curtis de la composición de órdenes de macro-invertebrados en L+M, Leucaena leucocephala asociado con Panicum maximum, L+E, L. Leucaena leucocephala asociado con Cynodon plectostachyus, ADP y SMS.
Las curvas de extrapolación y de rarefacción (Fig. 3A) muestran que los sitios donde se encontró la máxima diversidad (tanto interpolada como extrapolada) fueron L+M (curva rosa), seguido de L+E (curva azul) y ADP (curva naranja). En la SMS (curva morada), se esperaría mayor esfuerzo para lograr captar su diversidad. Asimismo, en el caso de los sistemas de L+E y L+M se estaría llegando a la completitud del muestreo al llegar a ser casi asíntota la curva. En el SSP con ADP se observa que con el esfuerzo realizado se obtuvo la diversidad representativa y con lo proyectado en la extrapolación no se esperaría mayor cambio, mientras que en el sistema SMS no se observa una tendencia hacia la asíntota y por lo tanto se esperaría mayor esfuerzo de muestreo para lograr captar su diversidad, pero sin cambios notables de acuerdo con lo esperado (Fig. 3A).
Por su parte, las curvas de rarefacción-extrapolación de la cobertura de abundancias (Fig. 3B) muestran que presentaron una cobertura de casi el 100 % en los cuatro sitios con sus respectivas diferencias en riqueza de órdenes. Se evidenció el comportamiento de la diversidad de macro-invertebrados en función a los muestreos realizados. El análisis reflejó las curvas de rarefacción basadas en coberturas de abundancia y riqueza para los cuatro sitios. El SSP de L+E con 354 macro-invertebrados presentó una cobertura del 100 %, mientras que la SMS y los SSP con ADP y L+M tuvieron una cobertura de 99, 98 y 97 %, respectivamente.
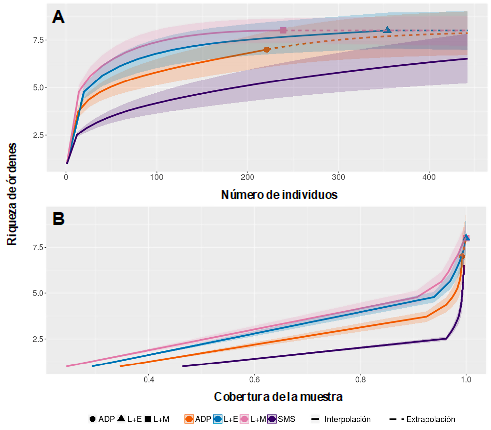
Fig. 3 Curvas de extrapolación (línea punteada) y rarefacción (línea continua). A. Curvas de extrapolación y de rarefacción basadas en el número de individuos de macro-invertebrados en los diferentes sitios. B. Curvas de extrapolación y rarefacción basadas en la cobertura de las muestras. L+M, L. leucocephala asociado con Panicum maximum (curva rosa); L+E, L. leucocephala asociado con Cynodon plectostachyus (curva azul); SMS (curva morada); ADP (curva naranja). Línea sombrada representa el 95 % de intervalo de confianza de remuestreos (Bootstrap).
Discusión
A pesar de las variaciones en la abundancia total de individuos en los cuatro agro-ecosistemas (L+M, L+E, SMS y ADP), los valores de diversidad fueron similares. Sin embargo, en la estructura de la comunidad de macro-invertebrados hay baja similitud en comparación con los agro-ecosistemas, lo que concuerda con lo reportado por Blüthgen et al. (2000) y Kaspari et al. (2008), quienes señalan que la abundancia de especies de macro-invertebrados se encuentra positivamente relacionada con la complejidad vegetal, que determina una mayor cantidad de micro-hábitats y de recursos disponibles y de manera negativa con las prácticas de manejo (Philpott & Armbrecht, 2006).
La mayor abundancia de Hymenoptera y Coleoptera en la SMS comparado con el SSP con ADP difiere con los estudios realizados por Escobar et al. (2017) en Nicaragua, donde el género Hymenoptera fue más abundante en el SSP comparado con un bosque latifoliado. No obstante, coincide en que la presencia de árboles en los potreros o en sitios deforestados, favorecen las condiciones ambientales para que las especies oportunistas colonicen estos micro-hábitats y propaguen sus poblaciones (i.e. hormigas). Otros estudios también han señalado que la presencia de árboles en los sistemas aumenta la abundancia de estos órdenes con respecto a sitios menos arbolados como los potreros de pasturas en monocultivo (Gómez & Velásquez, 1999; Rivas & Schoereder, 2007; Brown et al., 2001; Cabrera et al., 2011). Del mismo modo, diversos estudios señalan a Hymenoptera y Coleoptera como potenciales bio-indicadores de las condiciones de salud del ecosistema y por tanto el tipo de manejo (Lavelle et al., 1994; Lang-Ovalle et al., 2011), sobre todo en agro-ecosistemas que incluyen árboles.
De la misma manera, cabe destacar que en los SSP que tuvieron a L. leucocephala como especie forrajera, el género Orthoptera fue mayor en abundancia con respecto a los sistemas que no tuvieron a L. leucocephala (ADP y SMS), en este grupo de macro-invertebrados destacan sus especies por ser herbívoros y granívoros y potencialmente consumidores de hojas tiernas propias de cultivos de leguminosas (Aguirre-Segura & Barranco, 2015), además, la presencia exclusiva de Blattodea en estos mismos sistemas se explica debido a que prefieren lugares con humedad y protección de hojarasca (Pascual, 2015). Esta cualidad de los SSP con L. leucocephala en pastizales encontradas en el presente estudio ha sido previamente reportada por otros autores (Lavelle et al., 1994; Rodríguez, Crespo, Rodríguez, Castillo, & Fraga, 2002; Sayer, 2006), donde además de aportar nitrógeno al suelo, mejoran la calidad de la materia orgánica que favorece los microambientes y la disponibilidad de nutrimentos y estos a su vez influyen sobre las poblaciones de los artrópodos del suelo.
Por otra parte, el SSP con ADP tuvo la menor riqueza de macro-invertebrados, lo cual podría ser atribuido al menor reciclaje de nutrientes, así como a la irregular y baja cobertura arbórea que ocasiona condiciones ambientales adversas para el comportamiento animal, fertilidad de los suelos, lo que afecta las interacciones ecológicas con la fauna edáfica (Iriondo, Álvarez, Chinea, & Borroto, 1998; Nodari, Vidar, & Guerra, 2001; Giraldo et al., 2011). Además de lo anterior, se ha documentado que el uso de desparasitantes en los sistemas ganaderos podría influir negativamente en la riqueza de los macro-invertebrados del suelo, tal como lo sugieren Wall y Beynon (2012).
Las curvas de rarefacción por cobertura muestran de manera menos sesgada la proporción de la diferencia de la diversidad y abundancias encontradas en los diferentes sitios, lo cual permite asegurar la existencia de diferencias en las medidas de diversidad mostrada entre sitios (Chao & Jost, 2012). De igual manera, los resultados obtenidos en las curvas muestran que la diversidad esperada y extrapolada no difiere de lo encontrado en el presente estudio. Por lo tanto, es posible argumentar que se realizó un esfuerzo de muestreo suficiente para encontrar la diversidad y abundancia de los agro-ecosistemas de estudio, no obstante, las curvas también muestran que en los SSP (L+M, L+E, ADP), se pudo alcanzar antes la diversidad esperada, a diferencia de la SMS donde se espera que con mayor esfuerzo puedan surgir más especies.
Los resultados de este estudio muestran que, los sistemas pecuarios manejados con componentes leñosos (árboles y arbustos), como los SSP que incluyen a la leguminosa L. leucocephala, pueden equipararse, en términos de abundancia y diversidad de órdenes de fauna edáfica, con las selvas en proceso recuperación. Por lo tanto, los SSP pueden ser sugeridos como estrategias de manejo, recuperación o interconexión funcional de áreas naturales conservadas
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

