Introducción
El aumento de las emisiones de Gases de Efecto Invernadero (GEI) derivadas de las actividades humanas, divididas en cuatro grandes grupos (Energía, Procesos Industriales, Agricultura, Silvicultura y otros usos de la tierra y Residuos), según Penman, Gytarsky, Hiraishi, Irving, y Krug (2006), que se acumulan en la atmósfera del planeta, son el principal responsable del cambio climático que se experimenta en la actualidad (Penman et al., 2006; IDEAM, PNUD, MADS, DNP, & CANCILLERÍA, 2016).
Respecto a los usos de la tierra, las actividades pecuarias tienen un impacto significativo en casi todas las esferas del medio ambiente, incluidos el cambio climático, el aire, la tierra, el suelo, el agua y la biodiversidad (Steinfeld et al., 2006), produciendo un 9 % de las emisiones de dióxido de carbono (CO2) de origen antropogénico, donde el sector ganadero en general, es considerado responsable del 18 % de las emisiones de gases de efecto invernadero medidos en equivalentes de CO2, además de emitir el 37 % de metano (CH4) y el 65 % del óxido nitroso (N2O) (FAO 2006; Steinfeld et al., 2006; González et al., 2015), principalmente por manejo antropogénico inadecuado, considerándose, equivocadamente, una actividad contaminante, de baja productividad y poco eficiente en el uso de recursos naturales (Botero, 2001).
Las praderas pueden ser un aliado en la mitigación de los GEI, como el CO2, al capturarlo de la atmósfera y acumular el carbono (C) en el suelo (0.3 toneladas (ton) de C ha-1 año-1 que se acumula en el suelo corresponden a la mitigación atmosférica de 1 ton C equivalente ha-1 año-1) (FAO, 2010; Silva, Gómez, Landazury, & Preciado, 2013).
Las gramíneas son componentes importantes en muchos ecosistemas terrestres (Giraldo, 2010), ocupando 250 millones de hectáreas (Mha) en Sur América y 20 Mha en Colombia (Fisher et al., 1994). En el Norte Antioqueño, el pasto kikuyo (Cenchrus clandestinus (Hochst. ex Chiov.) Morrone), como forraje predominante (85 % de los sistemas especializados) (Echeverri, Restrepo, & Parra, 2010) y pasturas perennes, ofrece beneficios medioambientales, por su contribución al secuestro de carbono en los sistemas de pastoreo (Sanderman et al., 2013), además se ha demostrado que es tolerante a heladas, altos niveles de salinidad (Skerman & Riveros, 1990), sequías (Whiteman, 1980) y encharcamientos (Dale & Read, 1975); factores que contribuyen a la disminución del proceso fotosintético, considerado un proceso importante para el planeta porque consumen CO2 y liberan oxígeno (O2) a la atmósfera (Del Valle & Sánchez, 2015).
Las plantas que realizan la vía fotosintética C4, como el kikuyo (Giraldo, 2010), son consideradas más eficientes en el proceso fotosintético ya que optimizan la captura y fijación del CO2, atribuido, en parte, a los procesos evolutivos sufridos por ellas, desde su origen (Del Valle & Sánchez, 2015); adicionalmente, según una investigación realizada por Silva et al. (2013), cuando las plantas C4 se encuentran dentro de un sistema silvopastoril, ayudan a mejorar la productividad ofreciendo la oportunidad de aumentar el secuestro del carbono. El objetivo de este trabajo fue identificar las existencias de carbono en el pasto kikuyo en sus diferentes compartimentos, biomasa aérea (hojas, tallos y colchón) y biomasa radicular (raíces finas y gruesas o “estoloníferas”) a 20 y 40 cm de profundidad del suelo, evaluado bajo dos sistemas y cuatro relieves topográficos.
Materiales y Métodos
Sitio de estudio: El estudio se realizó entre junio 2016 y junio 2017, período durante el cual se ubicaron y delimitaron las parcelas; se colectaron y analizaron las muestras. El estudio se realizó en la hacienda La Montaña de la Universidad de Antioquia, ubicada en el municipio de San Pedro de los Milagros (Antioquia, Colombia), en una zona de vida de bosque húmedo montano bajo (Bh-Mb), temperatura promedio de 15 °C, con precipitación anual de 1 575.1 mm, humedad relativa del 72 %, a una altitud de 2 350 metros sobre el nivel del mar (msnm) (Estrada & Restrepo, 2015) a 6° 26’59” N & 75° 32’37” W (Google Earth, 2018). Sus suelos pertenecen al orden de los andisoles según lo reportado por Medina, Velásquez, & Pinzón (2012).
Establecimiento: Se utilizaron 16 parcelas experimentales ya establecidas con pasto kikuyo, cada una de 10 x 5m, ubicadas en diferentes sistemas o tratamientos: tradicional (ST) y silvopastoril (SS). En diferentes relieves topográficos: flanco cóncavo (FCC), flanco convexo (FCX), flanco rectilíneo (FR) y relieve plano (RP).
La toma de muestras se realizó cada 32 (±3) días (período de descanso y momento de mayor producción del pasto del sitio de estudio), con un total de seis muestreos consecutivos. Se emplearon marcos de aforo para medir la biomasa del pasto y un barreno para raíces para determinar la biomasa de las mismas a 20 y 40 cm de profundidad. Los puntos en cada parcela se determinaron con la metodología de muestreo por radiales (Acosta, Etchevers, Monreal, Quednow, & Hidalgo, 2001) georreferenciados con GPS 100 Magellan Explorist®.
Sistemas evaluados: El ST correspondió a los potreros con monocultivo de pasto C. clandestinus. El SS, correspondió a un arreglo con kikuyo como herbácea y las arbóreas aliso (Alnus acuminata Kunth) y acacia negra (Acacia decurrens Willd.), sembradas a una distancia entre árboles de 5 x 7 m, en dirección perpendicular a la pendiente y con una edad de 15 años utilizados principalmente para aportar sombra como parte del bienestar animal y recuperadores de la calidad del suelo. Los sistemas son pastoreados en franjas con carga animal de 3.5 vacas ha-1 de la raza Holstein, con ocupación de un día. Anualmente se aplican 400 kg de nitrógeno (N) ha-1.
Aforo: Se adaptó la metodología propuesta por Sierra (2017), usando dos marcos aforadores de 0.25 m2 . Se determinaron cinco puntos de aforo (1.0; 1.5; 2.0; 2.5; 3.0), realizándose 40 visuales al azar en el potrero y calificando el rendimiento del forraje con base en la escala mencionada.
Muestreo de biomasa aérea (BA): La BA está conformado por las hojas (H), tallos (T), colchón vivo (CV) y muerto (CM) del pasto kikuyo. La recolección de las muestras se realizó con el método del “reloj”, marcando un punto central georreferenciado para facilitar la ubicación en muestreos sucesivos y con diámetro de 1 m, donde las 12 h correspondió con el norte magnético (Acosta et al., 2001). Para cada parcela se realizaron seis muestreos: 12:00 (M1), 6:00 (M2), 3:00 (M3), 9:00 (M4), 5:00 (M5) y 11:00 (M6) horas respectivamente. Tanto para el ST como para el SS se usaron marcos aforadores, cortando toda la biomasa contenida en éste. La biomasa de las H y T se empacaron en una bolsa diferente a la del colchón. Se emplearon bolsas resellables, extrayendo la mayor cantidad del aire de forma manual e identificándolas con el número de parcela, muestreo y fecha; se transportaron al laboratorio en nevera térmica para conservar la calidad de las muestras.
Muestreo de biomasa radicular (BR): La BR se conformó por las muestras de todas las raíces, finas (RF) y gruesas (RG), del pasto kikuyo. En un estudio realizado por Giraldo, Zapara, & Montoya (2008) se tomaron muestras del suelo hasta una profundidad de 30 cm. Para este estudio, las profundidades fueron 0 a 20 cm (desde el nivel del suelo) y 20 a 40 cm (desde el punto final de la primera profundidad), debido a que no se observaron raíces significativas a mayor profundidad, en el mismo punto de colecta y con la misma frecuencia de muestreo de la BA. Se utilizó un barreno para raíces con una longitud total de 70 cm (cilindro más asa), con medidas del cilindro interior de 10 cm de diámetro y 25 cm de largo, marcado para identificar las profundidades requeridas. Las muestras se empacaron, debidamente identificadas con la profundidad, número de parcela, de muestreo y fecha de colecta; se trasportaron al laboratorio en nevera térmica.
Pretratamiento de las muestras: Para la BR se separaron las raíces del suelo por medio de extracción (con un tamiz de malla de 5 mm) y lavado manual con agua hasta retirar el excedente de suelo, dejando la base del tamiz para evitar la pérdida de raíces. La clasificación se realizó en: RF (< 5.0 mm) y RG (5.0 mm) (Schlonvoigt, Chesney, Schaller, & Kanten, 2000). Se secaron en estufa de ventilación forzada a 60 °C durante 48 h (Yaranga & Custodio, 2013), luego pasaron por un molino con criba de 1 mm y se cernieron con un tamiz de 0.05 mm. La BA se separó en material verde (H y T) y material senescente (CV y CM). Se considera colchón a la capa de pasto acumulado, debido a que no está dentro de la porción comestible del animal. El CV son rebrotes principalmente de los estolones, y el CM, porción que alcanza un alto grado de maduración. Las muestras se procesaron con el mismo protocolo explicado para las raíces.
Determinación del carbono: Se adaptó del método de Walkley & Black (1934) empleando dicromato de potasio {K2Cr2O7 1N}, ácido sulfúrico (H2SO4), solución indicadora de ortofenantrolina {C12H8N2. H2O} y la titulación con sulfato ferroso de amonio {Fe(NH4)2(SO4).6H2O. Al obtener los ml de solución ferrosa gastados en la titulación (M), ml gastados en el blanco (B), normalidad de la solución ferrosa (N), peso en gramos de la muestra y el factor 0.6708 hallado a partir de multiplicar 0.003 (peso de un meq de carbono en gramos) por 1.72 (factor conversión de carbono a materia orgánica) y por 1.3 (factor de corrección debido a la eficiencia), se halló el porcentaje de materia orgánica (% MO) a partir de la ecuación % MO = 0.6708(B-M)N/peso de la muestra de biomasa en gramos.
Tiempos, tasas de descomposición y flujos de carbono: Se determinó el tiempo y las tasas de descomposición según reportes de Zhang, Hui, Luo & Zhou (2008), con base en la fórmula y = e-kt (Olson, 1963; Wieder & Lang, 1982; Silver & Miya, 2001), donde y = % de la masa en un tiempo, t = tiempo transcurrido desde el inicio de la descomposición y k = está presentado como el coeficiente de determinación del diseño experimental. La estimación de los flujos de carbono del pasto al suelo, se realizó a partir de los datos reportados por Kuzyakov & Domanski (2000).
Diseño experimental: Se empleó un diseño en bloques incompletos aleatorizados, definiendo dos tratamientos: SS y ST y cuatro bloques: FCC, FCX, FR y RP. Se realizó en bloques incompleto porque el área limitó incluir el RP dentro del SS. El arreglo correspondió a medidas repetidas en el tiempo, realizando seis muestreos para cada parcela experimental. El análisis de resultados y la transformación BoxCox de los datos se realizaron con el software estadístico R-project® (R Core team, 2016). Se validó normalidad del modelo por medio de Shapiro-Wilk que permitió tomar la decisión de transformación y ajuste del modelo Yijk = µ+Ti +βj + ΩK + εijk, donde Yijk es la variable respuesta (carbono), µ el efecto de la media, Ti el efecto del tratamiento (sistema), βj el efecto del bloque (relieves), ΩK el efecto del muestreo y εijk el efecto del error aleatorio.
Resultados
Correlación de la BA del pasto kikuyo con sus contenidos de carbono: Los contenidos de carbono en los diferentes compartimentos estuvieron influenciados positivamente por la cantidad de biomasa seca de los mismos, comportamiento que se evidenció con la correlación (r) obtenida al analizar la BA del pasto kikuyo (Fig. 1), como el caso de la BH y el carbono con r = 0.99.
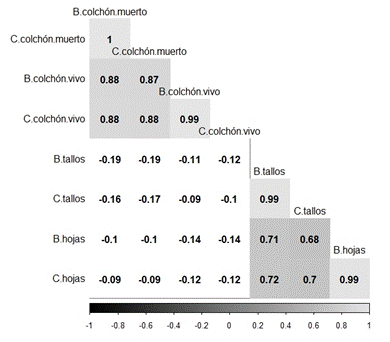
Fig. 1 Fig. 1 Correlaciones entre el contenido de carbono y la biomasa aérea del pasto kikuyo. Correlations between carbon content and above-ground biomass of the kikuyu grass.
Existencias de carbono dentro de los sistemas, relieves y su variación en el tiempo (muestreos) en los diferentes compartimentos: En las figuras 2, 3 y 4 se pueden observar las diferencias que existen entre los sistemas, los bloques y los muestreos, y los promedios del contenido de carbono analizados para cada compartimento del pasto (Fig. 2, Fig. 3 y Fig. 4).
Se observaron diferencias (P < 0.05) entre tratamientos (SS y ST) (Fig. 2A, Fig. 2B, Fig. 4B), entre el RP y FR (Fig. 2A), el FR con los demás relieves (Fig. 2B) y entre el bloque RP con los demás bloques (Fig. 4B). Respecto a los muestreos, se obtuvo P < 0.05 entre algunos muestreos de la BA y en las RF 20 cm (Fig. 2, Fig. 3 y Fig. 4A).
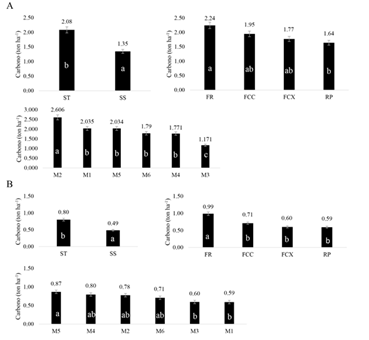
Fig. 2. Fig. 2 Carbono en ton ha-1 de acuerdo a los sistemas, relieves y muestreos para los compartimentos (A) hojas y (B) tallos. a, b, c = diferencia significativa. Valores encima de las barras indica el contenido de carbono promedio para los tratamientos, bloques y muestreos dentro de los diferentes compartimentos. Carbon in ton ha-1 according to the systems, reliefs and samplings for the compartments (A) leaves and (B) stems. a, b, c = significant difference. Values above the bars indicate the average carbon content for the treatments, blocks and samples within the different compartments.
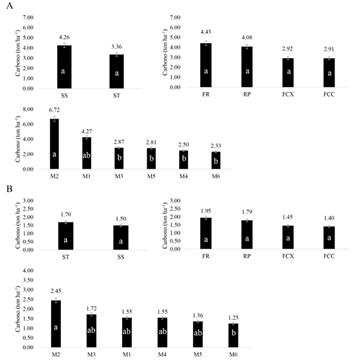
Fig. 3 Fig. 3 Carbono en ton ha-1 de acuerdo a los sistemas, relieves y muestreos para los compartimentos (A) colchón vivo (B) colchón muerto. Carbon in ton ha-1 according to the systems, reliefs and samplings for the compartments (A) creeping stem alive (B) creeping stem dead.
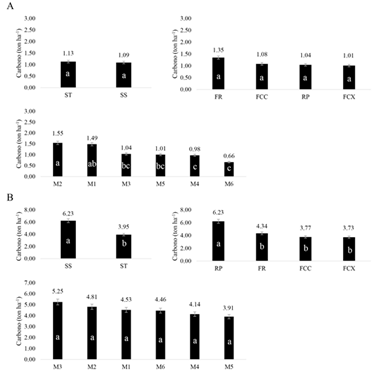
Fig. 4 Fig. 4 Carbono a 20 cm de profundidad del suelo en ton ha-1 de acuerdo a los sistemas, relieves y muestreos. (A) raíces finas (B) raíces gruesas. Carbon to 20 cm soil depth in ton ha-1 according to the systems, reliefs and samplings. (A) fine roots (B) thick roots.
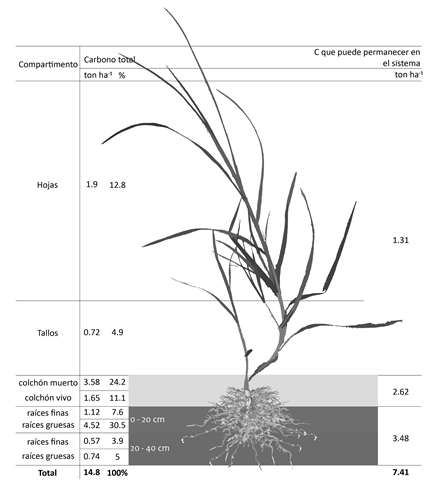
En la BR se obtuvo mayor cantidad de ton de C ha-1 a 20 cm, tanto para raíces finas como gruesas, con valores de 1.12 y 4.52 ton ha-1, respectivamente y a 40 cm fue de 0.57 y 0.74 ton ha-1. Se encontró que las raíces gruesas acumulan más carbono que las finas. El contenido de carbono de raíces a 20 cm de profundidad fue alrededor de 5.64 ton ha-1, frente a 1.31 ton ha-1 para raíces hasta 40 cm.
El contenido total de carbono obtenido en el presente estudio para pasto C. clandestinus se ve representado en la Fig. 5, donde las RG 20 cm presentaron el mayor contenido de carbono (4.52 ton ha-1), representando un 30.5 % del total de carbono hallado para este estudio (14.8 ton ha-1). Adicionalmente, se ve representado la tasa y los tiempos de descomposición del C en el pasto kikuyo (Tabla 1), estimando que las raíces son las que tardan el mayor tiempo en descomponer el 99 % de la biomasa producida (12.2 años).
Discusión
La relación directa que existe entre las variables biomasa y los contenidos de carbono puede explicar el resultado de la alta correlación positiva entre la BA y sus contenidos de carbono (Fig. 1). Se encontró una alta correlación (r = 0.88) entre biomasas de CV y CM; que podría explicarse por factores como la intensidad de pastoreo, que provocará un aumento del material rechazado por el animal, cuando no tiene una adecuada programación (Fales et al., 1995).
Anguiano, Aguirre, & Palma (2013), reportan relación inversa del secuestro de carbono de la gramínea Pennisetum purpureum Cuba CT-115 bajo un sistema agrosilvopastoril con una alta densidad de arbóreas leguminosos, lo que podría explicar la diferencia entre los sistemas, demostrando mayor eficiencia de las pasturas capturando carbono cuando se trabajó bajo ST. Por otra parte, Arias et al. (2009), afirma que pasturas bajo SS tienen mayor contenido de carbono que pasturas sin árboles. Otro estudio realizado con Brachiaria brizantha, reflejó que el carbono total almacenado fue mayor al asociarse con Eucalipto deglupta y Arachis pintoi, indicando que la interacción árbol pastura permite al pasto un crecimiento más acelerado que en monocultivo (Casasola et al., 2013). Esto concuerda con algunos resultados de este estudio, donde en algunos compartimentos, el pasto kikuyo también almacenó menos cantidad cuando se evaluó bajo un ST. Casasola et al. (2013), reportan también que las pasturas en trópico húmedo tienen mayor capacidad de almacenar y fijar CO2 que las pasturas en trópico subhúmedo y que la precipitación o la humedad favorecen la cantidad de carbono capturado, lo que podría explicar la diferencia entre algunos muestreos.
La disminución en los contenidos de carbono de acuerdo a la profundidad de las raíces, cuya biomasa se hace menor cuando aumenta la distancia a la superficie de suelo, era un comportamiento esperado, similar a lo reportado por autores como Céspedes, Fernández, Gobbi, & Bernardis (2012) para pastizales en praderas bajo pastoreo. Al realizar una comparación con las sabanas, las pasturas con base en gramíneas “mejoradas” secuestran más carbono en partes profundas del perfil del suelo, generalmente bajo la capa arable (10 - 15 cm). Esta característica hace que el carbono esté menos expuesto a procesos de oxidación, y por tanto, su pérdida como gas invernadero (Fisher et al., 1994); explicando algunos resultados en los que las RG 20 cm contienen mayor cantidad de carbono con respecto a los demás compartimentos. El carbono de las RF fue menor en ambas profundidades, pero este cumple un papel importante como fuente de rápida disponibilidad para microorganismos, útiles en dinámicas de transformación y descomposición de la materia orgánica del suelo, procesos necesarios en el flujo y reciclaje de nutrientes.
Las pasturas son una posibilidad para incrementar la captura de carbono en el suelo (ocupan alrededor del 25 % de la superficie terrestre) (Asner, Elmore, Olander, Martin, & Harris, 2004), si se mejoran las prácticas de manejo (Rutledge et al., 2017) principalmente aquellas relacionadas con el ajuste de carga animal, el reciclaje de nutrientes y el manejo agronómico adecuado. La alta producción de raíces en el pasto kikuyo permite una rápida recuperación post-pastoreo, ya que la planta moviliza reservas de carbono desde la raíz para la producción de rebrotes, como lo demostraron otros autores en algunas pasturas (Guitian & Bardgett, 2000; Schmitt, Pausch, & Kuzyakov, 2013) indicando que el carbono almacenado es un mecanismo importante para recuperar las pasturas después de situaciones de estrés como el pastoreo (Schmitt et al., 2013). Las plantas perennes pueden translocar más carbono que las plantas anuales, lo que indica que tienen mayor capacidad de almacenamiento de carbono en las raíces. En el caso de los pastos perennes, esta propiedad facilita el rebrote después del corte o pastoreo (Kuzyakov & Domanski; Schmitt et al., 2013). En general, la principal fuente de carbono del suelo proviene de las plantas y corresponde al aporte que realizan las raíces y residuos vegetales de la biomasa aérea al descomponerse y a la rizodeposición (Kuzkyakov et al., 2000).
Según los resultados obtenidos en este estudio, la BA aporta un 53 % del carbono total del pasto (14.8 ton ha-1), valor próximo a los reportados por Paul (2016) del 30 y 50 % para la mayoría de los pastos. En su mayoría, las pasturas translocan aproximadamente 50 % del carbono asimilado desde la BA a BR, donde, aproximadamente 25 % se incorpora a biomasa radicular, 6 % permanece en el suelo y en biomasa microbial del mismo, y 18 % se emplea para procesos fisiológicos de respiración, tanto de raíces como de microbiota del suelo (Kuzyakov & Domanski, 2000; Johnson, Leake, Ostle, Ineson, & Read, 2002). Del 6 % de carbono que permanece en el suelo y biomasa microbiana, otros autores consideran que hasta 5 % del mismo puede convertirse en humus estable y almacenarse en éste (Lal, Kimble, Levine, & Whitman, 1998). Algunos trabajos indican que los sistemas radiculares representan la biomasa bajo el suelo constituyendo otro sumidero de carbono (Andrade & Ibrahim, 2003). El kikuyo por ser perenne, con hábito de crecimiento estolonífero y alta capacidad de rebrote bajo condiciones adversas; permite amarrar el terrero lo que contribuye a conservar los suelos de ladera, predominantes en trópico alto. A pesar de la aparición de colchón, debido principalmente al mal manejo (factor negativo en un sistema de producción), éste se convierte en un reservorio de carbono a mediano plazo.
TABLA 1: Estimación de flujos de carbono para una pastura de kikuyo con períodos de descanso de 35 días
| Compartimento | C total (ton ha-1) (100 %) | Repartición del carbono en el sistema | Tiempo* (en años) | |
| - | - | C que puede permanecer en la planta (ton ha-1) | Flujos estimados de C desde la pastura (ton ha-1) | - |
| Biomasa aérea | 2.62 | 1.31 (50 % que permanece como parte de la biomasa residual de la pastura) | 1.31 (50 % por el consumo animal o por corte del pasto) | 4.3 |
| Colchón del pasto | 5.23 | 2.62 (50 % permanece en el colchón, depende del manejo de la pastura) | 2.62 (50 % que se puede perder del sistema según el manejo de la pastura) | 9.6 |
| Raíces de 0 a 40 cm de profundidad | 6.95 | 3.48 (50 % permanecen en la biomasa radicular) | 0.83 (12 % permanece en el suelo y en la biomasa microbial) | 12.2 |
| 2.5 (36 % se emplea para los procesos fisiológicos de respiración tanto de las raíces como de la biota del suelo) | ||||
* = tiempo estimado para que se descomponga el 99 % de la biomasa producida en cada compartimento.
* = estimated time to decompose 99 % of the biomass produced in each compartment.
Factores como las condiciones climáticas, tipo de vegetación, de suelo, composición de biota microbiana relacionada con procesos de descomposición, variables geográficas de ubicación, entre otros, regulan la tasa de descomposición y el aporte de carbono al sistema. De acuerdo a los valores para pasturas reportados en un meta-análisis sobre tasas de descomposición (Zhang et al., 2008); se pudo estimar para este trabajo, que el tiempo medio para que se descomponga 50 % de la biomasa producida por el pasto kikuyo puede tardar para las hojas aproximadamente 200 días (k = 1.16), colchón 1.3 años (k = 0.52) y raíces 1.7 años (k = 0.41). La descomposición del 99 % de la biomasa producida, puede tardar aproximadamente 4.3; 9.6 y 12.2 años para los compartimentos de hojas, colchón y raíces respectivamente.
En este estudio, en el ST, se encontraron valores respectivos de 4.2 y 1.9 ton ha-1, para la BA seca y su contenido de carbono, semejantes a los encontrados por Cárdenas, Bustamante, Espitia, & Páez. (2012), 4.5 ton ha-1 de BA seca y 2.0 ton de carbono ha-1 y contrario a lo obtenido por los mismos autores en un SS con B. brizanta, con un valor de 11.7 ton ha-1 en la BA seca, por encima del resultado obtenido para este estudio (3.9 ton ha-1), con contenidos de carbono de 4.4 y 2 ton ha-1, respectivamente (Tabla 2). Lo anterior puede deberse a que el pasto B. brizanta fue analizado a un promedio de 162 días (tiempo desde que se sembró el pasto hasta la toma de muestras para análisis), superior al tiempo de muestreo del pasto kikuyo (cada 35 días). Sin embargo, estos resultados son consecuentes con el hecho de que a mayor cantidad de biomasa seca, mayor contenido de carbono. El pasto C. clandestinus presentó mejor captura de carbono en la BR tanto para el sistema tradicional como para el silvopastoril (1.6 ton ha-1 y 2.1 ton ha-1, respectivamente) frente a resultados reportados por Céspedes et al. (2012) para otras especies de pastos (S. setosum y C. nlenfuensis).
TABLA 2: Comparación de la los contenidos de biomasa aérea y carbono del kikuyo con los de otros autores
| Especie | Biomasa aérea seca (ton ha-1)1 | Existencias de carbono biomasa aérea (ton ha-1) | Biomasa raíces secas (ton ha-1)2 | Existencias de carbono en raíces (ton ha-1)3 | Sistema de manejo |
| Cenchrus clandestinus (En este estudio) | 4.2 | 2.0 | 3.3 | 1.6 | Tradicional |
| Cenchrus clandestinus (En este estudio) | 3.9 | 1.9 | 4.3 | 2.1 | Silvopastoril |
| Lolium perenne (Schmitt et al., 2013) | 3.4 | 1.3 | ND | ND | Bajo luz |
| Lolium perenne (Schmitt et al., 2013) | 3.4 | 1.7 | ND | ND | Bajo sombra |
| Brachiaria brizantha (Cárdenas et al., 2012) | 4.5 | 2.0 | ND | ND | Tradicional |
| Brachiaria brizantha (Cárdenas et al., 2012) | 11.7 | 4.4 | ND | ND | Silvopastoril |
| Brachiaria dyctoneura (Giraldo et al., 2006) | ND | 2.5 | ND | 15.2 | Tradicional |
| Brachiaria dyctoneura (Giraldo et al., 2006) | ND | 1.2 | ND | 13.4 | Silvopastoril |
1, 2, 3 ND = no disponible.
Giraldo, Zapata, y Montoya (2006) reportaron contenidos de carbono de la BA y BR para el pasto B. dyctoneura, cuando se evaluó bajo los sistemas tradicional y silvopastoril, obteniendo en la BA contenidos de 2.5 y 1.2 ton ha-1 y en las raíces, 15.2 y 13.4 ton ha-1, para los sistemas evaluados, respectivamente. El presente estudio muestra resultados parecidos en la BA (2.0 y 1.9 ton ha-1), siendo diferentes en la BR (1.6 y 2.1 ton ha-1), al ser evaluados bajo los mismos sistemas. Schmitt et al. (2013), reportan contenidos de carbono en L. perenne de aproximadamente 39 y 49 % de la biomasa seca, evaluado bajo sistemas de luz y de sombra respectivamente. Teniendo en cuenta un rendimiento medio de 3.4 ton ha-1, el aporte de carbono de la BA sería de 1.3 y 1.7 ton ha-1 para los sistemas evaluados, indicando que las pasturas varían su aporte de carbono dependiendo del sistema de producción en el que se encuentren, siendo considerados los SS como los principales sumideros de carbono (Andrade & Ibrahim, 2003).
El kikuyo por ser una planta C4 realiza un aporte significativo de carbono. Las mayores tasas de captura de carbono en pasturas se atribuyen principalmente a la presencia de grupos funcionales de leguminosas y gramíneas C4. Fornara & Tilman (2008) encontraron relación positiva significativa entre la acumulación de carbono y la BR, sugiriendo que las raíces son importantes para la acumulación de carbono; reportado también en numerosos estudios (Rasse, Rumpel, & Dignac, 2005; Lu et al., 2011; Fornara & Tilman, 2012; Fornara et al., 2013). Existe gran diferencia en la distribución de biomasas aéreas y radiculares de bosques y praderas; los bosques (mayoritariamente vegetación C3) depositan residuos principalmente en la superficie, mientras que las praderas (mayoritariamente plantas C4) incorporan residuos al interior del suelo, que provienen principalmente de la biomasa radicular (Céspedes, 2007). Los forrajes perennes C4 muestran altos índices de secuestro anual de carbono orgánico del suelo en los primeros centímetros del perfil (Neal, Eldridge, Fulkerson, Lawrie, & Barchia, 2013).
Las plantas C4 pueden capturar carbono cuando sus estomas están cerrados, ellas presentan un sistema de bombeo de carbono en la célula y pueden cerrar sus estomas y continuar eficientemente el proceso fotosintético (Mota, Alcaraz, Iglesias, Martínez, & Carvajal, 2010). Además, pueden soportar factores de estrés como radiación, precipitación, manejo (frecuencia de corte, altura de corte, tiempo de pastoreo), que alteran su estructura y metabolismo; asimismo, tiene buen crecimiento y capacidad para capturar carbono, según lo indican Del Pozo (2004), Martínez, López, Muries, Muñoz, & Carvajal (2009) y lo reafirma Mota et al. (2010). Con un buen manejo en los sistemas de pastoreo, podría considerarse el pasto kikuyo importante en la disminución de GEI, ya que mostró una alta capacidad en la producción de biomasa y captura de carbono.












 uBio
uBio