Introducción
Toxoplasma gondii (phylum Apicomplexa) es un protozoario parásito con distribución mundial, capaz de infectar aves, animales mamíferos (terrestres o marinos) y al ser humano. De todos ellos, los felinos domésticos o silvestres son los hospederos finales o definitivos, por lo que su participación en el ciclo de transmisión es fundamental (Dubey & Jones, 2008). La infección en seres humanos (conocida clínicamente como toxoplasmosis) es generalmente resultado de la ingestión accidental de carne mal cocida con quistes tisulares, o de alimentos o agua contaminados con ooquistes de T. gondii. Aunque también se transmite vía vertical o congénita (dependiendo de la semana de gestación) y por transfusiones sanguíneas contaminadas con el parásito (Elmore et al., 2010).
La seroprevalencia en seres humanos puede ser desde un 10 % en zonas templadas, hasta superar el 80 % en países en vías de desarrollo o en áreas tropicales; no obstante, la infección generalmente es asintomática, pero llega a complicarse en fetos afectados o en personas inmunocomprometidas o inmunosuprimidas (Kaplan et al., 2009). En México, la seroprevalencia reportada varía del 15 al 50 % (Galván-Ramírez, Troyo, Román, Calvillo-Sánchez, & Bernal-Redondo, 2012). Específicamente en la Península de Yucatán, la infección con T. gondii ha sido detectada en seres humanos y animales domésticos (Hernández-Cortazar et al., 2015) o silvestres (Torres-Castro et al., 2016a; Torres-Castro et al., 2016b; Torres-Castro, Medina-Pinto, Noh-Pech, Puerto, & Rodríguez-Vivas, 2019), lo cual indica una alta contaminación ambiental con ooquistes que sobreviven por las condiciones medioambientales favorables (Hernández-Cortazar et al., 2015).
Los murciélagos (orden Chiroptera) son los únicos mamíferos con capacidad de vuelo y representan a uno de los taxones más numerosos y diversos (superados por los roedores) con aproximadamente 1 386 especies reconocidas a nivel mundial (Burgin, Colella, Kahn, & Upham, 2018), de las cuales 138 (alrededor del 10 % de la diversidad total) han sido identificadas en México (Ceballos & Arroyo-Cabrales, 2012) y 62 en la Península de Yucatán (MacSwiney, Vilchis, Clarke, & Racey, 2007). Estos animales tienen relevancia en los ciclos epidemiológicos de varios agentes etiológicos, ya que algunas especies son reservorios naturales u hospederos accidentales, convirtiéndolos en probables fuentes de infección para seres humanos y animales domésticos o silvestres (Calisher, Childs, Field, Holmes, & Schountz, 2006). Sin embargo, muchos aspectos sobre su participación en el ciclo de transmisión de T. gondii son desconocidos (Cabral et al., 2013).
Por otra parte, en murciélagos australianos cautivos de las especies Pteropus conspicillatus (conocido como zorro volador) y P. scapulatus (conocido como zorro volador rojo), la infección con T. gondii, detectada por inmunohistoquímica en pulmones y cerebro, ocasionó enfermedad clínica caracterizada por fallas orgánicas y signos nerviosos severos. No obstante, no fue posible determinar el tiempo de evolución y tampoco la fuente de contagio (Sangster, Gordon, & Hayes, 2012).
Mundialmente existen algunas investigaciones (serológicas y moleculares) que han evidenciado la infección con T. gondii en murciélagos de distintas especies y hábitos alimenticios (Cabral et al., 2013; Yuan et al., 2013; Dodd et al., 2014; Biazus et al., 2016). En México y otros países de Centro y Norteamérica, no existe información sobre su inclusión en el ciclo de transmisión de T. gondii, por lo que el objetivo del presente estudio es reportar la infección con T. gondii en murciélagos capturados en sitios de Campeche y Yucatán, México.
Materiales y métodos
Sitios de estudio: La captura de murciélagos se llevó a cabo en dos sitios del estado de Yucatán y uno del estado de Campeche, todos localizados en la Península de Yucatán, México. La primera captura se realizó en el centro ecoturístico ‘Ich ha lol xaan’, Hampolol, Campeche (19°55’36.944” - 19°56’36.2” N & 90°23’15.979” - 90°22’29.6” W), cuya vegetación predominante es la selva mediana subperennifolia y el clima cálido subhúmedo con lluvias en verano (Aw0) con temperatura media de 25.6 °C y precipitación pluvial media de 81.3 mm. Tiene una altitud media de 10 m (Gutiérrez-Báez, Zamora-Crescencio, & Puc-Garrido, 2013).
Las capturas en Yucatán se realizaron en: 1) San Francisco, Panabá (21°17’49.466” - 21°21’48.2” N & 88°16’12.437” - 88°19’23.6” W), cuya vegetación característica es la selva baja caducifolia con áreas de pastizal y el clima es Aw0 con temperatura media de 27 °C y precipitación pluvial de 1 094 mm. Tiene una altitud media de 17 m (Instituto Nacional para el Federalismo y el Desarrollo Municipal, 2018); 2) X’matkuil, Mérida (20°51’41.04” N & 89°37’27.84” W), la cual se encuentra dentro de la reserva ecológica “Cuxtal” y cuya vegetación original era la selva baja caducifolia, pero que actualmente el suelo está ocupado por asentamientos humanos y en menor grado por explotaciones agropecuarias (Ucan-Euan, Hernández-Betancourt, Arjona-Torres, Panti-May, & Torres-Castro, 2019). El clima predominante en la región es Aw0 con temperatura media de 26 °C y precipitación pluvial de hasta 1 100 mm. Tiene una altitud media de diez metros (INAFED, 2018).
Captura y recolección de muestras biológicas: Las capturas se realizaron en mayo (Hampolol), agosto (Panabá) y septiembre (X’matkuil) de 2017. La recolecta fue aprobada por el Comité de Bioética de la Facultad de Medicina Veterinaria y Zootecnia (FMVZ) de la Universidad Autónoma de Yucatán (UADY) (registro de acta: CB-CCBA-I-2018-001) y de la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT) de México (registros de actas: SGPA/DGVS/03705/17 y SGPA/DGVS/01186/17).
Cada sitio de estudio se muestreó hasta por tres noches, según la actividad de los murciélagos y las condiciones climáticas. Se colocaron de 18:30 - 23:00 h, tres redes de niebla (12 de largo x 2.6 m de alto) en puntos previamente seleccionados cercanos a cuerpos de agua, posibles zonas de descanso y/o tránsito para alimentación. Las revisiones de las redes fueron en intervalos de hasta 20 min. Todos los murciélagos se retiraron con guantes de carnaza y se colocaron en bolsas de tela con jareta, identificadas con el número de red y la hora de captura; posteriormente se trasladaron a laboratorios temporales para su procesamiento.
Los murciélagos fueron anestesiados e insensibilizados con isoflurano y sacrificados con una sobredosis de pentobarbital sódico vía intracardiaca, siguiendo las especificaciones de la American Veterinary Medical Association (AVMA, 2013). Las especies se identificaron con ayuda de claves taxonómicas (Medellín, Arita, & Sánchez, 2008; Reid, 2009).
Durante la anestesia se registraron las medidas somáticas convencionales, peso, sexo y edad (machos: adultos con testículos escrotados se consideraron activos y jóvenes con testículos inguinales se consideraron inactivos. Hembras: adultas gestantes, lactantes o con el orificio vaginal abierto, se consideraron activas y jóvenes con el orificio vaginal cerrado se consideraron inactivas).
Se realizó una necropsia para la recolección de muestras biológicas de bazo, hígado y riñón, las cuales fueron depositadas en viales para microcentrífuga de 1.5 ml (Eppendorf®, Hamburgo, Alemania) y conservadas a -4 °C hasta su traslado al Laboratorio de Enfermedades Emergentes y Reemergentes (LEER) del Centro de Investigaciones Regionales “Dr. Hideyo Noguchi” (CIR) - UADY, en donde se almacenaron a -70 °C para su posterior empleo en la extracción de ADN total. Los cadáveres de todos los animales capturados se procesaron y depositaron en las colecciones zoológicas de la FMVZ-UADY y de El Colegio de la Frontera Sur (ECOSUR), cede San Cristóbal de las Casas, Chiapas.
Extracción de ADN total y diagnóstico molecular de Toxoplasma gondii: El ADN total se extrajo por medio del estuche comercial NucleoSpin® Tissue (MACHEREY-NAGEL GmbH & Co. KG, Düren Alemania), previa digestión con proteinasa K (OMEGA Bio-tek, Georgia, Estados Unidos), siguiendo las especificaciones de la casa comercial. Desafortunadamente, por cuestiones ajenas a la presente investigación (objetivos de otros estudios), no fue posible emplear los tres órganos de cada uno de los murciélagos capturados.
Posteriormente, empleando un espectrofotómetro (NanoDrop 2000™, Thermo Scientific®, Wilmington, Estados Unidos) se cuantificó y se verificó la presencia de contaminantes o inhibidores en los aminoácidos extraídos y se conservaron a -20 °C para su uso en el diagnóstico molecular de T. gondii.
La infección con T. gondii se determinó a través de PCR anidada. En la primera reacción se utilizaron los cebadores descritos por Sroka, Szymańska y Wójcik-Fatla (2009): ml/S1 (5’-TGTTCTGTCCTATCGCAACG-3’) y Pml/AS1 (5’-ACGGATGCAGTTCCTTTCTG-3’) y en la segunda Pml/S2 (5’-TCTTCCCAGACGTGGATTTC-3’) y Pml/AS2 (5’-CTCGACAATACGCTGCTTGA-3’). Ambas reacciones amplifican un segmento del gen B1 de T. gondii con un tamaño final de 560 pares de bases (pb).
Los reactivos en ambas reacciones tuvieron las siguientes concentraciones en un volumen final de 25 µl: PerfeCTa SYBR® Green FastMix® 1X (Quantabio®, Massachusetts, Estados Unidos), 0.1 µM de cada oligonucleótido correspondientes a la primera o segunda reacción y 3 µl de ADN templado. Asimismo, las condiciones en el termociclador fueron: un ciclo de tres minutos a 95 °C, seguido de 35 ciclos de 30 s a 95 °C, 30 segundos a 64.2 °C y 45 s a 72 °C, finalmente un ciclo de cinco min a 72 °C.
La electroforesis de los productos de PCR se efectuó en geles de agarosa al 1 %, teñidos con bromuro de etidio. La visualización se hizo en un fotodocumentador (Bio-Rad®, California, Estados Unidos).
Purificación, secuenciación, análisis de secuenciación y construcción del árbol filogenético: Ocho productos positivos fueron purificados con el estuche comercial Zymoclean™ Gel DNA Recovery (Zymo Research, California, Estados Unidos) y enviados para secuenciación al laboratorio DIMYGEN (http://www.dimygen.com; Mérida, México).
Las secuencias obtenidas fueron alineadas con el programa MEGA versión 7.0® (https://www.megasoftware.net/) y comparadas con otras secuencias previamente depositadas en el GenBank®, utilizando el algoritmo Megablast (https://blast.ncbi.nlm.nih.gov/Blast.cgi).
La construcción del árbol filogenético se realizó utilizando el método de inferencia evolutiva Neighbor-Joining (Saitou & Nei, 1987) con mil réplicas según el método bootstrap (Felsenstein, 1985). Las distancias evolutivas se calcularon empleando el modelo de 2-parámetros de Kimura (Kimura, 1980). El análisis evolutivo se realizó en el programa MEGA versión 7.0® (Kumar, Stecher, & Tamura, 2016).
Resultados
Se capturaron un total de 69 murciélagos en las tres localidades de estudio, pertenecientes a ocho especies distintas: 41 (59.4 %, 41/69) Artibeus jamaicensis; seis (8.7 %, 6/69) Pteronotus parnellii; seis (8.7 %, 6/69) Noctilio leporinus; seis (8.7 %, 6/69) Chiroderma villosum; cuatro (5.8 %, 4/69) Glossophaga soricina; dos (2.9 %, 2/69) Carollia sowelli, dos (2.89 %, 2/69) Artibeus lituratus y dos (2.9 %, 2/69) Rhogeessa aeneus. Hampolol, Campeche, registró la mayor riqueza y la mayor abundancia de individuos recolectados. La especie con mayor frecuencia de captura fue Artibeus jamaicensis (Tabla 1).
TABLA 1 TABLE 1 Especies y número total de los murciélagos capturados por sitio de estudio en los estados de Campeche y Yucatán, México Species and the total number of bats captured by study site in the states of Campeche and Yucatán, Mexico
| Sitios | ||||
| Yucatán | Campeche | |||
| Especies | Panabá | X’matkuil | Hampolol | Total |
| Artibeus jamaicensis | 12 | 22 | 7 | 41 |
| Pteronotus parnellii | 0 | 0 | 6 | 6 |
| Noctilio leporinus | 0 | 0 | 6 | 6 |
| Chiroderma villosum | 5 | 0 | 1 | 6 |
| Glossophaga soricina | 3 | 0 | 1 | 4 |
| Carollia sowelli | 0 | 0 | 2 | 2 |
| Artibeus lituratus | 1 | 0 | 1 | 2 |
| Rhogeessa aeneus | 1 | 0 | 1 | 2 |
| Total | 22 | 22 | 25 | 69 |
La PCR anidada identificó ocho (11.6 %, 8/69) murciélagos positivos a la infección con T. gondii, distribuidos de la siguiente manera: seis (75 %, 6/8) A. jamaicensis (cuatro de X’matkuil y dos de Panabá), un (12.5 %, 1/8) G. soricina y un (12.5 %, 1/8) C. villosum (ambos capturados en Panabá), por lo que en Hampolol, Campeche, no se capturaron animales positivos (Tabla 2). Ninguno de los murciélagos positivos presentó signos clínicos compatibles con la enfermedad (Sangster et al., 2012).
TABLA 2 TABLE 2 Número de individuos capturados y porcentaje de infección según las especies de murciélagos capturados en sitios de la Península de Yucatán, México Number of individuals captured and infection percentage according to the species of bats captured in sites of the Yucatán Peninsula, Mexico
| Especie | Hábitos alimenticios | Número de individuos capturados | Número de individuos positivos (porcentaje de infección) |
| Artibeus jamaicensis | Frugívoro | 41 | 6 (14.6 %) |
| Pteronotus parnellii | Insectívoro | 6 | 0 (0 %) |
| Noctilio leporinus | Ictiófago/Insectívoro (ocasionalmente) | 6 | 0 (0 %) |
| Glossophaga soricina | Nectarívoro/Frugívoro (ocasionalmente) | 4 | 1 (25 %) |
| Carollia sowelli | Frugívoro | 2 | 0 (0%) |
| Chiroderma villosum | Frugívoro/Nectarívoro o insectívoro (ocasionalmente) | 6 | 1 (16.6 %) |
| Artibeus lituratus | Frugívoro | 2 | 0 (0 %) |
| Rhogeessa aeneus | Frugívoro | 2 | 0 (0 %) |
| Total | 69 | 100 % |
La infección con T. gondii se detectó en todos los órganos explorados: riñón (8.7 %, 6/69), hígado (4.6 %, 2/43) y bazo (9.1 %, 2/22). Dos A. jamaicensis (capturados en X’matkuil) fueron reactivos en riñón y bazo, cuatro individuos únicamente en riñón y dos en bazo.
El análisis de identidad arrojó porcentajes de 99-100 % para cobertura y 97-99 % para identidad en comparación con secuencias previas de T. gondii (claves de acceso en GenBank KY514164.1 y MF576257.1). De igual forma, el árbol filogenético demostró que los aislados de los murciélagos obtenidos en nuestra investigación son similares o idénticos a secuencias del grupo (genotipo) tres (III) de T. gondii (Fig. 1).
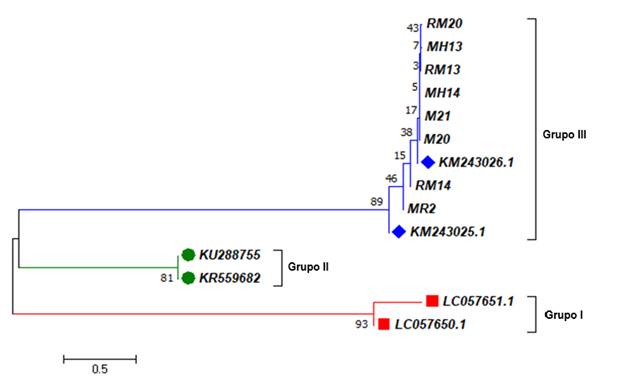
Fig. 1. Fig. 1 Secuencias de los fragmentos del gen B1 de T. gondii obtenidas de los murciélagos capturados en sitios de Yucatán y Campeche, México. Los aislados del presente estudio corresponden a los prefijos RM, MH y M, relacionadas con el genotipo (grupo) tres (III) de T. gondii. Las longitudes de rama están en las mismas unidades que las distancias evolutivas utilizadas para inferir el árbol filogenético. Se muestra el árbol óptimo con la suma de longitud de rama igual a 6.70649030. El análisis involucró un total de 14 secuencias de nucleótidos y 143 posiciones en el conjunto final de datos. Las secuencias de referencia en el grupo III (KM) fueron aisladas de Mytilus californianus. Las secuencias del grupo II (KU y KR) fueron aisladas de Myrmecophaga tridactyla y Phalacrocorax carbosinensis, respectivamente. Las secuencias del grupo I (LC) fueron aisladas de seres humanos. Phylogenetic tree constructed with the sequences of the T. gondii B1 gene fragments, obtained from the captured bats in Yucatán and Campeche, Mexico. The isolates of the present study correspond to the RM, MH, and M prefixes, related to the genotype (group) three (III) of T. gondii. The branch lengths are in the same units as the evolutionary distances used to infer the phylogenetic tree. The optimal tree is shown with the sum of the branch length equal to 6.70649030. The analysis involves a total of 14 nucleotide sequences and 143 positions in the final data set. The reference sequences in group III (KM) were isolated from Mytilus californianus. Group II sequences (KU and KR) were isolated from Myrmecophaga tridactyla and Phalacrocorax carbo sinensis, respectively. Group I (LC) sequences were isolated from humans.
Discusión
A nivel mundial se conocen pocos aspectos sobre la infección con T. gondii en murciélagos (Cabral et al., 2013), por lo que nuestros resultados contribuyen al entendimiento del ciclo de transmisión del parásito en estos animales. Además, representan el primer registro en quirópteros capturados en países de Centro o Norteamérica.
Las frecuencias de infección con T. gondii en murciélagos alrededor del mundo son variadas. En Brasil, Cabral et al. (2013), reportaron una prevalencia de 0.05 % (2/369) obtenida a partir de PCR-RFLP (polymerase chain reaction-restriction fragment length polymorphism), también, de Jesus et al. (2017), describieron un 2 % (2/97) en murciélagos frugívoros capturados en el estado de Bahía, empleando la amplificación de un fragmento del gen B1 de T. gondii. En China, Qin et al. (2014) y Jiang et al. (2014), determinaron un 6.1 % (38/626) y 9.7 % (59/608) de animales infectados capturados en cuatro provincias y en la región sureste, respectivamente; ambos estudios utilizaron el aislamiento de un fragmento del gen B1 por PCR anidada. Estos trabajos arrojaron frecuencias menores a la encontrada en la presente investigación (11.6 %, 8/69). No obstante, en la región nororiental de Brasil, Fournier et al. (2014), obtuvieron una prevalencia del 21.6 % (11/51), y en Birmania, Sun et al. (2013), determinaron un 29.3 % (161/550) en murciélagos de cinco especies distintas, por lo que ambos resultados son superiores al establecido por nosotros. Por último, Dodd et al. (2014), mencionaron una tasa de infección (similar a la nuestra) del 10.39 % (8/77), obtenida a través de PCR anidada dirigida a una fracción del antígeno de superficie 1 de T. gondii, siendo hasta el momento el único reporte en el continente europeo.
Las variaciones entre las frecuencias de infección pueden deberse a los numerosos hábitos alimenticios (frugívoros, insectívoros, hematófagos, etc.) de los murciélagos (Sun et al., 2013). Existen varias hipótesis sobre cómo estos animales adquieren la infección. En el caso de los insectívoros, el contagio puede presentarse por el consumo de insectos descritos como vectores mecánicos de ooquistes de T. gondii (Chinchilla & Ruiz, 1976; Graczyk, Knight, & Tamang, 2005). Otra vía, la cual es común en animales mamíferos (independientemente del tipo de dieta), es el consumo de agua en fuentes naturales contaminada con ooquistes (Cabral et al., 2013), lo cual es argumentado por Dodd et al. (2014) en murciélagos frugívoros capturados en Reino Unido. Asimismo, la conducta de acicalamiento en algunas especies (especialmente hematófagas), tal vez provoca la ingesta involuntaria de ooquistes presentes en el pelaje, lo cual ocurre principalmente en hembras maduras (Sodré, da Gama, & Almeida, 2010). Otra hipótesis sobre la transmisión en murciélagos hematófagos es el consumo de taquizoítos en sangre de animales en la etapa aguda de la infección, aunque este mecanismo es poco probable debido al carácter crónico de T. gondii (Cabral et al., 2013).
Adicionalmente, la transmisión congénita de T. gondii en animales mamíferos (que es considerada extremadamente inusual), ha sido reportada en estudios hechos con mamíferos pequeños como roedores (Hide et al., 2009; Thomasson et al., 2011), por lo que también podría ocurrir en murciélagos e influir en las frecuencias de infección detectadas (Dodd et al., 2014); sin embargo, son necesarios trabajos futuros para esclarecer esta vía.
En el caso particular de los murciélagos ictiófagos como el N. leporinos (el cual no fue identificado como positivo en nuestro estudio), también pueden infectarse por el consumo de peces con quistes tisulares de T. gondii, ya que algunos de ellos (en fuentes de agua dulce) han sido identificados como hospederos accidentales (Aakool & Abidali, 2016).
La distribución de quistes de T. gondii en murciélagos afectados es poco conocida; no obstante, se ha reportado tropismo en cerebro, músculo esquelético, corazón, pulmones, bazo e hígado (Sangster et al., 2012; Fournier et al., 2014), coincidiendo estos dos últimos con lo encontrado en nuestra investigación. Vale la pena mencionar que la infección en los murciélagos estudiados también se identificó en riñones, lo cual es similar a lo descrito en algunos roedores capturados en la región (Torres-Castro et al., 2016b) y otros animales silvestres (Torres-Castro et al., 2019). Es posible que la distribución de los ooquistes de T. gondii en los organismos de animales afectados esté asociada al genotipo involucrado en la infección (Sangster et al. 2012; Cabral et al., 2013).
El análisis filogenético correspondiente al fragmento del gen B1 de los aislado obtenidos en los murciélagos capturados, demostró que las secuencias finales resultaron similares al genotipo III de T. gondii (Fig. 1). Lo cual concuerda con lo reportado por Cabral et al. (2013) en murciélagos frugívoros e insectívoros de Brasil.
El hallazgo de murciélagos infectados con T. gondii resulta relevante debido a que, en ambientes silvestres, estos animales y otros mamíferos pequeños forman parte de la dieta habitual de felinos, lo cual ocurre esporádicamente con gatos domésticos, convirtiéndose en fuentes de infección y en posibles mecanismos de transmisión (Cañón-Franco, de Araújo, & Gennari, 2013; Yuan et al., 2013).
Son necesarias más investigaciones epidemiológicas para determinar otros genotipos de T. gondii circulantes en murciélagos de la región, ya que estudios anteriores han demostrado que pueden presentar genotipos aislados en otros animales (domésticos o silvestres) e incluso en seres humanos (Qin et al., 2014), lo cual influye en la dinámica de transmisión e infección entre las especies de murciélagos presentes (Jiang et al., 2014). Por otra parte, también son necesarias evaluaciones ambientales para determinar el nivel de contaminación por ooquistes de T. gondii en las cavernas o sitios de reposo de los murciélagos capturados, ya que previamente ha sido señalado como factor influyente en la prevalencia de infección (Yuan et al., 2013).












 uBio
uBio 

