Introducción
El consumo de agua contaminada es causa de aproximadamente 842 000 defunciones al año, principalmente en los países en desarrollo donde patologías como la disentería y el parasitismo intestinal se asocian al inadecuado manejo de las fuentes de agua. Esto no solo sucede por deficiencias en los sistemas de higienización y potabilización del agua para consumo, sino por el vertimiento de aguas residuales no tratadas a fuentes hídricas superficiales que posteriormente se utilizan para actividades recreativas o agrícolas (Levengood, Hörman, Hänninen, & O’Brien, 2018). La presencia en una fuente de agua en permanente contacto con la comunidad de microorganismos de origen fecal genera un importante impacto para la salud pública, más aún cuando la contaminación fecal es de origen humano, ya que puede contener patógenos como los virus de la hepatitis A, enterovirus causantes de enfermedad diarreica, bacterias patógenas, formas parasitarias infectantes, entre otros (OMS, 2017). Los métodos tradicionales de cultivo para determinar la contaminación fecal en cuerpos de agua y otras matrices como los recuentos de Coliformes Totales (CT), Coliformes Termo Tolerantes (CTT), entre otros utilizados comúnmente, no permiten especificar si la contaminación es de origen humano o animal, diferenciación que haría posible mejorar el control sanitario y prevenir la trasmisión de enfermedades especie-específicas a través del agua (Rochelle, Nguyen, Le, Sengtaheuanghoung, & Ribolzi, 2015).
En las últimas décadas se ha generado gran interés por la creación de nuevos métodos para determinar contaminación fecal humana, incluida la investigación de sustancias químicas y medicamentos exclusivos de uso humano (como la cafeína), o la presencia de virus entéricos especie específicos (Waso, Ndlovu, Dobrowsky, & Khan, 2016; Subbarao, Chester, & Cooley, 2015; Hellmér, Stranddorf, Seidel, Aarestrup, & Schultz, 2017). Se han diseñado numerosos marcadores genéticos bacteriales para la detección molecular de contaminación fecal humana en aguas ambientales. Sin embargo, el uso extendido de estos marcadores se ha dificultado por falta de conocimiento en cuanto a su estabilidad y validez geográfica, por ser diseñados y probados de manera restrictiva en un pequeño número de regiones bien caracterizadas (Mayer et al., 2018).
Determinar en cuerpos de agua, la presencia de especies de bifidobacterias que habitan de forma exclusiva el intestino humano, como Bifidobacterium adolescentis y B. dentium ha sido uno de los marcadores propuestos de contaminación fecal humana mejor aceptados en los últimos años (Ballesté, Bonjoch, Belanche, & Blanch, 2010; Casanovas, Gómez, Sánchez, & Belanche, 2015; Gómez-Doñate, Ballesté, Muniesa, & Blanch, 2012). Sin embargo, este marcador ha sido desarrollado y probado en regiones con temperaturas, condiciones biológicas y características socio económicas diferentes de las que se presentan en las regiones tropicales. Hasta la fecha no existe evidencia de que, en ambientes tropicales, la presencia de estas especies de bifidobacterias pudiese ser un adecuado indicador de contaminación fecal humana; destacando que en dichos ambientes predominan las altas temperaturas y humedad relativa elevada, así como condiciones sanitarias precarias y la convivencia entre humanos y animales domésticos que favorecen la contaminación cruzada.
En este estudio, realizado en un asentamiento humano aledaño a un cuerpo de agua contaminado de la Región Caribe colombiana, se evaluó en agua y heces de humanos y animales la presencia de bifidobacterias como potenciales marcadores de contaminación fecal humana. Se utilizó técnicas moleculares como la PCR-DGGE (Electroforesis en gel con gradiente desnaturalizante).
Materiales y métodos
El lugar de muestreo corresponde a la Ciénaga de Mesolandia, cuerpo de agua que forma parte del delta en la desembocadura del río Magdalena al Mar Caribe en el norte de Colombia. Esta ciénaga en el 2015 presentaba altos niveles de contaminación microbiológica (Corporación Autónoma Regional de Atlántico, 2011). La contaminación proviene principalmente de las aguas vertidas de los municipios aledaños (Malambo y Soledad) y de asentamientos urbanos marginales a la orilla de la ciénaga como el Barrio Mesolandia, con deficientes condiciones sanitarias. Se realizó un muestreo puntual para obtención muestras fecales de humanos y animales, de acuerdo con los procedimientos establecidos por el Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM, 2003) y del Instituto Nacional de Salud de Colombia (INS, 2011). La geoposición (10°53’30” N & 74°45’53” W) corresponde aproximadamente a 3 m del costado oriental de la ciénaga, en el área que limita con el barrio Mesolandia.
Los parámetros fisicoquímicos in situ: pH, temperatura, conductividad, turbiedad, oxígeno disuelto y salinidad; fueron determinados utilizando el equipo Multiparamétrico WTW Multi 3420 debidamente calibrado. La muestra (por duplicado) fue transportada a 5 °C al laboratorio de la Universidad Metropolitana para su procesamiento.
En el Barrio Mesolandia se recolectaron 260 muestras fecales humanas (muestreo simple con un margen de error del 6.0 % y nivel de confianza del 95 % en relación con la población del Barrio) y 94 muestras fecales de animales domésticos así: 6 muestras provenientes de cerdo (Sus scrofa), 5 de gallo (Gallus gallus), 5 de gato (Felis silvestris), 4 de aves (Orden Paseriformes), y 74 de perro (Canis lupus). Las muestras de animales fueron recolectadas por los dueños o cuidadores a partir de deposiciones frescas, extrayendo sólo el material de la parte superior sin tocar el suelo para evitar contaminación. Las muestras fueron transportadas a 5 °C al laboratorio de la Universidad Metropolitana y almacenadas a -80 °C hasta su uso.
Análisis microbiológico del agua por métodos culturales: Se realizó el recuento de Coliformes Totales (CT) y Coliformes Termo Tolerantes (CTT), por la técnica de tubos múltiples que determina el número mas probable de microorganismos en 100 ml de agua (NMP/100 ml) de acuerdo con los protocolos de la American Public Health Association (APHA) (Rice, Baird, Eaton, & Clesceri, 2017).
Extracción de ADN bacteriano de agua y heces: De la muestra de agua, se centrifugaron 100 ml a 13 000 g durante 10 min, el sedimento se sometió a un tratamiento pre-lisis de 1 h a 37 °C en buffer salino fosfato 100 mM pH 7.0 adicionado con 1 mg/ml de lisozima, y posteriormente se extrajo el ADN (Kit NucleoSpin de Macherey Nagel). De cada muestra de heces de humanos y animales, 200 mg fueron diluidos en 2 ml del buffer salino fosfato con lisozima, centrifugados y utilizados para extraer el ADN bacteriano (Kit Isolate II Genomic ADN Kit de Bioline, USA). Todos los ADN fueron cuantificados por espectrofotometría midiendo la absorbancia a 260 nm.
Amplificación por PCR de las especies del género Bifidobacterium en agua y heces: 100 ng del ADN extraído del agua o heces fueron amplificados por PCR utilizando los cebadores especie específicos Bif164F (5`-GGGTGGTAATGCCGGATG-3`) y Bif662R-GC (5`-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGCCACCGT TACACCGGGAA-3`) que amplifican 523 pb del rADN 16S (Satokari, Vaughan, Akkermans, Saarela, & De Vos, 2001; Bonjoch, Balleste, & Blanch, 2004). La reacción de PCR consistió en 3 min a 98 °C, 34 ciclos de 98 °C 30 s, 62 °C 30 s y 72° C 1 min, con un ciclo final de 72 °C durante 5 min, utilizando la polimerasa Velocity de Bioline. Las reacciones de PCR se verificaron en geles de agarosa al 2 % utilizando Syber Green para visualizar el ADN amplificado.
DGGE de los amplificados por PCR: Se utilizaron geles de acrilamida al 8 % de tamaño 16 x 17.5 cm con gradiente desnaturalizante de urea y formamida creciente en dirección a la electroforesis entre 30 a 50 % (100 % de desnaturalización corresponde a 7 M de Urea y 40 % de formamida) y utilizando el equipo Cleaver Cientific DGGE. Se realizó la electroforesis durante 6 h a 130 V constantes y una temperatura de 62 ºC, en Buffer TAE 1X (TAE 50X: TRIS base 2 M, Ácido acético 1 M y EDTA pH 8.0 50 mM). Posteriormente los geles se colorearon durante 15 min en una solución de Syber Green en Buffer TAE 0.5X y la fluorescencia producida fue registrada con el fotodocumentador ChemiDoc XRS+ System de BIO-RAD.
Identificación de las especies de bifidobacterias presentes en el agua: Las bandas resultantes en DGGE de la muestra de agua, fueron cortadas y el ADN extraído (kit ISOLATE II PCR and Gel Kit de Bioline); re amplificado por PCR utilizando los cebadores Bif164F y Bif662R sin cola de guanina citosina (5´-CCACCGTTACACCGGGAA-3`) en las condiciones de PCR descritas previamente. La identidad de los aislamientos se realizó por secuenciación de las dos cadenas de ADN amplificado (Método Sanger, en la empresa Corpogen Bogotá-Colombia) y su posterior comparación en la base de datos del Gen Bank utilizando el programa Blast. Los re-amplificados por PCR de las especies de bifidobacterias identificadas fueron utilizados como control en DGGE de las muestras fecales de humanos y animales.
Aspectos éticos de la investigación: En cumplimiento al decreto 1376 del 21 de junio de 2013, que reglamenta la recolección de especímenes de la diversidad biológica con fines de investigación científica, se solicitó el permiso Auto No. 00000021 de 2015 ante la Corporación Autónoma Regional del Atlántico (CRA). Las muestras humanas fecales fueron colectadas previa aprobación del comité de ética y firma de consentimiento informado.
Resultados
Análisis de la muestra de agua: Los parámetros fisicoquímicos determinados directamente en el cuerpo de agua fueron los siguientes: pH 8.3; temperatura 31 °C; Oxígeno disuelto 10.13 mg/lt; Salinidad 1.3; Conductividad 2.5 ms/cm. Los resultados de los recuentos de CT y CTT fueron superiores a 160 000 NMP / 100 ml, superando los límites permitidos para actividades de contacto primario y secundario (Presidencia de la República de Colombia, 1984). El análisis por PCR-DGGE mostró un perfil de bandas que al ser re amplificadas y secuenciadas permitieron identificar ocho especies de bifidobacterias presentes en el agua (Tabla 1).
TABLA 1 TABLE 1 Identificación de Bifidobacterias mediante PCR-DGGE a partir de una muestra de agua de la ciénaga de Mesolandia Identification of Bifidobacteria by PCR-DGG from a sample of water from the Mesolandia swamp
Perfil de bandas de bifidobacterias en PCR-DGGE de la muestra de agua. La identidad de las bifibobacterias representadas en cada banda se determinó por la secuenciación del ADN re-amplificado de las bandas y su comparación en la base de datos del GenBank.
Band profile in PCR-DGGE of the water sample. The Bifidobacterium identity was determined by DNA sequencing, reamplification and comparison in the GenBank database.
Análisis de muestras fecales de humanos y animales: La amplificación por PCR de las especies del género Bifidobacterium en las condiciones experimentales descritas, fue posible en el 31.54 % de las muestras fecales humanas y el 36.17 % de las muestras animales. En DGGE se observó que las ocho bandas correspondientes a las bifidobacterias identificadas en el agua de la ciénaga estaban presentes en heces humanas (Fig. 1), siendo las bandas correspondientes a B. lactis y B. adolescentis las más frecuentes en la población con 19.23 % y 11.92 % respectivamente, B. dentium estuvo presente en el 4.61 % de las muestras humanas.
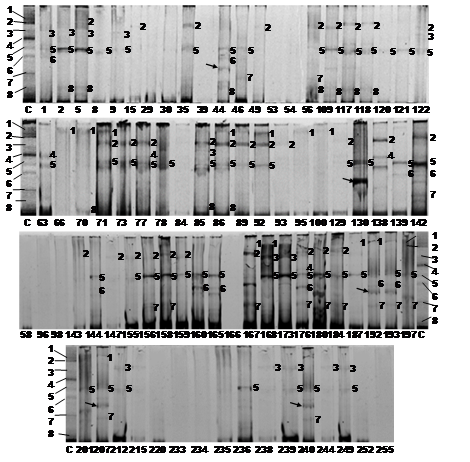
Fig. 1. Fig. 1 Perfiles de bandas en PCR-DGGE de las especies de Bifidobacterias presentes en muestras humanas fecales. C: Patrón de bandas donde 1: Bifidobacterium longum, 2: B adolescentis, 3: B. dentium, 4: B. pseudolongum subsp. globosum, 5: B. lactis, 6: B. animalis subsp. lactis, 7: B. ruminantium y 8: Bifidobacterium sp. Los números en cada perfil corresponden a su banda homologa en el patrón. Las flechas indican bandas con marcada intensidad en algunas muestras que no están en el patrón. Band profiles in PCR-DGG of the Bifidobacteria species present in fecal human samples. C: Band profiles 1: Bifidobacterium longum, 2: B adolescentis, 3: B. dentium, 4: B. pseudolongum subsp. globosum, 5: B. lactis, 6: B. animalis subsp. lactis, 7: B. ruminantium y 8: Bifidobacterium sp. The numbers in the profile correspond to its equivalent band in the marker. The arrows indicate intense bands in some samples that are not in the marker.
En animales, el porcentaje de positividad en la PCR fue variable de acuerdo con la especie: cerdo 50 % (n = 3), gallo 60 % (n = 3), gato 40 % (n = 2), pájaro 25 % (n = 1) y perro 33.78 % (n = 25). En DGGE (Fig. 2) las bandas correspondientes a B. lactis y B. pseudolongum fueron las más frecuentes en perros. En cerdos y gatos la intensidad de las bandas en DGGE fue muy tenue, identificándose B. animalis en un cerdo; en aves se observó más bandas de las muestras tomadas de pájaro (loro que habita en cautiverio) que de las muestras tomadas de gallos. Las especies de Bifidobacterias que se consideran habitantes exclusivos del intestino humano, como B. adolescentis y B. dentium, fueron encontradas en muestras fecales de animales, estando B. adolescentis en el 4.05 % de los perros (n = 3) y B. dentium en un pájaro. Todas las especies de bifidobacterias identificadas en el agua también estaban presentes en las muestras de humanos y al menos en una especie de animal.
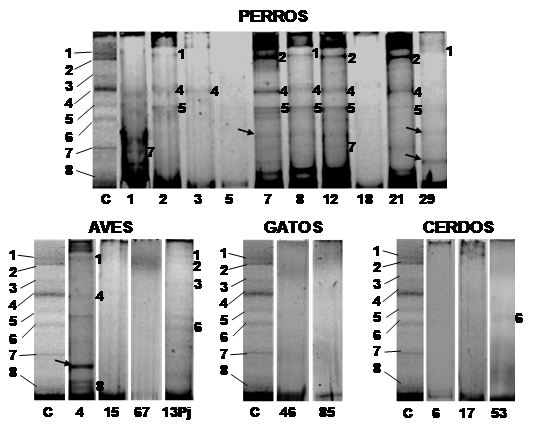
Fig. 2. Fig. 2 Perfiles de bandas en PCR-DGGE de las especies de Bifidobacterias presentes en muestras fecales de animales domésticos. C: Patrón de bandas donde 1: Bifidobacterium longum, 2: B adolescentis, 3: B. dentium, 4: B. pseudolongum subsp. globosum, 5: B. lactis, 6: B. animalis subsp. lactis, 7: B. ruminantium y 8: Bifidobacterium sp. Los números en cada perfil corresponden a su banda homologa en el patrón. Band profiles in PCR-DGG of the Bifidobacteria species present in fecal samples of domestic animals. C: Band profiles 1: Bifidobacterium longum, 2: B. adolescentis, 3: B. dentium, 4: B. pseudolongum subsp. globosum, 5: B. lactis, 6: B. animalis subsp. lactis, 7: B. ruminantium y 8: Bifidobacterium sp. The numbers in the profile correspond to its equivalent band in the marker.
Discusión
En la ciénaga de Mesolandia se encontraron elevados niveles de contaminación microbiológica mediante el recuento de CT y CTT, resultado coherente con lo reportado previamente por la Corporación Autónoma Regional de Atlántico (2011). De manera que evidencia una problemática recurrente en este cuerpo de agua con implicaciones para la salud pública, más aún cuando en sus alrededores existen asentamientos humanos en interacción constante con el agua. En cuanto a los parámetros fisicoquímicos encontrados en este estudio, mostraron ser similares a los reportados por la CRA y el Instituto de Investigaciones Marinas y Costeras (INVEMAR) (Garcés-Ordóñez, Vivas-Aguas, Martínez, Córdoba, Contreras, & Obando, 2016), los cuales se consideran compatibles con la conservación de la vida en el ecosistema acuático de la ciénaga.
Ocho especies diferentes de bifidobacterias fueron identificadas mediante PCR-DGGE en el agua de la ciénaga. Este hallazgo demuestra que, pese a las condiciones de temperatura, radiación solar, alta presencia microbiana e incluso contaminación química proveniente de empresas aledañas a la ciénaga, es posible la identificación de especies de bifidobacterias por los métodos moleculares descritos, demostrando una permanencia suficiente en el agua que permite su identificación. Aunque el alcance de este estudio no permite evaluar el tiempo de permanencia de las bifidobacterias en el cuerpo de agua después de su ingreso a través de materias fecales, algunas especies de las bacterias identificadas en este estudio podrían servir como indicadores de contaminación fecal. Al respecto hay que destacar que microorganismos como Escherichia coli y otros coliformes fecales comúnmente usados para definir contaminación fecal pueden ser muy susceptibles a factores medio ambientales, lo cual afecta su utilidad como indicador (Al-Gheethi, Ismail, Efaq, Bala, & Al-Amery, 2015; Burkhardt, Calci, Watkins, Rippey, & Chirtel, 2000). Por lo tanto, resultaría de gran interés plantear nuevos estudios que permitan comparar la susceptibilidad a factores ambientales de los indicadores tradicionales de contaminación fecal con las bifidobacterias. Con el fin de evitar falsos negativos en la investigación de contaminación fecal en aguas tropicales, debido a la susceptibilidad de los microorganismos a las condiciones ambientales, algunos autores plantean el uso combinado de la identificación de microorganismos con la evaluación de sustancias como el coprosterol (Cabralab, StarkcHedda, Kolmb, & Martins, 2018).
Además de su resistencia a factores ambientales, las características ideales que debe reunir un microorganismo para ser considerado un adecuado indicador de contaminación fecal son: estar presente en el tracto intestinal, no proliferar en el ambiente, no ser patógeno y ser fácilmente detectable por métodos relativamente económicos (Rochelle et al., 2015). Estas características están presentes en cepas específicas de bifidobacterias como son B. adolescentis y B. dentium, reconocidas como posibles indicadores de contaminación fecal de origen humano en diferentes estudios (Casanovas et al., 2015; Balleste et al., 2010; Gómez et al., 2012). En este estudio algunas de dichas características fueron ratificadas por el hallazgo de bifidobacterias en las muestras fecales y en el agua. Además, teniendo en cuenta que las bifidobacterias no son microorganismos facialmente cultivables, su identificación por técnicas moleculares (tecnología ampliamente difundida actualmente) puede resultar rápida, confiable y relativamente económica.
Se conoce que las bifidobacterias son generalmente los primeros microorganismos que colonizan del intestino humano desde el nacimiento y que hacen parte importante de la microbiota intestinal hasta la edad adulta, con modificaciones en su población asociadas a la dieta, la interacción con otros microorganismos intestinales y bajo diversas condiciones ambientales (Flint, Duncan, & Louis, 2017). En este trabajo, llama la atención que solo en el 31.54 % de las muestras fecales humanas fue posible la amplificación por PCR con cebadores específicos para ese género, lo que amerita plantear nuevos estudios que expliquen la baja frecuencia de bifidobacterias en la población estudiada. Es posible que se requiera modificar las condiciones experimentales, ya que a pesar de que los cebadores utilizados en este estudio han sido empleados con éxito por otros autores en la evaluación de bifidobacterias en ecosistemas intestinales o ambientales complejos, no existen precedentes de su uso en las condiciones ambientales y poblacionales del Caribe Colombiano. Por otra parte, el tipo de dieta y condiciones sanitarias deficientes como las encontradas en la población marginal estudiada, pueden ser razones que expliquen la baja frecuencia de bifidobacterias en las muestras fecales humanas, ya que la microbiota intestinal depende directamente de la calidad y cantidad de carbohidratos, proteínas y otros nutrientes de la dieta (Korpela, 2018). La presencia de B. adolescentis y B. dentium fue relativamente baja en las muestras humanas evaluadas, condición poco favorable para un indicador de contaminación fecal específico.
Existen pocos estudios que evalúan la presencia de bifidobacterias en animales. Sin embargo, Gavini, Delcenserie, y Kopeinig (2006) aislaron bifidobacterias en 122 de 145 muestras de heces de animales domésticos: res (Bos taurus); cerdo (S. scrofa); oveja (Ovis orientalis); cabras (Capra aegagrus); caballos (Equus caballus); conejos (Oryctolagus cuniculus); pollos (G. gallus); gansos (Anser anser) y palomas (Columba livia) en granjas de Francia y en 92 de 955 animales en Austria (B. Taurus y S. scrofa), y encontraron que B. pseudolongum es la especie más frecuente en animales. En un estudio reciente se encontró que en perros (C. lupus), B. animalis y B. pseudolongum son las especies de bifidobacterias más encontradas, sugiriendo que cambios en la dieta pueden modificar la población intestinal de estas (Sabbioni et al., 2016). En este trabajo, se incluyeron principalmente perros por ser la especie animal más frecuente en el barrio marginal evaluado, también B. pseudolongum fue la especie de bifidobacteria más encontrada en animales. Sin embargo, hay que destacar que las ocho bifidobacterias identificadas por PCR-DGGE en el agua de la ciénaga estuvieron presentes en las heces de por lo menos una de las muestras de animales evaluadas.
La contaminación microbiológica de la Ciénaga de Mesolandia con restos fecales de animales y humanos, indica la presencia de un importante número de microorganismos en el agua, muchos de los cuales tienen potencial patógeno para los habitantes rivereños. Esto constituye además un problema de salud pública al ser un posible reservorio de diversos mecanismos de resistencia microbiana. Esta contaminación que se evidenció por métodos culturales como el recuento de CT y CTT, fue corroborada mediante el hallazgo de secuencias específicas de bifidobacterias, lo cual permitió una aproximación más cercana al origen real de la contaminación fecal, dada la presencia de dichas secuencias directamente en el agua y en las heces de humanos y animales. Estos resultados permiten proponer que la identificación de secuencias específicas de bifidobacterias podría ser un método efectivo para determinar contaminación fecal.
Los mecanismos de transferencia génica y de herencia epigenética que ocurren en el complejo ecosistema intestinal permiten la adaptación y constante cambio de las poblaciones microbianas (Turroni, Milani, Douwe, & Ventura, 2018). Bajo esta proposición, microorganismos como B. adolescentis y B. dentium considerados habitantes exclusivos del intestino humano, se podrían adaptar también a condiciones ambientales intestinales de otros animales de sangre caliente, más aún cuando la convivencia entre humanos y animales domésticos resulta muy cercana y en condiciones higiénicas y ambientales que podrían favorecer la coprofagia de los animales. En este trabajo se encontró que el estudio de las bifidobacterias por métodos moleculares como PCR-DGGE en aguas superficiales contaminadas en regiones tropicales, permite identificar la contaminación fecal, pero resulta poco confiable para discriminar si su origen es humano o animal. Se genera la necesidad de plantear nuevos estudios que permitan crear indicadores de contaminación fecal que en ambientes tropicales contaminados permitan identificar de manera específica la contaminación fecal humana.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


