Introducción
Para una gran variedad de organismos -desde artrópodos hasta mamíferos- la comunicación acústica es importante en diversos contextos (Bradbury & Vehrencamp, 2007). Entre las funciones principales de la comunicación acústica están la defensa de territorio, atracción de pareja, indicación de alarma y presencia de alimento (Langmore, 1998; Catchpole & Slater, 2008; Bradbury & Vehrencamp, 2011; Herrera-Montes & Aide, 2011); por lo tanto, transmitir correctamente los mensajes acústicos es fundamental para la comunicación. Sin embargo, las señales acústicas pueden ser enmascaradas por el ruido del medio ambiente, generado por ríos, viento, lluvia, otros animales, o fuentes artificiales o antropogénicas (Amézquita et al., 2006; Herrera-Montes & Aide, 2011; Vargas-Salinas & Amézquita, 2013), afectando negativamente la comunicación acústica al disminuir la distancia de transmisión (Boncoraglio & Saino, 2007; Ey & Fisher, 2009) y degradar la energía y señal (Slabbekoorn & den Boer-Visser 2006, Warren, Katti, Ermann & Brazel, 2006). Consecuentemente, varios grupos de animales (ej.: grillos, aves, mamíferos, y anfibios) minimizan el efecto del enmascaramiento mediante cambios en el comportamiento, como incrementar los valores de las frecuencias mínimas e intensidad del canto o algunos de sus elementos (Bermúdez-Cuamatzin, Ríos-Chelén, Gil, & García, 2011; Lampe, Schmoll, Franzke, & Reinhold, 2012; Redondo, Barrantes, & Sandoval, 2013; Hanna, Wilson, Blouin-Demers, & Mennill, 2014), o cantando a horas con menos ruido (Herrera-Montes, & Aide, 2011; Roy, Miller, Gottsch, & Wang, 2011)
En las zonas urbanas, se disminuye el área del hábitat natural para las especies de animales (Harris, 1984; Melles, Glenn, & Martin, 2003; Biamonte, Sandoval, Chacón, & Barrantes 2011), y se da un aumento en los niveles de ruido debido a actividades antropogénicas (Slabbekoorn&Peet,2003; Lengagne, 2008). Ambos aspectos pueden afectar la sobrevivencia, salud, y comunicación de los individuos que persisten en estos ambientes (Barber, Crooks, & Fristrup, 2010; Hanna et al., 2014). Por lo tanto, comprender cuales especies de animales son más propensos a los efectos del ruido antropogénico y cómo contrarrestan este factor para comunicarse eficientemente, se vuelve importante para proponer planes de manejo, planificación de ciudades, políticas de conservación y entender los cambios en la distribución de las especies (Laiolo, 2010).
Uno de los grupos de animales que se está viendo afectado por el enmascaramiento de sus señales acústicas son los anuros (Herrera-Montes & Aide, 2011), debido a que la mayoría de sus vocalizaciones ocurren por debajo de los 5 kHz, rango al cual ocurre también la mayoría del ruido antropogénico (Wood & Yezerinac, 2006; Hanna et al., 2014). Por lo tanto, es intuitivo pensar que los anuros podrían presentar adaptaciones similares a las que utilizan otros grupos de animales para hacer frente a los efectos de traslape o enmascaramiento acústico cuando viven en ambientes urbanos (Vargas-Salinas & Amézquita, 2013; Herrera-Montes & Aide, 2011; Lampe et al., 2012). Una de las especies de anuros donde se esperaría encontrar diferentes comportamientos para contrarrestar el efecto del ruido antropogénico en la comunicación acústica es Hyalinobatrachium fleischmanni (Centrolenidae), debido a que es una especie común en ríos y arroyos urbanos cercanos a carreteras o zonas de alto tránsito de personas, y cuyo canto se produce entre los 3.8 y los 5.3 kHz (Savage, 2002; Kubicki, 2007), traslapando con el ruido antropogénico, que se produce por debajo de los 5 kHz (Wood & Yezerinac, 2006; Hanna et al., 2014). Debido a que el ruido antropogénico generado en estas áreas puede llegar a enmascarar importantes señales sociales dentro de las poblaciones urbanas de estas especie (Herrera-Montes & Aide, 2011), consideramos que es una especie adecuada para estudiar el efecto del ruido en la comunicación de anuros.
Nuestro objetivo con este estudio es analizar si existe una relación entre la variación de los niveles de ruido antropogénico a través de la noche y la actividad vocal (cantidad de vocalizaciones por unidad de tiempo) de H. fleischmanni, a lo largo de un gradiente de ruido urbano. Si el ruido influye en la actividad vocal de H. fleischmanni predecimos que a mayor nivel de ruido antropogénico menor la actividad vocal de esta especie en la noche. También predecimos que a las horas con menos ruido es donde habrá una mayor actividad vocal, ya que esto facilitaría la comunicación acústica.
Materiales y métodos
Sitio de estudio: Realizamos las grabaciones durante el mes de junio de 2015, dentro del campus universitario Rodrigo Facio, San Pedro, San José (09°56′ N & 84°05′ W, 1 200 m.s.n.m.) (Fig. 1). El sitio de estudio es una mezcla de zonas verdes, edificios, carreteras internas y una reserva ecológica de bosque secundario, todos rodeados por una de las principales carreteras del país al oeste (circunvalación este) y carreteras de menor tráfico al norte, sur y este. Lo anterior produce que los niveles de ruido varíen dentro del área de estudio y a lo largo de la quebrada Los Negritos, que atraviesa todo el campus, dividiéndolo en áreas similares. Esta quebrada tiene aproximadamente 5 m de ancho y 800 m de largo dentro del área de estudio. Además presenta un cauce intermitente a lo largo del año, secándose completamente en la época seca y con un cauce constante durante la época lluviosa, cuando se realizó el estudio.
Realizamos las grabaciones en tres puntos a lo largo de la quebrada Los Negritos (Fig. 1). Sitio Económicas, es el que aparentemente presenta mayores niveles de ruido por estar más cercano a la carretera de mayor tránsito y la entrada principal del campus universitario. Además, posee una alta abundancia de árboles con diámetros a la altura del pecho mayores a 10 cm como Ficus sp. (Moraceae), Cedrella odorata (Meliaceae), Erythrina poeppigiana (Fabaceae), Eucalyptus sp. (Myrtaceae) o bambúes gigantes (Poaceae) mezclada con enredaderas, arbustos y plantas ornamentales como zingiberaces, costaces y bambues pequeños. Sitio Bosquecito, es el que aparentemente presenta menor nivel de ruido al encontrarse en el interior de la reserva ecológica y al centro del campus, y cuenta con acceso restringido de personas. La vegetación de árboles en términos de especies y abundancia de este sitio fue muy similar a la del sitio Económicas, pero con mayor diversidad de arbustos. Sitio Música, es el que aparentemente presenta niveles de ruido intermedio por ubicarse al extremo norestes del campus, y poseer menor número de autos transitando cerca. La vegetación es abierta al poseer muy pocos árboles en el borde del cauce de la quebrada y no tener arbustos por ser un área de jardines.
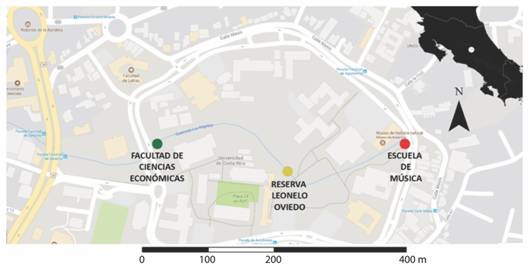
Fig. 1 Fig. 1 Mapa del campus Universitario Rodrigo Facio con los tres sitios utilizados para grabar la actividad vocal de la rana de vidrio Hyalinobatrachium fleischmanni y medir los niveles de ruido. En la esquina superior derecha se observa el mapa de Costa Rica. Rodrigo Facio University Campus map with the three sites used for recording of Hyalinobatrachium fleischmanni glass-frog (Centrolenidae) vocal activity and measured of noise levels. Costa Rica’s map on the upper right corner.
Grabación de sonidos y medición de ruido: Colocamos en cada sitio una grabadora Song Meter SM2+ (WildlifeAcoustics), con dos micrófonos omnidireccionales SMX-II (WildlifeAcoustics) y configuradas a una tasa de muestreo de 32 kHz y una precisión de 16 bits en un formato WAV. Cada grabación la realizamos en estéreo. Las grabadoras fueron colocadas en árboles al borde de la quebrada entre 0.5 y 1 m de altura, y cerca de posibles perchas para las ranas (arbustos con hojas colgantes sobre el cauce de la quebrada). Los tres sitios para colocar las grabadoras fueron seleccionados porque los niveles de ruido a los que están expuestos aparentemente parecen variar. Las grabadoras fueron configuradas para grabar de las 17:00 a las 06:00, periodo durante el que grabaron 59 min por hora. En cada sitio grabamos dos días consecutivos, cada dos semanas, por un mes, para un total de cuatro días por sitio, equivalentes a 52 horas en cada punto de grabación. Además, las grabadoras fueron colocadas lo mismos cuatro días en los tres sitios.
Los datos de ruido los obtuvimos durante dos días, siempre el día previo a realizar las grabaciones. Para tal fin utilizamos ocho puntos alrededor de cada sitio de grabación de los cuales cuatro se encontraron a 10 m y cuatro a 20 m de la grabadora y al menos a 10 m entre sí. En cada uno de estos puntos medimos los valores de ruido mínimo y máximo cada hora de las 17:00 a 06:00. Para la toma de la medición de ruido empleamos un Sonómetro SperScientific 840014 mini soundmeter (ámbito de medidas 32-130 dB, en respuesta rápida y con medición tipo A). Posteriormente estimamos el promedio del valor de ruido para cada hora por punto.
Actividad vocal: Utilizamos el programa Raven 1.4 (Cornell Lab of Ornithology, Ithaca, Nueva York, EEUU), para anotar la cantidad de vocalizaciones que fueron emitidas por hora de 17:00 a las 06:00 en cada punto de grabación. Aunque estas ranas únicamente vocalizan durante la noche, algunas veces si llueve muy fuerte durante la tarde pueden empezar a vocalizar después del aguacero (Savage, 2002; Kubicki, 2007). Sin embargo, durante nuestro periodo de muestreo no llovió durante la tarde por lo tanto, estamos seguros que grabamos todo el periodo de actividad de los individuos en cada sitio. Debido a que no fue posible discernir la cantidad de individuos que estaban vocalizando a partir de los sonogramas (representación visual de los sonidos), es intuitivo pensar que existe relación positiva entre la cantidad de individuos y la cantidad de vocalizaciones contadas en cada hora de grabación por punto. No fue posible discernir la cantidad de machos debido a que pudieron haber varios individuos a distancias similares de la grabadora horizontal y verticalmente, lo que produciría observar cantos con la misma cantidad de energía en los sonogramas y por lo tanto, asignárselos erróneamente a un único macho (subestimando la cantidad de individuos). Además, los machos tienden a moverse y cambiar su posición durante el canto (obs. pers.), por lo que este cambio en la dirección va a causar una diferencia de energía en la señal captada por el micrófono, y podría confundirse con señales de machos distintos (sobreestimando la cantidad de individuos). Por lo tanto nuestra medida de actividad y comparación entre sitios es la cantidad de vocalizaciones promedio por hora por sitio.
Análisis estadístico: Hicimos un análisis linear mixto para determinar si hay variación en el valor del ruido por hora por sitio. En este modelo utilizamos como variable dependiente el valor de ruido por hora, como variables independientes la hora del día, el sitio y la interacción entre ambas, y como variable aleatoria la fecha del muestreo. Realizamos otro análisis linear mixto para determinar si hay variación en la cantidad de vocalizaciones por hora por sitio. En este modelo utilizamos como variable dependiente el número de vocalizaciones por hora, como variables independientes la hora del día, el sitio y la interacción entre ambas, y como variable aleatoria la fecha del muestreo. Además, realizamos una correlación entre la cantidad promedio de vocalizaciones por hora y el ruido promedio por hora. Los análisis los realizamos utilizando el programa JMP versión 7.0 (SAS Institute, Cary, NC, EEUU) para realizar nuestros análisis estadísticos.
Resultados
Encontramos que el sitio con mayor nivel de ruido promedio fue Económicas (F2,509 = 5.64, P = 0.004), mientras que los sitios de Música y Bosquecito presentaron un nivel de ruido similar (Fig. 2). El nivel de ruido promedio varió a lo largo de las horas de muestreo (F13,508 = 16.21, P < 0.001), presentando los valores máximos de ruido de las 17:00 a las 21:00 y de nuevo a las 06:00. Los valores mínimos de ruido se registraron de 01:00 a 04:00 (Fig. 2). Además, encontramos que las horas a las que ocurren los valores mayores de ruido promedio variaron entre sitios (F26,507 = 4.94, P < 0.001). En el sitio Económicas, el mayor nivel de ruido lo medimos entre las 17:00 y las18:00 y el menor nivel de ruido se dio a las 03:00 (Fig. 2). En el sitio Música, el mayor nivel de ruido lo medimos a las 20:00, el menor nivel de ruido a las 02:00 (Fig. 2). En el sitio Bosquecito, el mayor nivel de ruido lo medimos a las 19:00 y 06:00 y el menor nivel de ruido fue la 01:00 (Fig. 2).
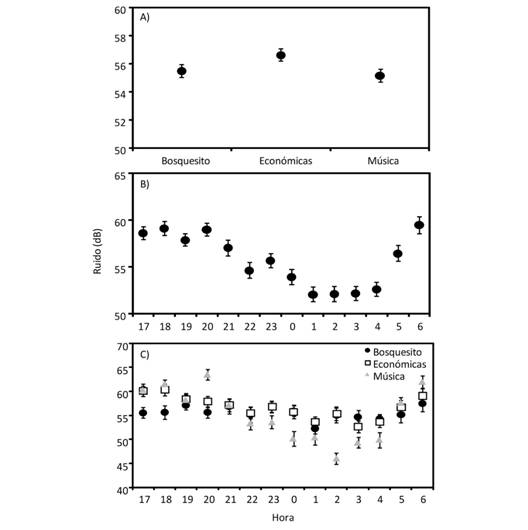
Fig. 2 Fig. 2 Niveles de ruido promedio (± error estándar) en tres sitios del Campus Universitario Rodrigo Facio (A), a lo largo de la noche (B), y en la interacción entre sitio y hora (C). Average noise levels (± standar error) at three sites of Rodrigo Facio University Campus (A), throughout night (B), and the interaction between sites and hour (C).
Encontramos que la mayor actividad vocal fue en el Bosquecito (F2,68 = 5.38, P = 0.007), mientras que Música y Económicas presentaron un nivel de actividad vocal menor y similar entre ellos (Fig. 3), aunque variaron en la cantidad de vegetación. El nivel de actividad vocal general también varió a lo largo del periodo de muestreo (F13,66 = 1.94, P = 0.04), presentando los valores mayores de actividad vocal entre las 20:00 y 21:00 h y el menor a las 17:00 h (Fig. 3). Finalmente, encontramos que no hubo interacción entre las horas y la actividad vocal por sitio (F26,66 = 0.94, P = 0.56; Fig. 3), aunque la mayor cantidad de vocalizaciones promedio para el Bosquecito y Música fue a las 21:00 y para Económicas a las 18:00 (Fig. 3). No encontramos una correlación entre la cantidad de ruido en cada sitio por hora y la actividad vocal de las ranas (r < |0.18|, P > 0.52 para todas las comparaciones).
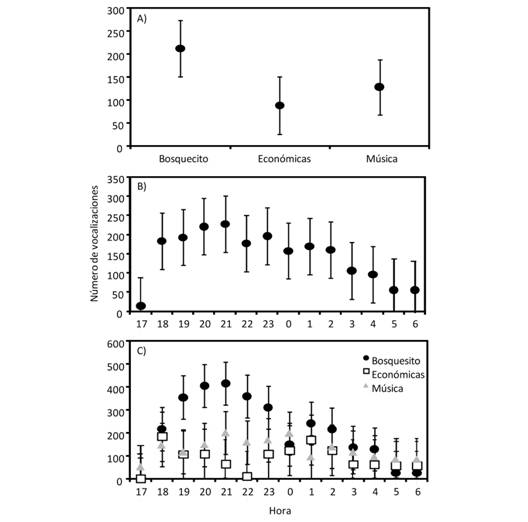
Fig. 3 Fig. 3 Número de vocalizaciones promedio (± error estándar) de machos de Hyalinobatrachium fleischmanni en tres sitios del Campus de la Universidad de Costa Rica (A), a lo largo de la noche (B), y en la interacción entre sitio y hora (C). Average vocal activity (± standar error) of Hyalinobatrachium fleischmanni males at three sites of Rodrigo Facio University Campus (A), throughout night (B), and the interaction between sites and hour (C).
Discusión
Nuestros resultados demuestran que, tanto el ruido como la actividad vocal de H. fleischmanni variaron a lo largo de la noche, aunque, no hubo una relación entre la cantidad de ruido y la actividad vocal de la especie en ninguno de los tres sitios. Esto contrasta con nuestras predicciones y lo reportado en la literatura, ya que aunque el ruido antropogénico tiene el potencial de enmascarar señales acústicas (Barber et al., 2010; Halfwerk et al., 2011) como las de H. fleischmanni (que cantan por debajo de los 5 kHz), no encontramos dicho efecto en este estudio. No obstante la mayor actividad vocal a lo largo de toda la noche la registramos en el sitio Bosquecito, que fue el que presentó menor nivel de ruido.
Aunque estudios previos sugieren que el ruido del tráfico puede inhibir la producción de vocalizaciones en anuros llevando a un patrón de espaciamiento temporal, donde los individuos vocalizan en momentos en que el ruido ambiental es menor (Sun & Narins, 2005; Vargas-Salinas & Amézquita, 2013), en nuestro caso no hubo tal relación. Esto se puede deber a que la contaminación acústica enmascara especialmente vocalizaciones que se emiten con frecuencias por debajo de los 5 kHz (Gerhardt & Klump, 1988; Brumm & Slabbekoorn, 2005; Vargas-Salinas & Amézquita, 2013). Pero en el caso de H. fleischmanni las vocalizaciones de los machos presentan una frecuencia mínima que varía entre 3.8 y 4.5 kHz (Savage, 2002), cercana al límite superior de las frecuencias del ruido antropogénico (Wood & Yezerinac, 2006; Hanna et al., 2014). Este poco traslape entre frecuencias podría justificar que no haya una relación entre los valores de la actividad vocal y los del ruido en el sitio de estudio, por lo tanto el ruido no estaría interfiriendo en la comunicación acústica de esta especie. Una situación similar se presenta en la rana Pseudacris crucifer donde tampoco se encontró una relación entre el aumento de la tasa de llamadas y el aumento en la cantidad de ruido (Hanna et al., 2014). Variar la tasa de canto es una estrategia aparentemente común en otros anuros, pues aumenta la probabilidad de detectabilidad por parte de los receptores (Penna, Pottstock, & Velásquez, 2005; Kaiser & Hammers, 2009).
La diferencia en los picos de actividad vocal entre sitios, se puede deber a dos causas principales, la cantidad de vegetación y el nivel de ruido en cada sitio. Por ejemplo, los sitios Bosquecito y Música, tuvieron un nivel de ruido bajo y similar entre ellos,variaron en la cantidad de vegetación (mayor en Bosquecito), y presentaron patrones de actividad vocal similar (picos y valles a horas similares, Fig. 2), pero con cantidades mayores de vocalizaciones por hora en sitio Bosquecito. La mayor cobertura vegetal de sitio Bosquecito en comparación con sitio Música, puede estar creando mejores variables microclimáticas como mayor humedad, temperatura más constante, y menor grado de iluminación, características que se ha visto que influyen en el aumento de la actividad acústica de otros anuros (Alonso, Rodríguez-Gómez, & Estrada,2001; Oseen & Wassersug, 2002; Ospina, Villanueva-Rivera, Corrada-Bravo, & Aide, 2013). Adicionalmente, niveles mayores de humedad como los que puede haber en el sitio Bosquecito en comparación con el sitio Música favorecen el aumento en la cantidad de cantos que producen los machos de H. fleischmanni, ya que si la humedad relativa baja del 93 % la actividad vocal también decrece drásticamente (Hayes, 1991). Una mayor densidad de vegetación puede aumentar la cantidad de perchas adecuadas (hojas colgantes sobre el aguaentre 1 y 5 m; Savage, 2002; Kubicki, 2007) para cantar por parte de los machos y para ovopositar por parte de las hembras. Por lo que el número de machos en este sitio podría ser mayor y por lo tanto la actividad vocal también, si existe una relación positiva entre ambos.
Sin embargo, sitio Bosquecito y Económicas fueron similares en la abundancia de vegetación, pero variaron en la cantidad y los patrones de actividad, así como en los niveles de ruido (Fig. 2 y Fig. 3). Por lo tanto, a pesar de que no se encontró una relación directa entre los niveles de ruido ambiental con la actividad vocal de H. fleischmanni, si observamos que los patrones de actividad variaron cuando varió el ruido. Esto se encontró para el sitio Económicas, que es el que presentó mayor ruido y el único con un patrón de actividad acústica distinto, vocalizando mayormente en las horas de más ruido (18:00). La causa de esta diferencia entre sitios es desconocida, pero se podría deber a que retrasar la actividad vocal para cantar en los momentos con menos ruido (más tarde en la noche) puede disminuir la probabilidad de que lleguen hembras a copular, especialmente si existen otros machos en las cercanías vocalizando desde el inicio de la noche a los cuales las hembras detectarían primero. De este modo, es posible que los machos de H. fleischmanni en sitio Económicas, que es el más ruidoso, estén modificando las características espectro-temporales de sus vocalizaciones (ej.: incrementando la frecuencia mínima, la cantidad de energía, o duración). Esto ocurre en otros anuros que habitan sitios ruidosos (Penna et al., 2005; Lengagne, 2008; Kaiser & Hammers, 2009; Cunnington & Fahrig, 2010; Gross, Pasinelli, & Kunc, 2010; Both & Grant, 2012; Vargas-Salinas & Amézquita, 2013; Hanna et al., 2014), los cuales incrementan sus frecuencias en lugar de disminuir la actividad vocal o cambiar los patrones de actividad para facilitar su comunicación. Sin embargo nosotros no medimos esas características y sería un trabajo a realizar en el futuro para comprender este patrón observado.
En conclusión, a pesar de que no se encontró una relación directa entre el nivel de ruido antropogénico y la actividad acústica de H. fleischmanni, sí observamos un efecto de este en los patrones de actividad de la especie. Las variables ambientales parecen tener un papel importante en la actividad acústica de estas ranas, especialmente la cobertura boscosa y posiblemente la humedad aunque esta última no fue medida. Consideramos que deben tomarse en cuenta más variables tanto bióticas como abióticas en estudios futuros, por ejemplo la fase lunar, características de la quebrada y cantidad de iluminación, entre otras; ya que sólo el ruido no explica completamente los patrones de llamadas encontrados en este trabajo. Lo anterior sugiere que los factores ambientales y ruido antropogénico, podrían estar definiendo de manera conjunta los patrones de actividad acústica para esta especie.La información anterior resulta importante ya que brindan información para el manejo de remanentes de zonas naturales o de importancia para la reproducción de distintas especies de anfibios en las zonas urbanas, así como para la toma de decisiones sobre control o manejo de los niveles de ruido que podrían estar afectando la reproducción, y por ende sobrevivencia, de distintas especies similares a H. fleischmanni.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

