Las comunidades bióticas que habitan el suelo representan 25 % de la diversidad global existente y sostienen una fracción importante de las funciones de los ecosistemas, constituyendo un valioso recurso cuya importancia fue por mucho tiempo subestimada (Eisenhauer, Cesarz, Koller, Worm, & Reich, 2012; Zamioudis & Pieterse, 2012; Bertsch & Henríquez, 2015). Por esa razón, investigadores a nivel mundial afirman que es necesario aumentar los estudios sobre los ecosistemas edáficos con el objetivo de conservarlos, gestionar la producción y luchar contra el cambio climático (Ferris, Griffiths, Porazinska, Powers, Wang, & Tenuta, 2012; Eisenhauer et al., 2012; Mueller et al., 2016; Looby & Treseder, 2018).
Entre la biota edáfica, los nematodos son un grupo muy diverso y cosmopolita que ha sido estudiado por su importancia ecológica, económica, y por ser eficientes indicadores ambientales (Culman et al., 2010; SánchezMoreno & Talavera, 2013). Cada taxón del filo Nematoda responde de forma diferente a los cambios en el ambiente, por lo que el análisis de la composición de la comunidad nematológica permite evaluar la condición del ecosistema con relación al impacto de contaminantes y otros factores estresantes, así como monitorear los cambios en la estructura y funcionamiento de las redes tróficas del suelo (Sánchez-Moreno & Talavera, 2013).
Por otro lado, como los nematodos del suelo están presentes en muchos niveles tróficos, inciden en el flujo de nutrientes y energía, con la consecuente influencia en la producción y secuestro de carbono, en la movilización de minerales y en la regulación de las poblaciones microbianas (Ferris, 2010; Ferris et al., 2012; Gingold, Moens, & Rocha-Olivares, 2013).
Con el fin de simplificar la información que brinda el análisis de las comunidades de nematodos se utilizan índices que permiten resumir los datos en pocas variables. Los índices específicos para este grupo fueron propuestos inicialmente por Bongers (1990), quien desarrolló el índice de madurez, el cual está basado en las diferentes estrategias de sobrevivencia de las familias de nematodos. Posteriormente, se desarrollaron otras herramientas derivadas del mismo: el ∑ índice de madurez (Bongers & Bongers, 1998), el índice de madurez 2-5 (Neher & Olson, 1999), los índices de la red trófica, (Ferris, Bongers, & de Goede, 2001) y las huellas metabólicas (Ferris, 2010).
Respecto al estudio del efecto de factores climáticos en las comunidades nematológicas, especialmente en aquellas investigaciones enmarcadas en el área del cambio climático, éstas sugieren que el efecto observado depende del ecosistema bajo análisis. En estudios realizados en la Antártida se determinó que el aumento de la temperatura provoca un aumento en la abundancia, la riqueza de especies y la complejidad de las redes tróficas, además de favorecer la presencia de nuevas especies (Nielsen, Wall, Adams, & Virginia, 2011). Mientras que en un clima tropical en Ecuador se encontró que la temperatura y el tipo de suelo no influyeron en la diversidad, si bien sí se observó un cambio en la proporción de grupos tróficos dominantes. La disminución de la temperatura favoreció a los nematodos fungívoros sobre los herbívoros en diferentes altitudes, y los autores relacionaron este cambio a la disponibilidad de recursos (Traunspurger, Reiff, Krashevska, Majdi, & Scheu, 2017).
Los últimos estudios, que incluyen el análisis de huellas metabólicas, consideran que un aumento en la temperatura reducirá la huella metabólica de los nematodos, es decir la participación de los nematodos en el flujo de la energía en las redes tróficas (Bhusal, Tsiafouli, & Sgardelis, 2015; Kergunteuil, Campos-Herrera, Sánchez-Moreno, Vittoz, & Rasmann., 2016).
En Costa Rica algunos estudios realizados en plantaciones de café y banano han validado la utilidad de los nematodos como indicadores de la calidad de los suelos costarricenses, y su relación con el tipo de manejo agronómico (Salguero-Londoño, 2006; Peraza, 2010; Rodríguez, Muñóz, & Pocasangre, 2011). Ninguno de estos estudios ha explorado el efecto de los factores climáticos en las comunidades nematológicas del suelo.
Por otro lado, Costa Rica es un país tropical donde se pueden encontrar gran variedad de microclimas en un área pequeña, esta característica se ve reflejada en las diferentes zonas de vida descritas por Holdridge (1967) para el territorio nacional, las cuales difieren en sus patrones de precipitación, temperatura y evapotranspiración.
En este trabajo se estudiaron las comunidades de nematodos en diversos ecosistemas ubicados en distintas zonas de vida, como una contribución para entender el efecto de los factores climáticos en las comunidades de nematodos y su participación en el flujo de la energía en las redes tróficas.
Materiales y métodos
Localización del estudio y muestreo: Las comunidades nematológicas de cuatro diferentes zonas de vida (ZV) en la Región Huetar Norte de Costa Rica fueron estudiadas. Las ZV incluidas en el estudio fueron: bosque húmedo montano bajo (HMB), bosque pluvial premontano (BPP), bosque húmedo premontano (HP) y bosque muy húmedo tropical (MHT). Su descripción, así como la ubicación y características de los lugares muestreados de detalla en el Cuadro 1.
Cuadro 1 / table 1. Ubicación y descripción de sitios de muestreo / Location and description of sampling sites.
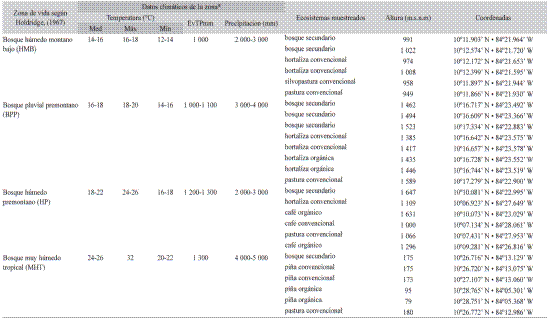
*Datos climáticos tomados de: Atlas climatológico del Instituto Metrorológico Nacional de Costa Rica, https://www.imn.ac.cr/atlas-climatologico, IMN ©2008.
Med: temperaturas medias anuales en °C, Máx: temperatura máximas anuales en °C, Min: Temperaturas mínimas anuales en °C, Precipitación anual media en mm, EvTP: evapotranspiración estimada anual en mm.
Los muestreos se realizaron entre julio 2015 y junio 2016, en ecosistemas naturales y productivos. En cada ecosistema se definió un área de 50 m2 (7 x 7 m aproximadamente) y en ella se realizaron 50 perforaciones equidistantes entre sí, a una profundidad de 15 cm y con un barreno oakfield de 2 cm de diámetro. Las muestras fueron trasladadas en cajas de aislamiento térmico hasta el Laboratorio de Nematología del Instituto Tecnológico de Costa Rica en Santa Clara de San Carlos y ahí se almacenaron por no más de tres días a 4 °C hasta la extracción de los nematodos.
Extracción e identificación de nematodos: Cada muestra de suelo fue homogenizada y cuarteada hasta obtener cinco submuestras de 100 g, las cuales fueron procesadas por medio de un elutriador de Oostenbrink (van Bezooijen, 2006). La separación final de los nematodos de las partículas de suelo se realizó mediante cribas de extracción con doble filtro de algodón. La suspensión resultante con nematodos fue recogida 24 y 48 horas después, fue vertida en una cámara de conteo, y la totalidad de los individuos presentes fue contada con la ayuda de un microscopio invertido Olympus CKX41 con el fin de obtener la abundancia total de nematodos en cada sistema. Seguidamente, cada muestra fue fijada en su totalidad con formalina caliente al 4 %, y transferida a glicerina pura usando el método modificado de Seinhorst (1959).
Para la identificación de los nematodos cada muestra fue homogenizada antes de ser dispersada en una cámara de conteo cuadriculada, y los primeros 100 individuos en la cámara fueron recuperados para ser montados en láminas permanentes. Seguidamente fueron identificados a nivel de familia o género utilizando un microscopio compuesto Olympus BX53 con contraste interferencial Nomarski hasta una magnificación de 400X. La abundancia de cada taxón fue expresada como número de nematodos en 100 g de suelo
Índices de la comunidad de nematodos: Cada grupo taxonómico fue asignado a un grupo trófico según Yeates, Bongers, de Goede, Freckman, & Georgieva (1993), y a un grupo cp (colonizadores-persistentes) según Bongers (1990) y Bongers & Bongers (1998). Los grupos cp representan diferentes estrategias de sobrevivencia de los nematodos, a las familias de nematodos colonizadores se les asigna el número 1 en la escala cp, mientras que a los nematodos persistentes un 5 en la misma escala. Los nematodos con características intermedias se les asigna un 2, 3 ó 4, dependiendo de si su estrategia de sobrevivencia se acerca más a la de colonizadores o persistentes. Los nematodos en el extremo inferior de la escala (colonizadores), se consideran oportunistas de ambientes enriquecidos, y por lo tanto indican disponibilidad de nutrientes. Los nematodos en el extremo superior de la escala son persistentes, e indican estabilidad del ecosistema y redes tróficas complejas (Ferris & Bongers, 2009).
Se calcularon los índices de madurez, como indicadores del estado de sucesión biológica del suelo. Los índices calculados fueron: el índice de madurez, que es el valor ponderado de la distribución de frecuencias de los valores cp en una muestra dada (Bongers, 1990), el índice de fitoparásitos (Bongers, 1990), que se calcula únicamente con las familias de nematodos fitoparásitos, el ∑ índice de madurez (Yeates, 1994), en el que se incluyen las familias de fitófagos al realizar los cálculos, el índice de madurez 2-5 (Neher & Olson, 1999) que excluye los nematodos del grupo cp 1, los cuales han sido llamados por varios autores “oportunistas de ambientes enriquecidos” distinguiéndolos del grupo cp 2 u “oportunistas generales”.
Además se calcularon los índices de la red trófica, es decir, el índice de estructura y el índice de enriquecimiento (Ferris et al., 2001), que combinan la escala cp con los grupos tróficos reconocidos entre los nematodos (bacterívoros, fungívoros, herbívoros, omnívoros y depredadores), para establecer los gremios funcionales - los nematodos Ba1 serían colonizadores bacteriófagos, los nematodos Fu1 serían colonizadores fungívoros y así sucesivamente. Los índices de la red trófica permiten evaluar la complejidad de la misma y el tipo de descomposición de la materia orgánica que predomina en el ecosistema del suelo.
Por último, se calcularon las huellas metabólicas (Ferris, 2010), que tienen en cuenta además de los gremios funcionales, la biomasa de los nematodos en el suelo, la cual se estima para cada género según su tamaño, y se utiliza para evaluar el carbono medio consumido por cada nematodo a lo largo de su ciclo de vida. La huella metabólica puede calcularse como huella metabólica total o por grupo funcional. Las huellas de herbívoros, bacterívoros y fungívoros, indican el canal respectivo por el que ingresa el carbono. La huella de enriquecimiento: es la huella metabólica de aquellos nematodos que responden de manera más rápida al enriquecimiento, y la de estructura es la huella metabólica de los nematodos en los niveles más altos de las redes tróficas.
Todos los índices fueron calculados con ayuda de la herramienta NINJA: Nematode indicator joint analysis (Sieriebriennikov, Ferris & de Goede, 2014).
Por último, se estimó la diversidad de nematodos a través del índice de diversidad Shannon-Wiener (Shannon & Weaver, 1949) para cada una de las ZV.
Las diferencias estadísticas entre las abundancias de las diferentes familias en cada ZV y ecosistema fueron comprobadas mediante pruebas de Kruskal-Wallis.
Para determinar diferencias estadísticas entre los índices calculados en las diferentes ZV y ecosistemas se realizaron ANOVAs y pruebas de Tukey. Los índices fueron previamente transformados con logaritmo natural para reducir el efecto de la varianza según recomienda Ferris (2010).
También se estimó la correlación entre los índices calculados para las ZV, la temperatura media y media en cada una mediante el coeficiente Rho de Spearman (ρ), que se utiliza como una medida de asociación de datos ordinales.
Los análisis se realizaron con el software estadístico SPSS statistical software (SPSS, Inc., Chicago, IL, USA), las diferencias con un nivel de probabilidad menor a 0.05 (P < 0.05) fueron consideradas significativas.
Resultados
Abundancia y composición de la comunidad: En términos de composición de la comunidad no se determinó ninguna tendencia y no se encontraron diferencias significativas respecto a la abundancia de las familias y géneros estudiados entre los diferentes ecosistemas.
Por otro lado, y omitiendo aquellos grupos tróficos poco frecuentes (abundancia media menor que 1), la abundancia de algunas familias fue estadísticamente diferente entre ZV. Individuos de Setinernematidae fueron encontrados únicamente en los HMB y BPP. También las abundancias medias de Aporcelaimidae, Tylenchidae y Qudsianematidae fueron mayores en el HMB (P < 0.05), y la abundancia de Dorylaimidae fue significativamente menor en el MHT (P = 0.02). La abundancia promedio de individuos en cada ZV se presenta en el Cuadro 2.
Cuadro 2 Abundancia media de individuos por grupo taxonómico
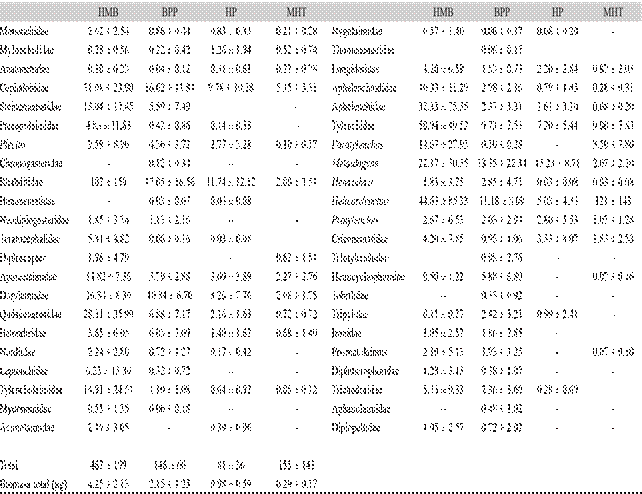
Abundancia expresada como número de indivíduos / 100 g suelo ± desviación estândar.
Por otro lado, la biomasa total de nematodos presentó diferencias, y se correlacionó significativamente con la temperatura media de las ZV (ρ = 0.814, P < 0.01). Según se observa en el cuadro 2, la biomasa de nematodos es mayor en el HMB, que presenta temperaturas más bajas y tiende a disminuir en correspondencia con el gradiente de temperatura que representan las diferentes ZV.
Índices de la comunidad de nematodos: No se encontraron diferencias significativas entre los índices de madurez, diversidad, ni los de la red trófica en las diferentes ZV (Cuadro 3), y no se obtuvo correlación significativa entre el valor del índice de madurez y la ZV o el tipo de ecosistema estudiado.
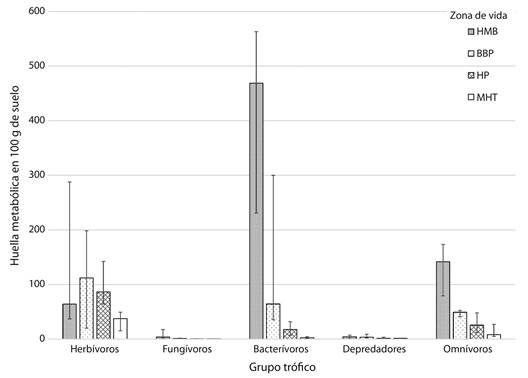
Por el contrario, las huellas metabólicas calculadas para cada ZV sí presentaron diferencias significativas (Cuadro 3), y una correlación con la temperatura media en cada ZV mayor de 0.74 (P < 0.01) en casi todos los casos. Las huellas metabólicas de herbívoros y depredadores fueron la excepción y se obtuvo una correlación de ρ = 0.3 y 0.25 (P > 0.05) respectivamente.
Cuadro 3 Valores promedio de índices de diversidad, de madurez, de la red trófica y huellas metabólicas
| Índice | HMB | BPP | HP | MHT | |
|---|---|---|---|---|---|
| Índices de Índice de madurez madurez Índice de madurez 2-5 | 2.6 ± 0.99 3.24 ± 0.60 | 2.67 ± 0.39 3.25 ± 0.41 | 2.65 ± 0.8 3.41 ± 0.60 | 2.85 ± 0.73 3.46 ± 0.47 | |
| Σ índice de madurez | 2.56 ± 0.74 | 2.76 ± 0.25 | 2.74 ± 0.43 | 2.75 ± 0.32 | |
| Índice de fitonematodos | 2.61 ± 0.27 | 2.88 ± 0.20 | 2.92 ± 0.21 | 2.81 ± 0.24 | |
| Índices de la red Canal trófica Basal | 11.48 ± 6.44 7.63 ± 5.52 | 5.23 ± 4.43 10.39 ± 9.33 | 8.41 ± 9.04 10.01 ± 5.65 | 40.83 ± 54.02 10.21 ± 8.58 | |
| Enriquecimiento | 77.84 ± 11.86 | 76.68 ± 17.45 | 57.19 ± 36.04 | 45.09 ± 46.09 | |
| Estructura | 79.87 ± 22.18 | 84.14 ± 12.85 | 86.18 ± 9.36 | 87.29 ± 11.07 | |
| Huellas metabólicas | Enriquecimiento Estructura | 446.94 ± 302.03a 134.97 ± 67.75a | 144.71 ± 149.29b 52.58 ± 23.15ab | 18.12 ± 18.18bc 34.15 ± 26.44bc | 3.13 ± 5.26c 16.99 ± 15.84c |
| - | Herbívoros | 181.89 ± 216.99 | 151.52 ± 171.65 | 96.34 ± 60.68 | 33.29 ±22.82 |
| - | Fungívoros | 9.35 ± 10.64a | 0.92 ± 0.66ab | 0.38 ± 0.48bc | 0.04 ± 0.06c |
| - | Bacterívoros | 450.42 ± 307.52a | 148.75 ± 149.98a | 20.51 ± 17.83b | 4.04 ± 4.66b |
| - | Depredadores | 4.83 ± 5.17 | 5.31 ± 4.93 | 2.48 ± 2.75 | 1.54 ± 1.18 |
| - | Omnívoros | 125.99 ± 59.85a | 46.91 ± 23.2ab | 31.57 ± 23.9bc | 15.43 ± 15.04c |
| Índice de diversidad | Shannon-Wiener | 0.831 ± 0.59 | 0.775 ± 0.32 | 0.791 ± 0.40 | 1.252 ± 0.51 |
Índices expresados como media ± desviación estándar.
Las casillas sombreadas y seguidas de una letra minúscula indican valores estadísticamente diferentes (P < 0.01) para el valor del índice en las zonas de vida. Las diferencias entre las medias que comparten una letra no son estadísticamente significativas.
La relación entre las huellas metabólicas y el gradiente de temperatura representado por las diferentes ZV se puede observar en la Figura 1 y en la Figura 2. A pesar de la variación en los datos, debido a la diversidad de ecosistemas incluidos en el análisis, se observó una clara correlación entre las huellas metabólicas calculadas y la temperatura media anual en las ZV.
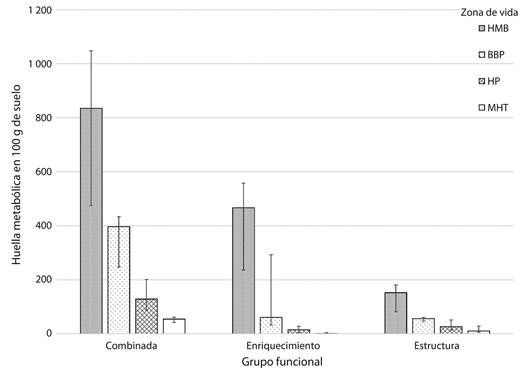
Fig. 1 Distribution of the values of the composite footprint, enrichment footprint and structure footprint, calculated for each life zone. The boxes represent the values of the median and the whiskers the 25th and 75th percentiles.
Las mayores correlaciones se obtuvieron con los valores de las huellas metabólicas de bacterívoros (ρ = 0.88; P < 0.01) y fungívoros (ρ = 0.88; P < 0.01), estos valores fueron significativamente mayores en el HMB y al igual que la biomasa disminuyeron progresivamente en las ZV con mayor temperatura media anual (Fig. 2).
Discusión
Al analizar los resultados obtenidos se debe tomar en cuenta la variedad de ecosistemas incluidos en este estudio, situación que se ve reflejada en los altos valores de las medidas de dispersión calculadas, pero que a la vez permite validar los resultados en un contexto en el que median muchos factores.
La alta variabilidad en los datos fue, probablemente, uno de los factores por los que no fue posible establecer diferencias estadísticamente significativas entre los diferentes ecosistemas respecto a las variables calculadas, por lo que se recomienda aumentar el número de repeticiones en futuras investigaciones. Aunque también es importante considerar que existen otros estudios en los que no se encontró diferencias entre ecosistemas con diferentes grados de manejo (Bloemers, Hodda, Lambshead, Lawton, & Wanless, 1997; Neher, 1999), lo que es un factor para tomar en cuenta en el uso de los nematodos como indicadores.
Por otro lado, estos resultados reafirman el planteamiento de Ferris (2010), que propone que los índices de madurez y de la red trófica tienen una función descriptiva, y no evalúan la participación de los nematodos en el flujo de la energía, que son los recursos que determinan el tamaño y la actividad de la red trófica. La validación que con el tiempo se haga de esta herramienta podría ayudar a comprender de mejor manera las interacciones de las poblaciones edáficas.
Los resultados obtenidos en este estudio coinciden, parcialmente, con los obtenidos por otros estudios similares (Bhusal et al., 2015, Kergunteuil et al., 2016; Traunspurger et al., 2017), que apuntan a que el papel que juegan los nematodos en la descomposición de la materia orgánica y las redes tróficas podría ser superior en lugares ubicados a mayor altura, y que la temperatura es uno de los factores que podrían explicar esta relación.
Sin embargo, los trabajos mencionados argumentan que los cambios observados en las huellas metabólicas pueden deberse, en parte, al tipo de vegetación presente en cada microclima y a la cantidad de raíces en cada uno, mientras que en este caso no se logró establecer ninguna correlación entre los diferentes ecosistemas estudiados en cada ZV, los cuales difieren en el tipo de vegetación presente y el manejo, y los índices calculados para la comunidad.
En este caso, la diferencia fue observada en la biomasa de la comunidad nematológica, lo que sugiere que los individuos de las especies presentes en lugares donde la temperatura media anual es menor son de mayor tamaño, y por lo tanto tienen mayor importancia relativa en la red trófica. También se subraya que familias que agrupan especies consideradas grandes, Aporcelaimidae, Qudsianematidae y Dorylaimidae, fueron más abundantes en las ZV con menor temperatura.
El aumento de las huellas metabólicas conforme disminuye la temperatura, evidencia un cambio en la dinámica de la descomposición química y biológica de la materia orgánica y en el flujo de energía en la red trófica que debería ser motivo de estudio. La influencia de la temperatura en los procesos enzimáticos, en la descomposición química de la materia orgánica y en la absorción y excreción de los minerales ya se ha estudiado (Davidson & Janssens, 2006), y podría explicar la composición de las comunidades biológicas en ecosistemas edáficos ubicados en diferentes microclimas.
Otro resultado que apoya la afirmación anterior es que las huellas metabólicas que se correlacionan más fuertemente con la temperatura media en las ZV fueron las que están directamente relacionadas con la descomposición de la materia orgánica del suelo (fungívoros, bacterívoros y la huella del enriquecimiento), mientras que las huellas de los herbívoros y depredadores no se correlacionaron con los sitos estudiados.
Otros autores (Gillingham, Palmer, Huntley, Kunin, Chipperfield, & Thomas, 2012; Suggitt et al., 2011), ya han mencionado que la temperatura podría influir más directamente en la distribución de las especies que las características del hábitat, lo que tendría importantes implicaciones en las políticas de mitigación del cambio climático y en la conservación que deben ser tomadas en cuenta.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de cualquier tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. El documento firmado se encuentra en los archivos de la revista.












 uBio
uBio