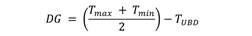Cascabela thevetia (L.) Lippold. (Syn. Thevetia peruviana) (Apocynaceae), es una especie arbórea ornamental originaria de México (Juárez-Jaimes, Álvarado-Cárdenas, & Villaseñor, 2007), ampliamente utilizada en arbolado urbano, parques y áreas verdes, que con frecuencia sufre defoliaciones producidas por Palpita flegia (Cramer, 1777) (Lepidoptera, Crambidae). Es comúnmente denominada Palpita blanca o mariposas de las Tevetias. Su distribución comprende la región Neotropical (Dekle, 1963) y Hayden y Buss (2012) también la citan en el sur de Estados Unidos. Está presente en México, Cuba, Puerto Rico, Honduras, Costa Rica, Colombia, Brasil y en Argentina (Lima-Coelho, Santos, & Lima, 2003; Balcázar, 2004; Mestre et al., 2009; Diodato, Martín-Cano, & Fuster, 2009; Miller et al., 2012), siempre asociada a C. thevetia.
Diodato et al. (2009) registraron por primera vez la presencia de P. flegia en Santiago del Estero, en el noroeste de Argentina y a partir de esa fecha se producen infestaciones periódicas, con expansiones a nuevas localidades. Sobre la biología y el comportamiento de P. flegia es escasa la bibliografía, por lo que conocer la duración del ciclo biológico y elementos sobre la ecología de la especie, son necesarios para el control de la plaga (Daly, 1985; Sakai et al., 2001). Muchos estudios sobre el desarrollo del estado larval de especies de Lepidoptera (McClellan & Logan, 1994; Calvo & Molina, 2008) se basaron en el análisis del ancho de las cápsulas cefálicas para la identificación de los distintos estadios larvales. La biología y ecología de las especies está condicionada por las características climáticas regionales donde se distribuyen, incidiendo tanto en la duración del ciclo biológico, su densidad poblacional, como en el comportamiento y alimentación (Silveira-Neto, Nakano, Bardin, & Villa-Nova, 1976; Gould, Venette, & Winograd, 2005; Guo & Qin, 2010); por lo que es esencial conocer como la temperatura y humedad impactan en el desarrollo de las especies. El objetivo del presente trabajo fue determinar el número de estadios larvales y la duración de las fases biológicas de P. flegia, los requerimientos calóricos y aspectos etológicos de la especie.
Materiales y métodos
El material biológico de P. flegia para los estudios de este trabajo se obtuvo durante el otoño 2015, en la ciudad de Santiago del Estero, Argentina (27°46’50.01” S - 64°15’48.76” W) en plantas infestadas de C. thevetia. El clima de Santiago del Estero, es seco semiárido. La temperatura media anual es de 21 °C. En las estaciones las temperaturas promedios son 23 °C en la primavera, 26 °C en el verano, 19 °C en el otoño y 15 °C en el invierno (Servicio Meteorológico Nacional, 2018). Las precipitaciones, ocurren durante el verano y oscilan entre los 600 y 650 mm (Minetti & Acuña, 1994).
A partir de 100 larvas neonatas obtenidas de las oviposturas recolectadas en campo se iniciaron las observaciones para la determinación del número de estadios larvales y la duración de fases postembrionarias (larva, pupa y adulto). La cría se mantuvo en laboratorio, a temperatura constante de 24 ± 2 °C, 50 ± 10 % de humedad relativa (HR) y 16:08 horas de fotoperíodo, con observaciones diarias hasta la muerte de los adultos. Las larvas recién emergidas, fueron acondicionadas individualmente en frascos plásticos de 15 cm de diámetro y 25 cm de profundidad y alimentadas con hojas frescas de C. thevetia. El número de estadios larvales y su duración se identificaron por las exuvias recolectadas y se midieron los anchos de las cápsulas cefálicas usando una lupa binocular con micrómetro ocular (Zeiss Stemi DV4). Para diferenciar los distintos estadios se aplicó la Ley de Dyar (1890) que expresa que el aumento del tamaño de la cápsula cefálica en estadios larvales sucesivos sigue una progresión geométrica. Este modelo ha sido utilizado en estudios de insectos de distintos grupos taxonómicos (Daly, 1985; Panzavolta 2007; Cazado, Van Nieuwenhove, O’brien, Gastaminza, & Murúa, 2014). Para todos los estadios se calculó la constante de Dyar dividiendo los valores promedios del tamaño de la cápsula cefálica del estadio (x+1) con el anterior (x). Los estadios larvales se representaron, según los picos de máxima frecuencia en un análisis de distribución del tamaño de las cápsulas cefálicas. Se calculó la ecuación del ajuste lineal entre el número de estadios larvales y los promedios de anchos de las cápsulas cefálicas, siguiendo la metodología propuesta por Gaines y Campbell (1935). Los valores medios de las cápsulas cefálicas fueron transformados a logaritmos naturales a fin de cumplir con el supuesto de normalidad, que se comprobó mediante la prueba de Shapiro-Wilk. La significancia estadística de las diferencias en el promedio de ancho de la cápsula cefálica para los distintos estadios se determinó mediante un análisis de varianza (ANOVA) y se compararon por la prueba de Tukey.
Las pupas fueron sexadas tomando como referencia la ubicación del poro anal y genital, lo cual permitió determinar la proporción sexual. Los adultos fueron alimentados con miel diluida en agua (1:1). Solo los individuos que sobrevivieron al estado adulto fueron incluidos en los análisis de duración de ciclo de vida postembrionario. Se determinó la duración promedio en días de los estados larvales, pupal y adulto. Las diferencias en duración del ciclo biológico de acuerdo con el sexo, fueron analizadas estadísticamente mediante prueba de t. La descripción del comportamiento de alimentación de las larvas y del daño en el follaje se realizó mediante observaciones en laboratorio e in situ. De pupas recolectadas y acondicionadas en recipientes cerrados se identificaron los parasitoides emergidos según descripciones de Fernández y Sharkey (2006) y Burks (1960).
La estimación del requerimiento de grados días (DG) para el desarrollo del ciclo biológico de P. flegia fue a partir de oviposturas recolectadas en el campo. Se registraron las temperaturas máximas y mínimas mediante un registrador de temperatura y humedad USB modelo KG100. Para el cálculo de los DG se usó el método propuesto por Arnold (1960), según la fórmula:
El valor de temperatura umbral más baja (TUBD) para el desarrollo del ciclo biológico se basó en Honek (1996), quien definió para mariposas tropicales en 10.46 °C para el ciclo completo, en tanto, para los estados de huevo en 12.94 °C, de larva en 13.45 °C y de pupa en 13.14 °C.
Todos los análisis estadísticos fueron realizados utilizando el programa InfoStat, 2008 (Di Rienzo et al., 2011).
Resultados
Descripción de los estados de desarrollo de P. flegia: Los adultos se distinguen por las alas de color blanco con vena costal azul, presentan una expansión alar de 38 a 53 mm (Fig. 1A), no se observan diferencias notables entre machos y hembras y realizan vuelos nocturnos. Se alimentan del néctar de flores de distintas plantas y para la cópula y oviposición se posan preferentemente en las ramas superiores de la copa de C. thevetia. Las hembras colocan los huevos en el envés de las hojas de los brotes terminales, los cuales son pequeños, de coloración blanco amarillento, circulares y aplanados, lo que dificulta distinguirlos a simple vista, al semejarse a manchas en la hoja. Las oviposturas son imbricadas en número variable, en grupos de 10 a 15 huevos, o en agrupamientos mayores de hasta 45 huevos (Fig. 1B). A medida que avanza el desarrollo del embrión la coloración del huevo cambia, inicialmente es amarillo y casi al final de la fase se observa en el centro una coloración castaño-rojiza.

Fig. 1 Developmental phases of P. flegia. A. Adult female adult. B. Eggs. C. Neonate larvae. D. Last larval stage. E. Prepupa in protective case. F. Cocoon with pupa.
Las larvas neonatas son de 4 a 5 mm, se mantienen agrupadas en el envés de las hojas e inician su alimentación a partir de la epidermis inferior y el mesófilo, sin dañar las nervaduras ni la epidermis superior. Son de color amarillo claro con placas dorso-laterales negras y a ambos lados presentan una franja amarilloanaranjada (Fig. 1C).
Las larvas de los últimos estadios, alcanzan 25 a 35 mm de longitud. La cabeza es de color castaño claro y el cuerpo de tonalidades celeste; manchas amarillo-anaranjadas irregulares se intercalan con las placas dorso-laterales negras, de las cuales se proyecta una seta a cada lado (Fig. 1D). A medida que crecen las larvas, se dispersan por toda la copa del árbol. La alimentación continúa en el envés de las hojas, incrementándose la superficie dañada. Durante los últimos estadios larvales y finalmente para empupar, las larvas se protegen en refugios en forma de estuche con hojas unidas por hilos de seda (Fig. 1E). Los estuches se localizan en las extremidades de las ramas y con preferencia en la porción superior de la copa. La pupa es de color marrón-castaño de 1.8 a 2 cm de longitud, con tres anillos anaranjados en los segmentos abdominales (Fig. 1F).
Duración del ciclo de vida de P. flegia: En las condiciones de laboratorio estudiadas, 24 ± 2 °C y 50 ± 10 % HR, el período comprendido desde el nacimiento de las larvas hasta la muerte de los adultos fue de 45 días en promedio. La duración del período larval fue de 25.08 ± 2.58 días. El período pupal fue de 16.16 ± 1.62 días y los adultos sobrevivieron 4.76 ± 2.83 días, en promedio. No hubo diferencias estadísticamente significativas (P < 0.05) en la duración de los ciclos biológicos entre machos y hembras. La razón sexual observada fue de 1: 0.4 (macho: hembra).
El ancho promedio de la cápsula cefálica varió entre 0.44 mm a 2.67 mm (Cuadro 1). La tasa de incremento del tamaño de las capsulas cefálicas entre los diferentes estadios en promedio fue de 1.23.
La curva de distribución del ancho de cápsulas cefálicas mostró la existencia de seis picos de máxima frecuencia, lo que indicaría el desarrollo de P. flegia en seis estadios larvales (Fig. 2).
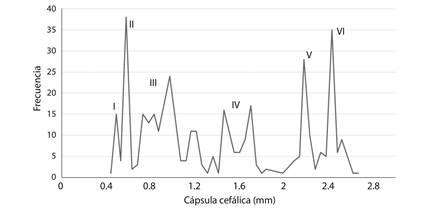
Fig. 2 Curva de distribución de frecuencias del ancho de cápsulas cefálicas de larvas de P. flegia a 24 °C y HR 60 %. Fig. 2. Frequency distribution of cephalic capsule width in larvae of P. flegia at 24 °C and RH 60 %.
La ecuación de regresión lineal entre logaritmo natural del ancho de cápsula cefálica y estadio larval fue y= 0.31x-0.85 y altamente significativa (R2 = 0.99; F = 294,89; P > 0.0001). El ajuste del modelo lineal indica que no hay estadios solapados (Fig. 3). Las diferencias observadas entre el ancho de la cápsula cefálica para los diferentes estadios fue estadísticamente significativa (P < 0.0001) (Cuadro 1); lo que confirma los resultados observados en la relación lineal.
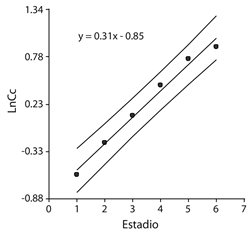
Fig. 3 Linear regression between the natural logarithm mean cephalic capsule width and larval stage number in P. flegia; whit prediction range (confidence interval at 95 % of probability).
Cuadro 1 Valores promedios del ancho de las cápsulas cefálicas de P. flegia
| Estadio | Media ± D.E. (mm) | Mínimo (mm) | Máximo (mm) | Constante Dyar |
|---|---|---|---|---|
| I | 0.55 ± 0.04a | 0.44 | 0.63 | - |
| II | 0.8 ±0.07b | 0.63 | 0.97 | 1.44 |
| III | 1.1 ± 0.14c | 0.87 | 1.46 | 1.39 |
| IV | 1.58 ± 0.13d | 1.21 | 1.84 | 1.43 |
| V | 2.15 ± 0.15e | 1.55 | 2.43 | 1.36 |
| VI | 2.45 ± 0.06f | 2.33 | 2.67 | 1.14 |
Letras distintas indican diferencias significativas entre medias (P < 0.05).
Different letters indicate significant differences between means (P < 0.05).
Enemigos naturales: Los parasitoides emergidos de las pupas de P. flegia se identificaron como Brachymeria flegiaeBurks, 1960 (Hymenoptera, Chalcididae). En los restantes estados biológicos estudiados no se observaron presencia de enemigos naturales.
Comportamiento de alimentación y canales laticíferos de C. thevetia: Las larvas de P. flegia muestran un comportamiento específico al alimentarse, cortando los canales laticíferos que contienen sustancias tóxicas y luego barrenan el parénquima. Debido al pequeño tamaño de sus mandíbulas, las larvas neonatas son gregarias al inicio de la alimentación, para el corte de los canales laticíferos, interrupción y disminución del flujo del látex.
Daños: P. flegia daña el follaje de C. thevetia tanto de plantas jóvenes como adultas. Como resultado de la alimentación de las larvas, la epidermis del haz de las hojas queda reducida a una lámina translucida, que con el tiempo se seca y se torna de un color castañoamarillento (Fig. 4A y Fig. 4B). El follaje es dañado parcialmente o en su totalidad (Fig. 4C y Fig. 4D). Las larvas al alimentarse afectan principalmente las hojas y en ataques intensos pueden incluir también a los frutos. En los primeros estadios larvales, el daño es apenas perceptible, ya que no se alimentan de la epidermis superior y las hojas mantienen su coloración. El mayor daño lo causan las larvas de los últimos estadios. A medida que avanza el desarrollo de las larvas, el número de hojas dañadas y el área de alimentación aumenta y se observa la formación de estuches de hojas ligadas por hilos de seda (Fig. 4E y Fig. 4F). Una vez completado el ciclo biológico, el pie queda con el follaje totalmente seco.

Fig. 4 Damage produced by P. flegia on C. thevetia. A. Damaged leaf by first instar larvae. B. Leaf with herbivory damage. C. Damaged foliage in the canopy. D. Partial view of deteriorated foliage by larvae. E and F. Rolled leaves linked by silk threads.
Fenología de la especie: Los picos poblacionales de P. flegia, en el área estudiada, se producen durante el otoño, con inicio en marzo-abril y mayores manifestaciones en mayo-junio. A finales de agosto y principios de septiembre ya no se observa actividad de la mariposa. Los años de registros de daños intensos, coinciden con otoños de temperaturas promedio de 15 °C y HR de 60 a 75 %. El ciclo biológico se completó con una acumulación de 403.52 grados días. Los requerimientos calóricos para las etapas de huevo, larva y pupa fueron de 65.22; 226.50 y 164.57 grados días respectivamente.
Discusión
Palpita flegia se distingue por el tamaño corporal de otras especies del género, importantes plagas de Oleaceae, que oscilan entre 19 y 30 mm (Hayden & Buss, 2012; Noori & Shirazi, 2012; Perrone et al., 2014) y por la coloración de la vena costal. P. persimilis Munroe, 1959 (Gomez, 1999), P. vitrealis Rossi, 1794 (Noori & Shirazi, 2012) y P. forficifera Munroe, 1959 (Perrone et al., 2014) poseen la vena costal con tonalidades amarronadas.
El comportamiento de P. flegia en oviposición, alimentación y protección es similar a otras especies del género (Badawi, Awadallah, & Foda, 1976; Khaghaninia & Pourabad, 2009; Alavi, 2010; Perrone et al., 2014). La única excepción ocurre en P. unionalis que en altas densidades puede ubicar las pupas en el suelo entre terrones, bajo piedras y escombros (Noori & Shirazi, 2012).
La duración de las distintas etapas del desarrollo post-embrionario, así como el número de estadios determinados en laboratorio es congruente con lo observado para otras especies de Palpita (Rahhal, 1972; Badawi et al., 1976; Kumral, Bahattin, & Akbudak, 2007; Alavi, 2010; Yilmaz & Genc, 2012). La humedad relativa es un factor ambiental que no solo incide en el desarrollo, sino también en la emergencia de mariposas. Badawi et al. (1976) determinaron que valores superiores a 75 % HR son desfavorables para la emergencia de adultos y los valores comprendidos entre 35 y 65 % HR son favorables. De acuerdo a estas observaciones los resultados obtenidos en este trabajo se encuentran comprendidos entre los valores óptimos para el desarrollo de P. flegia.
La proporción sexual determinada es coherente con los trabajos de Noori y Shirazi (2012), Vassilaina-Alexopoulou y Santorini (1973) y Badawi et al. (1976), quienes registraron que los machos son más abundantes que las hembras. Este parámetro es un factor clave en el potencial de reproducción de las especies, ya que implica la velocidad a la cual los individuos son capaces de reproducirse y por lo tanto de aumentar su población (Silveira-Neto et al., 1976).
Varios estudios han aplicado la ley de Dyar para determinar los estadios larvales de distintas especies (Caltagirone, Getz, & Meals, 1983). En la distribución de frecuencias del ancho de cápsulas cefálicas, en el estadio IV, no se observa una única máxima frecuencia. Sin embargo, la relación lineal significativa entre los estadios y anchos de capsulas cefálica confirman el número de estadios larvales, que presenta P. flegia. Los resultados sobre su biología son de gran importancia para el reconocimiento de aumentos de las poblaciones, pues permiten diagnosticar la etapa en que se encuentra la plaga.
Cascabela thevetia posee un mecanismo de defensa contra la fitofagia, por la presencia de canales laticíferos en sus hojas y otros órganos. El látex integrado por componentes químicos como alcaloides y terpenos actúa como sustancia deterrente y como una defensa mecánica, por sus propiedades físicas (Farrell, Dussourd, & Mitter, 1991; Bernays & Chapman, 1994). Ante estos mecanismos defensivos, los insectos fitófagos poseen estrategias de comportamiento a fin de superarlas (Rosentthal & Janzen, 1979) que les permite alimentarse de las hojas, evitando o cortando los canales laticíferos a fin de drenar el látex (Dussourd & Denno, 1991; Dussourd, 2009), como efectúa P. flegia en C. thevetia.
Existen procesos co-evolutivos entre plantas e insectos. Los insectos se especializan en la selección de los hospedantes y a su vez, los vegetales desarrollan estrategias de resistencia contra la herbivoria sintetizando sustancias químicas toxicas (Bernays & Graham, 1988). La eficiencia en las estrategias de los fitófagos para evitar la toxicidad, les confiere características de especificidad y ventajas en la competencia por alimentos (Whittaker & Feeny, 1971). Probablemente la especificidad de P. flegia en C. thevetia, responda al éxito evolutivo en evitar las sustancias tóxicas con estrategias de alimentación.
En ataques intensos de P. flegia, los mayores daños ocurren en vivero, ocasionado muerte de plantas (Herrera, Cristóbal, Reyes, & Barahona, 2013); y en el arbolado urbano afectan sus servicios ambientales, como sombra, valor estético, de recreación, valor de la propiedad privada y calidad del aire (Ponce Donoso & Piedrahita, 2009). En el caso de plantas adultas de C. thevetia, defoliaciones severas únicas difícilmente causan la muerte como ocurre en vivero, pues otros factores como la frecuencia de las defoliaciones, fase vegetativa y tolerancia de la planta inciden en el riesgo de muerte (Kulman, 1971; Rubio, Loetti, & Bellocq, 2013).
El rango de grado días determinado para P. flegia se encuentra comprendido entre los valores enunciados por Honek (1996) para especies de mariposas tropicales y semejante al obtenido para P. indica (Wookkyun, Gilhah, Cheol, Jeongwha, & Kwangyun, 2000).
Distintas técnicas se han ensayado para el control de especies de Palpita en plantaciones de olivo (Lopez-Villalta, 1999). El control químico es parcialmente eficaz a causa del refugio de las larvas en estuches y por los riesgos ecológicos y toxicológicos (Youssef et al., 2004). También se hicieron ensayos para el control mediante uso de feromonas (Witzgall, Kirsch, & Cork, 2010; Athanassiou, Kavallieratos, & Mazomenos, 2004). Bacillus thuringiensis var. kurstaki y parasitoides nativos (Hymenoptera: Trichogramma) se aplicaron para el control de larvas de P. unionalis obteniéndose resultados satisfactorios (Hegazi et al., 2007). Brachymeria flegiae (Hymenoptera, Chalcididae), citado como parasitoide de P. flegia (Krombein & Burks, 1967; Diodato et al., 2009), encontrado en este estudio; sería un efectivo controlador biológico mediante la técnica de conservación, evitándose las aplicaciones químicas.
La poda del material infestado es efectiva y con resultados a corto plazo. Para el control de Cydalima perspectalis (Walker, 1859), defoliador del boj (Buxus sempervirens L.) esta técnica fue aplicada con resultados positivos (Korycinska & Eyre, 2011). En la aplicación del control mecánico para P. flegia, las podas sanitarias y destrucción del material vegetal deberían realizarse a principios del otoño, cuando inician los vuelos los primeros adultos emergentes. La intensidad de la poda, será en concordancia con la severidad del daño. Cuando el daño comprende toda la copa del árbol, debería aplicarse una poda intensa.
Los resultados obtenidos sobre la biología y el comportamiento, facilitan la determinación de la fase biológica de la especie, la severidad de la infestación y la selección de la estrategia de control.












 uBio
uBio