Los estudios ecológicos permiten conocer además de la diversidad de especies de un ecosistema, las interacciones bióticas interespecíficas e intraespecíficas. Además, el conocimiento de la dieta de las especies permite describir tales interacciones y la forma en la que se encuentran organizadas las especies al interior de un nicho ecológico en su eje trófico, con base en el alimento que consumen. Asimismo, permiten explorar la amplitud del nicho trófico mediante la cuantificación de la variación en la utilización de los recursos (Valverde, Cano-Santana, Meave, & Carabias, 2005). Para estudios de ecología alimentaria de los peces, es necesario abordar interrogantes como: ¿qué consumen?, ¿dónde?, ¿cómo lo hacen? y ¿cuál es la magnitud de la variación de la dieta con relación al tamaño? Considerar también las variaciones entre sexos y el momento hidrológico, dado que la dinámica entre la disponibilidad de alimento y la amplitud del nicho trófico de las especies tropicales están sujetas a los pulsos de inundación (Abelha, Agostinho, & Goulart, 2001).
En investigaciones ecológicas donde se estudia la estructura trófica relacionada con rasgos ecomorfológicos en peces, se usan diversos métodos de análisis que permiten conocer las relaciones que se establecen entre el ambiente y los organismos. Entre ellos, estudios cuantitativos y cualitativos del contenido estomacal (Hyslop, 1980), y estudios de diversos rasgos morfológicos que se encuentran estrechamente correlacionadas y permiten explicar la explotación de los recursos y lo cual depende en gran medida de la morfología interna (Pianka, 2000; Chen, 2002; Pouilly, Lino, Bretenoux, & Rosales, 2003; Sánchez, Galvis, & Victoriano, 2003; Zarate-Hernández, Aguirre-León, Ortiz-Burgos & Castillo-Rivera, 2007). Este campo de estudio brinda conocimiento no solo de cuáles son los recursos consumidos sino también de cómo intervienen las adaptaciones morfológicas (Ebert & Bizarro, 2007). Asimismo, la existencia de variabilidad en los rasgos morfológicos a nivel intraespecífico impulsa a la especialización trófica de las especies. Sin embargo, a pesar de tales variaciones, la mayoría de los trabajos se han centrado principalmente en las diferencias en los rasgos funcionales entre las especies, sin tener en cuenta los efectos potenciales de variaciones intraespecíficas (Zhao, Villéger, Lek, & Cucherousset, 2014).
Triportheus magdalenae (Steindachner, 1878) es un pez endémico de la cuenca Magdalena con un alto valor como recurso pesquero en la región, además de su papel ecológico en los ecosistemas, ya que es un consumidor secundario (Rodríguez & Rodríguez, 1976; Malabarba, 2004; Caraballo, 2009; Jiménez-Segura, Carvajal-Quintero, & Aguirre, 2010; Mariguela, Roxo, Foresti, & Oliveira, 2016). El objetivo de este estudio fue analizar las variaciones tróficas intraespecíficas de esta especie en el embalse El Guájaro-Atlántico Colombia, en donde estudiamos las relaciones entre la dieta y rasgos ecomorfológicos asociados a la explotación del alimento, principalmente a las características del branquio-cráneo.
Material y métodos
Área de estudio: El área hidrográfica del Magdalena-Cauca (5 701 101 ha) alberga los embalses más grandes del país, y representan el 18 % del total de humedales continentales a nivel nacional. El embalse El Guájaro, fue construido entre 1964 y 1965 por INCORA con el fin de captar agua y para los distritos de riego del sur del departamento del Atlántico (CRA, 2002). Se Ubica entre los 10º25’-10º38’ N & 75º00’-75º08’ W, y de 3 a 13 m.s.n.m., a la ribera izquierda del Río Magdalena, al sur-occidente del departamento de Atlántico, costa Caribe Colombiana. Actualmente el embalse ocupa una extensión de 16 000 ha, donde se desarrollan principalmente actividades pesqueras, agrícolas, consumo humano, recreación y turismo, ubicándolo como el cuerpo de agua más importante de la región (CRA, 2002; Caraballo, 2009; García-Alzate, Moreno, & De la Parra, 2016).
El embalse corresponde a áreas bajas del río Magdalena y se conecta con sus aguas en el extremo sur, por medio del Canal del Dique, se caracteriza por poseer gradientes limnológicos horizontales con concentraciones de mayor a menor en sentido Norte-Sur de la conductividad eléctrica, alcalinidad, dureza y pH, especialmente en periodos de sequia (Villalón & Vega, 2016; García-Alzate et al. 2016). Considerando la morfología del embalse, el aporte de agua y el comportamiento de las características limnológicas, se establecieron nueve estaciones de muestreo (E1 a E3 en la zona Norte, E4 a E6 en el Centro, y en el Sur de E7 a E9) (Figura 1).
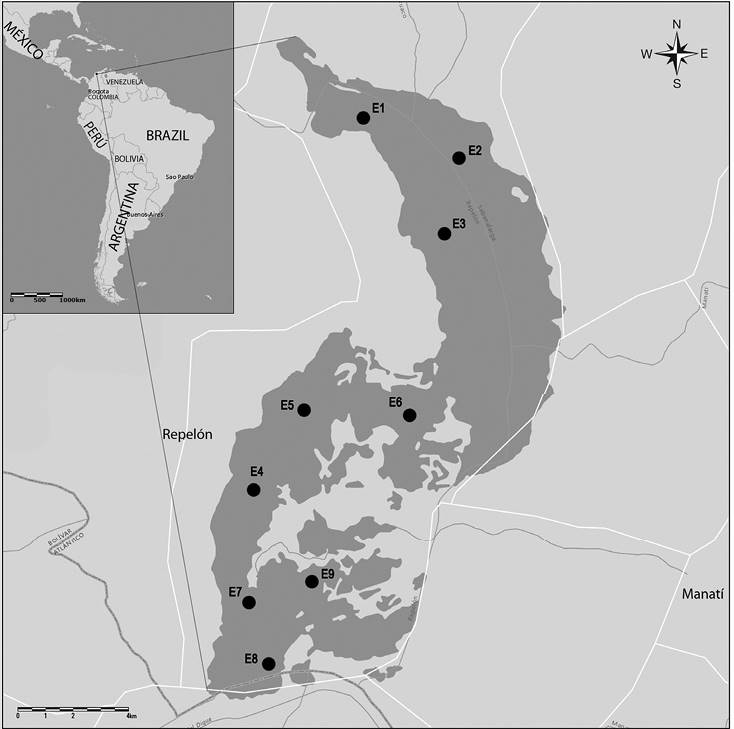
Figura 1 Embalse El Guájaro (9 estaciones de muestreo: E1, E2, E3 en la zona Norte, E4, E5, E6 en el Central, y E7, E8, E9 en el Sur).
Diseño muestral: Se realizaron cinco salidas de campo (M1 a M5) entre septiembre 2014 y febrero 2016 con el propósito abordar cada momento del pulso de inundación: subida de aguas (M1 septiembre de 2014, 3.27 m de nivel), en aguas altas (M2 diciembre de 2014, 4.37 m), retirada de aguas (M3 y M4 abril y junio 2015, 3.56 m y 3.18 m de nivel respectivamente), y aguas bajas fuertemente influenciado por el fenómeno El Niño 2015-II a 2016-I (M5 en febrero 2016, 2.46 m) (Figura 2).
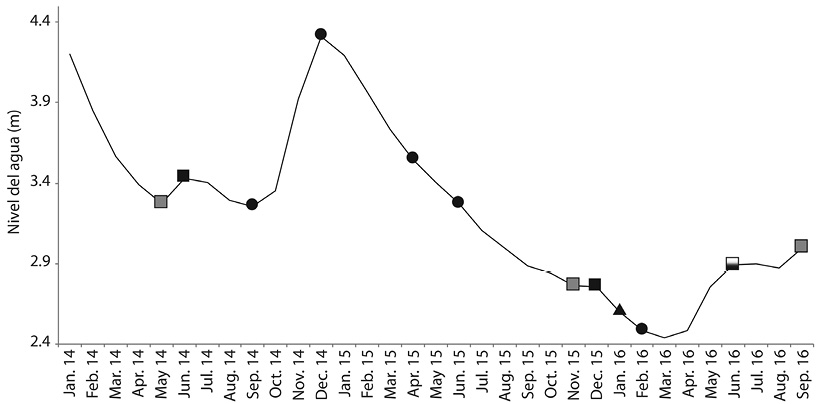
Figura 2 Pulso de inundación del embalse El Guájaro entre 2014 y 2016, modificado de García-Alzate et al. (2016) y estación AcuaCultivos El Guájaro en La Peña. = compuertas abiertas; = compuertas cerradas; = muestreos 1, 2, 3, 4 y 5 de izquierda a derecha; = inicio de bombeo desde el canal del Dique; = apertura y cierre de las compuertas.
Las capturas de los peces se llevaron a cabo mediante el uso de atarrayas (ojos de malla de 1 cm y 2.5 cm, con 3 y 5 m de diámetro, respectivamente) y redes de arrastre (ojos de malla de 0.5 cm y 1 cm, 3 x 4 y 3 x 5 m, respectivamente). Los ejemplares capturados fueron registrados y depositados en neveras de polietileno con hielo para su posterior análisis.
Trabajo de laboratorio: Los ejemplares recolectados, fueron medidos (con un calibrador digital; Longitud Estándar [LE mm]) y pesados (con una balanza digital de 0.01 mm de precisión [g]). Seguidamente con base en la longitud estándar se clasificaron en intervalos de tallas, al utilizar la ecuación: A = N/R; R = √n; N = Max-Min; donde, A = amplitud de los intervalos, R = número de intervalos, n = número de observaciones, Max = valor máximo, Min = valor mínimo (Se sigue a García-Alzate, Román-Valencia & Barrero, 2012; Morales & García-Alzate, 2016; Ibarra-Trujillo & García-Alzate, 2017).
Posteriormente, mediante incisión longitudinal en la zona uroventral se extrajo el tracto digestivo de todos los ejemplares el cual fue pesado, medido, rotulado y conservado en alcohol al 70 % para el posterior análisis. Los ejemplares fueron fijados en formol al 10 % y depositados en la colección de referencia científica de la Universidad del Atlántico reconocida por el IAvH con número de registro UARC-132 (Morales & García-Alzate, 2016).
Se realizó una caracterización del tracto digestivo como longitud; ancho y forma del estómago, y longitud del intestino con la ayuda de un calibrador digital (0.01 mm de precisión). Asimismo, estructuras bucofaríngeas como el número y longitud de branquiespinas, y el número y forma de los dientes. Los cuales fueron contados y medidos por cada intervalo de talla, con la ayuda del método de clareado y teñido (Taylor, 1969), bajo un microscopio estereoscópico.
Se midieron 11 rasgos ecomorfológicos relacionados con las funciones vitales tales como la posición de la especie en la columna de agua, explotación del recurso trófico, hábito trófico y tamaño de las presas (Zhao et al., 2014) (Cuadro 1), basados las publicaciones de Gatz (1979), Watson & Balon (1984), Balon, Crawford & Lelek (1986), Pouilly et al. (2003); Teixeira & Bennemann (2007), Fernández, Ferriz, Bentos & López (2012) y Ramírez, Lee & Mojica (2015). Los datos de los rasgos ecomorfológicos se analizaron con relación a la Longitud Estándar (LE) con el fin de reducir el efecto alométrico y disminuir el efecto de las diferencias en tamaño corporal (Winemiller, 1991).
Cuadro 1: Rasgos ecomorfológicos, código y descripción asociados con tamaño de presa, posición del pez en la columna de agua, explotación del recurso trófico y hábito trófico. Table 1: Ecomorphological traits, code and description associated with the size of the dams, position of the fish in the water column, exploitation of the trophic resource and trophic habit
| ASOCIADOS A: | RASGO | CÓDIGO | DESCRIPCIÓN |
|---|---|---|---|
| Tamaño de las presas | Longitud estándar | LE | Distancia de la punta del hocico hasta la última vértebra. |
| Longitud relativa de la cabeza | LRC | Relaciona la distancia de la punta del hocico hasta el margen posterior del opérculo y es estandarizada al dividirla por la longitud estándar (LE). | |
| Altura relativa de la boca | ARB | Es la relación entre la altura máxima de la boca sobre la longitud estándar. | |
| Posición del pez en la columna de agua (vertical) | Posición de la boca | PB | Es la orientación de la boca: Posición dorsal = 1; Terminal = 2; Ventral =3. Basados en la clasificación de Watson & Balon (1984) y Hugueny & Pouilly (1999): indica la posición de los alimentos con respecto al pez. |
| Diámetro relativo del ojo | DRO | Es la relación del diámetro horizontal del ojo estandarizado al dividirlo entre la LE. | |
| Posición relativa de los ojos | PRO | Es la relación entre la distancia vertical desde el centro del ojo hasta el límite inferior de la cabeza dividida entre la altura total de la cabeza medida a nivel de los ojos. | |
| Configuración de la aleta pectoral izquierda | CAP | Es el producto de relación entre la longitud y ancho máximo de la aleta pectoral estandariza con la LE. | |
| Explotación del recurso trófico | Dientes | D | se combinaron en un código basados en el número y la forma en el pre-maxilares, maxilar y dentario para describir el modo de la ingesta: 0 = ausencia de dientes (asociado con la función de succión o aprovechando las presas pasivas). 1 = pocos dientes < 50 de forma cónica o multicuspidal (asociados al morder o desgarrar). 2 = numerosos dientes > 50 filiformes (asociados con la actividad de raspado). 3 = banda de numerosos dientes (asociado con succión aprovechando las presas activas). |
| Número de branquiespinas en el primer arco branquial izquierdo | NBE | Es la suma de las branquiespinas en la parte superior e inferior del primer arco branquial. | |
| Longitud relativa de branquiespinas en el primer arco branquial izquierdo | LRBE | Es la relación de la longitud media de la profundidad de corte de las branquiespinas del primer arco branquial sobre la LE. | |
| Hábito trófico | Longitud relativa del intestino | LRI | Es la relación entre la longitud total del intestino sobre la LE. |
Análisis de datos: Para la determinación de los ítems alimentarios el contenido estomacal fue depositado en cajas Petri y examinado bajo el microscopio estereoscopio. La identificación se realizó con la ayuda de claves específicas hasta la categoría taxonómica más baja posible (Roldán, 1996; Ramírez, 2000; Fernando, 2002 y Domínguez & Fernández, 2009).
Posteriormente, se siguió a Morales & García-Alzate (2016), con el uso del Coeficiente de Vacuidad (CV %), el cual expresa en porcentaje el número de individuos capturados que no tenían contenido en sus estómagos. Seguidamente, para evaluar la suficiencia del tamaño de la muestra de los estómagos con alimento, se realizó una curva de acumulación de presas o ítems con el usó del índice no paramétrico Chao2 para estimar la riqueza específica de la dieta consumida, basados en datos de presencia/ausencia.
Para establecer el hábito trófico de la especie y evaluar la variación intraespecífica de la dieta se aplicó el Índice Alimentario (IAi %) (Kawakami & Vazzoler, 1980). Los datos fueron sometidos a pruebas de normalidad y homocedasticidad, posteriormente se aplicó una prueba de Kruskal-Wallis con el fin de determinar diferencias en la dieta a nivel temporal e intraespecíficas, es decir, entre sexos, y ontogénico de la población.
Se determinó la amplitud de nicho trófico con el índice de Levins estandarizado (Hurlbert 1978) (BA) con base en Krebs (2014), la escala de valores resultantes son entre 0 (mínima amplitud), y 1 (máxima amplitud), cuando son menores a 0.6 indica estrecha amplitud. Asimismo, en el análisis de similitud trófico, se aplicó el índice de Morisita simplificado (Krebs, 2014), cuyos valores varían entre 0 y 1, donde 0 (ausencia de similitud) y 1 (máxima similitud) trófica. Se calculó la amplitud y similitud trófica entre intervalos de tallas, sexos y momentos del pulso de inundación, basados en los valores del índice alimentario (IAi).
Se realizaron análisis de posición central y de dispersión para observar la tendencia de los rasgos ecomorfológicos, pruebas de normalidad (Shapiro-Wilk, n = 11) y un ANDEVA con el fin de determinar las diferencias intraespecíficas de los rasgos ecomorfológicos. Las relaciones entre la dieta y de los rasgos ecomorfológicos se estudiaron mediante el análisis de correspondencia canónica (ACC), contrastando los rasgos ecomorfológicos en cada intervalo de talla y las categorías alimenticias registradas (IAi %), donde los rasgos ecomorfológicos se constituyen como variables explicativas de la alimentación (Ter-Braak, 1986). La significación estadística se estimó con 1 000 permutaciones. Todas las pruebas fueron realizadas con la ayuda de los programas Microsoft Excel 2008 y Software PAST (versión 3.1.4) (Hammer, 2016).
Resultados
Se recolectaron 89 individuos con un peso medio de 44 g (0.5 y 105 g), y tamaño medio de 147 mm (± 27 SD) LE (34 y 190 mm), los más frecuentes fueron de 150 mm, 170 mm y 180 mm de LE. Se establecieron seis intervalos de talla: I correspondió a individuos entre 34 mm a 64 mm LE, II entre 64.1 a 94 mm LE, III de 94.1 a 124 mm LE, IV entre 124.1 a 154 mm LE, V de 154.1 a 184 mm LE, y VI de 184.1 a 214 mm LE. La especie no fue capturada en zona Norte (E1, E2 y E3) del embalse, mientras que en la zona Centro se llevó a cabo el 37 % de las capturas y en el Sur el 63 % (Cuadro 2).
Cuadro 2: Morfometría de T. magdalenae entre tallas, sexo y pulso de inundación. Table 2: Morphometry of T. magdalenae between sizes, sex and flood pulse
| Tallas, sexo y pulso de inundación | N° | LE Mín-Máx (Ẋ±SD) | LT (Ẋ±SD) | WT Ẋ (±SD) | N° estómagos con alimento | N° estómagos Vacíos | Zona de Captura |
|---|---|---|---|---|---|---|---|
| I | 2 | 34-64 (38.24±6.36) | 47.05 (±9.19) | 0.70 (±0.35) | 2 | 0 | Sur |
| II | 2 | 64.1-94 (91.49±٢.١٢) | 115.49 (±2.12) | 8.22 (±0.02) | 2 | 0 | Sur |
| III | 8 | 94.1-124 (109.9±١٠.٧٩) | 134.21(±11.17) | 14.48 (±4.49) | 7 | 1 | Sur |
| IV | 33 | 124.1-154 (146.3±6.31) | 176.2 (±8.03) | 40.13 (±11.03) | 9 | 24 | Centro y Sur |
| V | 40 | 154.1-184 (167.9±8.64) | 204.3 (±11.06) | 72.68 (±15.31) | 20 | 20 | Centro y Sur |
| VI | 4 | 184.1-190 (187.5±2.88) | 214.2 (±6.99) | 83.4 (±14.5) | 3 | 1 | Centro y Sur |
| Hembras | 32 | 130-190 (167.4±١٣.٤) | 203.2 (±15.26) | 71.6 (±20.7) | 19 | 13 | Centro y Sur |
| Machos | 30 | 136-170 (150.7±7.97) | 181.2 (±10.58) | 45.2 (±13.2) | 10 | 20 | Centro y Sur |
| Aguas subiendo | 4 | 114-152(132.9±19.8) | 158.5 (±22.5) | 27.3 (±10.8) | 0 | 4 | Sur |
| Aguas altas | 18 | 145-190(159.6±11.8) | 191.5 (±11.8) | 64.7 (±14.3) | 10 | 8 | Centro y Sur |
| Aguas bajando | 37 | 34-190(136.4±38.4) | 166.9 (±46.2) | 33.8 (±35.2) | 26 | 11 | Centro y Sur |
| Aguas bajas | 30 | 136-185(156.4±14.8) | 188.2 (±17.6) | 50 (±16.5) | 5 | 25 | Centro y Sur |
N° = número de ejemplares recolectados; LE = longitud estándar (mm); mínima-máxima; Ẋ = promedio; SD = desviación estándar; LT = longitud total (mm); WT = peso total (gr); Incluye número de estómagos con alimento y vacíos.
N° = number of specimens collected; SL = standard length (mm); minimum-maximum; Ẋ = average; SD = standard deviation; LT = total length (mm); WT = total weight (gr); Includes number of stomachs with food and gaps.
En la dieta de T. magdalenae se registraron 22 ítems alimentarios, de los cuales 11 fueron de origen animal especialmente zooplancton e insectos, y 10 de origen vegetal principalmente fitoplancton (Cuadro 3). El coeficiente de vacuidad fue de 54 % equivalente a 48 estómagos vacíos. El estimador de acumulación de ítems alimentarios, indicó que la dieta equivale al 80 % de los ítems estimados (Chao2: 28 ítems alimentarios vs 22 ítems observados). La especie mostró hábitos tróficos especialistas (BA = 0.12) zooplanctófago, puesto que los microcrustáceos fueron los más importante en la dieta (12.37 % IAi), principalmente Copépoda (Notodiaptomus sp.: 37.7 % IAi; Thermocyclopssp.: 13.2 % IAi) y Cladócera (Ceriodaphnia sp.: 32.97 % IAi), seguido de Insectos (3.37 % IAi) especialmente alóctonos. Mientras que otros componentes como microalgas, ictioplancton (0.07 % IAi), escamas (0.13 % IAi), material vegetal (0.51 % IAi; semillas y fibra vegetal) y detritus (0.02 % IAi) fueron considerados como alimentos accidentales.
Cuadro 3: Dieta de T. magdalenae (n = 89) en el embalse El Guájaro. Table 3: Diet of T. magdalenae (n = 89) in the reservoir El Guájaro
| Division / Phylum | Orden | Ítems | IAi % | |
|---|---|---|---|---|
| Fitoplancton | Cyanobacteria | Nostocales | Dolichospermum sp. | 0 |
| Oscillatoriales | Oscillatoria sp. | 0 | ||
| Cyanophyta | Phormidium sp. | 0 | ||
| Chlorophyta | Chlorellales | Planctonema sp. | 0 | |
| Bacillariophyta | Fragilariales | Synedra goulardii | 0 | |
| Aulacoseirales | Aulacoseira granulata | 0 | ||
| Heterokontophyta | Naviculales | Navicula sp. | 0 | |
| Pinnularia sp. | 0 | |||
| Zooplancton | Rotifera | Ploima | Keratella sp. | 0 |
| Trichocerca sp. | 0.02 | |||
| Brachionus sp. | 0.17 | |||
| Arthropoda- Crustáceos | Cladocera | Ceriodaphnia sp. | 32.97 | |
| Calanoida | Notodiaptomus sp. | 37.67 | ||
| Cyclopoida | Thermocyclops sp. | 13.24 | ||
| Rest. microcrustaceos | Rest. microcrustaceos | 11.82 | ||
| Macroinvertebrados | Arthropoda-Insecta | Diptera | Diptera (L) | 0.06 |
| Rest. insectos | Rest. insectos | 3.31 | ||
| Pisces-Osteichthyes | Chordata-Vertebrata | Ictioplancton | Ictioplancton (L) | 0.07 |
| Escamas | Escamas | 0.13 | ||
| Embryophyta | Spermatophyta | Mat. Vegetal | Mat. Vegetal | 0.22 |
| Semillas | Semillas | 029 | ||
| Otros | Materia Orgánica | Detritus | Detritus | 0.02 |
L: larvas; IAi % = Índice alimentario.
L: larvae; IAi % = Food index.
Variación de la dieta entre juveniles y adultos: se detectaron diferencias significativas de la dieta entre tallas (K-W, p = 0.037), dado que los juveniles [I = 0 BA; II = 0.07 BA; III = 0.11 BA] tuvieron hábitos zooplanctófagos seguido por el consumo de insectos; a excepción de los individuos de la talla I que consumieron exclusivamente insectos (alóctonos), y la talla III incluyó además de insectos (5.3 % IAi), Copépoda (5.7 % IAi), mientras que los adultos [IV = 0.12 BA; V = 0.11 BA; VI = 0.10 BA] solo tuvieron hábitos zooplanctófagos, las tallas IV y V incluyeron larvas de insectos en bajos valores de índice alimentario 1.4 % IAi y 7x10-2 % IAi, respectivamente (Figura 3). La similitud trófica entre los intervalos de tallas mostró dos grupos: el grupo A con las tallas I y III (similitud 0.62) por el consumo de insectos, y el grupo B con las tallas II, IV, V y VI (similitud 0.64) por el consumo de microcrustáceos.
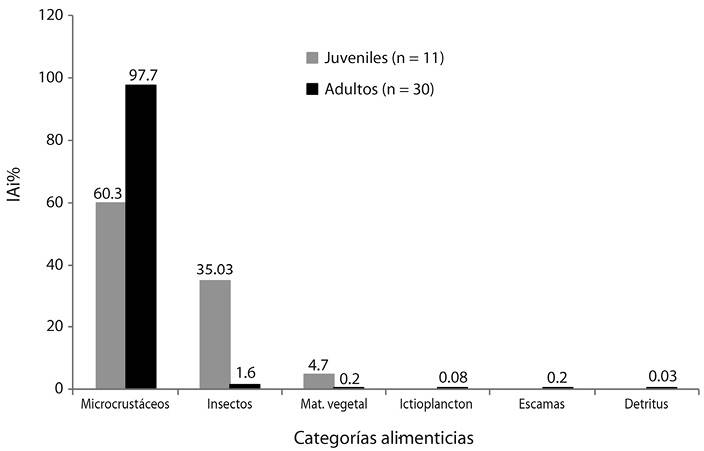
Figura 3 Índice alimentario (IAi %) en juveniles (34-124 mm LE) y adultos (124.1-190 mm LE). n = número de estómagos con alimento.
Variación de la dieta entre sexos: se identificó 18 y 11 ítems en hembras y machos, respectivamente, sin diferencias significativas, dado que se observó una similitud trófica de 0.78, esto debido a que los adultos muestran una especialización trófica sobre el consumo de Microcrustáceos que constituyó el componente alimenticio más importante en la dieta, tanto en hembras (97.2 % IAi Copépoda y Cladócera) como en machos (80.04 % IAi: Rotífera, Copépoda y Cladócera), seguidos por el consumo de insectos [hembras (1.43 % IAi) vs machos (17.4 % IAi)].
Variación temporal de la dieta: la similitud trófica fue del 0.63, donde los momentos de aguas altas y bajas fueron las más similares con el 0.81, y no se observaron diferencias estadísticamente significativas (K-W, p = 0.07), dado el alto porcentaje de microcrustáceos en la dieta. En aguas altas los microcrustáceos representaron el 99 % IAi, le sigue insectos alóctonos (0.27 % IAi), escamas (0.32 % IAi) y detritus (0.11 % IAi), mientras que en aguas bajas los microcrustáceos correspondieron el 100 % IAi. La dieta durante la retirada de las aguas incluyo microcrustáceos (77.8 % IAi), ictioplancton (43 % IAi), insectos (18.3 % IAi), material vegetal (3.67 % IAi) y escamas (0.08 % IAi) (Figura 4).
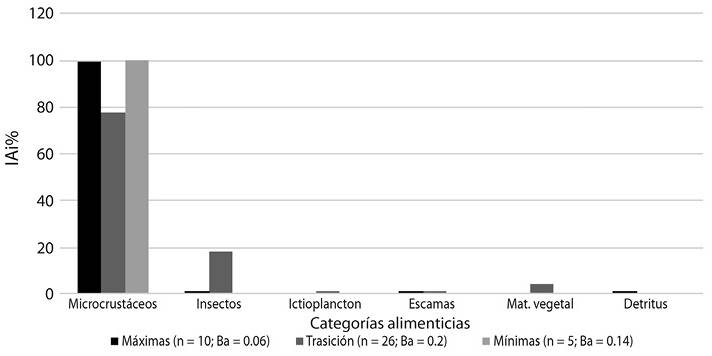
Figura 4 Índice alimentario (IAi %) momentos de muestreo: aguas máximas (M2); aguas en transición o en retirada (M3 y M4); aguas mínimas (M5); n = número de estómagos con alimento; BA = Índice estandarizado de Levin (Krebs, 2014).
Estructuras bucofaríngeas y tracto digestivo: Triportheus magdalenae posee dos hileras de dientes en el premaxillar, en la fila externa un promedio de 5 dientes (± 0.5 SD), mínimo 5 y máximo 6 tricúspides; y en la fila interna 9 (± 0.6 SD), mínimo 8 y máximo 10 dientes tricúspides-multicúspides, el maxillar es adentado, y el dentario posee 7 (± 1.9 SD) dientes multicúspides, con mínimo 6 (adultos) y máximo 8 (juveniles) (Figura 5). Los arcos branquiales no poseen lóbulos o protuberancias, y las branquiespinas son más largas en el epibranquial, luego se acortan progresivamente hacia el hipobranquial, el número y la longitud de las branquiespinas varían significativamente (ANOVA; p < 0.001), dado que aumentan en número y longitud conforme los individuos pasan de juveniles a adultos (Cuadro 4).
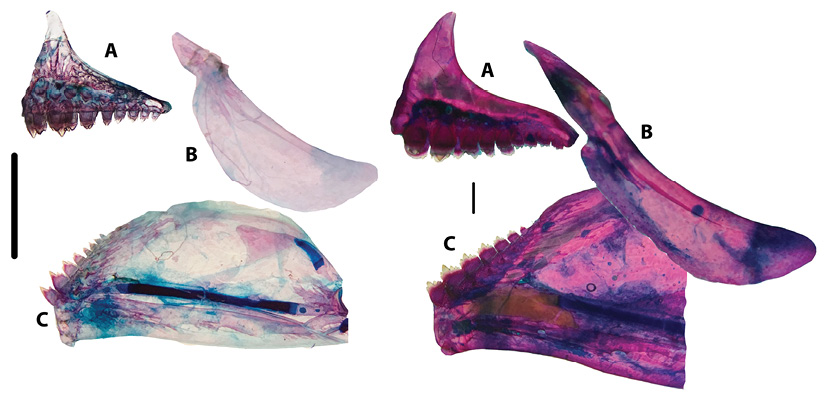
Figura 5 Mandíbulas de T. magdalenae, Talla I izquierda y V derecha: A) pre-maxillar con dos hileras de dientes tricúspides y multicúspides; B) maxillar sin dientes; C) dentario con dientes multicúspides. Escala de 1 cm.
Cuadro 4: Número promedio de branquiespinas en el primer arco branquial izquierdo (#BE1°) por cada intervalo de tallas. Table 4: Average number of gillrakers in the first left gill arch (# BE1 °) for each size range
| Tallas | LE (rango mm) | #BE1° (SD) |
| I (n = 2) | 38.2 (34-64) | 58 (±10.9) |
| II (n = 2) | 91. 5 (64.1-94) | 81 (±13.9) |
| III (n = 3) | 109.9 (94.1-124) | 101 (±5.0) |
| IV (n = 3) | 146.1 (124.1-154) | 107 (±8.08) |
| V (n = 3) | 167.9 (154.1-184) | 113 (±3.46) |
| VI (n = 3) | 179.7 (184.1-214) | 108 (±12.2) |
n = número de ejemplares; SD = desviación estándar.
n = number of examples; SD = standard deviation.
El estómago es de forma sacular más largo (19.5 mm) que ancho (9.1 mm) con 8 a 16 ciegos pilóricos, siendo 14 el número más frecuente. El peso y la longitud del estómago estuvieron significativamente asociados con la longitud estándar (Sperman; r = 0.79; p = 2.72 x 10-20, y r = 0.72; p = 1.54 x 10-15, respectivamente). La longitud del intestino mostró una media de 86. 3 mm (±33.3) la cual equivale al 58.7 % la longitud estándar.
Rasgos ecomorfológicos: entre los valores de los rasgos ecomorfológicos para cada intervalo de talla (I a VI) existieron diferencias significativas (K-W; p < 0.001), esto debido a el número y longitud de las branquiespinas (se excluyen las formas larvales las cuales no fueron consideradas), mientras que entre sexos no existieron diferencias significativas (ANDEVA; p = 0.91) (Cuadro 5).
Cuadro 5: Valores en intervalos de tallas y sexo de los rasgos ecomorfológicos considerados. Table 5: Values in size and sex ranges of ecomorphological traits
| Tallas | LE mm(mín-máx) | LRC | ARB | DRO | PRO | NBE | LRBE | LRI | CAP | PB | D |
| I (n = 2) | 38.2(34 - 64) | 0.28 | 0.103 | 0.066 | 0.607 | 58 | 8.4 | 0.398 | 0.143 | 2 | 1 |
| II (n = 2) | 91.5(64.1 - 94) | 0.26 | 0.093 | 0.066 | 0.599 | 81 | 15.4 | 0.354 | 0.071 | 2 | 1 |
| III (n = 8) | 109. 9(94.1 - 124) | 0.26 | 0.089 | 0.066 | 0.628 | 98 | 20.3 | 0.534 | 0.057 | 2 | 1 |
| IV (n = 32) | 146.1(124.1 - 154) | 0.24 | 0.079 | 0.059 | 0.636 | 107 | 24.8 | 0.556 | 0.042 | 2 | 1 |
| V (n = 40) | 167.9(154.1 - 184) | 0.24 | 0.084 | 0.055 | 0.638 | 113 | 29.3 | 0.652 | 0.035 | 2 | 1 |
| VI (n = 5) | 179.7(184.1 - 214) | 0.23 | 0.074 | 0.053 | 0.657 | 108 | 31.2 | 0.657 | 0.033 | 2 | 1 |
| ♂ (n = 29) | 146.9 (114 - 170) | 0.235 | 0.078 | * | 0.634 | * | * | 0.581 | 0.007 | 2 | * |
| ♀ (n = 32) | 166.9 (130 - 190) | 0.243 | 0.085 | * | 0.631 | * | * | 0.645 | 0.036 | 2 | * |
n = número de individuos medidos; mín = mínimo; máx = máximo: LRC = longitud relativa de la cabeza, ARB = altura relativa de la boca; PB = posición de la boca [2= terminal]; DRO = diámetro relativa del ojo; PRO = posición relativa de los ojos; D = dientes [1 = pocos dientes (<50) de forma cónica o forma multicuspidal]; NBE = número de branquiespinas en el primer arco branquial izquierdo; LRBE = longitud relativa de branquiespinas en el primer arco branquial izquierdo; LRI = longitud relativo del intestino; CAP = configuración de la aleta pectoral izquierda;* = sin calculo.
n = # of individuals measured. LRC = relative head length, ARB = relative height of the mouth; PB = position of the mouth [2 = terminal]; DRO = relative eye diameter; PRO = relative position of the eyes; D = teeth [1 = few teeth (<50) of conical or multicuspidal shape]; NBE = number of gillrakers in the first left branchial arch; LRBE = relative length of gillrakers in the first left branchial arch; LRI = relative length of the intestine; CAP = configuration of the left pectoral-fin; * = no calculation.
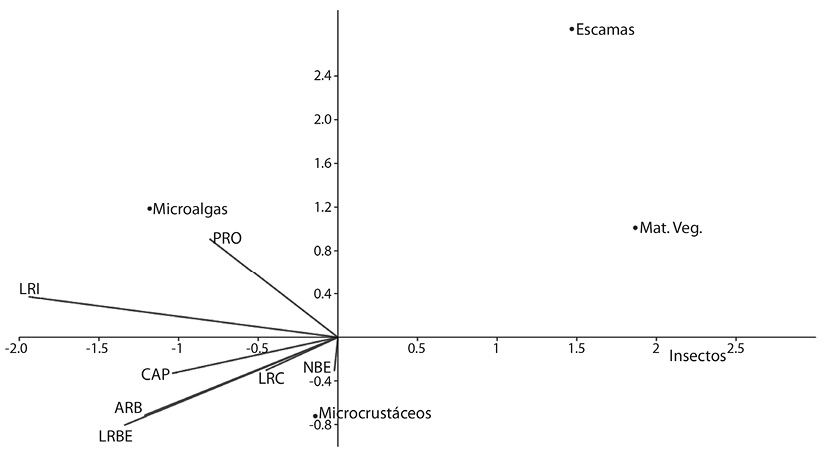
Los dos primeros ejes del ACC explicaron el 96.4 % de la variación (1 000 permutaciones; p = 0.8), en el eje X = 90.8 % los rasgos que se correlacionaron directa y positivamente con el consumo de microcrustáceos (Cladócera y Copépoda) fueron la altura relativa de la boca (ARB), configuración de la aleta pectoral (CAP), número de branquiespinas (NBE) y longitud relativa de las branquiespinas (LRBE). Por otro lado, la explotación del consumo de otros componentes como las algas fitoplanctónicas explicadas en el eje Y= 5.6 estuvo correlacionada con la longitud relativa del intestino (LRI) y la posición relativa de los ojos (PRO) (Figura 6).
Discusión
El hábito zooplanctófago de la especie concuerda con lo encontrado en otros trabajos como Rodríguez & Rodríguez (1976) los cuales concluyeron que en ecosistemas lénticos de la región alta del Canal del Dique sigue un régimen zooplanctófago, ayudada por sus numerosas y largas branquiespinas que constituyen el principal indicio del tipo de alimentación. Moreno (2006) en la ciénaga de Ayapel también la reporta con hábito trófico zooplanctófago, igual que otros trabajos no publicados como Benavides (2007) en el embalse El Guájaro donde los análisis correspondieron a ejemplares entre 140 y 260 mm LT, por lo tanto, solo comparables con los adultos del presente estudio. Sin embargo, Herrera-Molina (2010) indicó que aunque la especie tiene hábitos zooplanctófagos, también tiene la capacidad de cambiar la dieta dependiendo de la oferta del recurso, ya que puede consumir insectos y restos de material vegetal alóctonos en ambientes lóticos, igual a lo observado en este estudio.
Generalmente las especies del género Triportheus tienen hábitos tróficos omnívoros con tendencia a la insectivoría (T. albus, T. elongatus, T. paranensis, T. nematurus, T. signatus y T. angulatus), donde pueden presentar diferencias en la composición de sus dietas dependiendo de la oferta alimentaria en el tipo de ecosistema habitado (Galina & Hahn, 2003). Por otro lado, T. culter especie hermana de T. magdalenae (Mariguela et al. 2016) es exclusivamente zooplanctófaga independientemente del tipo de ecosistema en el que se encuentre (Galina & Hahn, 2003; Alván-Aguilar, Alencar, Hardy, & Chu-Koo, 2009).
Triportheus magdalenae posee dientes tricúspides y multicúspides que están asociado a morder o desgarrar (Gatz, 1979). En el estudio de Rodríguez & Rodríguez (1976) describieron en el premaxilar dos filas de dientes (10 en la fila externa, y 14 en la interna), el maxilar adentado, y en el dentario 14 dientes. En comparación con otras especies del mismo género, posee un menor número de dientes, por ejemplo, Almeida (1984) reportó en T. culter dos filas de dientes en el premaxilar (12 tricúspides en la fila externa y 19 multicúspides en la fila interna), con 16 dientes multicúspides en el dentario, y el maxilar adentado como T. magdalenae.
Las branquiespinas y el tipo de dientes son consideradas como las estructuras que están más íntimamente relacionadas con el tipo de alimento ingerido para las especies del género Triportheus (Almeida, 1984; Galina & Hahn, 2003). Por ejemplo, T. culter poseen 109 branquiespinas, y mayor longitud de las branquiespinas en comparación con T. angulatus y T. elongatus con valores medios de 51 y 28, respectivamente. Para T. paranensis la explotación del zooplancton se debe a una especialización de los arcos branquiales, que son más delgados, largos y unidos que las de sus congéneres, dichas modificaciones en el aparato branquial, les permiten aumentar la eficiencia de la captura del zooplancton (Almeida, 1984; Galina & Hahn, 2003). Los resultados de este trabajo mostraron que las variables relacionadas positivamente con la actividad de filtración y el tipo de hábito trófico zooplanctófago de T. magdalenae fueron el número y longitud de las branquiespinas, donde se evidencio variación en el número entre los juveniles y los adultos, con valores que oscilaron entre 58 y 108 branquiespinas, respectivamente, indicando entonces que conforme los individuos crecen aumentan el número y longitud relativa de las branquiespinas, lo cual está relacionado con cambios en la dieta, con un consumo de zooplancton e insectos en juveniles a un consumo predominate de zooplancton en adultos.












 uBio
uBio