Los equinoideos son un recurso que cada vez cobra mayor interés para su explotación, conservación y sostenibilidad (Lawrence, 2007). En Venezuela se han reportado cerca de 50 especies que son relativamente abundantes en áreas someras y asociadas a praderas de Thalassia testudinum, arrecifes de corales y substratos rocosos. Dentro de éstos se conocen ocho especies de erizos regulares, de las cuales Lytechinus variegatus y Echinometra lucunter constituyen un recurso potencial en la producción de gónadas para el consumo tanto como producto fresco como procesado artesanalmente (Lodeiros et al., 2013). A la fecha, no existe una legislación para la administración del recurso y se ha observado una ligera disminución de sus poblaciones naturales, las cuales pudieran quedar en riesgo de desaparecer por sobreexplotación (Montealegre & Gómez, 2005). En este sentido, es importante conocer la biología poblacional y la reproducción de estos organismos, para coadyuvar a planes de administración del recurso, especialmente cuando es necesario diversificar la producción acuícola marina en el Caribe (Lovatelli & Sarkis, 2011).
Echinometra lucunter (Linnaeus, 1758), comúnmente conocido como erizo negro, es abundante en el Atlántico tropical. Se distribuye desde las costas de Beaufort, Carolina del Norte (Estados Unidos) hasta las Bermudas y Santa Catarina (Brasil); incluyendo la costa este y central de América y el occidental de África (Hendler, Miller, Pawson & Porter, 1995). En Venezuela se ha reportado en costas del estado Falcón hasta los estados Sucre y Nueva Esparta (Zoppi, 1967; Martínez, 1986; Cruz-Motta, 2007); habita desde la zona intermareal hasta 45m de profundidad (Hendler et al., 1995). En la costa del estado Sucre, se encuentra frecuentemente asociado a corales o en fondos rocosos con abundantes macroalgas (Espinoza, Reyes, Himmelman & Lodeiros, 2008).
El ciclo gametogénico en este grupo es complejo, se inicia con cambios en el epitelio germinal de las gónadas y el desarrollo de fagocitos nutritivos, que se diferencian originando los gametos femeninos y masculinos que maduran hasta su liberación (Walker, Tatsuya & Lesser, 2007). Echinometra lucunter desova varias veces al año en el Golfo de Cariaco (Espinoza et al., 2008), lo cual es importante para la producción de juveniles con fines de cultivo (Astudillo, Rosas, Velásquez, Cabrera & Maneiro, 2005). Sin embargo, dado que no se conocen los cambios asociados a la gametogénesis de esta especie, en este trabajo se caracterizó su ciclo reproductivo por técnicas histológicas y biométricas, contrastando dos zonas de diferentes condiciones ambientales del noriente de Venezuela: un área protegida del Golfo de Cariaco (Ensenada de Turpialito) y otra en mar abierto de la Península de Araya (Isla Lobos).
Materiales y métodos
Recolección de ejemplares
Se recolectaron mensualmente quince ejemplares de E. lucunter entre junio 2010 y noviembre 2011, en la Ensenada de Turpialito (Golfo de Cariaco; 10º 27’ 30” N - 64º 01’ 52” W) e Isla de Lobos (Península de Araya; 10º 41’ 38” N - 63º 52’ 33” W), Estado Sucre, Venezuela, con un diámetro de testa de 41.0 ± 6.61 mm. Los organismos se trasladaron al laboratorio en contenedores isotérmicos para su procesamiento inmediato.
Índice gonadosomático (IG)
Se escurrió el exceso de humedad para obtener el diámetro de la testa y la masa fresca total (Mt). Se extrajeron los cinco segmentos de las gónadas y se obtuvo su masa fresca (Mg). De estas se tomaron muestras para histología convencional de microscopía óptica. El índice gonadosomático (IG) se calculó por la relación porcentual de la masa fresca de las gónadas en relación a la masa fresca total del organismo (IG = (Mg / Mt) × 100) (Martínez-Pita, García & Pita, 2008).
Métodos histológicos
La porción apical de la gónada se fijó en formalina neutralizada (10 %; 48 h), y se lavó con abundante agua de chorro. Luego se deshidrató en concentraciones crecientes de etanol (70, 80, 90, 95 y 100 %), se aclaró en xilol y se infiltró e incluyó en parafina. Se obtuvieron cortes (4μm de grosor) que fueron teñidos con hematoxilina de Harris-Eosina (H-E) para diferenciar los tipos celulares, sexo y estadio de maduración sexual, las imágenes se digitalizaron con el programa Axion Vision. Se usó la escala de maduración sexual propuesta por Lima, Gomes y Souza (2009) que diferencia cinco etapas: reserva, proliferación, premaduro, maduro y desovado. Se elaboraron histogramas de frecuencias mensuales de madurez para estimar los períodos de desoves, la estrategia reproductiva y la sincronización del ciclo gametogénico en ambos sexos.
Análisis estadístico
Los datos de IG se examinaron utilizando una prueba de Kruskal Wallis entre los meses y los estadios de maduración (Johnson & Wichern, 1992). La proporción sexual mensual y del periodo de estudio se comparó usando una prueba de Chi-cuadrado χ2 (Zar, 2010).
Resultados
Análisis histológico de las gónadas
Se identificaron cinco estadios de maduración; Reserva, Proliferación, Premaduro, Maduración máxima y Desovado en ambos sexos (Figs. 1, 2). Entre las dos localidades, las gónadas presentaron características histológicas similares con diferencias entre las proporciones sexuales y en la frecuencia de los estadios de maduración mensuales (Figs. 3, 4).

Fig. 1 Echinometra lucunter, female gonad acini showing sexual maturity stages. A. Reserve, B. Maturity onset, C. Development stage, D. Developed stage and E. Regression stage. Nutritive fagocytes (FN), Lumen (L), Pre vitelogenic ovocyte (OPV), Regression ovocyte (OR), Vitelogenic ovocyte (OV), Mature ovocyte (OM). Staining H-E. Scale bar: 100 μm.
Histología de los ovarios
Reserva: El lumen gonadal (L) se encontró ocupado de 50 a 100 % por fagocitos nutritivos (FN); los cuales presentaron diámetros variables (0.5 - 4 µm) con inclusiones de distintos tamaños y coloraciones. El espesor de la capa de FN osciló entre 60 - 150 µm. En algunos casos se observaron ovocitos remanentes (OR) que no fueron expulsados durante los desoves (Fig. 1 A). Proliferación: Los FN ocuparon completamente el lumen y en las paredes del acino se observaron los ovocitos previtelogénicos (OPV) con una ligera basofilia (azul intenso), oscilando su tamaño entre 4 - 7 µm (Fig. 1 B). Los OPV se pudieron diferenciar de los ovocitos vitelogénicos (OV) porque presentaron una región nuclear envuelta por una vesícula germinativa que ocupó casi la mitad del citoplasma celular. Premaduros (en maduración): Se observaron numerosos OPV adosados a las paredes del folículo gonadal. Con la maduración, los gametos femeninos aumentaron en dimensión y número, presentando una coloración más acidófila (naranja a rojo claro). La capa de FN se redujo significativamente y ocupó la periferia del acino (Fig. 1 C). Maduración máxima: El número de ovocitos maduros (OM) fue superior en comparación al estadio anterior. Se observaron densamente empaquetados en la zona central del lumen (L), adquiriendo formas poliédricas. Los FN formaron una fina capa junto al epitelio germinal (EG) (Fig.1 D). Desovado (emisión de gametos): El acino se contrajo, evidenciando un vaciamiento del lumen gonadal debido a la expulsión de los ovocitos. En algunos casos se observaron OM sugiriendo desoves parciales. Los FN estuvieron casi ausentes, predominando espacios vacíos (Fig. 1 E).
Histología de los testículos
Reserva (Recuperación): El lumen (L) se encontró visiblemente reducido y ocupado principalmente por fagocitos nutritivos (FN). Se observó una zona basófila (ZB) de espermatocitos remanentes (ER) hacia la periferia de la pared del testículo y cerca del lumen (L) (Fig. 2 A). Proliferación: Se observó el desarrollo de una capa de células sexuales primarias (CP), espermatogonias y espermatocitos, en las paredes del acino formando una capa periférica continua, considerando ser primordios de las células espermáticas. Estas células se distinguieron por su basofil í a (azul oscuro). El lumen presentó abundantes FN de color rosado claro (Fig. 2 B). Premaduros (en maduración): Los FN disminuyeron significativamente en número y migraron hacia la periferia del acino. Esta migración ocurrió simultáneamente con un aumento en la cantidad de gametos maduros (E), que se concentraron en el centro del acino. Las células primarias (CP) aparecieron junto al epitelio germinal (Fig. 2 C). Maduración máxima: Los espermatozoides ocuparon densamente casi todo el lumen del acino; mientras que los FN formaron una capa fina de células periféricas junto a células primarias (CP) del epitelio germinal (EPG). Se observaron algunas células espermatogénicas así como una fuerte basofília en las CP (Fig. 2 D, E). Desove (emisión de gametos): El lumen presentó muchos espacios vacíos producto de la expulsión de los espermatozoides y una capa muy fina de FN. Ocasionalmente se encontraron espermatozoides remanentes (desove parcial) muy desorganizados (Fig. 2 F).
Variación mensual del ciclo gametogénico
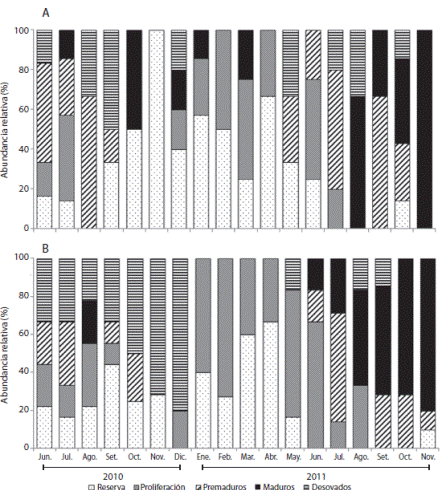
Ensenada de Turpialito: En las hembras, el estado de reserva sólo se observó en junio 2010 (63 %) y enero 2011 (50 %); mientras que la fase de proliferación predominó entre diciembre 2010 y abril 2011 (33 - 100 %), y los premaduros de junio a septiembre 2010 (11 - 40 %) y junio - agosto 2011 (25 - 100 %). Los organismos maduros se observaron en los periodos de agosto-diciembre 2010 (20 - 67 %) y septiembre-octubre 2011 (30-58%). Los erizos desovados se registraron desde agosto 2010 hasta noviembre 2010 (17 - 80 %) y entre septiembre-noviembre 2011 (43 - 100 %) (Fig. 3 A). Los machos en estado de reserva se registraron entre diciembre 2010-julio 2011 (13 - 67 %) y en proliferación entre diciembre 2010- noviembre 2011 (10 - 100 %). Los individuos premaduros y maduros se observaron en dos periodos: desde junio a noviembre 2010 (13 - 50 %) y julio-noviembre 2011 (14.3 - 83.3 %). Los erizos desovados se encontraron desde agosto hasta noviembre 2011 (10 - 42 %) (Fig. 3 B).
Isla Lobos
El estado de reserva en las hembras se observó desde junio 2010 a junio 2011 (10 - 67 %); mientras que la fase de proliferación se registró desde diciembre 2010 hasta julio 2011, comportamiento similar al registrado en las hembras. Se encontraron organismos premaduros entre junio-septiembre 2010 (11 - 33.3 %) y mayo-octubre 2011 (10 - 57 %). Se registraron individuos maduros casi todos los meses, con máximos en agosto y noviembre 2011 (80 - 100 %). Se presentaron erizos de mar desovados en dos periodos: junio a septiembre 2010 y de mayo a octubre 2011 (Fig. 4 A). En los machos la reserva se registró durante casi un año (desde junio 2010 hasta mayo 2011). Un comportamiento similar se encontró para los organismos en estadio de proliferación (junio 2010-agosto 2011). Los machos premaduros se observaron en dos periodos: junio a octubre 2010 y junio a noviembre 2011. Se encontraron individuos maduros principalmente entre junio a noviembre 2011; mientras que los desovados estuvieron entre junio a diciembre 2011, con algunos picos en mayo, agosto y septiembre de 2011 (Fig. 4 B).
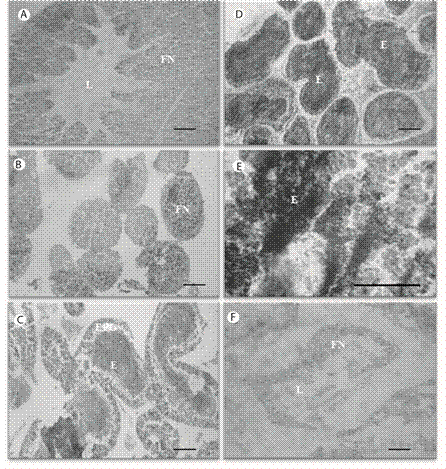
Fig. 2 Echinometra lucunter, male gonad acini showing sexual maturity stages. A. Reserve, B. Maturity onset, C. Development stage, D. Developed stage and E. Regression stage, F. Spent. Nutritive fagocytes (FN), Lumen (L), Sperm (E). Scale bar: 50 µm (A, B, C, D), 100 µm 8E, F).
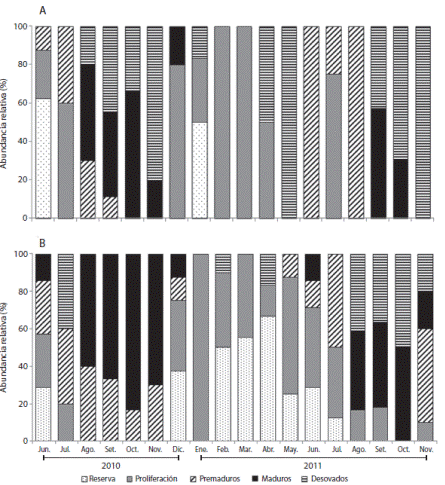
Fig. 3 Echinometra lucunter sexual maturity stages monthly oscillation at Turpialito. A. Females, B. Males
Proporción de sexos
En total se analizaron 471 erizos adultos, integrados por 282 machos (60 %) y 189 hembras (40 %). No se observaron diferencias significativas entre las localidades manteniendo una relación 1:1 entre hembras y machos (χ2 = 1.40, p > 0.05).
Índice gonadosomático (IG)
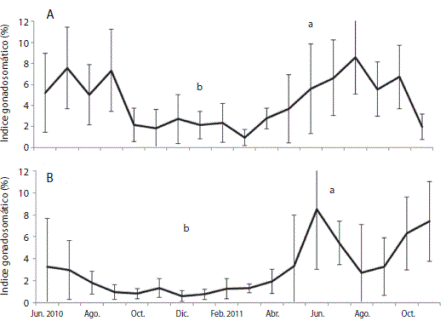
En la Ensenada de Turpialito el IG promedio fue 4.4 ± 2.58 % con valores máximos desde junio hasta septiembre 2010 (5.0 ± 2.87 % - 7.6 ± 3.61 %) y de junio a octubre 2011 (5.6 ± 4.25 % - 8.6 ± 3.50 %), con los valores mínimos entre octubre 2010 (0.9 ± 0.75 %) y mayo 2011 (3.7 ± 3.36 %), detectándose diferencias significativas entre los meses (KW: 127.15; P < 0.05) (Fig. 5). En Isla Lobos el IG promedio anual fue 3.0 ± 2.19 %, con máximos en junio (8.5 ± 5.48 %), julio (5.4 ± 1.96 %), octubre (6.3 ± 3.32 %) y noviembre 2010 (7.4 ± 3.63 %) y mínimos de septiembre 2010 a enero 2011 (0.6 ± 0.46 % - 1.3 ± 0.86 %). Se obtuvieron diferencias significativas entre los meses (KW 139,3; P < 0.05) y localidades (KW 28.12; P < 0.05) (Fig. 5 B).
Discusión
El ciclo reproductivo del erizo negro E. lucunter, tanto en el Golfo de Cariaco como en la Península de Araya, mostró períodos definidos de proliferación celular, maduración, desove y regresión gonadal. La gametogénesis se inicia entre diciembre y julio; mientras que la maduración y el desove ocurren principalmente entre agosto y noviembre. Los análisis histológicos de las gónadas evidenciaron desoves continuos en ambas localidades, con algunos periodos de recuperación intermensuales. En la ensenada de Turpialito se observaron desoves desde julio a noviembre, con un bajo porcentaje de organismos desovados entre enero-febrero y abril-mayo. En Isla Lobos, los desoves fueron frecuentes desde junio hasta diciembre y con menor frecuencia en mayo, julio y agosto.
La proporción de hembras y machos de E. lucunter no difirió de la relación 1:1 en las localidades, siendo similares a otras especies de equinoideos y del género Echinometra (Espinoza et al. 2008; Mahdavi et al., 2008; Lima et al., 2009; Mariante et al., 2009). Sin embargo, se observaron desviaciones a esta proporción en algunos meses. En el norte de Brasil, Lima et al., (2009) encontraron un patrón similar sugiriendo que los individuos se distribuyen al azar y recomienda aumentar el número de muestras mensuales. Esta desviación también se ha señalado para algunas especies de equinoideos que provienen de diferentes localidades, lo que hace suponer que las condiciones ambientales también influyen sobre la determinación de sexos (Alsaffar & Khalid, 2000), por lo que es necesario examinar estos aspectos más extensivamente.
Las variaciones mensuales en el desarrollo de los gametos posiblemente se encuentran asociadas a las condiciones ambientales (temperatura, salinidad, disponibilidad de alimentos) de cada localidad. En Isla Lobos predominan durante todo el año las corrientes marinas y oleaje, acompañado de fuertes vientos; mientras que en el Golfo de Cariaco este efecto solo se observa en los primeros meses del año, cuando los vientos alisios producen oleaje alto, repitiéndose ocasionalmente a lo largo del año. El movimiento de las masas de agua y la surgencia costera a conlleva a un incremento de los nutrientes y productividad primaria, que favorecen el crecimiento gonadal. A nivel poblacional la presencia simultánea de varios estadios de maduración, sugieren que posee una estrategia de reproducción conservadora, al almacenar energía en los meses con mayor producción primaria (periodos de surgencia costera) y desovar en los de baja disponibilidad de alimento o estratificación del agua.
En la Ensenada de Turpialito, Espinoza et al. (2008) observaron macroscópicamente que E. lucunter desova entre marzo y noviembre, encontrándose principalmente hembras maduras. En el norte de Brasil, el período reproductivo coincide con la estación seca y el verano (Lima et al., 2009; Mariante, Lemos, Eutrópio & Gomes, 2009). En las Islas Barbados, se relacionó al nivel de las mareas y oleaje (Lewis & Storey, 1984), y condiciones particulares de cada localidad (tipo de sustrato, acción de las mareas y producción de fitoplancton) (McPherson, 1969; Lessios, 1981; Cameron, 1986). Las variaciones en los patrones de maduración sexual son importantes para tomar en consideración la extracción del recurso, cumpliendo indudablemente con el criterio de preservación de la especie y su aprovechamiento para el consumo. Los resultados del IG sugieren que E. lucunter desovaría menos en el Golfo de Cariaco, siendo más aconsejable la extracción del recurso en esta localidad.
En la Ensenada de Turpialito e Isla Lobos, el comportamiento del IG coincidió en ambos sexos con el desarrollo gonadal, los cuales oscilaron sincronizadamente entre sexos, pero fue asincrónico entre las poblaciones principalmente durante la estratificación. Según McPherson (1969) las diferencias del IG entre años o áreas geográficamente separadas pueden reflejar diferencias en el crecimiento individual de las gónadas o en el grado de sincronización del desarrollo gonadal dentro de la población. Si los individuos están sincronizados, los cambios en el IG reflejan el crecimiento gonadal individual, por el contrario en poblaciones asincrónicas el IG promedio de la población dará bajos estimados de crecimiento gonadal.
Dado que el IG es una medida indirecta de la actividad reproductiva, debe ser interpretada con cautela, particularmente en los equinoideos, debido a que las gónadas además de producir los gametos también sirven para almacenar nutrientes (Walker et al., 2007; Mariante et al., 2009). Lessios (1981, 1991) propuso que el ciclo reproductivo en equinoideos responde a diversos estímulos y al parecer la sincronía es el único impulso para la periodicidad reproductiva, donde cada especie puede seguir su propio ciclo, de hecho un desove sincrónico no implica necesariamente que sea periódico. La respuesta a un estímulo ambiental puede sincronizar a todos los individuos en un área sin que el estímulo se produzca periódicamente. El único requerimiento es que el detonante ambiental ocurra con bastante frecuencia, de modo que todos los individuos que poseen gametos no tengan que mantenerlos por largos períodos de tiempo, y producir nuevos gametos después que el estímulo se haya dado.
Es probable, que las poblaciones de E. lucunter de Turpialito e Isla Lobos puedan liberar los gametos por una combinación de estímulos ambientales que les da una ventaja adaptativa al desovar antes del período de alta productividad primaria, lo cual puede ser aprovechado por las larvas para asegurar los recursos energéticos necesarios para fijarse (Mahdavi et al., 2008). Este estudio muestra que el IG representa los cambios del desarrollo gonadal en E. lucunter, la cual en el nororiente de Venezuela posee una estrategia reproductiva conservadora, acumulando reservas para el desarrollo de la fagocitos nutritivos que transfieren a los gametos hasta su maduración y desove, para reiniciar ciclos de recuperación gonadal en el período de mayor disponibilidad de alimento, ocurriendo varios desoves al año. Las características biológicas y reproductivas de los organismos del Golfo de Cariaco muestran mejores condiciones reproductivas para la explotación del recurso, especialmente durante julio y agosto cuando los organismos presentan gónadas maduras.












 uBio
uBio