El erizo negro Echinometra lucunter (Linnaeus, 1758) es una especie relativamente abundante en los ecosistemas tropicales del Atlántico. Se distribuye desde Carolina del Norte (Estados Unidos) y las Bermudas hasta Santa Catarina (Brasil), incluyendo el Caribe, América Central y toda la costa occidental de África. Habita desde la zona intermareal hasta 45m de profundidad, son comunes sobre rocas en ambientes con fuertes corrientes hasta áreas tranquilas, se sujeta firmemente con las espinas, pies ambulacrales y dientes (Hendler Miller, Pawson & Porter, 1995). Sus perforaciones son reconocidas como hábitats para una gran diversidad de organismos, muchos de ellos habitantes dependientes de dicha estructura (Schoppe & Werding, 1996). En Venezuela se ha reportado desde los estados Sucre y Nueva Esparta hasta el estado Falcón (Zoppi, 1967; Martínez, 1986; Cruz-Motta, 2007), se conocen algunos aspectos de su reproducción (Espinoza et al., 2008) y su potencial para el cultivo (Astudillo et al., 2005); sin embargo, se desconocen los componentes alimentarios que conforman su dieta.
El género Echinometra se caracteriza por tener hábitos alimenticios herbívoros generalistas que se alimentan de macrófitas, especialmente macroalgas, y ocasionalmente consumen invertebrados como esponjas, moluscos y corales. Asimismo, el alto contenido de sedimentos de carbonato de calcio del contenido estomacal (65 - 95 %) sugiere que las algas epi y endolíticas constituyen la principal fuente de alimento de estas especies (McClanahan & Muthiga, 2007).
En el sureste del Caribe y el noriente de Venezuela, la surgencia costera está asociada con la velocidad de los vientos alisios, durante los primeros meses del año. La intensidad y propagación de este fenómeno es considerable y se extiende cerca de 200 000 km2, contribuyendo a establecer una de las zonas más productivas del Mar Caribe (Penchaszadeh et al., 2000). Es posible que la variabilidad ambiental afecte la disponibilidad de alimento de muchos invertebrados marinos, incluyendo a los equinoideos. Además de ello, el desconocimiento de la dieta de E. lucunter puede representar una limitación para los programas de cultivo en el medio ambiente y en sistemas cerrados, siendo el objetivo de este trabajo caracterizar el contenido estomacal, cuantificar el índice de llenado del contenido estomacal, y sus relaciones con la disponibilidad de macroalgas y las oscilaciones asociadas a los períodos de surgencia costera y estratificación del Golfo de Cariaco, que potencialmente puedan usarse para proponer dietas para acondicionamiento de ejemplares en cautiverio.
Materiales y métodos
Recolección de ejemplares
Mensualmente entre junio 2010 y agosto 2011, se recolectaron en la Ensenada de Turpialito, Golfo de Cariaco, Venezuela (10º 27’ 30” N - 64º 01’ 52” W) aproximadamente a la misma hora en la mañana cinco ejemplares de E. lucunter con diámetro de testa promedio de 41.04 ± 6.60 mm. Para facilitar la identificación de los ítems alimenticios, se tomaron mensualmente al azar, de la zona de colecta de los erizos, las macroalgas contenidas en tres cuadrantes de 0.25 m2. Las muestras se llevaron al laboratorio en contenedores isotérmicos para su procesamiento inmediato.
Procesamiento de las macroalgas
En el laboratorio las macroalgas se identificaron y clasificaron taxonómicamente usando las claves de Taylor (1960), Chapman (1961, 1963), Joly (1967), Lemus (1979, 1984), Aponte (1985) y Wynne (2011). Una vez clasificadas se ubicaron en los grupos morfo-funcionales: filamentosas, sifonales, macrófitas corticadas, calcáreas y foliáceas (Steneck & Dethier, 1994). De cada especie vegetal, se obtuvo la masa seca (g), deshidratando a 60 ºC por 48 h, hasta masa constante con ± 0.0001 g de apreciación. Con estos datos se obtuvo la biomasa mensual de cada especie de macroalga (g m-2).
Análisis del contenido estomacal
Se determinó la masa fresca total de los erizos con una balanza analítica (0.0001 g de apreciación), se extrajo el estómago por incisión en el polo oral, se obtuvo su masa fresca y se preservó en formalina (10 %). La abundancia de cada ítem alimenticio en el estómago se analizó por el método de recuento de puntos, colocando una porción del contenido estomacal en una cápsula de Petri marcada con una rejilla cuadriculada de 25 mm2 con líneas separadas cada 5mm, en la que se contó la fracción de alimento ubicada en las intercepciones de la cuadrícula para obtener la frecuencia absoluta. La identificación de los ítems alimenticios se realizó usando un estereomicroscopio y para la clasificación de invertebrados y macroalgas se usaron claves taxonómicas. De cada estómago se analizaron cinco muestras con el fin de asegurar la consistencia de los resultados (Cobb & Lawrence, 2005).
Índice de llenado (ID): La condición fisiológica del intestino, se analizó por el índice de llenado (ID), el cual permite obtener una medida indirecta de la ingestión, según la relación ID = (masa húmeda del estómago/ masa húmeda total) × 100 (Cobb & Lawrence, 2005).
Análisis estadístico
Para el análisis estadístico los meses se clasificaron según la productividad primaria en: surgencia (< 24 °C) y estratificación (> 24 °C) (Pirela-Ochoa et al., 2007), con el propósito de comparar las diferencias mensuales entre las categorías de los tipos de alimentos y el ID usando una prueba de Kruskal-Wallis (Zar, 2010). Las diferencias significativas se establecieron con P < 0.05.
Resultados
Inventario de macroalgas y biomasa
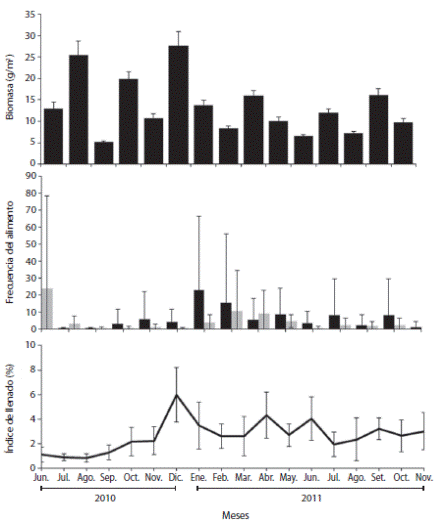
En la Ensenada de Turpialito se identificaron dos Cyanobacterias (2) y macroalgas de los Phylla: Rhodophyta (45), Heterokontophyta (11) y Chlorophyta (15). La biomasa mensual para cada especie de macroalga fue variable, con los valores más altos para Halimeda opuntia (56.5 g m-2) (Chlorophyta), Acanthophora spicifera (15.9 g.m-2) (Rhodophyta), Sargassum vulgare (15.3 g m-2) (Heterokontophyta), Centroceras clavulatum (12.3 g m-2) (Rhodophyta), Dictyota bartayresiana (8.33 g m-2) (Heterokontophyta) y Jania adhaerens (7.19 g m-2) (Rhodophyta), registrándose un total de 200.5 g m-2 (Cuadro 1) con un promedio anual de 13.4 ± 6.63 g m-2: El valor máximo de biomasa se observó en noviembre 2010 (60.4 g m-2) y el mínimo en agosto (5.15 g m-2) (Fig. 1 A).
Cuadro 1 Biomasa mensual (g m-2) de las macroalgas en la Ensenada de Turpialito
| - | - | - | 2010 | - | - | - | - | - | - | 2011 | - | - | - | - | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Especies/Meses | Jun. | Jul. | Ago. | Sep. | Oct. | Nov. | Dic. | Ene. | Feb. | Mar. | Abr. | May. | Jun. | Jul. | Ago. | Total | ||||||||||||
| Halimeda opuntia | 5.87 | 14.4 | - | 7.18 | 3.87 | 13 | 5.65 | - | 5.67 | - | - | 0.06 | 0.86 | 0.01 | - | 56.5 | ||||||||||||
| Acanthophora spicifera | - | - | - | 1.75 | - | - | 0.32 | 0.26 | 2.9 | - | 0.59 | 0.1 | 7.12 | 2.9 | 15.94 | |||||||||||||
| Sargassum vulgare | - | 4.9 | - | - | 3.07 | 2.46 | 0.96 | 2.52 | 1.18 | - | 0.07 | 0.02 | - | 0.14 | - | 15.28 | ||||||||||||
| Centroceras clavulatum | 3.81 | 1.12 | 0.4 | 0.41 | 0.06 | 2.36 | 1.74 | 1.37 | 0.62 | - | 0.08 | 1.01 | 1.06 | - | 2.05 | 12.26 | ||||||||||||
| Dictyota bartayresiana | - | 1.8 | 0.7 | - | 0.32 | 5.2 | - | - | - | 0.02 | - | - | 0.25 | 0.07 | - | 8.33 | ||||||||||||
| Jania adhaerens | 0.38 | - | - | 2.01 | 0.32 | 0.46 | - | 0.42 | - | 0.36 | - | 0.61 | 2.63 | - | 7.19 | |||||||||||||
| Padina boergesenii | 0.4 | 2.76 | 1.28 | 0.19 | 0.46 | 0.1 | - | 1.31 | - | - | 6.46 | |||||||||||||||||
| Gracilaria intermedia | 0.33 | 0.52 | 3.07 | 0.47 | - | 0.13 | 1.92 | 6.44 | ||||||||||||||||||||
| Dictyota cervicornis | 1.31 | 3.92 | 1.04 | 0.04 | - | 0.02 | 0.01 | 6.34 | ||||||||||||||||||||
| Boodlea composita | 1.23 | 0.57 | 0.34 | 0.51 | 0.32 | 1.54 | 0.39 | 0.21 | 0.69 | 0.09 | 5.89 | |||||||||||||||||
| Caulerpa racemosa | 0.57 | 1.1 | 0.24 | 0.62 | 0.38 | 0.54 | 1.21 | 0.76 | 0.36 | 5.76 | ||||||||||||||||||
| Valonia ventricosa | 0.1 | 0.04 | 0.17 | 0.23 | 0.4 | 4.02 | 0.64 | 0.19 | 5.75 | |||||||||||||||||||
| Dictyota pulchella | 2.44 | 1.62 | 0.74 | 0.38 | 0.14 | 0.18 | 5.5 | |||||||||||||||||||||
| Hypnea spinella | 0.17 | 0.61 | 0.3 | 0.06 | 0.16 | 1.01 | 0.73 | 2.36 | 5.4 | |||||||||||||||||||
| Ceramium cimbricum | 0.03 | 0.24 | 0.23 | 1.52 | 0.7 | 0.19 | 0.17 | 1.08 | 0.71 | 4.87 | ||||||||||||||||||
| Spyridia filamentosa | 0.34 | 0.14 | 1.06 | 0.36 | 2.35 | 0.43 | 4.68 | |||||||||||||||||||||
| Gelidium pusillum | 0.57 | 3.87 | 0.01 | 4.45 | ||||||||||||||||||||||||
| Herposiphonia tenella | 0.03 | 0.71 | 0.1 | 0.18 | 0.11 | 0.32 | 0.12 | 0.18 | 0.07 | 0.04 | 1.29 | 3.13 | ||||||||||||||||
| Sphacelaria tribuloides | 0.08 | 0.2 | 0.15 | 0.07 | 0.06 | 0.04 | 0.15 | 0.24 | 0.19 | 0.48 | 0.46 | 2.16 | ||||||||||||||||
| S. novae-hollandiae | 0.18 | 0.1 | 0.57 | 0.42 | 0.01 | 0.02 | 0.2 | 0.42 | 0.06 | 0.09 | 2.08 | |||||||||||||||||
| Laurencia microcladia | 0.52 | 0.32 | 0.28 | 0.36 | 0.21 | 0.15 | 1.84 | |||||||||||||||||||||
| Caulerpa sertularioides | 0.24 | 0.7 | 0.36 | 0.22 | 0.07 | 0.02 | 1.63 | |||||||||||||||||||||
| Hypnea musciformis | 0.4 | 0.64 | 0.13 | 0.16 | 0.24 | 0.02 | 1.62 | |||||||||||||||||||||
| Palisada perforata | 0.3 | 0.41 | 0.77 | 0.12 | 1.6 | |||||||||||||||||||||||
| Cladophora vagabunda | 0.13 | 0.07 | 0.23 | 0.38 | 0.81 | |||||||||||||||||||||||
| Polysiphonia subtilissima | 0.06 | 0.18 | 0.36 | 0.06 | 0.07 | 0.05 | 0.78 | |||||||||||||||||||||
| Ulva intestinalis | 0.02 | 0.1 | 0.01 | 0.18 | 0.02 | 0.19 | 0.24 | 0.01 | 0.68 | |||||||||||||||||||
| Herposiphonia bipinnata | - | - | 0.4 | 0.06 | - | 0.05 | - | - | 0.11 | - | - | 0.06 | - | - | - | 0.66 | ||||||||||||
| Bryopsis plumosa | - | 0.02 | - | - | - | - | - | - | - | 0.17 | - | 0.3 | 0.16 | - | - | 0.65 | ||||||||||||
| Ceramium flaccidum | - | - | - | 0.09 | 0.04 | - | - | 0.01 | 0.05 | - | 0.29 | - | - | 0.16 | - | 0.64 | ||||||||||||
| Gymnogongrus tenuis | - | - | - | 0.45 | - | - | - | - | 0.01 | - | 0.14 | - | - | 0.02 | 0.62 | |||||||||||||
| 2010 | 2011 | |||||||||||||||||||||||||||
| Especies/Meses | Jun. | Jul. | Ago. | Sep. | Oct. | Nov. | Dic. | Ene. | Feb. | Mar. | Abr. | May. | Jun. | Jul. | Ago. | Total | ||||||||||||
| Callithamnion sp. | 0.3 | 0.32 | 0.59 | |||||||||||||||||||||||||
| Phyllodictyon anastomosans | 0.12 | 0.09 | 0.06 | 0.29 | 0.56 | |||||||||||||||||||||||
| Polysiphonia denudata | 0 | 0.26 | 0.03 | 0.02 | 0.1 | 0.01 | 0.01 | 0.47 | ||||||||||||||||||||
| Chondria dasyphylla | 0.34 | 0.03 | 0.1 | 0.47 | ||||||||||||||||||||||||
| Chaetomorpha gracilis | 0.02 | 0.1 | 0.04 | 0.24 | 0.03 | 0.43 | ||||||||||||||||||||||
| Wrangelia argus | 0.08 | 0.17 | 0.03 | 0.07 | 0.38 | |||||||||||||||||||||||
| Hincksia mitchelliae | 0.1 | 0.07 | 0.13 | 0.06 | 0.02 | 0.38 | ||||||||||||||||||||||
| Ulva rigida | 0.02 | 0.2 | 0.05 | 0.03 | 0.12 | 0.01 | 0.38 | |||||||||||||||||||||
| Cladophora montagneana | 0.03 | 0.05 | 0.01 | 0.14 | 0.02 | 0.04 | 0.29 | |||||||||||||||||||||
| Bryocladia thyrsigera | 0.13 | 0.07 | 0.04 | 0.02 | 0.26 | |||||||||||||||||||||||
| Taenioma nanum | 0.01 | 0.01 | 0.14 | 0.05 | 0.03 | 0.24 | ||||||||||||||||||||||
| Chaetomorpha brachigona | 0.01 | 0.01 | 0.04 | 0.02 | 0.01 | 0.09 200.5 | ||||||||||||||||||||||
Análisis del contenido estomacal
Los items alimenticios se separaron en vegetales e invertebrados. Se identificaron dos especies de Cyanobacteria y 31 especies de macroalgas, distribuidas en los Phylla: Rhodophyta (16), Heterokontophyta (3) y Chlorophyta (12) (Cuadro 2). Entre los grupos morfo-funcionales, predominaron las filamentosas (18), seguidas por las sifonales (5), macrófitas corticadas (4), calcáreas (3) y foliáceas (3). La mayor frecuencia absoluta se obtuvo para las macroalgas filamentosas Sphacelaria sp. (546) y Herposiphonia sp. (441) y la foliácea Dictyota sp. (410). También se observaron restos del pasto marino Thallasia testudinum (Cuadro 3). Los invertebrados consumidos con mayor frecuencia fueron poríferos (155), moluscos bivalvos (70) y crustáceos cirrípedos (65), con tendencia a presentar mayor ocurrencia de invertebrados entre diciembre y junio (Cuadro 4).
Cuadro 2 Inventario de macroalgas de la Ensenada de Turpialito
| DIVISION CYANOBACTERIA | ||
|---|---|---|
| Oscillatoria sp. | Rivularia sp. | |
| PHYLLUM RHODOPHYTA | ||
| Acanthophora spicifera (Vahl) Børgesen | Grateloupia filicina (Lamouroux) C. Agardh | |
| Acrochaetium sp. | Gymnogongrus tenuis J. Agardh | |
| Aglaothamnion cordatum (Børgesen) Feldman-Mazoyer | Herposiphonia bipinnata Howe | |
| Amphiroa fragilissima (Linnaeus) Lamouroux | Heterosiphonia gibbesii (Harvey) Falkenberg | |
| Asparagopsis taxiformis (Delile) Trevisan | Herposiphonia tenella (C. Agardh) Ambronn | |
| Bostrychia radicans (Montagne) Montagne | Hypnea spinella (C. Agardh) Kützing | |
| Bostrychia tenella (Lamouroux) J. Agardh | Hypnea musciformis (Wulfen) Lamouroux | |
| Bryocladia thyrsigera (J. Agardh) Schmitz | Jania adhaerens Lamouroux | |
| Callithamnion sp. | Laurencia microcladia Kützing | |
| Ceramium flaccidum (Harvey ex Kützing) Ardissone | Laurencia obtusa (Hudson) Lamouroux | |
| Centroceras clavulatum Kützing, 1841 | Lithothamnion sp. | |
| Chondria dasyphylla (Woodward) C. Agardh | Murrayella periclados (C. Agardh) Schmitz | |
| Dichotomaria marginata (Ellis & Solander) Lamarck | Palisada perforata (Bory) K.W. Nam | |
| Erythrotrichia carnea (Dilwyn) J. Agardh | Polysiphonia denudata (Dillwyn) Greville ex Harvey | |
| Galaxaura rugosa (Ellis & Solander) Lamouroux | Polysiphonia subtilissima Montagne | |
| Gelidium pusillum (Stackhouse) Le Jolle | Stylonema alsidii (Zanardini) Drew | |
| Gracilaria intermedia ganesana Gurgel, Fredericq & Norris | Taenioma nanum (Kützing) Papenfuss | |
| DIVISION HETEROKONTOPHYTA | ||
| Asteronema breviarticulatum Ouriques & Bouzon | Hincksia Gray, 1864 | |
| Dictyota bartayresiana Lamouroux | Padina boergesenii Allender & Kraft | |
| Dictyota cervicornis Kützing | Sargassum vulgare C. Agardh | |
| Dictyota pulchella Hörnig & Schnetter | Sphacelaria novae-hollandiae Sonder | |
| Feldmannia sp. | Sphacelaria tribuloides Meneghini | |
| DIVISION CHLOROPHYTA | ||
| Boodlea composita (Harvey) Brand | Ectocarpus rallsiae Vickers | |
| Bryopsis plumosa | Halimeda opuntia (Linnaeus) Lamouroux | |
| Chaetomorpha aerea (Dillwyn) Kützing | Phyllodictyon anastomosans (Harvey) Kraf & Wynne | |
| Caulerpa racemosa (Forsskål) J. Agardh | Ulva fasciata Delile | |
| Caulerpa sertularioides (S.G. Gemelin) Howe | Ulva flexuosa subsp. flexuosa Wulfen | |
| Chaetomorpha antennina (Bory) Kützing | Ulva intestinalis Linnaeus | |
| Chaetomorpha brachygona Harvey | Ulva rigida C. Agardh | |
| Chaetomorpha gracilis Kützing Cladophora montagneana Kützing | Cladophora vagabunda (Linnaeus) C. Hoek | Valonia ventricosa J. Agardh |
Cuadro 3 Frecuencia de ocurrencia mensual de macroalgas e invertebrados en el estómago. Se indica el grupo morfo-funcional de las macroalgas
| Especie / Mes | - | 2010 2011 | Total | Tipo | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Jun. | Jul. | Ago. | Sep. | Oct. | Nov. | Dic. | Ene. | Feb. | Mar. | Abr. | May. | Jun. | Jul. | Ago. | |||
| Sphacelaria sp. | 53 | - | - | 7 | 68 | 14 | 129 | 116 | 28 | 30 | 33 | 36 | 32 | - | - | 546 | Filam. |
| Herposiphonia sp. | 43 | - | - | 21 | 63 | 9 | 65 | 1 | 58 | 63 | 19 | 83 | 13 | 3 | - | 441 | Filam. |
| Dictyota sp. | 70 | - | 2 | 38 | - | 10 | 66 | 197 | 4 | 20 | - | 3 | - | - | - | 410 | Foliác. |
| Gelidiu, pusillum | 10 | 1 | 2 | 29 | 29 | 11 | 96 | 37 | 14 | 22 | 11 | 96 | 1 | 2 | - | 361 | Macróf. |
| Oscillatoria sp. | 1 | - | - | - | - | 3 | 187 | 5 | 3 | 19 | 8 | 9 | 8 | - | - | 243 | Filam. |
| Jania capillacea | 17 | 1 | - | 1 | 8 | 13 | 78 | 15 | 34 | 45 | 5 | 9 | 7 | - | - | 233 | Calcár. |
| Halimeda opuntia | - | - | - | - | - | - | 56 | - | 21 | 26 | 13 | 13 | 5 | - | - | 134 | Calcár. |
| Amphiroa sp. | 22 | - | - | - | - | - | - | 84 | 2 | - | - | 2 | - | - | - | 110 | Calcár. |
| Laurencia sp. | - | - | - | - | - | 40 | - | - | - | - | - | - | - | 32 | 4 | 76 | Macróf. |
| Centroceras clavulatum | 3 | - | - | 1 | - | - | 24 | 2 | - | 39 | - | 2 | - | - | - | 71 | Filam. |
| Ulva sp. | 16 | - | - | 2 | 2 | 1 | 10 | 10 | - | 5 | 9 | 2 | 3 | - | - | 60 | Filam. |
| Cladophora sp. 1 | 7 | - | - | - | 4 | 11 | 6 | 6 | 7 | 6 | 6 | - | - | - | - | 53 | Filam. |
| Taenioma nanum | 5 | - | - | - | - | - | - | 36 | - | 4 | - | - | - | 5 | - | 50 | Filam. |
| Ceramium sp. | 1 | - | -- | - | 1 | 3 | 34 | - | - | - | 1 | 2 | - | 2 | - | 44 | Filam. |
| Acanthophora spicifera | - | - | - | - | - | - | - | 2 | - | - | - | - | - | 13 | 18 | 33 | Macróf. |
| Ulva flexuosa | - | 3 | - | 2 | 2 | 4 | 7 | - | 8 | 2 | - | - | - | - | - | 28 | Foliác. |
| Hincksia sp. | - | - | - | - | 9 | 4 | - | 4 | - | - | - | - | 2 | 7 | 1 | 27 | Filam. |
| Caulerpa sertularioides | - | - | -- | - | - | 6 | 4 | - | - | - | 6 | 9 | - | - | - | 25 | Sifon. |
| Chaetomorpha sp. | 3 | - | - | 1 | 2 | 3 | 3 | 4 | 4 | - | 1 | - | 2 | - | - | 23 | Filam. |
| Polysiphonia sp. | 5 | - | - | - | 6 | 1 | 1 | - | - | 4 | - | - | 2 | 1 | 3 | 23 | Filam.. |
| Rivularia sp. | 1 | - | - | - | - | - | - | 1 | - | - | - | - | - | 8 | 6 | 16 | Filam |
| Boodlea composite | - | - | - | 1 | - | 2 | - | - | - | 3 | 2 | 1 | - | - | - | 9 | Sifon. |
| Ceramium dawsonii | - | - | - | - | - | - | 8 | - | - | - | - | - | - | - | - | 8 | Filam. |
| Phyllodictyon anastomosans | 4 | - | - | - | - | 2 | - | 1 | - | - | - | - | - | - | - | 7 | Sifon. |
| Callithamnio sp. | - | - | - | - | - | - | - | - | - | 4 | 1 | 1 | - | - | - | 6 | Filam. |
| Thallasia testudinum | - | - | - | - | - | - | 1 | - | - | 2 | 1 | 2 | - | - | - | 6 | - |
| - | MACROALGAS | ||||||||||||||||
| Especie / Mes | 2010 ……………………………… 2011 | Total | Tipo | ||||||||||||||
| Jun. | Jul. | Ago. | Sep. | Oct. | Nov. | Dic. | Ene | Feb | Mar. | Abr. | May | Jun. | Jul. | Ago. | |||
| Gracilaria sp. | - | - | - | - | - | - | - | - | - | - | 4 | - | - | - | - | 4 | Macróf. |
| Bryopsis sp. | - | - | - | - | - | 1 | - | - | - | 1 | - | - | 0 | 2 | 0 | 4 | Sifon. |
| Caulerpa racemose | - | - | - | - | - | - | - | 3 | - | - | - | - | - | - | - | 3 | Sifon. |
| Cladophora sp. 2 | - | - | - | - | - | 2 | - | - | 1 | - | - | 1 | - | - | - | 3 | Filam. |
| Stylonema alsidii | 2 | - | - | - | - | - | - | 1 | - | - | - | - | - | - | - | 3 | Filam. |
| Aglaothamnion cordatum | - | - | - | - | - | 1 | - | - | - | - | - | - | - | - | 2 | Filam | |
| Chaertomorpha gracilis | - | - | - | - | - | - | - | 1 | - | - | - | - | - | - | - | 1 | Filam |
| Wrangelia argus | 1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 1 | Filam. |
La frecuencia de macroalfas osciló mensualmente entre 0.12 y 22.79 (6.0 ± 6.14) y de invertebrados entre 0 y 10.50 (4.2 ± 6.27). Las frecuencias mensuales para las macroalgas fueron bajos entre junio-noviembre, incrementando en diciembre y enero 2011, seguidos de un descenso hasta agosto, en tanto que los invertebrados presentaron mayores frecuencias en enero 2010 y enero 2011. Se obuvieron diferencias significativas entre el contenido vegetal y animal, registrando la mayor frecuencia de ingestión desde diciembre 2010 hasta marzo 2011; el material vegetal fue el más ingerido en todos los meses; excepto en junio-julio 2010 y febrero 2011 (Fig. 1 B), detectándose diferencias significativas en relación a las categorías alimenticias entre los períodos de surgencia costera y estratificación (KW = 6.47; p < 0.05).
Cuadro 4 Frecuencia absoluta de invertebrados en el contenido estomacal de Echinometra lucunter
| - | - | - | - | INVERTEBRADOS | - | - | - | - | - | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| - | - | - | 2010 | - | - | - | 2011 | - | - | - | - | ||||||||
| Especie / Mes | Jun. | Jul. | Ago. | Sep. | Oct. | Nov. | Dic. | Ene. | Feb. | Mar. | Abr. | May. | Jun. | Jul. | Ago. | Total | |||
| Porífera | 135 | 5 | - | 1 | - | 1 | 1 | 11 | 2 | 3 | - | - | - | - | - | 155 | |||
| Mollusca | 1 | - | - | - | 5 | - | 2 | 59 | 1 | 1 | - | - | 1 | - | - | 70 | |||
| Cirripeda | 3 | - | - | 1 | - | - | 4 | - | 34 | 10 | 2 | - | 1 | 10 | - | 65 | |||
| Briozoa | 4 | 12 | 2 | 2 | - | - | 2 | 4 | 16 | 8 | 1 | 10 | 1 | - | - | 62 | |||
| Foraminífera | - | - | - | - | - | 1 | 13 | - | 1 | 5 | 1 | - | - | 3 | - | 24 | |||
| Hydrozoa | - | - | - | - | - | - | - | - | - | - | - | 3 | - | - | - | 3 | |||
| Promedio | 23.83 | 2.83 | 0.33 | 0.67 | 0.83 | 0.33 | 3.67 | 10.50 | 9.00 | 4.50 | 0.67 | 2.17 | 1.67 | 2.17 | - | 63.17 | |||
Índice de llenado del estómago (ID)
El ID osciló entre 0.8 y 6.0% (2.6 ± 1.21 %), siendo más elevado en diciembre 2010 (6.0 ± 2.21 %), y en abril (4.3 ± 0.34%) y junio 2011 (4.0 ± 1.79 %); con valores mínimos en julio (0.8 ± 0.27 %) y agosto 2010 (0.8 ± 0.34 %). Se detectaron diferencias significativas entre los meses de muestreo (Fig. 1 C).
Discusión
De la variedad de algas identificadas en la Ensenada de Turpialito, solo la mitad de ellas se encontraron en el tracto digestivo de E. lucunter, con predominio un pequeño grupo de algas rojas filamentosas, algas pardas y cianobacterias. Entre los ítems alimenticios son frecuentes las macroalgas de hojas suculentas, y con frecuencia algas calcáreas que tienen un papel fundamental para el crecimiento aportando el carbonato de calcio para la testa y el aparato masticador. Es posible que las macroalgas que no son consumidas tengan metabolitos de composición química con baja palatabilidad. Se ha reportado que algunas elaboran sustancias alelopáticas, o forman cojinetes fuertemente adheridos al sustrato (Gelidium crinale), impidiendo que sean consumidas por los herbívoros. Por ejemplo, Ulva lactuca, Caulerpa prolifera y Cladophora sp., producen sustancias de defensa que no son palatables y a las que posiblemente es sensible E. lucunter (Erickson et al., 2006). En otras especies de erizos como Diadema antillarum consume relativamente poco a Laurencia obtusa y varias especies de Dictyota, sugiriendo que sus metabolítos secundarios actúan como mecanismos de defensa (McClanahan & Muthiga, 2007). La baja preferencia de Lytechinus variegatus en Playa Rasa (Brasil) por las algas rojas Plocamium brasiliense y D. menstrualis se debe a los metabolitos secundarios halogenados. Sin embargo, la morfología de C. racemosa, Ulva sp., Osmundaria obtusiloba y Sargassum sp. favoreció su ingestión (Ferreira, Santos de Oliveira & Crespo, 2008).
La biomasa de macroalgas osciló mensualmente en la Ensenada de Turpialito, alcanzando bajas densidades, y es posible que los erizos se vean forzados a ingerir algas coralinas incrustadas, algas desprendidas e invertebrados, como fue reportado para L. variegatus en las costas de Florida (Cobb & Lawrence, 2005) y Brasil (Ferreira et al., 2008), y Paracentrotus lividus en el Mediterráneo (Murillo-Navarro & Jiménez-Guirado, 2012). En el contenido estomacal de E. lucunter se observó una elevada frecuencia del alga calcárea articulada Jania capillacea, y aunque es conocido que la calcificación causa que los erizos eviten muchas macroalgas coralinas e incrustadas, posiblemente la consuman por su textura delgada (Boudouresque & Verlaque, 2007). En el contenido estomacal de Tripneustes ventricosus de Isla La Tortuga, Venezuela, se observaron la algas calcáreas Hydrolithom sp. y J. capillacea, sugiriendo que pueden ser importantes en el metabolismo del calcio (Barrios & Reyes, 2008). Una vez conocida la dinámica de la alimentación es recomendable, conocer los tipos de enzimas digestivas y el balance energético, para descifrar la importancia de los ítems alimenticios en el desarrollo y crecimiento de esta especie.
Los valores más altos del ID entre diciembre-febrero indican que el consumo de alimentos pudiera estas favorecido por las condiciones ambientales de disponibilidad de nutrientes con el período de surgencia costera (Lodeiros & Himmelman, 2000), coincidiendo con las mayores categorías alimenticias encontradas en los estómagos durante este período. La Ensenada de Turpialito muestra una elevada producción fitoplanctónica durante estos meses, simultáneamente con bajas temperaturas por lo que es probable que la mayor frecuencia de ítems ingeridos, se encuentre relacionado con la mayor productividad de la zona. Los índices bajos durante la estratificación permiten inferir que Turpialito se comporta como un sitio nutricionalmente de baja disponibilidad de alimentos, siendo este índice tiempo-dependiente con la ingesta de alimento (Murillo-Navarro & Jiménez-Guirado, 2012).
El erizo negro es un omnívoro oportunista, que se alimenta de T. testudinum, una amplia variedad de macroalgas e invertebrados, que lo ubica como un excelente control biológico de organismos que crecen sobre estructuras sumergidas incrementando el peso, causan pérdidas económicas de los cultivos, además de competir por el alimento de moluscos obstruyendo el flujo del agua (Lodeiros & García, 2004). E. lucunter es de hábitos alimenticios típicos de un invertebrado herbívoro, que ingiere con frecuencia poríferos y otros invertebrados, lo cual puede tener relación con la selección según su textura y palatabilidad (McClanahan & Muthiga, 2007). Es posible que esta especie tenga preferencia por algún alimento, siendo recomendable evaluar dietas o debido a limitaciones en la locomoción ingiere el que esté al alcance. En un ámbito más amplio, sería interesante evaluar las preferencias alimentarias, tomando como punto de partida las poblaciones del Golfo de Cariaco donde hay diferentes ambientes que contribuirían a comprender su biología, desarrollar protocolos de acondicionamiento para la reproducción y el engorde, dada la importancia adquirida del consumo fresco de las gónadas y su potencial para la acuicultura.












 uBio
uBio