La distribución espacial y la abundancia de los equinodermos están principalmente definidas por la influencia de factores físico-químicos y biológicos que operan durante cada estadio de su ciclo vital (Jones & Andrew, 1992; Levin, 2000), así como por las interacciones inter e intraespecíficas en los ecosistemas que habitan (Barry & Dayton, 1991). Existe una gran diversidad de factores y procesos que juegan un papel crucial en la dinámica y estructura de sus poblaciones, entre estos factores la depredación (Tegner & Dayton, 1981; Sala, 1997), el asentamiento y el reclutamiento son considerados como los de mayor relevancia y los más estudiados (Young & Chia, 1982; Ebert, 1983; Hereu, 2004). Sin embargo, otros factores como la disponibilidad de recursos tróficos (Menge, 1992), los factores ambientales como la temperatura, salinidad o el hidrodinamismo (Drouin, Himmelman & Béland, 1985; Tyler, Young & Clarke, 2000), las relaciones de competencia inter e intraespecífica (Hagen & Mann, 1992) y las enfermedades (Hagen, 1999) parecen ser también muy relevantes en la conformación de los ensambles de equinodermos.
La complejidad y heterogeneidad espacial del hábitat juegan un papel muy importante en la estructuración de las comunidades bentónicas (Andrew, 1993; Benedetti-Cecchi & Cinelli, 1997; Underwood, 2000; Freeman & Rogers, 2003; Kelaher, 2003; Chapman & Underwood, 2008) ya que, entre otras características, promueven la diversidad y coexistencia entre las especies (Bell, McCoy & Mushinsky, 1991; Kolasa & Pickett, 1991; Attrill, Strong & Rowden, 2000; Downes, Lake, Schreiber & Glaister, 1998, 2000). A pesar de esto, el estudio de la influencia de la estructura física del hábitat en la estructura de las comunidades ha recibido menos atención que otros factores como la competencia o la depredación (Mc Coy & Bell, 1991). Muchos trabajos realizados sobre equinodermos en el Caribe cubren sólo inventarios faunísticos, dejando un vacío de información en lo que respecta a su estructura comunitaria en los diferentes ambientes, sin embargo, algunos autores han enfocado sus trabajos al estudio de patrones de distribución de equinodermos con relación al ambiente (Devaney, 1974; Lewis & Bray, 1983; Hendler & Pawson, 2000; CelayaHernández, Solís-Marín, Laguarda-Figueras, Durán-González & Ruiz Rodríguez, 2008; Hernández-Ávila, 2010).
Además de los trabajos enfocados en inventarios y taxonomía, las investigaciones en equinodermos en venezuela han abordado interacciones tróficas (Bitter, Molinet & Penchaszadeh, 1980; Bitter & Penchaszadeh, 1983; Bitter 1984, 1999); ecología poblacional (Pompa, Prieto & Manrique 1989; Penchaszadeh & Molinet 1994; Noriega, 1998; Tagliafico, Rangel & Rago, 2011), reproducción (Espinoza, Reyes, Himmelman & Lodeiros, 2008; Reyes, 2014), y estudios en estructura comunitaria donde se considera este filo (Cruz-Motta, 2007; Hernández-Ávila 2010; Hernández-Ávila, Tagliafico & Rago, 2013; Fernández, Jiménez & Allen 2014). Una compilación de estos trabajos se presenta en Lodeiros et al. (2013). En particular en el Golfo de Cariaco se presentan amenazas relacionadas con el crecimiento poblacional y el desarrollo urbano, pero los estudios de línea base sobre equinodermos son escasos y limitados en general a la identificación de especies (ver revisión en Gómez-Maduro & Hernández-Ávila, 2011).
Para comprender y analizar la distribución de los organismos en el ecosistema es necesario el conocimiento de la presencia, abundancia y distribución espacial de las poblaciones, así de la comformaciôn de los ensambles (Andrew & Mapstone, 1987; Turner, 1989; Underwood, 2000). Por ello se plantea la realización de estudios más detallados sobre la distribución de las comunidades de equinodermos, como parte importante de la fauna bentónica local. El presente estudio tiene como objetivo describir los cambios en la estructura de las comunidades de equinodermos en diferentes ambientes costeros, utilizando como caso de estudio la bahía de Tunantal, Golfo de Cariaco, venezuela.
Materiales y métodos
Área de Estudio
La bahía de Tunantal se encuentra ubicada en la parte central del Golfo de Cariaco, venezuela, entre los 10° 26’ 34’’ N y 63° 59’ 53’’ W, presentando una profundidad inferior a 20 m y es considerada una zona relativamente desprotegida de los vientos alisios (Gutiérrez, 1999). Sin embargo esta se encuentra protegida del oleaje por ser una bahía ubicada dentro un golfo. Hacia el extremo oeste de la bahía se encuentran algunos manglares y hacia la parte central de esta se observa la desembocadura del Río Tunantal. Presenta variedad de ambientes marinos entre los que se pueden mencionar praderas de Thalassia testudinum, pequeños parches de corales y zonas de sustrato rocoso y arenoso-limoso de influencia marina, así como ambientes arenosos bajo descargas estacionales de ríos (obs. pers.).
Trabajo de Campo
Las colectas de campo comprendieron dos periodos, el primero se ejecutó durante septiembre - octubre de 2010, y el segundo durante febrero - abril de 2011. Estos periodos corresponden a las épocas de lluvias con baja intensidad de viento y al periodo seco con influencia de surgencia costera, respectivamente. De acuerdo a las características ambientales del entorno se establecieron cuatro estaciones ubicadas a lo largo de la línea de costa, y tipificados en cinco tipos de ambientes: coralino, sustrato rocoso, praderas de T. testudinum, fondo arenoso y desembocadura del río de Tunantal, a profundidades comprendidas entre 0 a 5 m. En cada estación fueron muestreados al azar al menos siete cuadrantes de 1 m2 (N = 37), y fueron colectados los equinodermos encontrados para su posterior identificación en el laboratorio, excepto aquellas especies grandes que pudieran ser identificadas en el campo. Además se utilizó un nucleador de 8 pulgadas de diámetro para la recolección de especies infaunales. Adicionalmente fueron realizados muestreos cualitativos de buceo libre en cada uno de los ambientes (18 muestreos en grupos de 2 - 3 personas), con el fin de poder capturar especies que pudieran no ser colectadas en los muestreos donde se emplearon los cuadrantes. Una vez obtenidos los ejemplares, estos fueron narcotizados con una pequeña cantidad de “mentol cristal”, para lograr que éstos se relajaran y expusieran algunas estructuras importantes para la identificación, además para colocarlos en una posición que permitiera apreciar mejor las proporciones corporales. Seguidamente fueron fijados en alcohol etílico al 70 %. Una vez en el laboratorio cada uno de los ejemplares fueron identificados a nivel de especie (Gómez-Maduro & Hernández-Ávila, 2011).
Análisis de Datos
A cada cuadrante se determinó la densidad (ind m-2), la riqueza o número de especies en cada colecta (S), la diversidad de Shannon (H) y equidad de Pielou (J) descritos en Ramírez (1999). Se calculó la diversidad general para el área basada en la curva de estimación del número de especie con respecto al número de individuos colectados, con la utilización del programa ESTIMATE, permutando 300 veces el orden de las colectas. Con la finalidad de comparar los ambientes, los descriptores univariados anteriormente señalados fueron analizados a través de una prueba t-student. Con el propósito de detectar si existen diferencias entre las comunidades de equinodermos presentes en los diferentes ambientes muestreados en cuanto a la magnitud de las abundancias de cada especie en los mismos se determinó el índice de similitud de Bray-Curtis entre las réplicas de cada ambiente, así como el índice de Sorensen (descritos en Ramírez, 1999) para estimar diferencias cualitativas entre hábitats. Para comprobar si existen diferencias en la composición de las comunidades entre ambientes diferentes, se empleó la prueba multivariada no paramétrica ANOSIM (Clarke, 1988) utilizando 9999 permutaciones. Adicionalmente se realizó un análisis SIMPER para determinar las especies que contribuyen a las diferencias entre los ensambles.
Resultados
La ocurrencia de equinodermos en la bahía de Tunantal fue de 72.72 % en 55 colectas realizadas con el empleo de cuadrantes y buceos cualitativos que incluyeron todos los ambientes y los dos periodos de muestreos. Los ambientes coralinos, compuestos principalmente por Millepora sp., y en menor proporción por otras especies de corales, presentaron un 100 % de ocurrencia de equinodermos, así como los ambientes rocosos. Sin embargo las praderas de T. testudinum presentaron una ocurrencia de equinodermos relativamente baja (21.42 %) tomando en cuenta todas las praderas muestreadas. En los ambientes arenosos se obtuvo una ocurrencia un poco mayor (42.85 %), pero los ejemplares allí colectados pertenecieron a una sola especie. La riqueza general fue de 40 ± 3.02 especies, abarcando todas las zonas de muestreo, la curva de diversidad acumulada denota una estabilización de la tasa de especies encontradas en relación al tamaño muestra, por lo que se considera que la diversidad obtenida es un reflejo de la diversidad del área (Fig. 1).
En los ambientes coralinos se obtuvo un total de 30 especies (Cuadro 1), considerando las colectas realizadas con cuadrantes y los buceos cualitativos. Las especies más abundantes fueron Echinometra viridis, Ophiactis savignyi y Ophiothrix angulata. En los sustratos rocosos se colectaron un total de 21 especies de equinodermos, donde dominaron Ophiocoma echinata, Echinometra lucunter, Ophionereis reticulata y E. viridis. Contrastando con estos resultados, en los sustratos arenosos sólo se obtuvo una especie, Leodia sexiesperforata. En las praderas de T. testudinum se obtuvo 10 especies, pero ninguna alcanzó densidades mayores a 1 ind m-2. En la desembocadura del Río Tunantal, con el empleo del nucleador, solo se colectó un ejemplar de Ophiophragmus sp.
Cuadro 1 Número total de ejemplares en los ambientes muestreados durante el presente estudio
| Especies | M(17) | R(11) | T(17) | A(8) | DR(+10) |
|---|---|---|---|---|---|
| Asteroidea Oreaster reticulatus | - | - | 1 | - | - |
| Ophiuroidea Ophiothrix angulata | 183 | 41 | - | - | - |
| Ophiactis savignyi | 160 | 42 | - | - | - |
| Ophiocomella ophiactoides | 73 | 43 | - | - | - |
| Ophiocoma echinata | 1 | 110 | - | - | - |
| Ophionereis reticulata | 40 | 70 | - | - | - |
| Ophioderma appressa | 43 | 28 | - | - | - |
| Ophioderma cinerea | 12 | 2 | - | - | - |
| Ophionereis squamulosa | 5 | 9 | - | - | - |
| Ophiolepis paucispina | 3 | 10 | - | - | - |
| Amphiura stimpsoni | 12 | - | - | - | - |
| Ophiocoma pumila | - | 8 | - | - | - |
| Ophioderma rubicunda | 5 | 1 | - | -- | - |
| Amphipholis squamata | 2 | 3 | 1 | - | - |
| Ophiocoma wendtii | - | 3 | - | - | -- |
| Ophioderma brevispina | 1 | - | 1 | - | - |
| Ophionereis olivacea | - | 2 | - | - | - |
| Amphipholis januarii | 2 | - | - | - | - |
| Ophiocnida scabriuscula | 1 | - | 1 | - | - |
| Ophioderma brevicauda | - | - | 1 | - | - |
| Ophiophragmus sp. | - | - | - | - | 1 |
| Ophiactis algicola | 1 | - | - | - | - |
| Echinoidea Echinometra viridis | 237 | 44 | - | - | - |
| Echinometra lucunter | 8 | 82 | - | - | - |
| Lytechinus variegatus | 42 | 25 | 1 | - | - |
| Arbacia punctulata | 14 | - | 1 | - | - |
| Leodia sexiesperforata | - | - | - | 8 | - |
| Eucidaris tribuloides | 2 | 1 | - | - | - |
| Clypeaster sp. | - | - | 2 | - | - |
| Tripneustes ventricosus | - | 1 | - | - | - |
| Diadema antillarum | 1 | - | - | - | - |
| Holothuroidea Holothuria (Platyperona) parvula | 41 | - | - | - | -- |
| Pseudothyone belli | 5 | 2 | - | - | - |
| Holothuria (Halodeima) grisea | 2 | - | 1 | - | - |
| Isostichopus badionotus | 3 | - | - | - | - |
| Holothuria (Thymiosycia) arenicola | 2 | - | - | - | - |
| Holothuria (cystipus) cubana | 2 | - | - | - | - |
| Holothuria (Selenkothuria) glaberrima | 1 | - | - | - | - |
| Holothuria (Semperothuria) surinamensis | 1 | - | - | - | - |
| Chiridota rotifera | 1 | - | - | - |
M. Millepora sp. (corales); R. Rocoso; T. Thalassia testudinum, A. arena; DR. Desembocadura del Río Tunantal. Entre paréntesis número de colectas.
M. Millepora sp. (corals) ; R. Rocky subtidal shore; T. Thalassia testudinum; A. sandy bottom; DR. mouth of Tunantal river. In brackets numbers of collections.
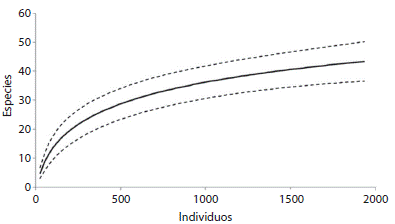
Fig. 1 General accumulative curve of species during sampling collection. Dashed lines represent 95 % confidence intervals.
Se encontraron diferencias estadísticas (Cuadro 2) entre ambientes en los indicadores univariados estudiados. En general los sustratos rocosos y coralinos mostraron mayor riqueza, abundancia, diversidad y equidad que el resto de los ambientes (Fig. 2). Incluso algunas comparaciones, especialmente con ambientes de arena y en la desembocadura del río, estuvieron limitadas por la nulidad de las estimaciones. Sin embargo, estos resultados no se atribuyen a insuficiencia en los muestreos sino a las características propias de los ambientes estudiados. Adicionalmente se destaca que la riqueza de equinodermos fue mayor en parches de Thalassia (0.21 ± 0.43 especies por muestreo) que en los ambientes de arena y desembocadura del río, aunque es relativamente diferente a otros parches de Thalassia estudiados en la región.
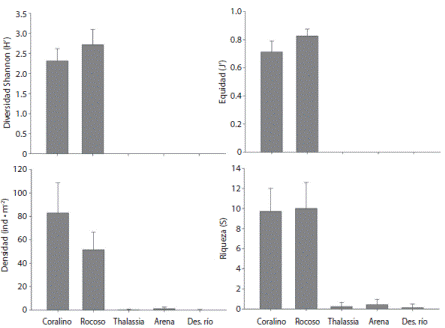
Fig. 2 Promedios y desviación estándar de los indicadores comunitarios entre los hábitats en la bahía de Tunantal. Fig. 2. Mean and standard deviation of community index between habitats in Tunantal bay.
En lo que se refiere a las características de los ensambles de equinodermos en corales y rocas, de las 27 especies de equinodermos colectadas en los dos ambientes, 13 fueron comunes para ambos ambientes, siete exclusivas de sustratos coralinos y siete sólo aparecieron en sustratos rocosos. El ambiente coralino presentó además mayor abundancia de equinodermos (83.00 ± 9.66 ind m-2), mientras que el sustrato rocoso exhibió una abundancia promedio de equinodermos de 50.55 ± 5.08 ind m-2 (t = 7.091, p = 0.0001).
A pesar de esto, los valores de diversidad de Shannon más altos se presentaron en el ambiente rocoso, con un promedio de 2.71 ± 0.37, pero con menor riqueza (9.66 ± 0.91) y aunque los ambientes coralinos presentaron mayor riqueza de especies (10.57 ± 0.84), la diversidad fue menor (2.31 ± 0.31). Sin embargo estos valores no mostraron diferencias significativas, respectivamente (t = 0.691, p = 0.251 y t = 0.733, p = 0.238). Tal como sucedió con la diversidad, la equidad fue menor en corales, exhibiendo un promedio de 0.71 ± 0.08 debido a que especies como E. viridis, O. savignyi y O. angulata, presentaron altas abundancias, dominando entre las demás especies y reduciendo así la equidad y, por ende, la diversidad. En los cascajos la equidad fue levemente mayor, con un promedio de 0.83 ± 0.05 pero las diferencias no son significativas (t = 2.295, p = 0.131).
Cuadro 2 Valores de la prueba t y valor p (error tipo I) (sección superior e inferior de cada matriz respectivamente), para las comparaciones entre ambientes de cada descriptor comunitario
| - | - | Diversidad | - | - | |
|---|---|---|---|---|---|
| Coral | Coral | Rocoso | Thalassia | Arena | Des. Rio |
| - | 0.691 | 18.246 | 14.319 | 18.246 | |
| Rocoso | 0.251 | - | 13.486 | 11.619 | 13.486 |
| Thalassia | < 0.0001 | < 0.0001 | - | 1.401 | * |
| Arena | < 0.0001 | < 0.0001 | 0.105 | - | 1.401 |
| Des. Rio | < 0.0001 | < 0.0001 | * | 0.105 | |
| - | - | Riqueza | - | - | - |
| Coral | Coral | Rocas | Thalassia | Arena | Des. Rio |
| - | 0.733 | 12.201 | 12.067 | 12.456 | |
| Rocoso | 0.238 | - | 10.268 | 10.122 | 10.488 |
| Thalassia | < 0.0001 | < 0.0001 | - | 1.808 | 1.166 |
| Arena | < 0.0001 | < 0.0001 | 0.047 | - | 5.363 |
| Des. Rio | < 0.0001 | < 0.0001 | 0.128 | 0.000 | |
| - | - | Densidad | - | - | - |
| Coral | Coral | Rocoso | Thalassia | Arena | Des. Rio |
| - | 7.091 | 19.560 | 19.203 | 19.601 | |
| Rocoso | 0.0001 | - | 28.796 | 11.619 | 13.486 |
| Thalassia | < 0.0001 | < 0.0001 | - | 1.335 | 1.166 |
| Arena | < 0.0001 | < 0.0001 | 0.115 | - | 1.576 |
| Des. Rio | < 0.0001 | < 0.0001 | 0.128 | 0.083 | |
| - | - | Equidad | - | - | - |
| Coral | Coral | Rocoso | Thalassia | Arena | Des. Rio |
| - | 2.295 | 22.381 | 22.381 | 22.381 | |
| Rocoso | 0.131 | - | 21.134 | 21.134 | 21.134 |
| Thalassia | 0.0142 | < 0.0001 | - | * | * |
| Arena | < 0.0001 | < 0.0001 | * | - | * |
| Des. Rio | < 0.0001 | < 0.0001 | * | * | - |
*Prueba t nula.
La estructura de los ensambles de equinodermos entre ambientes coralinos y rocosos mostró diferencias significativas en base al índice de similitud de Bray-Curtis (ANOSIM R = 0.846, gl = 1, p = 0.0001). El porcentaje de similitud de Bray-Curtis obtenido entre los ambientes coralinos y cascajos, presentó un valor relativamente bajo entre los ambientes (27.25 ± 1.55 %), lo cual se debe a las especies comunes entre ambos ambientes. El análisis SIMPER indica que nueve especies acumulan el 90 % de la contribución a las diferencias entre los ensambles. Entre estas se encuentran E. viridis, O. savignyi, y O. angulata, las cuales presentaron densidades mucho mayores en ambientes coralinos (27.71 ± 7.63, 21.00 ± 4.50 y 17.57 ± 2.87 ind m-2 respectivamente) que en ambientes rocosos (< 5 ind m-2 en todos casos). Adicionalmente, especies abundantes en ambientes rocosos como O. echinata y E. lucunter (13.38 ± 2.02, 8.88 ± 1.67 ind.m-2 respectivamente) estuvieron casi ausentes en los muestreos de ambientes coralinos. Completan este grupo O. reticulata, O. ophiactoides, O. appressa y L. variegatus con variaciones menores (Fig. 3).
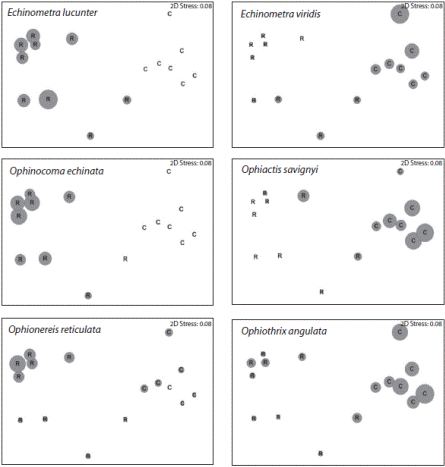
Fig. 3 MDS based on the Bray-Curtis index between echinoderm assemblages in rocky shores (R) and corals (c). The size of the bubble represents the relative abundance of a particular species between the habitats.
Adicionalmente, los porcentajes del índice de similitud de Bray-Curtis dentro de cada ambiente fueron mayores, en los ambientes coralinos 61.39 ± 2.39 % y en ambientes rocosos 51.35 ± 2.30 %, estos resultados reflejan la variabilidad de los ensambles dentro de cada ambiente. A pesar que los ambientes presentan mayor similitud dentro de sí mismos en cuanto a la estructura de los ensambles, se presenta una variación relativamente alta a escala espacial pequeña dentro de cada ambiente.
En cuanto al coeficiente de comunidad de Sorensen, se observó mayor afinidad entre sustrato coralino y rocoso (58.33 ± 1.05 %), resultado de la cantidad de especies comunes entre estos dos ambientes, a pesar que sus abundancias difieran considerablemente según el sustrato (lo cual no está reflejado en el índice). Sin embargo, al igual que lo detectado con el índice de Bray-Curtis, las diferencias entre los ensambles son significativas (ANOSIM R = 0.703, gl = 1, p = 0.0001). Así mismo, se presentó una mayor afinidad del índice de Sorensen dentro de cada ambiente, en sustrato rocoso se observó el mayor porcentaje con un valor de 71.03 ± 1.37 % y en menor grado dentro del ambiente coralino (68.46 ± 1.56 %). Lo anterior sugiere que, aunque existe cierta variabilidad interna en composición de especies, los cambios a escala pequeña dentro de cada ambiente se deben principalmente a cambios en la abundancia de las especies entre las muestras.
Discusión
La composición de equinodermos de la bahía de Tunantal y sus adyacencias presenta diferencias con respecto a otras localidades de venezuela y del Caribe. A pesar que se encontraron altas abundancias y ocurrencias de especies que son comunes en otras zonas, tales como: E. viridis, O. angulata, O. savignyi, O. echinata, O. ophiactoides, E. lucunter y L. variegatus (Zoppi, 1967; Hendler, Miller, Pawson & Kier, 1995; Serafy, 1979; Hernández-Ávila, 2010). Así mismo, se notó la ausencia o poca frecuencia de otras especies del Phyllum que son señaladas como comunes para la región oriental del país y para la mayor parte del Caribe. Sin embargo, el área de muestreo contemplado sólo incluye una pequeña zona del Golfo de Cariaco y el método de muestreo sólo permite abarcar zonas someras, y algunas de las especies de equinodermos reportadas tanto a nivel regional, nacional y del Caribe se encuentran preferiblemente en aguas más profundas y en zonas con mayor complejidad ambiental (Zoppi, 1967, Hernández-Ávila, 2010, Lodeiros et al., 2013). Aun cuando la diversidad local se encuentra bien representada, a escala regional pueden presentarse variaciones importantes.
La estimación de la diversidad general en la zona basada en la curva de estimación del número de especies con respecto al número de individuos colectados mostró una aproximación a la asíntota, lo que sugiere que con el aumento en el número de colectas, la incorporación de nuevas especies se reduce. Sin embargo, hubo gran cantidad de colectas realizadas en sustratos arenosos, praderas de T. testudinum y desembocadura del Río Tunantal en las que no se obtuvieron ejemplares.
Se señala una clara diferencia en cuanto a las especies colectadas en praderas de T. testudinum según lo obtenido por Hernández-Ávila (2010), quien consiguió un valor asintótico de diversidad general para las praderas de Thalassia en la Isla de Cubagua, venezuela, de 23.1. En el presente trabajo solo fueron encontradas 10 especies en un total de 18 colectas, 14 cuadrantes y cuatro buceos cualitativos donde fueron colectadas la mayoría de las especies con frecuencias y abundancias muy bajas. Esta notable diferencia en cuanto a la riqueza y densidades de las especies dentro de este tipo de ambiente entre la localidad de Tunantal y la Isla de Cubagua, se pudiera deber a que las praderas de fanerógamas de esta isla presentan una heterogeneidad ambiental más compleja que las del presente estudio ya que éstas no forman una pradera uniforme sino que se incorporan cascajos, rocas, corales, esponjas, agregaciones del alga calcárea Halimeda y del bivalvo Arca zebra, y espacios arenosos, lo que proporciona hábitats adicionales donde pueden encontrarse no solo especies que se asocien a hojas y rizomas de Thalassia (Hernández-Ávila, 2010). Mientras que en Tunantal el parche de Thalassia es continuo y desprovisto casi en su totalidad de rocas, agregaciones de algas o invertebrados sésiles.
En cuanto a la baja ocurrencia de equinodermos en la desembocadura del río se puede inferir que ésta se debe a los cambios bruscos de salinidad que ocurre en esta zona. Una de las características relevantes de este Phyllum es que son exclusivamente marinos y, excepcionalmente, viven en las desembocaduras de algunos estuarios; la invasión del medio dulceacuícola ha sido restringida por su intercambio gaseoso a nivel epidérmico y por la ausencia de estructuras excretoras y osmoreguladoras (Gaitán-Espitia, 2008). Esta condición podría estar limitando su distribución en estas zonas de descarga de agua dulce. Además, se constató que este ambiente solo presentó sustratos arenosos o areno-fangoso, lo cual pudiera limitar el desarrollo comunidades de equinodermos diversas y abundantes, especialmente de especies epifaunales. En referencia a los sustratos arenosos, solo se colectó L. sexiesperforata, la cual es característica de estos ambientes debido a sus hábitos excavadores. Telford y Mooi (1986) sugirieren que esta especie se restringe exclusivamente a sedimentos biogénicos carbonatados. Así mismo, se ha señalado que esta especie puede incrementar sus densidades a medida que se encuentran más alejadas de zonas arrecifales donde habitan peces que puedan depredarlas (Frazer, Lindberg & Stanton, 1991)
Los dos tipos de sustratos en los que se encontró mayor heterogeneidad de los valores de los índices evaluados en este estudio, sustratos rocosos y corales dominados por Millepora sp., no presentaron diferencias significativas en cuanto a la diversidad de Shannon, equidad de Pielou y riqueza, pero sí en las abundancias totales. Así tenemos que la fauna de equinodermos asociada a sustrato coralino exhibió mayor abundancia que en sustratos rocosos. Estos resultados se asemejan a los obtenidos por Lewis & Bray (1983) en Barbados, consiguiendo que la mayor densidad de ofiuros en ambientes coralinos se debe a sus características crípticas, por lo que estos ambientes bridan un hábitat ideal para las especies. Así mismo, Pompa et al. (1989) comentan que la heterogeneidad morfológica del sustrato caracterizado por la presencia de rocas de diferentes tamaños y especies de corales, tales como Millepora alcicornis, Porites porites y Diploria strigosa brindan a los erizos mayor superficie de fijación.
La mayor diversidad encontrada en ambientes rocosos y coralinos en comparación a los otros ambientes evaluados, se dan en función de las diferencias en las heterogeneidades topográficas de cada hábitat. Similar a lo encontrado en este estudio, Bolaños, Bourg, Gómez y Alvarado (2005) en su evaluación de la abundancia de equinodermos en una laguna arrecifal en Costa Rica, encontraron que los valores más altos del índice de diversidad se presentaron en las estaciones constituidas por sustratos coralinos, los cuales obtuvieron valores de equidad mayores. Adicionalmente estos autores reportaron que los ambientes de sustratos arenosos y pastos marinos presentaron muy baja abundancia y diversidad de equinodermos, así como se señala en este trabajo; igualmente encontraron diferencias significativas en cuanto a la diversidad y número de individuos por especie entre sustratos.
Coincidiendo con las especies más abundantes reportadas por Bolaños et al. (2005) se nombran a O. echinata, O. appressa, E. lucunter y E. viridis en ambientes de corales y roca coralina. Así mismo, Hendler y Pawson (2000) señalan como comunes a estas especies, y adicionalmente a O. angulata, O. reticulata y O. savignyi para ambientes coralinos en Belice. Estas especies también son categorizadas como abundantes y comunes por otros autores para el resto del Caribe (Hendler et al., 1995; Alvarado, Solís-Marín, & Ahearn, 2008; GaitánEspitia, 2008).
Un componente importante que pudiera explicar la diferencia en diversidad y composición de los ensambles entre los diferentes ambientes, es la diferencia en heterogeneidad del sustrato. De acuerdo con Gladstone (2007) existe una relación directa entre la riqueza de especies y la heterogeneidad ambiental. Adicionalmente la complejidad estructural determina la percepción y comportamiento de los organismos bentónicos, que a su vez influye en la dinámica de las poblaciones y la estructura comunitaria del ecosistema (Kostylev, Courtney, Robert & Todd, 2003). Aunado a esto, las interacciones entre las especies también se ven influenciadas por la mayor heterogeneidad ambiental, un caso es que en los ambientes más heterogéneos modula las relaciones competitivas, así como aquellas de predador - presa favoreciendo la diversidad en ambos casos. A diferencia de un hábitat más simple donde se podría dar lugar la dominancia de una especie y/o eliminación de otras, de esta manera ocurre una disminución de la diversidad general (Peterson, Allen & Holling, 1998.). Sin embargo, la ocurrencia de hábitats con distintos grados de heterogeneidad en un área pequeña como la bahía de Tunantal, promueve cambios en composición de especie de los ensambles lo cual favorece la diversidad general.












 uBio
uBio 

