Toxopneustes roseus (A. Agassiz, 1863) es un erizo de mar que se distribuye ampliamente a lo largo de la costa oriental del Pacífico, desde Baja California, México, hasta el norte de Perú, incluyendo las Islas Galápagos, Ecuador (Solís-Marín, Reyes-Bonilla, Herrero-Perezrul, Arizpe-Covarrubias & Laguarda-Figueras, 1997; James, 2000; Lawrence & Sonnenholzner, 2004; Alvarado, Solís-Marín & Ahearn, 2010). Esta especie es un habitante común desde la zona intermareal hasta aproximadamente 60 m de profundidad sobre sustrato rocoso, asociado a estructuras de coral, algas coralinas no geniculadas (rodolitos) y/o a parches de arena (James, 1988; Zamorano & Leyte-Morales, 2005). Los individuos de T. roseus suelen encontrarse solitarios, aunque también es común observar agregaciones de hasta varias decenas (James, 2000).
Una característica de esta especie es que tiene el comportamiento de cubrirse con fragmentos de rodolitos, coral, conchas y algas foliosas; lo cual aparentemente les proporciona camuflaje, aunque algunos autores proponen varias teorías al respecto, sugiriendo que esta conducta ocurre como respuesta a algún estrés ambiental (James, 1998, 2000; Richner & Milinski, 2000), protección contra factores físicos como la luz intensa (Verling, Crook & Barnes, 2002; Dumont, Drolet, Deschênes & Himmelman, 2007) y la temperatura (Verling et al., 2002), para aumentar la estabilidad durante movimiento intenso de agua, sirviendo como lastre (Dumont et al., 2007; Amato et al., 2008), o como almacenamiento de alimento (James, 2000; Tainá de Souza & De Medeiros, 2007).
Poco se sabe sobre los hábitos alimenticios de T. roseus, pero se ha reportado que se alimenta de la corteza de rodolitos y de coral muerto (James, 1998, 2000), esta actividad, a su vez beneficia a los rodolitos, transportándolos hacia otras zonas e influyendo en su distribución; aunque el pastoreo de T. roseus también puede reducir su biomasa y aumentar la producción de sedimentos de carbonato. El desplazamiento, comportamiento de cubrirse y la alimentación de T. roseus puede tener un efecto importante sobre la distribución y abundancia de las algas en mantos de rodolitos, lo cual puede constituir una de las causas de bioturbación sobre estas comunidades (James, 2000) afectando a la comunidad bentónica en general.
A pesar de su importancia ecológica, aun son escasos los estudios que describan la estructura y dinámica poblacional de esta especie (James, 2000; Edgar, Banks, Fariña & Martínez, 2004; González-Medina, Holguín-Quiñones & De la Cruz-Agüero, 2006; Cohen-Rengifo, 2008; Zamorano & LeyteMorales, 2009; Ramírez-Ortíz, 2010), además de los pocos estudios que se han enfocado al conocimiento taxonómico y sistemático (Caso, 1961, 1976, 1978; Solís-Marín et al., 1997).
Con la finalidad de incrementar el conocimiento del erizo de mar T. roseus, el objetivo de este estudio fue estimar y comparar su densidad poblacional, patrón de distribución espacial y mortalidad natural en tres localidades de la costa de Oaxaca, México. Adicionalmente se evaluó la relación de la densidad poblacional con las variables ambientales temperatura, salinidad, pH, precipitación pluvial e irradianza para cada localidad.
Materiales y métodos
Descripción de los sitios de muestreo
Una vez por mes se realizaron muestreos entre octubre 2009 y septiembre 2011 en tres localidades de la costa de Oaxaca, México, utilizando buceo con equipo SCUBA. Las localidades estudiadas fueron: Estacahuite (15° 40’ 14.88” N - 96° 28’ 0.96” W), la cual es una bahía semiprotegida con moderada energía de oleaje. La profundidad varía de 0.5 a 12 m y existe un área arrecifal de aproximadamente 7 300 m2 (LópezLópez, 2011). El fondo es arenoso con crestas rocosas asociadas a parches de coral y rodolitos (Reyes-Bonilla & Leyte-Morales, 1998).
Dos Hermanas (15° 42’ 29” N - 96° 12’ 610” W), es una de las localidades con un área arrecifal más extensa (~ 10 ha) de la costa de Oaxaca, con una profundidad promedio de 14 m (Leyte-Morales, 2001). A partir de los 4 m de profundidad inicia una zona de colonias de coral dispersas mezcladas con cantos rodados, restos de coral muerto desprendido y rodolitos. Esta localidad no se encuentra influenciada por escurrimientos importantes de agua dulce.
Isla Cacaluta (15° 43’ 16.32” N - 96° 10’ 0.48” W), es una isla en la Bahía de Cacaluta, con una zona arrecifal de aproximadamente 1 ha (López-López, 2011). La conformación de la costa es rocosa con abundantes cantos rodados y rodolitos, con una profundidad máxima de 8.3 m (Leyte-Morales, 2001). La presencia de lluvias tiene repercusiones importantes en la cantidad de sedimento que incide en la comunidad coralina de la isla (Granja-Fernández & López-Pérez, 2008).
Densidad poblacional
La densidad de T. roseus se estimó por metro cuadrado (ind.m-2) en los tres sitios de estudio. En cada localidad durante cada muestreo, se colocaron diez transectos (t) de banda (10 m de largo x 2 m de ancho) perpendiculares a la línea de costa, divididos a cada metro de longitud y separados entre sí por al menos 10 m. Los transectos se colocaron sobre el arrecife entre 2 y 10 m de profundidad. El área muestreada por sitio fue de 200 m2 mensuales (10 m x 2 m x 10 t) (CARICOMP, 2001).
Distribución espacial
Para caracterizar la distribución espacial en los tres sitios de muestreo se utilizó el índice de Morisita (1959), el cual determina cual patrón de distribución se aplica para la población estudiada (agregado, uniforme o aleatoria tipo Poisson). El método se basa en el análisis de la relación de la varianza (d2) y la media (µ).
Adicionalmente se aplicaron los modelos de probabilidad de Poisson y el modelo de distribución Binomial Negativa, los cuales permiten corroborar los resultados obtenidos con el índice de Morisita. Para evaluar el ajuste de los datos a alguno de los modelos se aplicó una prueba de X 2 , bajo los supuestos según Mendenhall y Reinmuth (1978). Para obtener el valor del parámetro K, el cual mide el grado de agregación de los individuos en una población (Ludwig & Reynolds, 1988; Krebs, 1999) se utilizaron dos métodos; si al calcular K con el primer método no se cumplía con los supuestos establecidos, se utilizaba el segundo método (Cuadro 1).
Mortalidad natural
Para estimar la mortalidad natural de T. roseus en los tres sitios de muestreo, se aplicó el método de Berry (1967), el cual ha sido empleado en el estudio de otros invertebrados marinos (Ramos-Cruz, Sánchez-Meraz, Carraco-Ayuso & CervantesHernández, 2006) y modificado para su uso con equinodermos (Díaz-Martínez, 2010). El modelo utiliza la variación mensual de la abundancia de un organismo obtenida en campo (Ramos-Cruz et al., 2006).
Cuadro 1 Métodos para calcular el parámetro K que indica el grado de agregación de los organismos de una población
| Primer método | K= μ2/(δ2-μ) | 1 | K/μ > 6 |
| - | - | 2 | K > 3 |
| - | - | 3 | ((K+μ) (K+2) / μ) ≥ 15 |
| Segundo Método | Log N/No = K 1* log[1+ μ/K 1 ] | - | - |
N = ∑ f(x), No = Es el primer dato de f(x), K 1 = valor obtenido usando el primer método, 1, 2, 3 son los supuestos a cumplir para aceptar el valor de K calculado con el primer método
El método de Berry supone que posterior al evento de reclutamiento ocurrido durante (n) intervalos de tiempo (considerados como independientes), la abundancia del organismo (en este caso mensual) disminuye debido a la acción de la mortalidad natural (M) (RamosCruz et al., 2006), por lo tanto, los cambios en la abundancia registrados por intervalo, se relacionan con la tasa de mortalidad natural mensual. Así para T. roseus la tasa de mortalidad se estimó en aquellos intervalos que presentaron tres o más valores continuos descendentes en la abundancia mensual registrada en campo. El algoritmo matemático para el cálculo de la mortalidad con este modelo es el siguiente:
Ln (Nt)= a+b(t)
Dónde:
a : es la ordenada al origen de la pendiente de la regresión.
β : es la pendiente de la regresión o valor de la tasa de mortalidad total (Z parcial).
t: es el intervalo de tiempo en el cual existe disminución en la abundancia.
Variables ambientales
En cada sitio y mes de muestreo se registraron valores de temperatura, salinidad y pH del agua del mar con un medidor multiparámetros Hannah HI9828 (precisión ± 0.01). La trasparencia de la columna de agua se midió con un disco de Secchi. Los datos de precipitación pluvial media mensual para la zona se obtuvieron de dos estaciones meteorológicas: Universidad del Mar, campus Puerto Ángel y del Servicio Meteorológico Nacional. Los datos de irradianza se obtuvieron mediante el cálculo del fotoperiodo según el modelo de duración del día de Jarmo Lammi (Lammi, 2012). Para el cálculo se tomó el dato de la energía solar en W·m-2 proporcionado por el programa Cálculo del fotoperiodo Online (Lammi, 2012). Se obtuvo un promedio mensual de la energía solar (irradianza en la superficie: Is) para cada mes de muestreo, que fue utilizado para determinar la irradianza a una profundidad particular, mediante el modelo exponencial negativo de atenuación de la luz en el océano, basado en la ley de Lambert (Dietrich, Kalle, Krauss & Siedler, 1980).
El coeficiente de extinción vertical de la luz (K), se calculó de acuerdo a Poole y Atkins (1929), utilizando los datos de la profundidad (m) a la cual el observador deja de ver el disco de Secchi.
Relación densidad poblacional versus ambiente
Se utilizó un modelo de regresión lineal múltiple paso a paso (Hair, Anderson, Tatham & Black, 1999), para evaluar el grado de relación existente entre la temperatura (T), salinidad (S), pH, Irradianza (IZ) y precipitación pluvial mensual (Pp), (variables independientes), con la densidad poblacional (Dn) de T. roseus (variable dependiente) en Estacahuite, Dos Hermanas e Isla Cacaluta.
Análisis de datos
Se aplicaron las pruebas de Kolmogorov-Smirnov y Levene para determinar si los datos cumplían con los supuestos de normalidad y homocedasticidad (Zar, 1999). Se aplicó un análisis de varianza de dos vías para identificar diferencias estadísticamente significativas entre las densidades mensuales para cada localidad (variación temporal) y entre localidades para cada mes de muestreo (variación espacial). Se aplicó una prueba a posteriori de comparaciones múltiples de Fisher LSD. Todos los resultados se analizaron con un nivel de significancia de 0.05 y todos los valores se reportaron como media ± desviación estándar (± DE).
Resultados
Densidad poblacional
En Estacahuite la densidad promedio (± DE) de T. roseus fue de 0.12 ± 0.02 ind m-2, con valores máximos en enero 2011 (0.27 ± 0.17 ind m-2), abril 2011 (0.21 ± 0.13 ind m-2) y diciembre 2010 (0.20 ± 0.13 ind m-2) (Fig. 1A). En Dos Hermanas la densidad promedio fue 0.05 ± 0.01 ind m-2, con valores máximos en mayo del 2010 (0.13 ± 0.08 ind m-2), febrero del 2011 (0.20 ± 0.13 ind m-2) y marzo del 2011 (0.14 ± 0.09 ind m-2) (Fig. 1B). En Isla Cacaluta la densidad promedio fue 0,04±0,01 ind m-2, con valores máximos en noviembre 2009 (0.13 ± 0.08 ind m-2), septiembre 2010 (0.21 ± 0.13 ind m-2) y abril 2011 (0.13 ± 0.08 ind m-2) (Fig. 1C).
Se observaron diferencias estadísticamente significativas entre las localidades para cada mes de muestreo. De los trece meses en los que coincidió el muestreo en las tres localidades, solo noviembre y diciembre de 2009 y enero y septiembre de 2010 no mostraron diferencias significativas entre las localidades, mientras que en los demás meses se observaron diferencias significativas (Cuadro 2).
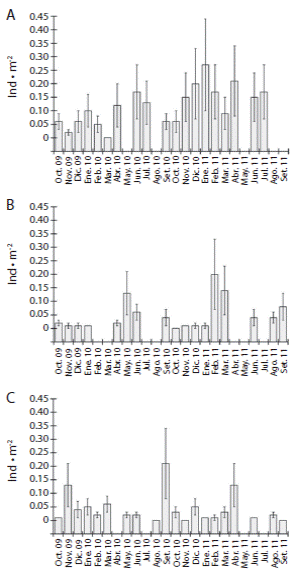
Fig. 1 Comparison of the population density (average±SD) of T. roseus for each sampling site: A) Estacahuite; B) Dos Hermanas; C) Isla Cacaluta. The months without values were not sampled.
Cuadro 2 Comparación de la densidad poblacional de T. roseus en los meses muestreados en las tres localidades
| MesesF | PLocalidades | Tukey | |
|---|---|---|---|
| oct-09 4.22 | 0.03 Estacahuite - Isla Cacaluta | 0.03 | |
| - | Estacahuite - Dos Hermanas | 0.09 | |
| - | Dos Hermanas - Isla Cacaluta | 0.85 | |
| nov-09 1.38 | 0.27 Estacahuite - Isla Cacaluta | 0.41 | |
| - | Estacahuite - Dos Hermanas | 0.96 | |
| - | Dos Hermanas - Isla Cacaluta | 0.28 | |
| dic-09 1.76 | 0.19 Estacahuite - Isla Cacaluta | 0.74 | |
| - | Estacahuite - Dos Hermanas | 0.17 | |
| - | Dos Hermanas - Isla Cacaluta | 0.51 | |
| ene-10 3.13 | 0.06 Estacahuite - Isla Cacaluta | 0.43 | |
| - | Estacahuite - Dos Hermanas | 0.05 | |
| - | Dos Hermanas - Isla Cacaluta | 0.43 | |
| jun-10 11.83 | 0.00 Estacahuite - Isla Cacaluta | 0.00 | |
| - | - | Estacahuite - Dos Hermanas | 0.01 |
| - | - | Dos Hermanas - Isla Cacaluta | 0.43 |
| sep-10 | 1.15 | 0.33 Estacahuite - Isla Cacaluta | 0.44 |
| - | - | Estacahuite - Dos Hermanas | 0.99 |
| - | - | Dos Hermanas - Isla Cacaluta | 0.37 |
| oct-10 | 4.22 | 0.03 Estacahuite - Isla Cacaluta | 0.27 |
| - | - | Estacahuite - Dos Hermanas | 0.02 |
| - | - | Dos Hermanas - Isla Cacaluta | 0.40 |
| nov-10 | 9.40 | 0.00 Estacahuite - Isla Cacaluta | 0.00 |
| - | - | Estacahuite - Dos Hermanas | 0.00 |
| - | - | Dos Hermanas - Isla Cacaluta | 0.99 |
| dic-10 | 6.24 | 0.01 Estacahuite - Isla Cacaluta | 0.03 |
| - | - | Estacahuite - Dos Hermanas | 0.01 |
| - | - | Dos Hermanas - Isla Cacaluta | 0.76 |
| ene-11 | 5.25 | 0.01 Estacahuite - Isla Cacaluta | 0.02 |
| - | - | Estacahuite - Dos Hermanas | 0.03 |
| - | Dos Hermanas - Isla Cacaluta | 1.00 | |
| feb-11 11.08 | 0.00 Estacahuite - Isla Cacaluta | 0.00 | |
| - | Estacahuite - Dos Hermanas | 0.70 | |
| - | Dos Hermanas - Isla Cacaluta | 0.00 | |
| mar-11 3.92 | 0.03 Estacahuite - Isla Cacaluta | 0.24 | |
| - | Estacahuite - Dos Hermanas | 0.50 | |
| - | Dos Hermanas - Isla Cacaluta | 0.03 | |
| jun-11 8.53 | 0.00 Estacahuite - Isla Cacaluta | 0.00 | |
| - | Estacahuite - Dos Hermanas | 0.02 | |
| - | Dos Hermanas - Isla Cacaluta | 0.61 | |
Distribución espacial: En Estacahuite el tipo de distribución espacial de T. roseus en la mayoría de los meses fue agregada (Cuadro 3), observándose este comportamiento de octubre 2009 a febrero 2010 y de septiembre 2010 a julio 2011. Entre abril y julio 2010 los valores de K fueron altos, indicando que la agregación de los erizos fue baja (Fig. 2).
En la localidad de Dos Hermanas en nueve de diecisiete meses muestreados la distribución de T. roseus fue agregada y el resto fue del tipo aleatoria. Los meses con mayor agregación de organismos fueron diciembre 2009, mayo 2010 y junio 2010, mientras que los meses con menor agregación de organismos fueron septiembre 2010, febrero 2011 y junio 2011 (Fig. 2).
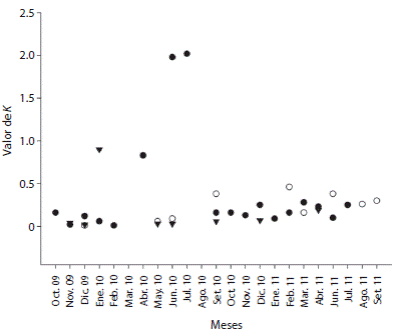
Fig. 2 Monthly aggregation value (K) of the population of T. roseus on the three localities from October 2009 to September 2011. Estacahuite (black circle), Dos Hermanas (White circle) e Isla Cacaluta (inverted triangle).
En Isla Cacaluta el tipo de distribución que presentó T. roseus en la mayoría de los meses fue del tipo aleatoria. La distribución fue del tipo agregada durante noviembre y diciembre 2009, enero, mayo, junio, septiembre, diciembre 2010 y abril 2011. La mayor agregación de organismos se observó en diciembre 2009, mientras que la menor agregación ocurrió en enero 2010 (Fig. 2).
Mortalidad
En Estacahuite el intervalo descendente de abundancia registrada de T. roseus se observó de enero a marzo 2011, dando como resultado una tasa de mortalidad natural (M) de 0,54, (r = 0.997, r2 = 0.995, p < 0.05).
En Dos Hermanas se consideró el intervalo comprendido en los meses de febrero, marzo, junio y agosto 2011 con una tasa de mortalidad natural (M) de 0,460, (r = 0.955, r2 = 0.912, p < 0.05). Para la localidad de Isla Cacaluta no fue posible calcular la mortalidad natural debido a que no hubieron periodos con descensos continuos en la abundancia.
Variables ambientales
En Estacahuite la temperatura media durante el periodo de muestreo fue de 27.40 ± 2.40 °C. La salinidad media fue de 33.34 ± 3.09, el valor promedio de pH fue de 8.45 ± 0.87. La radiación solar media a una profundidad promedio de 12 m fue de 133.04±63.74 W·m-2 y la época de lluvias se presentó de junio a septiembre 2010 y de mayo a julio 2011, con precipitación pluvial media anual de 77.39 ± 23.44 mm. El valor máximo se registró en julio 2010 con 320 mm (Figs. 3A y 4A).
En Dos Hermanas la temperatura media fue de 27.91 ± 1.97 °C. La salinidad media fue de 33.48 ± 2.51. El valor medio de pH fue de 8.69 ± 0.71. La radiación solar media a una profundidad promedio de 10.29 m, fue de 179.69 ± 91.65 W·m-2 (Fig. 3B y 4B).
En Isla Cacaluta la temperatura media fue de 27.98±1.80°C. La salinidad media fue de 34.47 ± 2.43. El valor medio de pH fue de 8.31 ± 1.04. La radiación solar media durante el periodo de muestreo a una profundidad promedio de 10.29 m fue de 179.69 ± 91.65 W·m-2 (Figs. 3C y 4C).
Cuadro 3 Distribución espacial mensual de T. roseus estimada con dos modelos.
| - | - | Estacahuite | - | - | Dos Hermanas | - | - | Isla Cacaluta | - |
|---|---|---|---|---|---|---|---|---|---|
| Meses | σ2>µ | λ | K | σ2>µ | λ | K | σ2>µ | λ | K |
| oct-09 | 1.45 | 15.77 | 0.16 | 0.98 | 0.36 | - | 1.00 | 0.04 | - |
| nov-09 | 1.62 | 21.09 | 0.02 | 0.99 | 0.16 | - | 4.56 | 20579583.00 | 0.04 |
| dic-09 | 1.73 | 39.76 | 0.12 | 2.00 | 47.11 | 0.01 | 3.20 | 5521.00 | 0.02 |
| ene-10 | 2.20 | 24.40 | 0.06 | 1.00 | 0.04 | - | 1.11 | 4.65 | 0.90 |
| feb-10 | 2.71 | 3356.00 | 0.01 | - | - | - | 1.01 | 0.36 | - |
| mar-10 | 0.00 | - | - | - | - | - | 1.09 | 4.72 | - |
| abr-10 | 1.19 | 26.16 | 0.83 | 0.98 | 0.35 | - | - | - | |
| may-10 | - | - | - | 4.80 | 134483.00 | 0.06 | 1.65 | 21.27 | 0.03 |
| jun-10 | 1.17 | 47.76 | 1.98 | 2.00 | 165.00 | 0.09 | 1.65 | 21.27 | 0.03 |
| jul-10 | 1.33 | 26.11 | 2.02 | - | - | - | - | - | - |
| ago-10 | - | - | - | - | - | - | 0.00 | - | - |
| sep-10 | 1.45 | 15.77 | 0.16 | 1.18 | 4.22 | 0.38 | 8.62 | 63692.00 | 0.06 |
| oct-10 | 1.45 | 15.77 | 0.16 | 0.00 | - | - | 0.96 | 0.99 | - |
| nov-10 | 3.36 | 70.81 | 0.13 | 1.00 | - | - | 0.00 | - | - |
| dic-10 | 2.69 | 184.00 | 0.25 | 0.99 | 0.16 | - | 2.93 | 108584.00 | 0.07 |
| ene-11 | 10.77 | 341.00 | 0.09 | 0.99 | 0.16 | - | 1.00 | 0.04 | - |
| feb-11 | 1.78 | 161.00 | 0.16 | 1.62 | 77.69 | 0.46 | 0.99 | 0.16 | - |
| mar-11 | 1.28 | 20.63 | 0.28 | 1.64 | 66.00 | 0.16 | 0.96 | 0.99 | - |
| abr-11 | 1.60 | 83.69 | 0.23 | - | - | - | 1.99 | 80.48 | 0.19 |
| jun-11 | 2.79 | 39.03 | 0.10 | 1.18 | 4.22 | 0.38 | 1.00 | 0.04 | - |
| jul-11 | 1.41 | 45.51 | 0.25 | - | - | - | - | - | - |
| ago-11 | - | - | - | 1.23 | 4.54 | 0.26 | 0.96 | 34235.00 | - |
| sep-11 | - | - | - | 1.52 | 17.68 | 0.30 | 0.00 | - | - |
Modelo de Distribución Binomial Negativa = σ2 >µ, modelo de Distribución Poisson = λ, valor de agregación (K). El guión bajo indica el mes en que no realizó muestreo.
La época de lluvias en Dos Hermanas e Isla Cacaluta se presentó de mayo a septiembre 2010 y junio a septiembre 2011, con precipitación pluvial media anual de 188.66±306.40 mm. El valor máximo se registró en septiembre 2010 con 1 150 mm (Fig. 4 B, C).
Relación densidad versus ambiente
El análisis de regresión lineal múltiple paso a paso para la localidad de Estacahuite y Dos Hermanas indicó que la relación de la variable dependiente densidad poblacional de T. roseus en términos de las variables independientes temperatura, salinidad, pH, precipitación pluvial e irradianza no presentó un efecto significativo (p > 0.05). Sin embargo, para la localidad de Isla Cacaluta el análisis de regresión lineal múltiple se resolvió a un paso (Dn IC: 0.0221 + 0.0000913 precipitación pluvial) indicando que la precipitación pluvial estuvo relacionada de manera significativa, aunque con un valor bajo, con la densidad poblacional de T. roseus (r = 0.537, r2 = 28.9, p = 0.032).
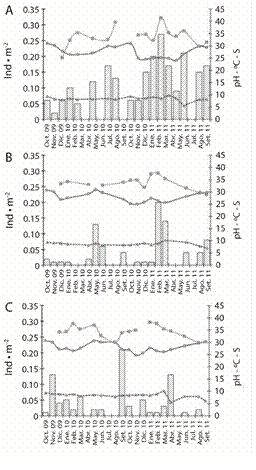
Fig. 3 Monthly variation of the temperature (solid line with circles), salinity (discontinuous line with squares) and pH (discontinuous line with triangles), in relation with the population density (bars) of T. roseus from October 2009 to September 2011: A) Estacahuite, B) Dos Hermanas, C) Isla Cacaluta.
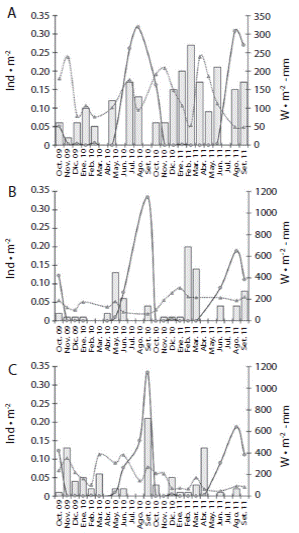
Fig. 4 Variación mensual de la precipitación pluvial (línea sólida con círculos) y la irradianza (línea discontinua con triángulos), en relación con la densidad poblacional (barras) de T. roseus de octubre 2009 a septiembre 2011: A) Estacahuite, B) Dos Hermanas, C) Isla Cacaluta. Fig. 4. Monthly variation of pluvial precipitation (solid line with circles) and irradiance (discontinuous line with triangles), in relation with the population density (bars) of T. roseus from October 2009 to September 2011: A) Estacahuite, B) Dos Hermanas, C) Isla Cacaluta.
Discusión
Son pocos los estudios que han reportado densidades poblacionales para T. roseus (James, 1998, 2000; Edgar et al., 2004; Zamorano & Leyte-Morales, 2005; González-Medina et al., 2006; Cohen-Rengifo, 2008; Zamorano & Leyte-Morales, 2009; Ramírez-Ortíz, 2010; Alvarado et al., 2011; Alvarado, Guzman & Breedy, 2012). De acuerdo a los resultados obtenidos y al comparar con las densidades reportadas para T. roseus en distintas localidades del área de distribución de la especie, se encontró que la densidad poblacional más alta ha sido la obtenida en este estudio en Estacahuite, seguida de Dos hermanas e Isla Cacaluta (Cuadro 4). Esta variación en la densidad de T. roseus puede deberse a las distintas características oceanográficas y atmosféricas de cada zona, a la variabilidad ambiental y/o la preferencia de las especies hacia un tipo particular de sustrato (Hereu et al., 2012). Varios autores coinciden que los cambios en diversos factores físicos como la temperatura del agua (Wing, Botsford, Morgan, Diehl & Lundquist, 2003), profundidad (González-Irusta, Punzón & Serrano, 2012), surgencias (Wing et al., 2003), sedimentación (Walker, 2007; González-Irusta et al., 2012), oleaje (Walker, 2007) y el incremento en el aporte de agua dulce (Andrew, 1991), pueden influir directamente en las poblaciones de erizos de mar, y en consecuencia su densidad poblacional (Hereu et al., 2012).
Cuadro 4 Densidades poblacionales (promedio ± EE) reportadas para género Toxopneustes. Las referencias están organizadas de acuerdo a las coordenadas latitudinales.
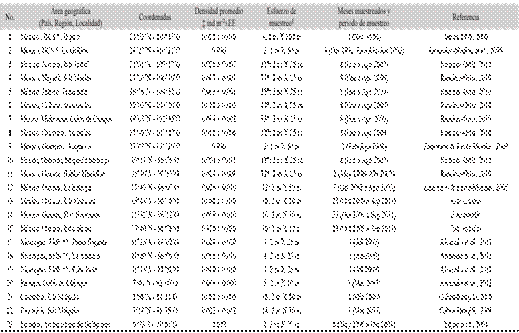
‡ Densidades de cada referencia homogenizadas y obtenidos a partir de la suma de todas las densidades dividida entre el número total de meses muestreados respectivamente en cada estudio (ind m-2 por mes)
*BCS, Baja California Sur
** SjdS, San Juan del Sur
§ Esfuerzo de muestreo expresado como “No. de Transectos (anchos x largo) - Mes-Localidad”
▪ Número de trasectos totales.
En el presente estudio, se observa que cada una de las localidades presenta características propias que las diferencian, creando las variaciones observadas en la densidad poblacional de T. roseus. De acuerdo con los datos poblacionales obtenidos se encontraron diferencias significativas entre la densidad registrada en la localidad de Estacahuite con Dos Hermanas e Isla Cacaluta; sin embargo, Dos Hermanas e Isla Cacaluta no presentaron diferencias significativas. Posiblemente esta similitud se deba a la cercanía de estas dos localidades (~ 3 km de separación), lo cual indica que no existe tanta variabilidad en cuanto a los parámetros oceanográficos y atmosféricos a diferencia de Estacahuite (~ 40 km de distancia), donde se registró la mayor densidad poblacional de T. roseus.
Un factor determinante que puede intervenir en los cambios de la densidad poblacional de T. roseus en las localidades de estudio es el aporte de agua dulce a la comunidad por la precipitación pluvial y particularmente la escorrentía asociada a la cantidad de lluvia. Se ha comprobado que la presencia de lluvias tiene repercusiones en la cantidad de sedimento que alcanza la comunidad arrecifal principalmente en la Isla Cacaluta, debido al aporte de grandes cantidades de material terrígeno por escurrimientos de los ríos Copalita y Coyula, que causan una disminución en la penetración de la luz en la columna de agua y también provocan el aumento de la tasa de sedimentación de materia orgánica, que se deposita sobre las poblaciones de organismos bentónicos en época de lluvias (Granja-Fernández & López-Pérez, 2008).
Varios autores coinciden que las densidades altas de T. roseus y T. pileolus en ciertos periodos pueden deberse a factores tales como la abundancia de alimento (James, 1998, 2000; Fjukmoen, 2006; Eklöf et al., 2009), comportamiento de agregación para el desove y protección contra la depredación (James, 2000; Foster, 2001; Verling et al., 2002; Fjukmoen, 2006; Eklöf et al., 2009), particularmente para Estacahuite las densidades de T. roseus fueron las más altas y más fluctuantes que en las otras dos localidades. Existe una relación estrecha de la densidad poblacional con el tipo de distribución espacial observada en el estudio, indicando que el hecho de que se encuentren altas densidades en una zona, probablemente se deba a que existe un mayor número de organismos agregados y esta relación se ha comprobado en distintas especies que tienen una conducta de agregación (Vadas, Elner, Garwood & Babb, 1986; James, 2000). De acuerdo con los resultados obtenidos, se puede inferir que la localidad de Estacahuite muestra esta relación, ya que fue donde se registró la densidad poblacional más alta y fue donde en la mayoría de los meses los organismos se encontraron más agregados, además de que la tasa de mortalidad fue más alta con respecto a las otras localidades estudiadas.
Los resultados obtenidos de la mortalidad para Estacahuite y Dos Hermanas resultan coherentes, ya que al encontrarse un mayor número de individuos en Estacahuite y siendo ésta una de las localidades más pequeña comparada con las otras zonas estudiadas; posiblemente se esté excediendo la cantidad de recursos disponibles, ocasionando competencia intra-específica alta, lo cual puede incrementar la susceptibilidad a la depredación debido a la disminución en la disponibilidad de refugio o protección. Por otra parte, en la localidad de Dos Hermanas, la cual posee el arrecife más grande (alrededor de 10 ha) y no se encuentra influenciada por escorrentías importantes de agua dulce, favorece a T. roseus en su desarrollo, sobrevivencia y dinámica poblacional, siendo la localidad con baja mortalidad comparada con Estacahuite.
Debido a las diferencias encontradas en las tres localidades de estudio se puede inferir que los factores que podrían determinan la dinámica poblacional de T. roseus en Oaxaca son: (1) áreas con mayor extensión en general y (2) el aporte de sedimento por la presencia de ríos en las localidades, ya que Isla Cacaluta fue la única localidad en la que se evidenció una relación importante con la precipitación pluvial y esta localidad se ve influenciada por los ríos Copalita y Coyula, los cuales producen un importante incremento en la tasa de sedimentación en esta localidad, afectando a la comunidad bentónica en general durante la temporada de lluvias.












 uBio
uBio 

