El tiburón ballena (Rhincodon typus) es el pez más grande del mundo con un tamaño máximo de 20m (Stevens, 2007) y el único miembro de la familia Rhincodontidae y del género Rhincodon. Tiene una distribución circumglobal presente en todos los mares tropicales y subtropicales del mundo exceptuando el Mediterráneo, encontrándose en ambientes oceánicos y costeros (Eckert & Stewart, 2001; Duffy, 2002; Graham, Roberts & Smart, 2006; Rowat, Meekan, Engelhardt, Pardigon & Vely, 2007; Stevens, 2007; Holmberg, Norman & Arzoumanian, 2009; Cárdenas Palomo, Silveira & Reyes, 2010; Riley, Hale, Harman & Rees, 2010; Parra-Venegas et al., 2011; McKinney, Hoffmayer, Fulford & Hendon, 2012). Es una especie altamente migratoria capaz de realizar viajes transoceánicos cubriendo distancias de hasta 13 000km, lo cual confirma la importancia de un manejo de carácter mundial de la especie por su tránsito en aguas internacionales (Eckert & Stewart, 2001; Graham et al., 2006).
La Unión Mundial para la Conservación (IUCN) lo clasifico en el 2002 como vulnerable y con una tendencia poblacional en disminución (Norman, 2005; Parra-Venegas et al., 2011), es una de las cuatro especies de tiburones enumerada dentro del Apéndice II de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestre (CITES) (Fowler, 2000; Duffy, 2002; Graham et al., 2006; Holmberg et al., 2009; Brooks, Rowat, Simon, Jouannet & Vely, 2010; McKinney et al., 2012).
El tiburón ballena es un filtrador oportunista que se alimenta de parches de alimento distribuidos irregularmente en el espacio (Heyman, Graham, Kjerfve & Johannes, 2001). En el caso del tiburón ballena este se alimenta de densas concentraciones de zooplancton (Eckert & Stewart, 2001; Heyman et al., 2001; Hobbs, Hamanaka, McDonald, Gilligan & Neilson, 2009), necton (Motta et al., 2010; Riley et al., 2010; Parra-Venegas et al., 2011; Robinson et al., 2013), y cardúmenes de peces como son sardinas y anchovetas (Hacohen-Domené, Galván-Magaña & Ketchum-Mejia, 2006).
El incremento de actividades de buceo y navegación recreativa desde finales de los años 80 llevó al descubrimiento de las agregaciones temporales de estos animales (Stevens, 2007), las cuales varían desde unos pocos individuos a un conjunto de individuos que se agregan en respuesta a un factor externo como es la disponibilidad de alimento o a causa de atracción mutua entre individuos (Castro et al., 2007; Parra-Venegas et al., 2011; Ketchum, GalvánMagaña & Klimley, 2013).
Las agregaciones temporales han sido reportadas en un sin número de localidades costeras alrededor del mundo entre las cuales se tienen la India (Silas, 1986), en el noroeste de Australia (Colman, 1997; Holmberg et al., 2009), las Maldivas (Rowat et al., 2007; Riley et al., 2010), Belice (Heyman et al., 2001), Nueva Zelanda (Duffy, 2002), México (Eckert & Stewart, 2001; Hacohen-Domené et al., 2006; Parra-Venegas et al., 2011; McKinney et al., 2012), Mozambique, Filipinas, Honduras (Holmberg et al., 2009), Sudáfrica (Cliff, Anderson-Reade, Aitken, Charter & Peddemors, 2007), Tanzania (Brooks et al., 2010), Galápagos, Indonesia, Madagascar (Jonahson & Harding, 2007), Tailandia (Theberge & Dearden, 2006), Seychelles (Rowat, Speed, Meekan, Gore & Bradshaw, 2009), Isla de Navidad (Hobbs et al., 2009), Taiwán, Japón (Castro et al., 2007), Bangladesh, Golfo de California (Ketchum et al., 2013), Golfo de Arabia (Robinson et al., 2013) y en el Mar Rojo (Golfo de Tadjoura) (Rowat et al., 2007).
Se considera que estas agregaciones se encuentran relacionadas frecuentemente a procesos oceanográficos tales como surgencias, corrientes costeras y frentes, que incrementan la productividad en el ambiente marino favoreciendo las concentraciones localizadas de alimento (Castro et al., 2007, Stevens, 2007, Cárdenas Palomo et al., 2010). En Costa Rica, no han sido reportados este tipo de eventos de agregación del tiburón ballena, por lo que este trabajo pretende aportar información base de la presencia de agregación de alimentación en la cuenca interna de Golfo Dulce, Península de Osa, Pacífico Sur de Costa Rica.
Materiales y métodos
Área de estudio
El área de estudio comprende un estuario tectónico semic errado ubicado en la costa sur de Costa Rica a 8°30’ N - 83°16’ E. Golfo Dulce mide 50km de largo por 15km de ancho, con una superficie total de 750km², y se caracteriza por poseer una cuenca interna de pendiente pronunciada con una profundidad máxima de 215m en su parte interna y un umbral poco profundo de aproximadamente 70m en su desembocadura (Svendsen et al., 2006). Por su profundidad máxima de 215m y la presencia en la entrada de un umbral a menor profundidad, la circulación interna de masas de agua es restringida, provocando periodos de anoxia similares a los fiordos europeos (Quesada-Alpízar & Morales-Ramírez, 2006).
Recolección de datos
Los datos colectados consisten en cuatro avistamientos incidentales de agregaciones de alimentación del tiburón ballena, realizados durante una investigación a largo plazo con cetáceos (2005-2013) en un total de 520 salidas y 2 800h de muestreo efectivo, llevado a cabo en Golfo Dulce, en donde cada 30min se tomo la posición geográfica, junto a la condición del mar (escala Beaufort), temperatura, ciclo de mareas, así como hora, estructura y tamaño del grupo, comportamiento, descripción detallada del sitio y se intentó identificar en el área el grupo taxonómico del cual se estaban alimentando los animales. Lo anteriormente descrito permitió a su vez un registro del esfuerzo en campo (Fig. 1). La estimación de la talla de los individuos se realizó comparando al tiburón con un objeto de tamaño conocido embarcación de 7m de eslora, esta información fue corroborada mediante fotografías y videos (Rowat et al., 2007; Hobbs et al., 2009). La madurez sexual de los individuos se determinó mediante la talla, ya que individuos menores a 9m son considerados juveniles, mientras que los mayores como adultos (Colman, 1997; Stevens, 2007; Hobbs et al., 2009). Cada evento fue documentado por medios de fotografías y videos submarinos.
Análisis de datos
La posición geográfica de cada uno de los avistamientos de agregaciones de alimentación fueron introducidos dentro de un sistema de información geográfica realizado con el programa ArcGis 9.3 (ESRI), con el fin de visualizar las áreas utilizadas por el tiburón ballena durante los eventos de alimentación y de esta manera tener una visión mas clara de las características físicas y morfológicas de las zonas utilizadas por esta especie. Se utilizaron los videos y fotografías tomadas durante las agregaciones de alimentación para corroborar la estructura y tamaño del grupo, así como para describir de manera detallada la conducta alimentaria observada.
Resultados
Las agregaciones de alimentación fueron observadas los días 7 de enero del 2009, 4 de agosto del 2009, 31 de marzo del 2012 y 20 de enero del 2013, durante estos eventos de agregación se observaron (n=13) individuos en total, en donde en tres eventos se observaron (n=2) individuos con una estructura y tamaño de grupo constante encontrándose una proporción similar de adultos (Media=1 DE=0, n=3) y juveniles (Media=1.5 DE=0.7, n=3), en el cuarto evento se observaron (n=8) individuos con una proporción mayor de adultos (n=5) que de juveniles (n=3) en el área. Durante estos eventos de agregación se tuvieron reportes por parte de tour operadores de avistamientos de tiburón ballena en otras áreas de Golfo Dulce, pudiendo estar relacionados a estos eventos.
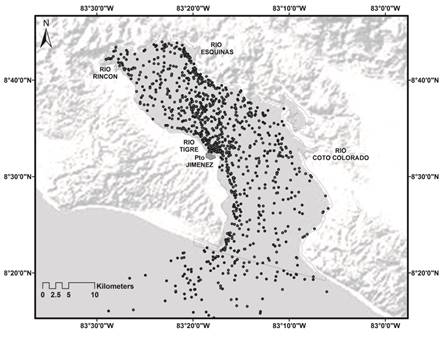
Fig. 1 Field effort distribution in Golfo Dulce. The dots show the location of the monitor stations, detectability and provide an overview of the field coverage.
Las agregaciones de alimentación fueron observadas dentro de la cuenca interna de Golfo Dulce, específicamente sobre la costa occidental en un área que abarcaba 23km desde la desembocadura del Río Tigre hasta la desembocadura del Río Rincón, a una distancia aproximada de la costa de entre 100 a 1 000m y una profundidad entre las isobatas de 5 a 100m (Fig. 2). Dichas agregaciones se presentaron en la zona de influencia de los ríos Tigre y Rincón sobre o cerca de la corriente que produce la desembocadura de estos ríos. (Fig. 2).
En todos los eventos la única conducta que se observó, fue la conducta alimentaria de R. typus de tipo pasiva, los individuos se encontraban nadando en círculos sobre la superficie del agua, en un área aproximada de 2km2, con el cuerpo sumergido e inclinado levemente hacia arriba formando un ángulo de aproximadamente 25°, mientras mantenían su boca abierta y sumergida de manera parcial, siempre con las hendiduras branquiales completamente abiertas permitiendo el filtrado de grandes cantidades de agua provocando la retención de zooplancton (Fig. 3). En uno de los eventos de agregación (7 de enero del 2009) se observó la presencia de copépodos en la columna de agua en el área que estaba siendo utilizada por la especie, al analizar de manera detallada la muestra de agua tomada se constató que eran copépodos pertenecientes al Orden Calanoidea (Morales-Ramírez, com. pers.). (Fig. 3).
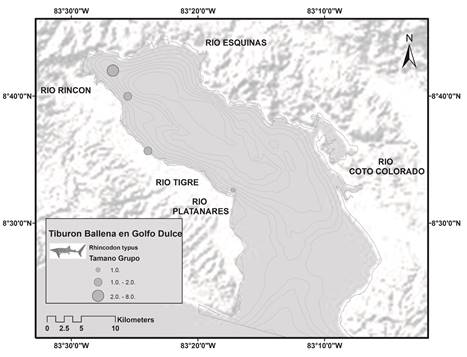
Fig. 2 Eventos de agregación de alimentación del tiburón ballena dentro de la cuenca interna de Golfo Dulce. Fig. 2. Whale shark feeding aggregations events in the inner basin of Golfo Dulce.
Discusión
Según Rowat et al. (2007), en el Golfo de Tadjoura, India y según Ketchum et al. (2013), en el Golfo de California, las agregaciones y segregación por tallas y sexos en tiburones es lo común, esto respondería a los requerimientos dietéticos, disminución de agresiones entre individuos, movilización de las hembras grávidas hacia áreas de crianza y por diferencia en las capacidades natatorias de los individuos, lo que provoca que los individuos se segreguen. Lo descrito anteriormente, no concuerda con lo encontrado durante las agregaciones de alimentación dentro de Golfo Dulce, esto podría asociarse con un número discreto de individuos durante las agregaciones en conjunto con la disponibilidad de recursos que se presentan en el área, que ocasiona que los individuos no tengan la necesidad de segregarse tal y como ocurre en la Península de Yucatán, México, conocida como la mayor área de agregación de adultos y juveniles del tiburón ballena en el mundo (Motta et al., 2010; ParraVenegas et al., 2011).
Las áreas utilizadas por R. typus durante los eventos de alimentación dentro de Golfo Dulce, son las áreas cercanas a las desembocadura de los ríos. Estas son zonas que poseen una alta concentración de nutrientes por el aporte de grandes cantidades de materia orgánica disuelta y particulada que ingresa al sistema (Spongberg & Davis, 1998, Umaña, 1998), favoreciendo la presencia de una alta concentración de zooplancton en la capa superficial de la columna de agua (por encima de la termoclina) (Quesada-Alpízar & Morales-Ramírez, 2006), pudiéndose considerar estas áreas de gran importancia para la especie. Según Wangelin y Wolff (1996), entre diciembre y febrero la comunidad planctónica de Golfo Dulce aumenta significativamente presentando características oceánica-nerítica, por la presencia de copépodos del orden Calanoidea, larvas de poliquetos, eufásidos, ostrácodos, quetognatos, y medusas, todos presas potenciales del tiburón ballena. Al comparar, estas áreas con el hábitat crítico de alimentación de la población residente del delfín nariz de botella (Tursiops truncatus), nos encontramos que coinciden justamente con la porción geográfica utilizada por los delfines para alimentarse, esto por la presencia de un fenómeno hidrográfico que ocurre durante la marea de reflujo en estas áreas conocido como frentes mareales, que provoca zonas de convergencia donde las presas se acumulan, ocasionando un incremento de la biomasa de presas en estas áreas, por la disponibilidad de alimento en forma de plancton (Pacheco- Polanco & Oviedo, 2007).
La conducta alimentaria que ocurre durante las agregaciones de alimentación en Golfo Dulce, es consistente con la observada en otras localidades alrededor del mundo (Heyman et al., 2001; Rowat et al., 2007; Motta et al., 2010), concordando con lo apreciado por otros investigadores en la Península de Yucatán, y Golfo de California, México, donde estas agregaciones son frecuentes (Hacohen-Domené et al., 2006; Motta et al., 2010; Parra-Venegas et al., 2011), y ocurren en respuesta a una fuente predecible de alimento.
El tiburón ballena, por su ciclo de vida de tipo K (gran tamaño, lento desarrollo, alta longevidad y madurez sexual tardía), hace que sea una especie considerada como vulnerable a la sobreexplotación pesquera la cual es motivada por el incremento en la demanda de subproductos y altos precios principalmente en mercados asiáticos (Stevens, 2007), formando parte del mercado de aletas de tiburón y al ecoturismo que a través de los años a tomado mayor popularidad en distintas localidades costeras donde es común observar las agregaciones de alimentación (Eckert & Stewart, 2001; Parra-Venegas et al., 2011; McKinney et al., 2012).
En Golfo Dulce preocupa la presión que está ejerciendo el desarrollo costero, en especial el establecimiento de proyectos turísticos, entre ellos la construcción y operación de marinas, que están planificadas en el área (Puerto Jiménez y Golfito), lo cual podría provocar un posible aumento en el tráfico marítimo, potenciando un impacto negativo sobre las agregaciones de alimentación de R. typus dentro del Golfo. Los estudios realizados en el Golfo de Tadjoura, India (Rowat et al., 2007), Belice (Graham et al., 2006) y en el arrecife de Ningaloo, Australia (Holmberg et al., 2009), demuestran que el 65% de los individuos observados en estas agregaciones presentan cicatrices producto de hélices de botes, lo que pone en riesgo a los animales y sus agregaciones. Esto ocurre durante los episodios de alimentación donde los tiburones se sitúan cercanos a la superficie, lo cual aumenta su vulnerabilidad a este tipo de impacto. De esta manera es indispensable la regulación de este tipo de proyectos e implementación de programas de concientización y medidas de regulación del tráfico marítimo en la zona de estudio. El tiburón ballena se ha visto igualmente afectado por su captura incidental con trasmallos y redes de cerco en diferentes partes del mundo (Silas, 1986; Romanov, 2002), es de gran importancia conocer más sobre esta interacción en las zonas aledañas a Golfo Dulce, donde se lleva a cabo este tipo de prácticas, así como determinar las áreas de migración de los tiburones ballena que visitan Golfo Dulce.












 uBio
uBio 


