Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.60 n.2 San José Jun. 2012
Actividad reproductiva de Chelonia mydas (Testudines: Cheloniidae) en Isla de Aves, Venezuela (2001-2008)
*Dirección para correspondencia:
Abastract
The second major nesting-site for green turtles in the Caribbean is Isla de Aves, an island protected as a wildlife refuge since 1972, located at 650km Northeast from La Guaira, Venezuela. In this island, the nesting population monitoring started in 1972 and in a more continuous way after 1978, when a Scientific-Naval Station was established and scientific observations started. Since historical data show that female captures had severely affected population levels in this island before 1978, this study aim to describe recent reproductive activities. For this, during the nesting seasons of 2001-2002 and 2005-2008, nesting females were measured and tagged using metal flipper tags. A total of 458 nights were sampled observing 5 154 female emergences, with a maximum of 53 in a single night. Non-observed emergences were calculated fitting the temporal distribution of observed emergences to a normal curve. Total emergences estimated varied from
 =637.1±106.6 in 2001 to
=637.1±106.6 in 2001 to  =2 853±42.5 in 2008 (ANOVA F(6.5df)=60.37, p<0.0001). Internesting interval in the same season was estimated in
=2 853±42.5 in 2008 (ANOVA F(6.5df)=60.37, p<0.0001). Internesting interval in the same season was estimated in  =10.71±1.32 days. Clutch frequency in a nesting season was calculated as
=10.71±1.32 days. Clutch frequency in a nesting season was calculated as  =1.71±1.6 times per female and season. Estimated number of nesting females per year varied from
=1.71±1.6 times per female and season. Estimated number of nesting females per year varied from  =373±12.5 females in 2001 to
=373±12.5 females in 2001 to  =1 669±56.1 females in 2008 (ANOVA F (5.6df)=89.42, p<0.0001); with a positive and significant trend (r=0.842, p=0.036). Results show that nesting females numbers are increasing. We suggest that the protection of the nesting area for more than 30 years, has contributed with this population increase. Rev. Biol. Trp. 60 (2): 745-758. Epub 2012 June 01.
=1 669±56.1 females in 2008 (ANOVA F (5.6df)=89.42, p<0.0001); with a positive and significant trend (r=0.842, p=0.036). Results show that nesting females numbers are increasing. We suggest that the protection of the nesting area for more than 30 years, has contributed with this population increase. Rev. Biol. Trp. 60 (2): 745-758. Epub 2012 June 01.Key words: Aves Island, green turtle, Chelonia mydas, nesting females, internesting interval, clutch frequency, population trends.
Resumen
Isla de Aves, una isla a 650km de La Guaira, Venezuela, protegida como Refugio de Fauna Silvestre, constituye el segundo sitio de mayor anidación de la tortuga verde (Chelonia mydas) (Linnaeus 1758) en el Caribe. El seguimiento de la población comenzó en 1972 y de manera más continua desde 1978. Los datos históricos indican que la captura de hembras en la isla, afectó severamente la población hasta 1978, cuando fue construida una base científico-naval. Durante las temporadas de anidación entre 2001-2008 con excepción de 2003 y 2004, las hembras fueron marcadas con placas metálicas y medidas. Asimismo, se muestreó durante 458 noches, en donde se observaron 5 154 eventos, con un máximo de 53 por noche. Los posibles eventos no observados fueron calculados ajustando la distribución temporal de eventos observados a una curva normal. El total de eventos estimados varió de
 =637.1±106.6 en 2001 a
=637.1±106.6 en 2001 a  =2 853±42.5 en 2008 (ANOVA F(6.5gl)=60.37, p<0.0001). El intervalo entre reanidaciones fue de
=2 853±42.5 en 2008 (ANOVA F(6.5gl)=60.37, p<0.0001). El intervalo entre reanidaciones fue de  =10.7±1.32 días. La frecuencia de anidación se calculó en
=10.7±1.32 días. La frecuencia de anidación se calculó en  =1.71±1.6 veces por hembra. El número de hembras estimadas varió entre
=1.71±1.6 veces por hembra. El número de hembras estimadas varió entre  =373±12.5 para 2001 y
=373±12.5 para 2001 y  =1 669±56.1 para 2008 (ANOVA F(5.6gl)=89.42, p<0.0001). La tendencia es significativa (r=0.842, p=0.036). Los resultados indican que el número de hembras que anidan en Isla de Aves ha aumentado, y se sugiere que más de 30 años de protección del área de reproducción está resultando en un creciente número de hembras.
=1 669±56.1 para 2008 (ANOVA F(5.6gl)=89.42, p<0.0001). La tendencia es significativa (r=0.842, p=0.036). Los resultados indican que el número de hembras que anidan en Isla de Aves ha aumentado, y se sugiere que más de 30 años de protección del área de reproducción está resultando en un creciente número de hembras.Palabras clave: Isla de Aves, tortuga verde, Chelonia mydas, hembras anidando, intervalo de reanidación, frecuencia de reanidación, tendencia poblacional.
Isla de Aves, su plataforma insular y el mar territorial correspondiente, fueron decretados como Refugio de Fauna Silvestre en Agosto de 1972, entre otras razones por la presencia de una abundante colonia de tortugas verdes.
La isla constituye el área de anidación de tortugas marinas más importante de Venezuela y a su vez, es el segundo sitio, después de Tortuguero (Costa Rica), de mayor anidación de la tortuga verde (Chelonia mydas) en el Caribe (Guada & Solé 2000). Isla de Aves es considerada una playa índice para evaluaciones poblacionales mundiales de la especie (Seminoff 2004). C. mydas es considerada en peligro (IUCN 2004) y está incluida en el Apéndice I del CITES, (Guada & Buitrago 2008).
El seguimiento y marcaje en Isla de Aves comienza a ejecutarse a través de instituciones como la “Island Resources Foundation” y “Fundación La Salle de Ciencias Naturales” (Rainey & Pritchard 1972, Brownell & Guzman 1974, Brownell 1974, Ralston 1974, Rainey 1977). En 1978 se crea una base científico-naval, por lo que la isla y sus aguas inician una fase de protección, no solo por la figura de refugio de fauna silvestre, sino por la presencia de personal militar. Desde esta fecha los esfuerzos de seguimiento continuaron de manera más sistemática por parte de FUDENA (Fundación para la Defensa de la Naturaleza) durante casi dos décadas, lo cual lo sitúa como uno de los proyectos caribeños con más larga trayectoria, y por tanto tiene considerables volúmenes de información (Láiz 1979, Gómez 1980, Gremone & Gómez 1983, González & Guada 1989, Solé & Medina 1989, Narciso & Solé 1999).
Entre los años 1998 y 2000 ocurre una interrupción de las actividades, pero posteriormente el Ministerio del Ambiente reinicia el seguimiento a través del proyecto denominado “Seguimiento y Conservación de la población de tortuga verde en el Refugio de Fauna Silvestre Isla de Aves” (Vera 2002, Vera 2003, Vera 2004a). Con lo anterior, se dio cumplimiento a una de las metas del Plan de Acción para la recuperación de las tortugas marinas de Venezuela (Solé 1992, Guada & Solé 2000).
Los retos impuestos en el seguimiento de poblaciones de tortugas varían directamente con el tamaño de la población. Las tortugas marinas típicamente no desovan cada año. La variabilidad en el intervalo de remigración, al parecer causada por la calidad del hábitat de alimentación, complica las estimaciones de tendencias poblacionales interanuales (Bjorndal et al. 1999).
Para grandes agregaciones de tortugas marinas, el esfuerzo para registrar meticulosamente todos los datos de anidaciones y hembras que arriban, es enorme. Sin embargo, la necesidad de obtener datos confiables para estimar la población es la misma (Bjorndal et al. 1999).
Los estudios en playas de anidación de tortugas marinas, y más en un sitio tan aislado y remoto como Isla de Aves, implican temporadas de muestreo muchas veces truncadas y diferentes a lo planeado e ideal, ya sea por las restricciones económicas o por las logísticas (Gratiot et al. 2006). Las estimaciones de la población, mas si tienen como objetivo buscar tendencias interanuales, requieren de niveles bajos de variabilidad no explicada y muestreos que sean lo más completos posibles, a fin de incrementar la robustez estadística de la estimación (Russo & Girondot 2009a). Los datos obtenidos pueden basarse en muestreos espaciales (Evans & Hammond 2004), en donde se cubre sólo una parte del área de anidación, o temporales (Bjorndal et al. 1999), cuando se incluye solamente una parte de la temporada de anidación. En el caso de Isla de Aves los muestreos son temporales dado su pequeño tamaño y su aislamiento.
Cualquier estimación, basada en muestreos, está sujeta a errores, generalmente cuanto mayor sea el esfuerzo, mayor será la precisión de la estimación. Asimismo, existe un compromiso natural entre el esfuerzo de muestreo y la minimización del error (Jackson et al. 2008). Como siempre existirán, en mayor o menor grado, vacíos temporales o espaciales en la información existente y estos vacíos variarán año con año, por esto, es indispensable usar algún sistema para estimar ésos datos faltantes. Estos métodos destinados a ajustar las observaciones faltantes suelen usar la línea base para estimar, con base en una regresión, la cantidad de hembras que deberían observarse en el periodo no muestreado, u otros arreglos similares (Jackson et al. 2008).
Las estimaciones sobre el número de hembras que han anidado en Isla de Aves en tiempos históricos basadas en evaluaciones, aún meramente referenciales, están resumidas en Antczak et al. (2007). Seminoff (2004), en su análisis de las tendencias mundiales de la especie, considera que la población de Isla de Aves, playa índice número 31, disminuyó entre 1886 y 1994, pero se muestra estable desde entonces. Otras estimaciones, consideran que la captura de hembras y el saqueo de nidadas, en Isla de Aves, afectó severamente a la población hasta 1978, pero desde 1979 no es apreciable ninguna disminución (Peñaloza 2000). Sin embargo, a pesar que en el Refugio de Fauna Silvestre Isla de Aves, se otorga protección completa a las hembras reproductoras y los neonatos, en el resto del rango de distribución de la especie, sus poblaciones siguen siendo diezmadas (Solé 1992, Vera 2004b), aún cuando han aumentado los proyectos y esfuerzos de conservación en esas zonas. En este trabajo se analizan las temporadas de anidación de la tortuga verde en Isla de Aves, entre 2001 y 2008.
Materiales y métodos
Área de estudio: Isla de Aves es una isla de unos 580m de largo y un ancho variable entre 30 y 120m; se encuentra localizada a unos 650km al noreste del puerto de La Guaira y a unos 200km de Dominica, en el Caribe oriental (Fig. 1).
Muestreo y marcaje: Durante cada temporada (2001, 2002, 2005, 2006, 2007 y 2008) generalmente entre los meses de julio y octubre, se realizaron patrullajes en la playa desde las 20:00 horas hasta las 03:00 horas, excepto en las oportunidades en las cuales las condiciones meteorológicas no lo permitieron. Las temporadas 2003 y 2004 no pudieron estudiarse por labores de reconstrucción de la base científico naval.
Las tortugas que se encontraban anidando se marcaron en ambas aletas delanteras, entre la segunda o tercera escama. En las temporadas previas a 2006 solo fueron marcadas en la aleta delantera izquierda. El marcaje fue efectuado utilizando placas metálicas del tipo Monel e Inconel, y según el grosor de la aleta del animal, serial de una o dos letras y el número con 4 o 5 dígitos y la leyenda “DEPT. ZOOLOGY UF. GAINESVILLE. FL USA”. También, se anotó la fecha, hora y el sector de la isla donde anidó y si el animal presentaba cualquier característica o señal particular. Además, se midieron con una cinta métrica flexible, la longitud curva del caparazón y el ancho curvo del caparazón, de tal manera que se siguieron las normas indicadas por Bolten (2000).
Estimación del número de eventos: La información recabada fue organizada, en bases de datos para su análisis y comparada con datos de temporadas anteriores u otras playas.
Dada la variedad de actividades realizadas por las tortugas en su breve estadía en tierra y los múltiples términos empleados para denominarlas, usamos la nomenclatura para las diferentes actividades de las tortugas en tierra aceptada por la UICN (Gerrodette & Taylor 1999, Schroeder & Murphy 1999, Chacón et al. 2007, Chacón et al. 2008). Típicamente, un evento, actividad o emergencia es cada ocasión en que una hembra sale a la playa (Gerrodette & Taylor 1999, Schroeder & Murphy 1999), independientemente de lo que haga al salir.
Para estimar el número de eventos que pudieron ocurrir durante los días en que no hubo muestreo existen varias estrategias, las más comunes son calcular el número esperado de eventos por hembra durante el periodo parcial de muestreo, y calcular la probabilidad que una hembra emerja y sea observada durante el muestreo parcial. Ambas estrategias requieren de una línea base de varios años para establecer las expectativas (Wetherall et al. 1998).
Otros métodos para obtener estimados confiables de los datos faltantes y diseñar planes de muestreo más eficientes, incluyen el uso de diferentes mecanismos. Peñaloza (2000), para Isla de Aves, corrigió los periodos sin muestreo de acuerdo con el porcentaje del total anual de hembras observado en dicha quincena en los años con muestreo más completo. Jackson et al. (2008), usa una regresión basada en años de muestreo total, para inferir las fechas no muestreadas en otros años. Gremone & Gómez (1983) para Isla de Aves utilizan el número de hembras por día de muestreo para cada mes. Otros autores, han ajustado las distribuciones de actividades de anidación a diferentes modelos estadísticos de distribución, en donde incluyen el ajuste de la distribución temporal (en días julianos) a una normal (Wetherall et al. 1998, Kerr et al. 1999, Troëng et al. 2004, Gratiot et al. 2006, Rondón-Medicci et al. 2010). Algunos métodos no corrigen para las anidaciones antes y después de la temporada de observaciones, por lo que sus estimados de eventos siempre son subestimaciones (Hilterman & Goverse 2007). El modelo sinusoidal de Gratiot et al. (2006) asume la simetría en la temporada de anidación, es decir, la misma tasa de incremento gradual de anidación al inicio y la misma de disminución, al final. En este caso, calculamos el número esperado de eventos para cada mes o fracción de mes no muestreado, con base en los datos observados de número de eventos para cada día, de cada mes de muestreo. Como durante los años de estudio nunca hubo muestreos antes de finales de junio y según los datos de finales de la década del 70 e inicios de los 80 del siglo pasado, en ese primer semestre se produce el 18% de los eventos (Gremone & Gómez 1983), usamos el número de eventos por día de observación, para estimar la cantidad de posibles eventos durante los meses faltantes. Como no han ocurrido muestreos en ningún año durante enero y diciembre, salvo cinco días durante diciembre 1982 (Gremone & Gómez 1983), en los que no llegó ninguna hembra, asumimos que en esos meses no hay anidación. Igualmente, ajustamos la distribución temporal (en días julianos) a una distribución normal (Rondón-Medicci et al. 2010).
Estimación del número de hembras: Las estimaciones del número de hembras que componen una población anidadora de tortugas marinas y sus tendencias, pueden tener dos posibles enfoques; modelar la dinámica poblacional o seguir las tendencias en el número de animales, o sus rastros observados (Girondot et al. 2007). La mayoría de los estudios de playas de anidación están basados en cuantificación de las nidadas, nidos o las huellas y donde hay trabajo de marcaje, también las hembras. Sin embargo, los muestreos suelen presentar incertidumbres en temporadas y horas y extensiones cubiertas. Por esto, para estimar el número de hembras que anidan (Broderick et al. 2002), los métodos están basados en la frecuencia de puesta inferida a partir de los eventos observados.
Con base en el número de hembras observadas y marcadas, y la proporción de eventos no observados estimados, calculamos el número de hembras que anidaron cada año. Para estimar el número de hembras anidadoras en la población, es necesario conocer la frecuencia de puesta de las hembras en una misma temporada y el éxito de puesta.
El número de nidadas inferidas fue estimado en base a los eventos inferidos y al éxito de puesta, es decir, cuántos de esos eventos produjeron un desove. Reanidación es cuando una hembra sale a anidar, hágalo o no, más de una vez en la misma temporada. La frecuencia de puesta observada (FPO) es el número de veces que una misma hembra anidó en la temporada y el intervalo de puesta observada (IPO), es el número de días entre una puesta exitosa y el próximo intento de anidación de esa hembra (Alvarado & Murphy 1999). Para calcular el intervalo de puesta inferido (IPI), cuando el lapso entre dos anidaciones consecutivas supera ampliamente la moda del intervalo observada, consideramos que una o más anidaciones intermedias no fueron reportadas y estimamos los eventos faltantes. En base a estos intervalos inferidos calculamos la frecuencia de puesta inferida (FPI) (Broderick et al. 2003).
Con los datos corregidos respecto a los posibles eventos no observados y teniendo estimaciones del éxito de puesta, el cálculo del número estimado de hembras en cada temporada según la fórmula propuesta por Gerrodette & Taylor (1999) queda simplificada a:
Número de Hembras=Número de nidadas inferidas/frecuencia de puesta inferida.
Con base en las incertidumbres en el estimado del número de eventos, y de la frecuencia de puesta, calculamos la variabilidad de los estimados, usadas en los análisis de varianza.
Los análisis estadísticos utilizados incluyeron: t de student, cálculo de probabilidades, correlaciones, regresiones y análisis de varianza, que se realizaron con el programa Statgraphic plus 5.1TM.
Resultados
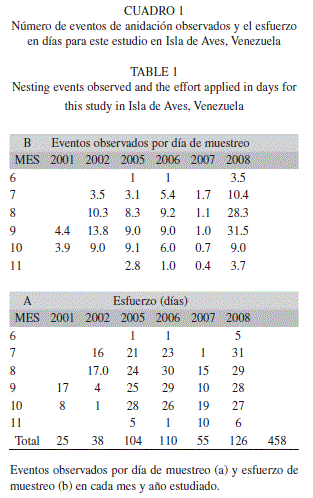
Muestreo y marcaje: Durante los seis años de estudio, fueron muestreadas 458 noches, en las cuales se observó un total de 5 154 eventos (
 =11.3 eventos por noche, rango 0 a 53) (Cuadro 1).
=11.3 eventos por noche, rango 0 a 53) (Cuadro 1). Las horas con mayor número de eventos están comprendidas entre las 21hr de la noche y las 02hr de la madrugada y se registró un mayor porcentaje de salidas de animales entre las 22 y 23hr (42%).
El esfuerzo de muestreo varió entre años y meses, dadas las múltiples dificultades logísticas y climatológicas, pero se trató de concentrar en los meses de julio-octubre.
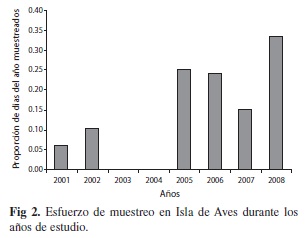
El esquema de selección de fechas a muestrear produjo una cobertura variable del año (Fig. 2), con un máximo de 35% de los posibles días de anidación (2008) y un mínimo de 7% (2001). Sin embargo, dada la ubicación de estos días de muestreo en las fechas de más alta ocurrencia de eventos estimados, tanto por el ajuste de distribución temporal como por el número de eventos por día de muestreo, la eficacia del esquema temporal de distribución de esfuerzo de muestreo se estima alcanzó un máximo de 82% (2008) con un mínimo de 16% (2001) (Fig. 3). Estas cifras consideran que durante los días de muestreo todos los eventos fueron reportados, lo cual no necesariamente es cierto, pues produce una subestimación del número total de eventos.
Distribución espacial de la anidación: Las tortugas mostraron en sus salidas a la superficie de Isla de Aves, una preferencia por las zonas norte y sur de la misma. En 2001 los animales tuvieron preferencia por el sector sur. Durante 2002 hubo una preferencia prácticamente igual por el sector norte y el sector sur. El año 2005, la tendencia fue marcada hacia el sector norte, probablemente por la presencia de nuevas luces externas (instaladas en 2004) en la base científico-naval. Después de haber minimizado en alguna medida el efecto de las luces, a través de protectores rudimentarios, en la temporada 2006, los animales prefirieron el sector sur en más del 50% de los casos.
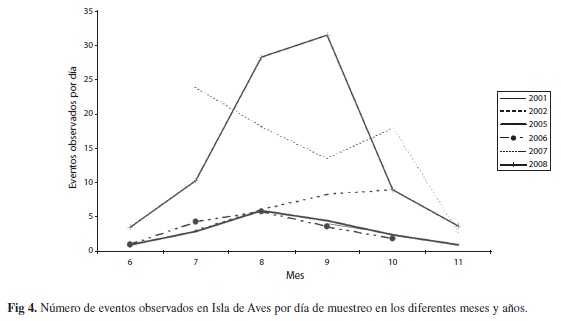
Estimación del número de eventos: El número de eventos observados por día de muestreo, varió tanto estacionalmente durante los meses del año como con cada año (Fig. 4). Es notable el claro aumento en número de eventos durante los años 2007 y 2008, aún cuando los meses de mayor concentración no coincidieron exactamente.
Aunque, las hembras de C. mydas pueden anidar en Isla de Aves, en cualquier día del año, las actividades reproductivas están concentradas en los meses de julio-octubre. Esto, causa una probable subestimación del número de hembras, pues el que no haya observaciones no garantiza que no lleguen hembras.
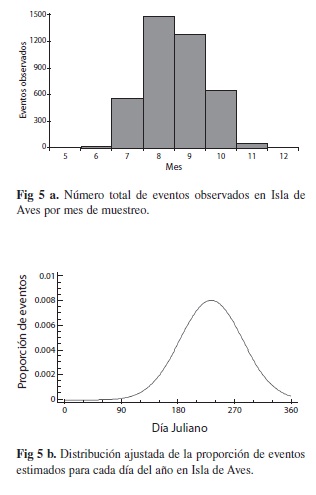
La figura 5A, muestra el número de eventos observados para cada mes en los seis años analizados. Al estimar la proporción de anidación para cada día del año, y al ajustar la distribución temporal a una distribución normal (
 =233.4 días, S=49.7 días) resulta la curva observada en la figura 5B. Con la información de esta distribución estimamos los posibles eventos no observados. La figura 6 muestra el número total de eventos estimados. Los valores varían de
=233.4 días, S=49.7 días) resulta la curva observada en la figura 5B. Con la información de esta distribución estimamos los posibles eventos no observados. La figura 6 muestra el número total de eventos estimados. Los valores varían de  =637.1±106.6 eventos en 2001 a
=637.1±106.6 eventos en 2001 a  =2 853±42.5 eventos en 2008. Un análisis de varianza, previa comprobación de la homogeneidad de las varianzas indica diferencia significativa entre el número de eventos estimados por año (F6 y 5gl=69.74, p<0.0001). Una prueba a posteriori de Tukey HSD indica dos grupos, un grupo de bajo número de eventos que incluye los años 2001, 2002, 2005, 2006 y dos años de alto número de eventos estimados 2007 y 2008. La tendencia, muestra una relación exponencial significativa (r=0.842, p=0.036).
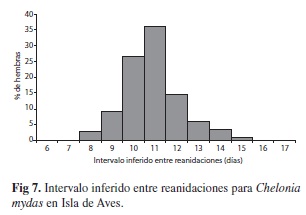
=2 853±42.5 eventos en 2008. Un análisis de varianza, previa comprobación de la homogeneidad de las varianzas indica diferencia significativa entre el número de eventos estimados por año (F6 y 5gl=69.74, p<0.0001). Una prueba a posteriori de Tukey HSD indica dos grupos, un grupo de bajo número de eventos que incluye los años 2001, 2002, 2005, 2006 y dos años de alto número de eventos estimados 2007 y 2008. La tendencia, muestra una relación exponencial significativa (r=0.842, p=0.036). Intervalo de reanidación: Para Isla de Aves entre 2001-2008 el intervalo de reanidación inferido medio, para las 1 150 hembras observadas reanidando en la misma temporada, fue de
 =10.71±1.32 días (Fig. 7). El intervalo entre anidaciones sucesivas es difícil de estimar sin contar con un muestreo de saturación, es decir con la seguridad que todas las hembras que regresan son contabilizadas, lo cual es muy difícil en lugares como Isla de Aves, donde las condiciones meteorológicas o circunstancias logísticas pueden interrumpir o dificultar las actividades.
=10.71±1.32 días (Fig. 7). El intervalo entre anidaciones sucesivas es difícil de estimar sin contar con un muestreo de saturación, es decir con la seguridad que todas las hembras que regresan son contabilizadas, lo cual es muy difícil en lugares como Isla de Aves, donde las condiciones meteorológicas o circunstancias logísticas pueden interrumpir o dificultar las actividades. Frecuencia de reanidación: En base a los 5 154 eventos observados, la frecuencia de puesta observada fue de
 =1.35±0.75 veces y la inferida
=1.35±0.75 veces y la inferida  =1.71±1.6 veces.
=1.71±1.6 veces. Un 77.7% de las hembras marcadas solo fueron observadas una vez en la misma temporada. En otras especies de tortugas marinas, como Dermochelys coriacea, esto se ha atribuido a que pueden anidar en otras playas de la región pero para Isla de Aves esto parece poco probable ya que solo hay reportes de una anidación en otro lugar distinto, de una hembra marcada en Isla de Aves y lo más lógico es asumir que hay reanidaciones no reportadas.
El 13% de las hembras permanecieron en la zona más de dos meses entre la primera y la última anidación observada, a pesar que en tres de los seis años analizados el muestreo fue inferior a 60 días.
Estimación del número de hembras: El éxito de puesta, de una muestra de 393 eventos observados entre julio-septiembre de 2007 fue de
 =0.944 al aplicar la formula de Gerrodette & Taylor (1999) a los eventos estimados por año, corregidos por el éxito de puesta, resultan valores entre
=0.944 al aplicar la formula de Gerrodette & Taylor (1999) a los eventos estimados por año, corregidos por el éxito de puesta, resultan valores entre  =373±12.5 hembras para 2001 y
=373±12.5 hembras para 2001 y  =1 669±56.1 hembras para 2008. La Fig. 8 muestra las estimaciones medias y las desviaciones estándar, las incertidumbres se propagan entre la debida al número de nidadas por año y la de la frecuencia de anidación (Lindberg 2000), por lo que son mayores que las debidas a cualquiera de las estimaciones independientes. El análisis de varianza, previa comprobación de la homogeneidad de las varianzas, indica diferencia significativa entre el número de hembras por año (F5.6gl=167.61, p<0.0001). El análisis a posteriori de Tukey HSD indica tres grupos de años de acuerdo con el número de hembras que anidan, un año de baja anidación 2001, un grupo de años de “media anidación” entre 2002-2006 y un grupo de alta anidación en 2007 y 2008. La tendencia ascendente es exponencial significativa (r=0.940, p=0.0052).
=1 669±56.1 hembras para 2008. La Fig. 8 muestra las estimaciones medias y las desviaciones estándar, las incertidumbres se propagan entre la debida al número de nidadas por año y la de la frecuencia de anidación (Lindberg 2000), por lo que son mayores que las debidas a cualquiera de las estimaciones independientes. El análisis de varianza, previa comprobación de la homogeneidad de las varianzas, indica diferencia significativa entre el número de hembras por año (F5.6gl=167.61, p<0.0001). El análisis a posteriori de Tukey HSD indica tres grupos de años de acuerdo con el número de hembras que anidan, un año de baja anidación 2001, un grupo de años de “media anidación” entre 2002-2006 y un grupo de alta anidación en 2007 y 2008. La tendencia ascendente es exponencial significativa (r=0.940, p=0.0052).Discusión
Russo & Girondot (2009b), postulan que la mejor estrategia para muestrear con recursos limitados y lograr la mejor precisión de estimados de abundancia interanual, es una noche cada diez noches durante los dos meses pico de anidación, pero ocho de cada diez noches durante el inicio y el final de la temporada de desove. Este postulado es opuesto a lo que tradicionalmente ocurre, concentrar los escasos recursos en los meses picos de anidación. La eficacia del esquema temporal de distribución del esfuerzo de muestreo, estimamos alcanzó un máximo de 82% (2008) con un mínimo de 16% (2001). En un sitio de tan difícil logística como Isla de Aves, el esfuerzo de 2008 o 2006 con 110 y 126 días de muestreo en las épocas pico es considerado óptimo pues maximiza resultados y minimiza costos.
Los resultados de distribución espacial y las horas de mayor anidación coinciden con los resultados obtenidos por otros investigadores en Isla de Aves durante las décadas de los 70 y 80 del siglo pasado (Gremone & Gómez 1983, Solé & Medina 1989, Witherington 1992, Narciso & Solé 1999).
La alta variabilidad interanual del esfuerzo reproductivo de las tortugas verdes, ha sido considerado como producto de la variabilidad en la disponibilidad y calidad del alimento y sabemos que en C. mydas, dado su carácter de herbívoro, esta diferencia es máxima (Broderick et al. 2001). Esto hace, por un lado, que ocurran intercalados, años de alto y bajo número de eventos reproductivos con otros de menor, lo que ratifica la necesidad de una serie de tiempo prolongada para lograr evidenciar tendencias.
El cálculo del número esperado de eventos para cada mes o fracción de mes no muestreado, que fue efectuado con base en los datos observados de número de eventos para cada día, de cada mes de muestreo y se ajustó la distribución temporal a una distribución normal (Rondón-Medicci et al. 2010) con resultados satisfactorios. Otros modelos, como el modelo sinusoidal de Gratiot et al. (2006), y el ajuste a una distribución normal usado por Rondón-Medicci et al. (2010), asumen el carácter asintótico de la distribución temporal y la simetría en la temporada de anidación, es decir, la misma tasa de incremento gradual de anidación, al inicio y la misma de disminución, al final.
Los intervalos entre sucesivas anidaciones en una misma temporada, varían considerablemente entre localidades y parecen ser propios de cada población dentro de una misma especie e incluso, donde hay variabilidad estacional en las condiciones ambientales, a lo largo de una misma temporada. El intervalo entre anidación observado por Gremone & Gómez (1983) fue de 16.97±9.82 días y de 14.6 días, y se corrigieron para aquellas que anidaron más de una vez. En otros estudios, tanto Solé & Medina (1989), como Peñaloza (2000), obtuvieron una moda de 11 días.
Para la tortuga verde en Tortuguero, Costa Rica, Carr et al. (1978) encontraron 12.1 días. En Surinam, Schulz, (1975) reportó 13.4 días y para Ascensión entre 14.5 días (Carr 1975) y 13.9 días (Mortimer & Carr 1987). Hirth (1980) en su resumen de la biología reproductiva de las tortugas marinas reporta, para la tortuga verde en 21 localidades del mundo, valores medios entre un máximo de 14.5 días en Ascensión (Carr & Hirth 1962) y en Heron Island (Bustard 1972) y un mínimo de 9.6 días para Yemen del Sur (Hirth & Carr 1970). Sato et al. (1998) consideran que el intervalo entre anidaciones consecutivas constituye el periodo de maduración de los huevos en el oviducto, de tal manera que está correlacionado negativamente con la temperatura corporal y por lo tanto con la temperatura del agua. Resultados similares han sido encontrados en el Mediterráneo y en Isla Ascensión (Hays et al. 2002) y en Taiwán, en dos playas con diferentes condiciones ambientales varió de 13.7 días en la más oceánica a 10.6 días en la más protegida y cálida (Cheng et al. 2008).
El número de nidadas por hembra de C. mydas en una temporada es muy variable. Para Isla de Aves, Peñaloza (2000) estima una media de 3.16±2.16 nidadas/hembra y Solé & Medina (1989) 2.6±1.48 veces. Hirth (1997) reporta para 23 colonias anidadoras distribuidas en todo el mundo, medias entre 1.8 nidos por temporada para Hawai, (Balazs 1980) y 5.5 nidos para Heron Island, Australia (Limpus 1980), con rangos para la mayoría de las localidades entre uno y nueve nidos por temporada. La alta variabilidad en el número de nidos por temporada para C. mydas, es atribuida a la variabilidad interanual y entre las distintas áreas de forrajeo usadas, de la cantidad y calidad del alimento disponible y las condiciones ambientales (Broderick et al. 2001). Asimismo, encontramos que varias hembras salieron a anidar en la isla hasta por más de 90 días. Ya Gremone & Gómez (1983) habían reportado hembras durante 85 días.
El número de hembras que se encuentran anidando es el más usual de los indicadores de tendencias poblacionales. Sin embargo, Russo & Girondot (2009b) afirman que una tendencia baja (±0.01) es imposible de demostrar con una potencia (1-ß, la capacidad de detectar una hipótesis nula falsa) de 0.95. Para detectar una variación de ±0.1 en el tamaño de la población, con esa misma potencia el coeficiente de variación interanual debería ser menor a 0.2, pero aún con este requerimiento, la potencia para especies con grandes variaciones interanuales, como la tortuga verde, es baja.
Las estimaciones previas del número de hembras anidando en Isla de Aves varían mucho, tanto en que fue estimado (hembras o nidadas), el lapso de la observación (diario, semanal, mensual o anual) y la potencia de los cálculos. Parece clara una tendencia a disminuir a partir de las 150 a 200 hembras por noche observadas en 1948 (Pinchon 1967). De acuerdo a esto, en tan solo 30 años, de 1948 hasta 1978 cuando fue creada la base científico naval y se detuvo el saqueo de nidadas y el sacrificio de hembras en Isla de Aves, la población disminuyó a cerca de la cuarta parte. Otras observaciones mencionan 100 hembras por mes en 1973 (Ralston 1974). En los años siguientes las estimaciones señalaban de 300-500 hembras por temporada (Pritchard & Trebbau 1984), número similar para 2006 (Guada & Buitrago 2008), o entre 500-700 hembras para 2004 (Vera 2004b). Peñaloza (2000), al modelar el comportamiento de la población durante los 19 años muestreados por FUDENA, estima el tamaño de la población de hembras reproductivas de C. mydas en Isla de Aves entre 347-1 439 hembras, con una tasa intrínseca de crecimiento de la población de r=0.0099. Lo que significaría que aunque aparentemente la población de tortuga verde de Isla de Aves estaba aumentando, tardaría aproximadamente 150 años para alcanzar los valores de la abundancia histórica.
Los resultados presentados aquí indican que el número de hembras que anida en Isla de Aves se ha incrementado. En 2007 y en 2008 se alcanzaron números estimados, entre 1 500-1 800 hembras anuales. Lo más cerca a los niveles de hace 60 o más años. En otros lugares de anidación de la misma especie, como Tortuguero, Costa Rica, esto se ha interpretado como resultado del esfuerzo de conservación (Troëng & Rankin 2005). En Tortuguero se observan tendencias positivas desde hace 25 años con incrementos del 94% por año (Atkinson et al. 2010). Es posible que más de 30 años de protección del área de reproducción y la presencia de más proyectos de conservación en sus áreas de distribución, esté resultando en un creciente número de hembras y la población anidadora está aumentando.
Las incertidumbres en las estimaciones del número de hembras en una población con un ciclo reproductivo tan complejo como el de la tortuga verde, son muy grandes y requieren de la mayor precisión posible en la toma de datos. En un sitio tan difícil logísticamente como Isla de Aves, esto requiere de un gran esfuerzo que debe ser apoyado con los recursos apropiados y oportunos.
Agradecimientos
Los autores agradecen a “The Archie Carr Center for Sea Turtle Research” por haber proporcionado las marcas metálicas y los instrumentos para el marcaje de las tortugas, así como a los diferentes funcionarios del Ministerio del Ambiente y los voluntarios que participaron en el trabajo de seguimiento. Además, resulta pertinente reconocer el apoyo logístico brindado por la Armada de Venezuela durante las distintas temporadas de anidación. Contribución 410 de la Estación de Investigaciones Marinas de Margarita. Fundación la Salle de Ciencias Naturales.
Referencias
Alvarado, J. & T.M. Murphy. 1999. Nesting Periodicity and Internesting Behavior, p. 115-118. In K.L. Eckert, K.A. Bjorndal, F.A. Abreu-Grobois & M. Donnelly (eds.). Research and Management Techniques for the Conservation of Sea Turtles. Marine Turtle Specialist Group. IUCN/SSC, Washington D.C., USA. [ Links ]
Antczak, A., J. Buitrago, M. Mackowiak de Antczak & H.J. Guada. 2007. A Contribution to the History of Marine Turtles Exploitation in Venezuela. 59th Gulf Caribb. Fish. Inst: 63-73. [ Links ]
Atkinson, C., L. Berrondo Ramos & E. Harrison. 2010. Report on the 2009 Green Turtle program at Tortuguero Costa Rica. Submitted to Caribbean Conservation Corporation and Ministry of the Environment Energy and Telecommunications, Costa Rica. [ Links ]
Balazs, G.H. 1980. Synopsis of biological data on the green turtle in the Hawaiian Islands. NOAA Tech. Memo. NMFS, Honolulu, Hawai. [ Links ]
Bjorndal, K.A., J.A. Wetherall, A.B. Bolten & J.A. Mortimer. 1999. Twenty-six years of green turtle nesting at Tortuguero, Costa Rica: an encouraging trend. Conser. Bio. 13: 126-134. [ Links ]
Bolten, A. 2000. Técnicas Para la Medición de Tortugas Marinas, p. 126-131. In K.L. Eckert, K.A. Bjorndal, F.A. Abreu- Grobois & M. Donnelly (eds.). Técnicas de Investigación y Manejo para la Conservación de las Tortugas Marinas. Grupo Especialista en Tortugas marinas UICN/CSE, Washington D.C., USA. [ Links ]
Broderick, A.C., B.J Odley & G.C. Hays. 2001. Trophic status drives interannual variability in nesting numbers of marine turtles. Proc. Royal Soc. London. Series B-Bio. Sci 268, no. 1475: 1481-1487. [ Links ]
Broderick, A., F. Glen, B.J. Godley & G.C. Hays. 2002. Estimating the number of green and loggerhead turtles nesting annually in the Mediterranean. Oryx 36: 227-236. [ Links ]
Broderick, A., F. Glen, B.J. Godley & G.C. Hays. 2003. Variation in reproductive output of marine turtles. J. Exp. Mar. Bio. Eco. 288: 95-109. [ Links ]
Brownell, W. 1974. Las Tortugas Marinas de Venezuela. Natura 53: 35-39. [ Links ]
Brownell, W. & C. Guzmán. 1974. Ecología de la Isla de Aves con especial referencia a los peces. Mem. Soc. Cien. Nat. la Salle 34: 91-168. [ Links ]
Bustard, H.R. 1972. Sea turtles: Their natural history and conservation. W. Collins & Sons, London, United Kingdom. [ Links ]
Carr, A. 1975. The Ascension Island Green Turtle Colony. Copeia 1975: 547-555. [ Links ]
Carr, A. & H. Hirth. 1962. The ecology and migrations of sea turtles, 5. Comparative features of isolated green turtle colonies. Am Mus Novi 2091: 1-42. [ Links ]
Carr, A., M.H. Carr & A.B. Meylan. 1978. The ecology and migrations of sea turtles, 7. The west Caribbean green turtle colony. Bull. Am. Mus. Nat. Hist. 162: 1-46. [ Links ]
Chacón, D., C.J. Sánchez & J. Ash. 2007. Manual para el Manejo y la Conservación de las Tortugas Marinas en Costa Rica, con Énfasis en la Operación de Proyectos en Playas y Viveros. Sistema Nacional de Áreas de Conservación (SINAC), Ministerio de Ambiente y Energía (MINAE), San José, Costa Rica. [ Links ]
Chacón, D., B. Dick, E. Harrison, L. Sarti & M. Solano. 2008. Manual sobre Técnicas de Manejo y Conservación de las Tortugas Marinas en Playas de Anidación de Centroamérica. Secretaría Pro Tempore de la Convención Interamericana para la Protección y Conservación de las Tortugas Marinas (CIT), San José, Costa Rica. [ Links ]
Cheng, I.J., P.H. Dutton, C.L. Chen, H.C. Chen, Y.H. Chen & J.W. Shea. 2008. Comparison of the genetics and nesting ecology of two green turtle rookeries. J. Zoo 276: 375-384. [ Links ]
Evans, P.G.H. & P.S. Hammond. 2004. Monitoring cetaceans in European waters. Mam. Rev. 34: 131-156. [ Links ]
Gerrodette, T. & B.L. Taylor. 1999. Estimating population size, p. 67-71. In K.L. Eckert, K.A. Bjorndal, F.A. Abreu-Grobois & M. Donnelly (eds.). Research and Management Techniques for the Conservation of Sea Turtles. Publication Nº 4. Marine Turtle Specialist Group. IUCN/SSC, Washington D.C., USA. [ Links ]
Girondot, M., M.H. Godfrey, L. Ponge & P. Rivalan. 2007. Modeling Approaches to Quantify leatherback nesting trends in French Guiana and Suriname. Chel. Cons. Bio. 6: 37-46. [ Links ]
Gómez, J.L. 1980. Conservación del ecosistema de Isla de Aves con especial énfasis en el control y marcaje de la tortuga verde (Chelonia mydas) y de las aves residentes y migratorias. Informe final del proyecto No. 43, FUDENA, Caracas, Venezuela. [ Links ]
González, L.A. & H.J. Guada. 1989. Algunos aspectos sobre la biología de la tortuga verde Chelonia mydas (Linnaeus), 1766 en especial la que anida en Isla de Aves. Venezuela Bol. Soc. Ven. Cien. Nat. 43: 213-226. [ Links ]
Gratiot, N., J. Gratiot, L. Kelle & B. De Thoisy. 2006. Estimation of the nesting season of marine turtles from incomplete data: statistical adjustment of a sinusoidal function. Ani. Cons. 9: 95-102. [ Links ]
Gremone, C. & J.L. Gómez. 1983. Isla de Aves como área de desove de la tortuga verde (Chelonia mydas). Fudena, Caracas, Venezuela. [ Links ]
Guada, H.J. & G. Solé. 2000. Plan de Acción para la Recuperación de las Tortugas Marinas de Venezuela. A. Suárez (ed.). Informe Técnico del PAC No. 39. UNEP Carib. Envir Pro., Kingston, Jamaica. [ Links ]
Guada, H.J. & J. Buitrago. 2008. Tortuga verde, p.169. In J.P. Rodríguez & F. Rojas-Suárez (eds.). Libro Rojo de la Fauna Venezolana. Provita y Shell Venezuela, S.A., Caracas, Venezuela. [ Links ]
Hays, G.C., A.C. Broderick, F. Glen, B.J. Godley, J.D.R. Houghton & J.D. Metcalfe. 2002. Water temperature and internesting intervals for loggerhead (Caretta caretta) and green (Chelonia mydas) sea turtles. J. Ther. Bio. 27: 429-432. [ Links ]
Hilterman, M. & E. Goverse. 2007. Nesting and nest success of the leatherback turtle (Dermochelys coriacea) in Suriname, 1999-2005. Chel. Cons. Bio. 6: 87-100. [ Links ]
Hirth, H.F. 1980. Some aspects of the nesting behavior and reproductive biology of sea turtles. Amer. Zool. 20: 507-523. [ Links ]
Hirth, H.F. 1997. Synopsis of the biological data on the green turtle Chelonia mydas (Linnaeus 1758). FWS Bio. Rep. 97 Tech Report p.126. [ Links ]
Hirth, H.F. & A. Carr. 1970. The green turtle in the Gulf of Aden and the Seychelles Islands. Verb. Konin. Nederl. Akad. Weten., Afd. Natuur. Tweede Reeks 58: 1-44. [ Links ]
IUCN. 2004. IUCN red list of threatened species. 2004. (Consultado: 25 de julio de 2010, http://www.redlist.org). [ Links ]
Jackson, A.L., A.C. Broderick, W.J. Fullerb, F. Glen, G.D. Ruxtond & B. Godley. 2008. Sampling design and its effect on population monitoring: How much monitoring do turtles really need? Bio. Cons. 141: 2932-2941. [ Links ]
Kerr, R., J.L. Richardson & T.H. Richardson. 1999. Estimating the annual size of hawksbill (Eretmochelys imbricata) nesting populations from mark-recapture studies: the use of long-term data to provide statistics for optimizing survey effort. Che. Cons. Bio. 3: 251-256. [ Links ]
Láiz, J. 1979. Conservación del ecosistema “Isla de Aves” con especial énfasis en el control y marcaje de la tortuga verde (Chelonia mydas) y de las aves residentes y migratorias. FUDENA. [ Links ]
Limpus, C.J. 1980. The green turtle, Chelonia mydas (L) in eastern Australia. Management of turtle resources. James Cook University of North Queensland, Research Monograph 1: 5-22. [ Links ]
Lindberg, V. 2000. Uncertainties and Error Propagation. (Consultado: 4 de agosto de 2010, http://www.rit.edu/cos/uphysics/uncertainties/). [ Links ]
Mortimer, J.A. & A. Carr. 1987. Reproduction and Migrations of the Ascension Island Green Turtle Chelonia mydas. Copeia 1: 103-113. [ Links ]
Narciso, S. & G. Solé. 1999. Seguimiento a la población reproductora de la Tortuga Verde Chelonia mydas en el refugio de fauna silvestre Isla de Aves en el lapso comprendido 1979-1997. Acta Cient. Ven. 233. [ Links ]
Peñaloza, C. 2000. Demografía y viabilidad de la población de tortuga verde, Chelonia mydas, en Isla de Aves. Tesis Licenciatura, Universidad Simón Bolívar, Sartenejas, Venezuela. [ Links ]
Pinchon, P. 1967. The green turtle and hawksbill (Reptilia: Cheloniidae) world status, exploitation and trade, p. 125-129. In B. Groombridge & R. Luxmoore 1989 (eds.). Secretariat of the Convention on International Trade in Endangered Species of Wild Fauna and Flora, Lausanne, Switzerland. [ Links ]
Pritchard, P.C.H. & P. Trebbau. 1984. The Turtles of Venezuela. Contributions to Herpetology, Number 2. Society for the Study of Amphibians and Reptiles. Ann Arbor, Michigan, USA. [ Links ]
Rainey, W.E. 1977. Tagging at Aves Island, Venezuela. Mar. Turt. News 2: 6-7. [ Links ]
Rainey, W.E & P.C.H. Pritchard. 1972. Distribution and management of Caribbean sea turtles. Virgin Islands Ecological Research Station, Caribbean Research Institute, College of Virgin Islands, St. Thomas. Contribution No. 105. [ Links ]
Ralston, C. 1974. Un mes en Isla de Aves. Natura 53: 29-33. [ Links ]
Rondón-Médici, M., J. Buitrago & H.J. Guada 2010. Biología reproductiva de la tortuga cardón (Dermochelys coriacea) en playas de la Península de Paria, Venezuela, durante las temporadas de anidación 2000-2006. Interciencia 35: 263-270. [ Links ]
Russo, M. & M. Girondot. 2009a. How long to monitor marine turtle populations to conclude for a trend? Ecol. Sys. Evol. Final report. París. Francia. [ Links ]
Russo, M. & M. Girondot. 2009b. How many night counts to get a defined level of intraannual coefficient of variation for nest counts? Ecol. Sys. Evol. Final report. Paris. Francia. [ Links ]
Sato, K., Y. Matsuzawa, H. Tanaka, T. Bando, S. Minamikawa, W. Sakamoto & Y. Naito. 1998. Internesting intervals for loggerhead turtles, Caretta caretta, and green turtles, Chelonia mydas, are affected by temperatura Can. J. Zool. Rev. Can. Zool. 76: 1651-1662. [ Links ]
Seminoff, J. 2004. Marine Turtle Specialist Group Review 2004 Global Status Assessment Green turtle (Chelonia mydas). Marine Turtle Specialist Group. The World Conservation Union (IUCN). Species Survival Comisión. Red List Programme. Washington, USA. [ Links ]
Schroeder, B. & S. Murphy. 1999 Population surveys on nesting beaches, p. 45-55. In K.L. Eckert, K.A. Bjorndal, F.A. Abreu-Grobois & M. Donnelly (eds.). Research and Management Techniques for the Conservation of Sea Turtles. Marine Turtle Specialist Group. IUCN/SSC. Washington D.C. USA. [ Links ]
Schulz, J.P. 1975. Sea turtles nesting in Suriname. Neder. Corn. Int. Natuur. Med. No. 23, STINASU, Verh. No. 3. [ Links ]
Solé, G. 1992. Isla de Aves, un refugio para la tortuga verde. Profauna 2: 19-20. [ Links ]
Solé, G. & G. Medina. 1989. The Green turtles of Aves Island: 171-173 In. S.A. Eckert, K.L. Eckert & T.H. Richardson (Compilers). Proceedings of the Ninth Annual Workshop on Sea Turtle Conservation and Biology. NOAA Technical Memorandum NMFS-SEFC-232. [ Links ]
Troëng, S., D. Chacón & B. Dick. 2004. Possible decline in leatherback turtle Dermochelys coriacea nesting along the coast of Caribbean Central America. Oryx 38: 395-403. [ Links ]
Troëng, S. & E. Rankin. 2005. Long-term conservation efforts contribute to positive green turtle Chelonia mydas nesting trend at Tortuguero, Costa Rica. Biol. Conserv. 121: 111-116. [ Links ]
Vera, V. 2002. Restarting the green turtle (Chelonia mydas) tagging and conservation project in Aves Island Wildlife Refuge. Venezuela. 22 Annual Symposium on Sea Turtle Biology and Conservation. Miami, Florida, USA. [ Links ]
Vera, V. 2003. Aves Island Wildlife Refuge, Venezuela. Results 2002 peak nesting season. 23 Annual Symposium on Sea Turtle Biology and Conservation, Kuala Lumpur, Malasia. [ Links ]
Vera, V. 2004a. Updating migratory movements of the green turtle (Chelonia mydas) population from Aves Island Wildlife Refuge, Venezuela. 24 Annual Symposium on Sea Turtle Biology and Conservation, San José, Costa Rica. [ Links ]
Vera, V. 2004b. Proyecto de seguimiento y conservación de a población de tortuga verde (Chelonia mydas) en el Refugio de Fauna Silvestre Isla de Aves (Dependencia Federales) 55-61. In R. Babarro, A. Sanz & B. Mora (eds.). Tortugas marinas en Venezuela. Acciones para su conservación. Oficina Nacional de Diversidad Biológica, Fondo Editorial Fundambiente, Caracas, Venezuela. [ Links ]
Wetherall, J.A., G.H. Balazs & M.Y.Y. Yong. 1998. Statistical Methods for Green Turtle Nesting Surveys in the Hawaiian Islands, 295-297. In S.P. Epperly & J. Braun (Compilers). Proceedings 17th Annual Sea Turtle Symposium, 4-8 March 1997, Orlando, Florida, USA. [ Links ]
Witherington, B.E. 1992. Behavioral responses of nesting sea turtles to artificial lighting. Herpetologica 48: 31-39. [ Links ]
*Correspondencia a: Vicente Vera: Ministerio del Poder Popular para el Ambiente. CSB. Torre Sur. Piso 9. El Silencio. Caracas. Venezuela; v.vicente1@gmail.com
Joaquín Buitrago: Estación de Investigaciones Marinas de Margarita. Fundación La Salle de Ciencias Naturales. Final Calle Colón. Punta de Piedras Isla de Margarita. Venezuela; jbuitrago@edimar.org
1. Ministerio del Poder Popular para el Ambiente. CSB. Torre Sur. Piso 9. El Silencio. Caracas. Venezuela; v.vicente1@gmail.com
2. Estación de Investigaciones Marinas de Margarita. Fundación La Salle de Ciencias Naturales. Final Calle Colón. Punta de Piedras Isla de Margarita. Venezuela; jbuitrago@edimar.org
Recibido 03-V-2011. Corregido 13-X-2011. Aceptado 17-XI-2011.