Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.59 n.2 San José Jun. 2011
Morfología de las especies de Hyphessobrycon (Characiformes: Characidae), grupo heterorhabdus, en Colombia
Carlos A. García-Alzate, Raquel I. Ruiz-C., César Román-Valencia, Melissa I. González & Diana X. Lopera
Universidad del Quindío, Laboratorio de Ictiología, A. A. 2639, Armenia, Quindío, Colombia; cagarcia@uniquindio.edu.co, zutana_1@yahoo.com, ceroman@uniquindio.edu.co, meli328@gmail.com
Dirección a correspondencia.
Abstract
Morphology of the species Hyphessobrycon, heterorhabdus group (Characiformes: Characidae) in Colombia. Hyphessobrycon is the most numerous and morphologically complex genus of Characidae, and includes 18 species reported for Colombia, from which thirteen belong to the heterorhabdus-group different methods have been proposed for species identification within this genus. This study used these species to undertake a morphogeometric analysis by the Box Truss and Thin Plate Splin (TPS) methods; 13 homologous landmarks type I and three type II were used. The result of cluster analysis indicated that these species are represented by two big groups: robust and thin. The uniform and non uniform components, and the principal warps (WP) and partial warps (Wparc), described the shape changes related to body depth, involving relative displacements of the appendicular skeleton and the cephalic region. All species were characterized by allometric growth with the exception of Hyphessobrycon mavro, who presented an isometry between the landmarks 6-7. Two new measures are proposed for species discrimination in the group (snout-supraoccipital spine distance and supraoccipital spine-pelvic fin). Rev. Biol. Trop. 59 (2): 709-725. Epub 2011 June 01.
Key words: box truss, landmarks, tropical fish, thin plate spline (TPS).
Resumen
El género Hyphessobrycon incluye dieciocho especies reportadas para Colombia de las cuales 13 son miembros del grupo heterorhabdus; con las mismas, se realizó un análisis morfogeométrico por medio del Método de Cerchas (Box Truss) y Láminas Delgadas (TPS). Se usaron 13 hitos homólogos tipo I y tres tipo II. El resultado del análisis cluster, llevado a cabo con cada una de las metodologías indicó que estas especies están representadas en dos grandes grupos: robustas y delgadas. Las deformaciones parciales, los componentes uniformes, no uniformes, Warps principales y Warps parciales describieron cambios de la forma relacionados con la profundidad del cuerpo e involucraron desplazamientos relativos del esqueleto apendicular y de la región cefálica. Todas las especies se caracterizan por presentar crecimiento alométrico excepto Hyphessobrycon mavro con isometría entre los hitos 6-7. Se plantean dos nuevas medidas discriminantes (hocico-supraoccipital y supraoccipital-aleta pélvica) para las especies del grupo.
Palabras clave: cerchas, hitos, pez tropical, thin plate spline (TPS).
Hyphessobrycon Durbin (en Eigenmann 1908) es un género de pequeños peces carácidos que cuenta con alrededor de 125 especies válidas (García-Alzate et al. 2010a) se encuentran distribuidas en todas las cuencas del norte de América del sur. Además, se ha planteado el reconocimiento de grupos de especies dentro del género basados en el modelo de coloración o pigmentación (Géry 1977, Weitzman & Palmer 1997), de interés particular el grupo heterorhabdus, definido inicialmente por presentar una banda oscura en la parte lateral del cuerpo (García-Alzate et al. 2008a). También, se ha planteado como grupo monofilético, con base en dos caracteres osteológicos: 13 a 14 epipleurales y metapterigoide sin proyección ventral y no en contacto con el simpléctico (García-Alzate 2009).
García-Alzate et al. (2010a) reportan 15 especies de Hyphessobrycon para Colombia, actualmente el número de especies asciende a 22: H. bentosi Durbin, H. columbianus Zarske & Géry, H. condotensis Regan, H. ecuadorensis Eigenmann, H. erythrostigma Fowler, H. panamensis Durbin, H. saizi Géry, H. sweglesi Géry, H. sebastiani García-Alzate et al., H. agulha Fowler, H. acaciae García-Alzate et al., H. amaronensis García-Alzate et al., H. diancistrus Weitzman, H. heterorhabdus (Ulrey), H. metae Eigenmann & Henn, H. mavro García-Alzate et al., H. niger García-Alzate et al., H. ocasoensis García-Alzate & Román-Valencia, H. oritoensis García-Alzate et. al., H. poecilioides Eigenmann, H. proteus Eigenmann, H. taguae García-Alzate et al., las últimas 13 pertenecientes al grupo heterorhabdus.
Dentro del género Hyphessobrycon los análisis tradicionales de la forma han sido ampliamente usados para discriminar diferencias entre especies, pero han sido poco útiles para analizar la variación entre grandes grupos, es así que los análisis de forma diferentes al tradicional como es el método de morfometría geométrica, representa un recurso metodológico en la determinación de medidas discriminantes entre grupos que pueden ser utilizadas para diferenciar especies dentro del género Hyphessobrycon (García-Alzate et al. 2010b), además, permite la distinción entre forma y talla, comparar organismos mediante sus estructuras homólogas, cuantificar la variabilidad de la forma en múltiples escalas espaciales, y estudiar las posibles correlaciones entre la variabilidad y otros parámetros morfológicos y/o ambientales (Rohlf 2000, Zelditch et al. 2004, Ruiz-Calderón & Cipriani 2006). Así, el objetivo de este trabajo fue realizar un análisis morfogeométrico de las especies del género Hyphessobrycon grupo heterorhabdus presentes en Colombia.
Materiales y Métodos
Se analizaron 612 ejemplares adultos provenientes de algunas de las instituciones y museos registrados en la siguiente página web: http://www.asih.org/codons.pdf entre las que se incluyen: AUM, IAvHP, ICNMHN, MBUC-V, MCNG, MCP y MUSM, con la adición de: Colección de Ictiología de la Universidad de Antioquia, Colombia (CIUA), Instituto para la Investigación y Preservación del Patrimonio Cultural y Natural del Valle del Cauca, Cali, Colombia (IMCN), Colección de Peces del Museo de Historia Natural de la Pontificia Universidad Javeriana, Bogotá, Colombia (MPUJ) y Laboratorio de Ictiología-Universidad del Quindío, Armenia, Colombia (IUQ).
El análisis de disparidad general se realizó en las especies que tuvieron más de 30 ejemplares (número mínimo para que el programa TPS arroje resultados): H. acaciae, H. agulha, H. amaronensis, H. ocasoensis, H. poecilioides, H. proteus e H. taguae a partir de la metodología propuesta por Rolff (1996). Otras especies del grupo heterorhabdus fueron analizadas mediante la técnica de cerchas (Strauss & Bookstein 1982). El análisis de disparidad morfológica a partir del TPS consistió en digitalizar en el programa TpsDig2 (Rolhf 2005) los hitos morfológicos sobre la imagen, la cual fue obtenida sobre el lado izquierdo de cada individuo con una cámara digital de alta resolución Sony (Cybershot W130), instalada sobre un banco de fotografía a 10cm del ejemplar (Fig. 1). Entonces, se utilizó la opción macro del lente para adquirir imágenes sin deformación en los márgenes y papel milimetrado como fondo al seguir la metodología descrita por Ruiz-Calderón & Cipriani (2006). Se seleccionaron 16 puntos anatómicamente homólogos o hitos, los cuales fueron ubicados en estructuras homólogas que permitieron describir la forma general del cuerpo: 1-Hocico, 2-Extremo posterior de la espina supraoccipital, 3-Base anterior de la aleta dorsal, 4-Base posterior de la aleta dorsal, 5-Base de la aleta adiposa, 6-Extremo dorsal del pedúnculo caudal, 7-Punto de origen de los radios medios caudales, 8-Extremo ventral del pedúnculo caudal, 9-Base posterior de la aleta anal, 10-Base anterior de la aleta anal, 11-Base de la aleta pélvica, 12-Base de la aleta pectoral, 13-Sinfisis, 14-Borde anterior de la órbita ocular, 15-Borde posterior de la órbita ocular y 16-Borde posterior de la abertura opercular; los 13 primeros hitos correspondieron al tipo I y los tres últimos al tipo II o puntos pseudohomólogos, ya que fueron tomados con respecto al hito 1 (Fig. 1).
La talla de cada configuración fue estimada usando la “Talla del Centroide” (TC) (Bookstein 1991); una vez que todos los individuos fueron digitalizados los efectos de traslación, escala y rotación fueron eliminados del conjunto de configuraciones, al utilizar un análisis ortogonal de mínimos cuadrados generalizados de Procrustes (AGP) (Rohlf & Slice 1990), se implementa en el programa tpsSmall (Rolhf 2003); en este procedimiento todas las configuraciones fueron escaladas a TC=1.
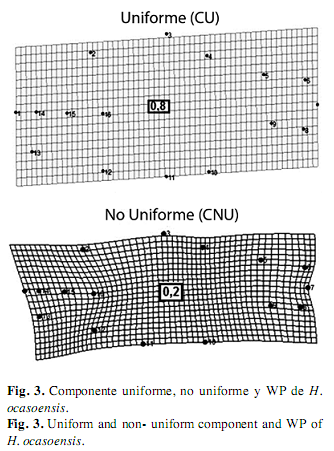
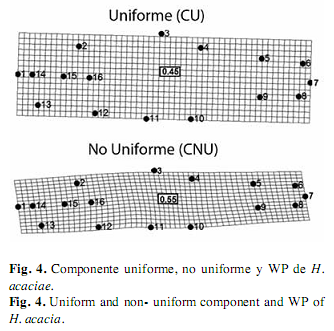
La disparidad entre las configuraciones alineadas fue descrita con un análisis de láminas finas, conocido como TPS (Thin Plate Spline) (Bookstein 1991, Zelditch et al. 2004). En este análisis cada una de las configuraciones (CI) fue comparada con la configuración consenso (CC) de toda la muestra en dos pasos: 1) Al sobreponer CI a CC y 2) Y al deformar el plano de CI hasta hacer coincidir las posiciones de todos sus hitos con las posiciones de los hitos correspondientes en la CC. La deformación que requiere esta lámina imaginaria para lograr la sobreposición de todos los hitos es una medida de la diferencia entre las dos formas. Esta distorsión se determinó a través de dos componentes; el primero consistió en un componente uniforme o affine y el segundo en uno no uniforme o no affine; las deformaciones asociadas a este componente fueron resultado de la adición de los efectos de todos los Wparc (Warp Parciales) calculados para cada comparación realizada (Zelditch et al. 2004, Rohlf et al. 1996).
Por lo tanto, se describió la forma y variabilidad en cada especie a partir de contrastar las configuraciones individuales (individuos) con la CC de la especie en el programa tpsSplin (Rohlf 2004), del cual se obtienen los WParc que explican los ejes de deformación en la especie a partir del componente uniforme y no uniforme. Los WP (Warps Principales) fueron obtenidos mediante la ecuación K-3 (K=Número de hitos) (Zelditch et al. 2004); el análisis de los WP describieron la magnitud de las deformaciones (locales o globales) con un factor de escala de 0.22.
Para probar si las diferencias de forma están relacionadas con la talla, se realizó un análisis de regresión multivariada de las deformaciones uniformes y de los valores de los WParc con la TC de cada ejemplar. La significancia de este ajuste (H0=isometría) fue evaluada de cuatro formas: la prueba generalizada F de Goodall, Lambda de Wilks, análisis de permutación y regresión lineal simple; todos ellos llevados a cabo en el programa tpsRegr (Rohlf 2003).
Así mismo, se realizó un diseño de cerchas mediante la metodología propuesta por Strauss & Bookstein (1982) y posteriormente seguida por García-Alzate et al. (2010b); donde se incluyen las 13 especies del grupo heterorhabdus, la digitalización de los hitos sobre la imagen de cada uno de los individuos se realizó en el programa Scion Image Beta 4.02 y se determinaron las distancias entre estos, las coordenadas obtenidas fueron procesadas en el programa Past 1.81 (Paleontological Statistics) bajo Windows (Hammer et al. 2008), donde se obtuvieron 28 coordenadas y se realizaron tres análisis: 1) Deformaciones parciales con los datos transformados a distancias procrustes, 2) Análisis de componentes principales (ACP), donde las coordenadas fueron transformadas con el método de Burnaby para especies con crecimiento alométrico, el cual maximiza las diferencias de aquellas variables que contribuyen a la separación de los grupos por su forma, independiente del tamaño, y 3) Análisis de alometría multivariada. Con las coordenadas de cada una de las especies por medio de los dos métodos, se llevó a cabo un análisis de agrupamiento en el programa PAST versión 1.83 bajo Windows (Hammer et al. 2008), para evaluar la similitud de formas entre las especies por medio del algoritmo UPGMA.
Material examinado: Hyphessobrycon agulha: Colombia: IAVH-P 8333, (22) (26.2-47.2mm de LE); Leticia, afluente rio Purité, Amazonas, 25 mar. 2001. IAVH-P 8335, (32) (32.6-47.9mm de LE); Leticia, afluente quebrada Matamatá, Amazonas, 18 mar. 2001. IAVH-P 8345, (15) (20.6-26.0mm de LE); Leticia, afluente Quebrada Matamatá, Amazonas, 19 mar. 2001. Perú: MUSM 23173, (8) (29.2-39.8mm de LE); Madre de Dios, Quebrada Km. 43 Tambopata. MUSM 25315, (9) (25.1-32.1mm LE); Madre de Dios, quebrada Tambopata, Km 43. H. diancistrus: ver García-Alzate et al. 2008c. H. heterorhabdus: Colombia: ICNMHN 5063, (5) (26.4-31.4mm de LE); Río Puré, Letícia, Amazonas, 8 ene. 2000. Brasil: MCP 41577, (4) (26.3-29.5mm de LE); Para, Igarapé Acuí, 21 oct. 2006. H. metae: Colombia: ICNMHN 12274, (8) (24.0-30.0mm de LE). IUQ 2340, (2) (22.1-24.1mm de LE); Brazuelo caño Guayapa, playa rica, Vista Hermosa, Meta, 9 jul. 2008. IUQ 2341, (1) (23.1mm de LE); caño 1km antes de las Brisas, Vista Hermosa, Meta, 10 jul. 2008. IUQ 2342, (4) (21.7-27.3mm de LE), 1km antes del caño Guapaya en la vía playa rico, Vista Hermosa, Meta, 9 jul. 2008. MPUJ 3801, (7) (21.6-24.4mm de LE). MPUJ 3848, (15) (21.6-27.7mm de LE). Venezuela: MCNG 32469, (18) (21.9-26.0mm de LE), Parque Nacional Aguara-Guariquita, rio San José, 13 ene. 1995. H. ocasoensis: ver García-Alzate & Román-Valencia 2008a. H. poecilioides: ver García-Alzate et al. 2010c. H. proteus: ver García-Alzate et al. 2010c. H. amaronensis: ver García-Alzate et al. 2008c. H. taguae: ver García-Alzate et al. 2008c. H. mavro: ver García-Alzate et al. 2010c. H. niger: ver García-Alzate et al., 2010c y H. acaciae: ver García-Alzate et al. 2010c.
Resultados
Disparidad general: El valor de la pendiente (0.99) y la correlación (1.0) indicó que inferencias sobre la forma de éstas especies pueden ser analizadas en el espacio lineal tangente. El ajuste del modelo lineal multivariado en relación a las deformaciones descritas por WParc (i.e. componente uniforme + componente no uniforme) no arrojó evidencias para aprobar la hipótesis de isometría (Cuadro 1).
La mayor explicación sobre las deformaciones de las especies es dada por el componente uniforme (>50%), mientras cambios locales (componente no uniforme) presentaron una menor influencia sobre la forma general de las especies. En H. agulha las deformaciones del componente uniforme describieron el desplazamiento anterior de la región cefálica, mientras la región dorsal presenta un desplazamiento hacia el extremo posterior, explica el 89% de la disparidad morfológica de la especie. El componente no uniforme señaló el desplazamiento transversal en sentido anteriordorsal de la región ventral, mientras la región dorsal presentó desplazamiento transversal en sentido anterior-ventral (Fig. 2). Mientras que en H. amaronensis el componente uniforme describió el desplazamiento de la región de la aleta hacia el extremo posterior del cuerpo, entre tanto, la zona ventral se desplazó hacia la región anterior, explicó el 61% de la variación de la forma. El componente no uniforme señaló un desplazamiento dorsal de la región pectoral y pélvica, una contracción de la parte anterior del cráneo y de la región caudal, explicó el 39% de la variación morfológica de la especie.
En H. ocasoensis, el componente uniforme describió cambios en la región de la aleta dorsal hacia la parte anterior, mientras la región ventral se desplazó hacia el extremo posterior, lo cual describe el incremento de la profundidad del cuerpo en la especie, el componente no uniforme describió el movimiento hacia la parte posterior de la región opercular, lo cual reveló el 20% de variación de la forma en ésta especie (Fig. 3), al mismo tiempo en H. poecilioides, el componente uniforme describió el desplazamiento de los hitos de la zona anterior hasta la región posterior del cuerpo, y hacia la región anterior de los de la zona ventral, este componente expresó el 79% de la variación de la forma; por otro lado, el componente no uniforme señaló una contracción de la región media ventral en donde explica el 21% de la variación de la forma.
En H. proteus, el componente uniforme solo describió el 38% de la variación total en el cual se observó desplazamientos no muy marcados desde la espina supraoccipital al inicio de la aleta dorsal y hacia la parte anterior del cuerpo, entre tanto con el componente no uniforme se presentaron desplazamientos de los hitos de la región dorsal hacia arriba y de los hitos de la región ventral de tal manera que resulta en una expansión, a su vez se visualizó una contracción entre estos hitos y originó un acercamiento entre la base de las aletas y explicó el 62 % de la variabilidad total. Así mismo, en H. taguae, la deformación descrita por el componente uniforme resultó del desplazamiento anterior y hacia arriba de los hitos de la zona dorsal del cuerpo que dan origen a la expansión de la parte media del cuerpo y revelo el 82% de la variabilidad total, mientras que el componente no uniforme describió una expansión de la cabeza y una contracción en el extremo ventral del pedúnculo caudal y explicó 18% de la variación de la forma de esta especie.
En H. acaciae la deformación explicada por medio del componente uniforme resultó del desplazamiento de los hitos de la zona dorsal hacia atrás y de los hitos de la zona ventral hacia delante, estos movimientos dieron origen a la expansión de la región media del cuerpo, este componente explicó el 55% de la variación morfológica de esta especie, y el componente no uniforme describió la contracción longitudinal del cuerpo debido al desplazamiento hacia arriba de todos los hitos de la zona ventral, lo cual explicó el 45% de la variación (Fig. 4).
Se obtuvieron 13 WP para cada especie, los cuales describieron la magnitud de los ejes de deformación general y local para cada una. La variación morfológica interespecificas presentó alta similaridad (>50%), sólo un pequeño porcentaje explicó la variación morfológica, desde los cuales se puede plantear diferencias de los principales ejes de deformación de las especies.
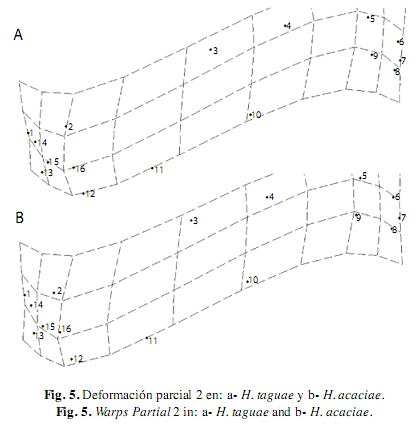
El WP 1 posee el menor autovalor, describe una deformación generalizada en todas las especies, la curvatura del cuerpo y el acortamiento de la cabeza a partir de la expansión de la parte media para todas las especies analizadas, excepto en H. poecilioides e H. amaronensis, en la que el WP 1 detalló la contracción sobre la región caudal. El WP 2 contrasta la exposición de la parte anterior y posterior del cuerpo, en todas las especies se observó mayor exposición de la parte anterior debido a la expansión de la región dorsal (hitos 3 y 4) y de la contracción dorsal de la región pélvica (hito 11); excepto en H. taguae e H. acaciae en las que el WP 2 presentó una mayor expansión en la región caudal en contraste con la menor exposición de la parte anterior del cuerpo (Fig. 5). El WP3 describió la contracción dorsal de la región caudal (hitos 8, 9, 10 y 11) en contraste a la expansión de la región cefálica, excepto en H. poecilioides, H. proteus y H. acaciae en donde la contracción dorsal del WP 3 se mostró en la región cefálica, mientras se contempló la expansión de la región caudal (Fig. 6).
El WP 4 detalló ondulaciones continuas, en donde la altura de la región cefálica y caudal se contraen en tanto la altura de la región media del organismo se expande, excepto en H. taguae donde el eje de cambios plantea una expansión gradual y transversal de la región caudal respecto a la parte anterior del cuerpo. El WP 5 indicó contracciones de las regiones cefálica y caudal junto a una expansión de la región media, excepto en H agulha, H. proteus y H. acaciae en donde éste eje describe una contracción en la región media del cuerpo y al mismo tiempo la región cefálica y caudal se desarrolla en éstas especies.
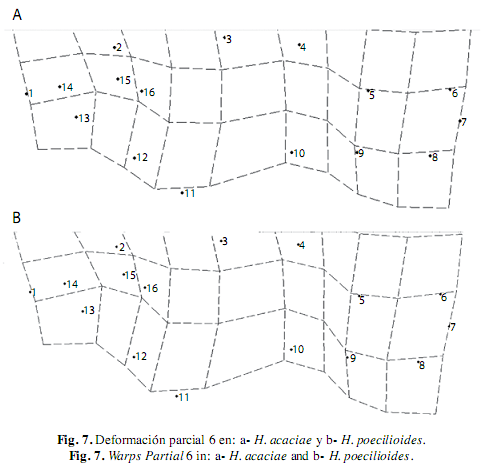
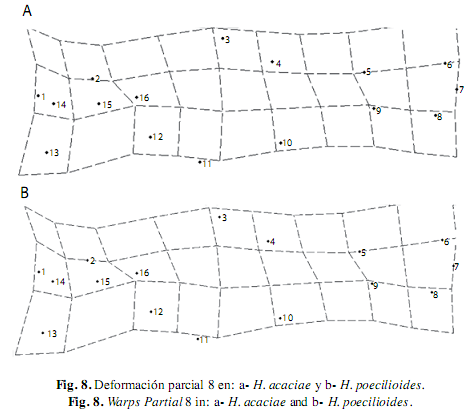
El WP 6 expresó múltiples ondulaciones en el cuerpo, generadas a partir del desplazamiento dorsal posterior del borde posterior de la órbita y del opérculo (hitos 15 y 16), al igual que el origen y fin de la aleta anal (hitos 10 y 9), excepto en H. acaciae y H. poecilioides en donde el eje de cambios descrito por éste WP, a pesar de conservar la deformación de múltiples ondas en el cuerpo de las especies analizadas, plantea en H. acaciae un declive transversal de la región dorsal del cuerpo hacia el extremo posterior (Fig. 7), mientras en H. poecilioides describe un ascenso transversal de la región ventral hacia el extremo posterior (Fig. 8).
Los WP restantes describieron deformaciones de tipo local que contribuyeron en un 14.64% a la explicación de los cambios de la forma. Después, se destacan los WP 8, 9 y 11.
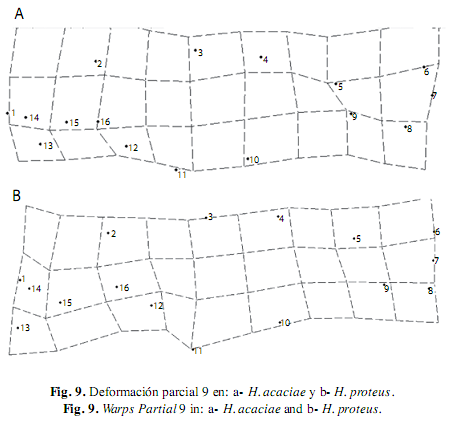
El WP 8 describe una deformación en la región posterior al opérculo, el cual se contrae junto con el borde posterior de la órbita, mientras que la espina supraoccipital se desplazó en sentido anterior ventral que resulta en una expansión en la región predorsal, excepto en H. poecilioides y H. acaciae donde éste eje de deformación detalla un desplazamiento uniforme de ascenso transversal de la región dorsal del cuerpo hacia el extremo posterior del cuerpo (Fig. 9).
El WP 9 en las especies H. proteus e H. taguae plantea un desplazamiento ventral del origen de la aleta pélvica (hito 11) que genera una expansión en dicha región. En las especie H. agulha y H. amaronensis el eje de deformación descrito por éste WP plantea una contracción de la región pélvica y una corta expansión de la región pectoral. H. ocasoensis presenta una expansión en la región del origen de la aleta dorsal (hito 3). Mientras en las especies H. acaciae y H. proteus el eje de cambio indica un cambio uniforme de ascenso transversal de la región dorsal del cuerpo hacia el extremo posterior del cuerpo.
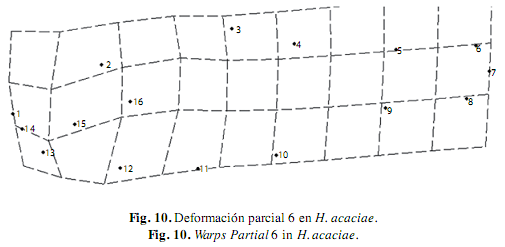
El eje de cambio referido por el WP 11 describe deformaciones locales de la región caudal en H. agulha, resultado de la expansión dorsal del pedúnculo caudal (hito 6) y del fin de la aleta anal. En las especies H. amaronensis, H. poecilioides, H. proteus, y H. taguae éste eje de deformación representa un acercamiento entre el hocico y borde anterior de la órbita con el borde posterior del opérculo, acompañado de una expansión de la región pectoral, generado desde el desplazamiento dorsal del punto medio del opérculo (hito 16), y en H. acaciae se observó un desplazamiento posterior corto del opérculo, sin embargo, éste WP represento en la especie movimiento uniforme de ascenso transversal de la región dorsal del cuerpo hacia el extremo posterior (Fig. 10).
Análisis de cerchas: H. poecilioides, H. proteus y H. ocasoensis se distinguieron de las demás especies del grupo heterorhabdus por presentar mayor robustez; H. ocasoensis describió un cambio que involucró el desplazamiento posterior de los hitos de la región cefálica (1, 2, 13, 14, 15 y 16), los cuales dieron origen a una expansión; entre tanto, dos contracciones fueron visualizadas, la primera en la aleta anal por el acercamiento entre la base de esta y las demás aletas ventrales (pélvicas y pectorales), y la segunda en el pedúnculo caudal (Fig. 11a I). Así bien, H. proteus presentó una contracción y una expansión; la primera involucró el acercamiento entre el punto de origen de los radios medios caudales (hito 7), el extremo ventral del pedúnculo caudal (hito 8) y la base posterior de la aleta anal (hito 9); la segunda deformación involucró los hitos de la parte posterior de la región cefálica (2, 11, 15 y 16) (Fig. 11a II). H. poecilioides mostró una expansión en la parte anterior de la cabeza (1, 13, 14 y 15), y una contracción, como resultado del acercamiento de la base anterior de la aleta anal y pélvica (Fig. 11a III). H. proteus se distingue de H. ocasoensis por tener una aleta anal más larga (cercha IV) y un pedúnculo caudal menos profundo (cercha V).
Las especies restantes se caracterizaron por presentar un cuerpo alargado; en H. agulha se visualizaron dos contracciones; una en la parte posterior de la región cefálica y otra en el pedúnculo caudal, y una expansión en la región de la aleta anal (Fig. 11a IV). H. heterorhabdus registró una expansión que involucró todos los hitos de la región cefálica y una contracción en la base anterior de la aleta dorsal (hitos 3 y 4) (Fig. 11a V); H. agulha se distingue de H. heterorhabdus por un pedúnculo caudal corto (cercha V). En H. taguae exhibió una expansión que involucró todos los hitos de la región cefálica y de la base de la aleta dorsal; y el acercamiento del hito 8 (radios medios caudales) y 9 (extremo ventral de los radios medios caudales) (Fig. 11b I). En H. amaronensis se visualizó el acercamiento entre los hitos 1 y 14 (hocico y borde anterior de la órbita ocular) que resultó en el acortamiento del hocico; además, se divisó una expansión en la aleta anal (hitos 9 y 10); esta especie fue la única que presentó este tipo de deformación (Fig. 11b II).
H. metae se distinguió de las demás especies por dos contracciones, la primera en la parte anterior de la cabeza (hitos 1, 13 y 14) y la segunda en el pedúnculo caudal, la cual resultó en la reducción de la profundidad del cuerpo por el acercamiento de los hitos 5, 6, 8 y 9 (Fig. 11b III). H. diancistrus se caracterizó por poseer una región predorsal (entre los hitos 2-3) más larga en comparación con las demás especies; se visualizó una contracción que surgió como resultado del acercamiento de los hitos de la cabeza (1, 14, 15 y 16) (Fig. 11b IV).
En H. mavro se percibió una expansión entre los hitos 4 y 5 (base anterior y posterior de la aleta dorsal), en esta especie la parte anterior de la cabeza se acorta como resultado del acercamiento de los hitos 13 y 14 (sínfisis y borde anterior de la órbita ocular) (Fig. 11b V); Hyphessobrycon acaciae presentó cambios en la cabeza producto del desplazamiento de sus estructuras; la parte anterior se acorta debido al acercamiento del hocico y borde anterior de la órbita ocular (hitos 1 y 14), y la parte posterior se expande por el desplazamiento hacia la parte posterior de los hitos 12 (base de la aleta pectoral) y 16 (borde posterior de la abertura opercular) (Fig. 11b VI); en H. niger se visualizó el acortamiento de la parte ventral del pedúnculo caudal por el acercamiento de los hitos 8 y 9 (origen de los radios medios caudales y extremo ventral del pedúnculo caudal). Esta especie sobresale de las otras dos por tener el borde dorsal del pedúnculo caudal más largo (cercha V), mientras que H. mavro y H. niger se distinguen por la profundidad del cuerpo (cerchas III y IV) (Fig. 11b VII).
El análisis de componentes principales indicó que todas las especies son diferentes, los dos primeros componentes explicaron el 96.640% de la varianza total, el primer componente explicó el 86.092% de la variación por las coordenadas hocico-extremo posterior de la espina supraoccipital; en tanto el componente 2 fue explicado por las coordenadas extremo posterior de la espina supraoccipital-inicio de la pectoral (Cuadro 2 y Fig. 12).
Las especies se caracterizaron por presentar un crecimiento alométrico en todas sus cerchas. La región dorsal entre los hitos 2-7, 2-12, 3-11, 4-10, 5-9 y 6-8 mostraron crecimiento alométrico positivo; entre los hitos del margen dorsal de la región cefálica (1 y 2) ocurre el caso contrario, el crecimiento es de tipo alométrico negativo. En la región ventral entre los hitos 9-10, 11-12 y 13-1 se presentó un crecimiento alométrico negativo mientras que entre los hitos 12-13, 11-10 y 9-8 se observó crecimiento alométrico positivo; en estas especies a medida que el desarrollo ontogénico avanza se incrementa la longitud y profundidad del cuerpo, al mismo tiempo la región cefálica se reduce en relación al tamaño corporal; sin embargo, ocurren dos excepciones en H. mavro ya que se expone una isometría entre los hitos 6-7 y en H. acaciae alometria positiva entre los hitos 1-12 (Fig. 1 y Cuadro 3).
Análisis de similitud: El análisis cluster realizado por el método de cerchas indicó que las especies mas parecidas fueron H. proteus e H. poecilioides, y éstas a su vez con H. ocasoensis; por otra parte, se encontró a H. heterorhabdus y H. agulha, H. taguae y H. amaronensis, H. metae y H. diancistrus, H. mavro, H. niger e H. acaciae como especies que tienen una mayor afinidad morfológica (Fig. 13a); y, el análisis cluster realizado por medio del TPS mostró resultados similares, ya que se dividen en dos grupos; en el primero se encuentran H. poecilioides, H. proteus e H. ocasoensis, de tal forma que estas dos últimas son las más similares; en el otro grupo se encuentran H. amaronensis, H. agulha, H. taguae e H. acaciae (Fig. 13b).
Discusión
Los análisis de morfometría, en particular en teleósteos, han sido la fuente primaria de información para estudios taxonómicos y evolutivos (Meléndez 2002). Las deformaciones observadas tienen relación con el tipo de crecimiento de las especies, es evidente por comparaciones realizadas entre los individuos de cada especie, donde el componente uniforme en la mayoría de los casos describió deformaciones relacionados con el incremento o reducción de la región cefálica y/o profundidad del cuerpo, esta es la razón por la cual este componente explica la mayor parte de las diferencias entre los individuos; a diferencia del componente no uniforme donde se describen desplazamientos generalmente locales ubicados en la región cefálica o del pedúnculo caudal. Las relaciones lineales simples fueron significativas, indican la dependencia del componente uniforme y de los trece Wparc con la talla de los individuos, además, existe una relación significativa entre el componente uniforme y los Wparc de la muestra de cada una de las especies y la talla centroide (Ruiz-Calderón & Cipriani 2006).
El uso de la metodología de cerchas permitió encontrar medidas discriminantes que junto con las tradicionales corroboran la identidad taxonómica de las especies; entre las medidas usuales destacan la profundidad del cuerpo, longitud de la aleta dorsal y anal, de la mandíbula superior y del hocico (García-Alzate et al. 2008a, b, c; 2010b, García-Alzate & Román-Valencia 2008a); en cerchas son evidentes aquellas relacionadas con la profundidad del cuerpo (extremo posterior de la espina supraoccipital-inicio de la aleta pectoral) y el tamaño de la cabeza (hocico-extremo posterior de la espina supraoccipital); estas medidas pueden servir como referencia en estudios de variación entre poblaciones dada su utilidad para separar especies. Los resultados obtenidos en las deformaciones parciales fueron corroborados con las láminas TPS, los WP, Wparc, componentes uniforme y no uniforme, indican así que ambas metodologías fueron adecuadas para evaluar la disparidad morfológica de las especies.
García-Alzate & Román-Valencia (2008a) plantean que las especies del género Hyphessobrycon trans-andinas se caracterizan por ser de gran tamaño y extremadamente robustas comparadas con las demás especies cisandinas, hecho que se confirma con los resultados obtenidos en el análisis cluster por medio de las dos metodologías; este análisis indicó que la similaridad de formas se relaciona con la distribución de las especies, son más equivalentes las especies distribuidas en la misma área geográfica, en este caso Amazonas, Orinoco y alto Cauca/Magdalena; sugiere que la comparación morfológica probablemente se debe al aislamiento geográfico reciente (González-Díaz et al. 2005).
García-Alzate (2009) asume que H. ocasoensis es la especie basal y se excluye a las especies H. proteus e H. poecilioides del grupo e inclusive del género debido a que presentan una estructura osteológica distinta a las demás especies de Hyphessobrycon; sin embargo, estas dos especies son muy cercanas a H. ocasoensis, por lo cual se plantea que la forma robusta y grande corresponde a especies ancestrales estrechamente relacionadas con el género Hyphessobrycon, y específicamente con el grupo heterorhabdus, mientras la forma delgada y pequeña corresponde a especies más derivadas, se incluye H. diancistrus, H. heterorhabdus, H. metae, H. agulha, H. amaronensis, H. taguae, H. mavro, H. niger y H. acaciae; así la semejanza de formas no solo se debe al aislamiento geográfico reciente, si no que también a las estrechas relaciones de parentesco entre las especies (García-Alzate et al. 2010b).
Las especies analizadas en este estudio se caracterizaron por exhibir un crecimiento alométrico; la longitud y profundidad del cuerpo presentaron alometria positiva; y la región cefálica, entre la base de la aleta pélvica y pectoral, la región de la aleta anal y del aparato mandibular alometria negativa; con base en esto y en los reportes realizados para otras especies se plantea que este tipo de crecimiento es generalizado para las especies de la familia Characidae (García-Alzate & Román-Valencia 2008b; García-Alzate et al. 2010b y Ruiz-Calderón & Cipriani 2006).
Agradecimientos
Se recibió financiación de la Universidad del Quindío-Vicerrectoria de Investigaciones (Proyectos 357 y 464) y programa de Biología. A las siguientes personas e instituciones por los préstamos, donaciones u otro tipo de acceso a los ejemplares bajo su cuidado: Juan D. Bogota (IAvHP), Janeth Muñoz Saba y Jaime Aguirre (ICMNH), Luz Fernanda Jiménez (CIUA), Armando Ortega-Lara (IMCN); Francisco Provenzano y Alberto Marcano (MBUCV), Donald C. Taphorn (MCNG), Carlos A. Lucena (MCP) y Saúl Prada-Pedreros (MPUJ). Donald C. Taphorn (USA) corrigió resumen en ingles. Tres revisores anónimos hicieron correcciones, críticas y comentarios que mejoraron su contenido y presentación.
Referencias
Bookstein, F.L. 1991. Morphometric tools for landmark data: geometry and biology. Cambridge, Cambridge, Inglaterra. [ Links ]
Eigenmann, C.H. 1908. Zoological results of the Thayer Brazilian Expedition. Preliminary descriptions of new genera and species of Tetragonopterid characins. Bull. Mus. Comp. Zool. 52: 93-106. [ Links ]
García-Alzate, C.A. 2009. Análisis filogenético y biogeográfico de las especies de Hyphessobrycon (Characiformes: Characidae) grupo heterorhabdus. Tesis de Doctorado, Universidad Central de Venezuela, Caracas, Venezuela. [ Links ]
García-Alzate, C.A. & C. Román-Valencia. 2008a. Hyphessobrycon ocasoensis sp.n. (Teleostei, Characidae) una nueva especie para el Alto Cauca, Colombia. Anim. Bio. Conserv. 31: 11-23. [ Links ]
García-Alzate, C.A. & C. Román-Valencia. 2008b. Biología alimentaria y reproductiva de Hyphessobrycon poecilioides (Pisces: Characidae) en la cuenca del río La Vieja, Alto Cauca, Colombia. Rev. Mus. Argen. Cien. Nat. n.s. 10: 17-27. [ Links ]
García-Alzate, C.A., C. Román-Valencia & D. Taphorn. 2008a. Hyphessobrycon oritoensis (Characiformes: Characidae), a new species from the Putumayo River drainage, Colombian Amazon. Zootaxa 1813: 42-50. [ Links ]
García-Alzate, C.A., C. Román-Valencia & D. Taphorn. 2008b. Revision of the Hyphessobrycon heterorhabdus-group (Teleostei: Characiformes: Characidae), with description of two new species from Venezuela. Vert. Zool. 58: 139-157. [ Links ]
García-Alzate, C.A., C. Román-Valencia & D. Taphorn. 2008c. Two new species of Hyphessobrycon (Pisces: Characiformes: Characidae) from Putumayo River, with keys to the Colombian Hyphessobrycon heterorhabdus-group species. Brenesia 70: 33-46. [ Links ]
García-Alzate, C.A., C. Román-Valencia & D. Taphorn. 2010a. A new species of Hyphessobrycon (Teleostei: Characiformes: Characidae) from the San Juan river drainage, Pacific versant, Colombia. Zootaxa 2343: 55-64. [ Links ]
García-Alzate, C.A., C. Román-Valencia & M. González. 2010b. Análisis morfogeométrico de las especies de Hyphesssobrycon grupo heterohabdus de Venezuela. Rev. Biol. Trop. 58: 801-811. [ Links ]
García-Alzate, C.A., C. Román-Valencia & S. Prada-Pedreros. 2010c. Tres nuevas especies de Hyphessobrycon grupo heterorhabdus (Teleostei: Characiformes: Characidae), con clave para especies de la cuenca del río Orinoco. Caldasia 32: 415-433. [ Links ]
Géry, J. 1977. Characoids of the World. THF, Neptune City, Nueva Jersey, EEUU. [ Links ]
González-Díaz, A., E. Díaz-Pardo, M. Soria-Barreto & R. Rodiles-Hernández. 2005. Análisis morfométrico de los peces del grupo labialis, género Profundulus (Cyprinodontiformes: Profundulidae), en Chiapas, México. Rev. Mex. Biod. 76: 55-61. [ Links ]
Hammer, Ø., D.A.T. Harper & P.D. Ryan. 2008. PAST: Paleontological Statistics, ver. 1.81. Paleontological Museum, University of Oslo, Noruega. (También disponible en línea: http://folk.uio.no/ohammer/past/index.html). [ Links ]
Meléndez, R. 2002. Morfometría y meristíca de Aplodacytlus punctatus Valenciennes 1832 (Pisces: Aplodactylidae) provenientes de la zona entre Iquique (20º 13’s) y Concepción (36º 47’ s), Chile. Guayana 66: 207-212. [ Links ]
Rohlf, F.J. 2000. Statistical power comparison among alternative morphometric methods. Amer. J. Phys. Anthropol. III: 463-478. [ Links ]
Rohlf, F.J. 2003. TpsRegr, shape regression, version 1,28. Department of ecology and Evolution, State University of New York, Stony Brook, EEUU. [ Links ]
Rohlf, F.J. 2004. TpsSpline, thin-plane spline, version 1.20. Department of Ecology and Evolution, State University of New York, Stony Brook, EEUU. [ Links ]
Rohlf, F.J. 2005. TpsDig2, digitize landmarks and outlines, version 2.05. Department of Ecology and Evolution, State University of New York, Stony Brook, EEUU. [ Links ]
Rohlf, F.J. & D.E. Slice. 1990. Extensions of the procruster method for the optimal superimposition of landmarks. Syst. Zool. 39: 40-50. [ Links ]
Rolf, F.J., A. Loy & M. Corti. 1996. Morphometric analysis of Old World Talpidae (Mammalia, Insectivora) using partial warp scores. Syst. Biol. 45: 344-362. [ Links ]
Ruiz-Calderón, R. & R. Cipriani. 2006. Análisis morfogeométrico de Astyanax siapae. Dahlia. Rev. Asoc. Colomb. Ictiol. 9: 63-75. [ Links ]
Strauss, R.E. & F.L. Bookstein. 1982. The truss: body form reconstructions in morphometrics. Syst. Zool. 31: 113-135. [ Links ]
Weitzman, S.H. & L. Palmer. 1997. A new species of Hyphessobrycon (Teleostei: Characidae) from the Neblina region of Venezuela and Brazil, with comments on the putative “rosy tetra clade”. Ichth. Explor. Fresh. 7: 209-242. [ Links ]
Zelditch, M.L., D.L. Swiderski, H.D. Sheets & W.D. Fink. 2004. Geometric morphometrics for biologists: A primer. Elsevier, Amsterdam, Holanda. [ Links ]
Correspondencia a: Carlos A. García-Alzate, Raquel I. Ruiz-C., César Román-Valencia, Melissa I. González & Diana X. Lopera: Universidad del Quindío, Laboratorio de Ictiología, A. A. 2639, Armenia, Quindío, Colombia; cagarcia@uniquindio.edu.co, zutana_1@yahoo.com, ceroman@uniquindio.edu.co, meli328@gmail.com
Recibido 18-V-2010. Corregido 03-XI-2010. Aceptado 03-XII-2010.